…
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Как ставить коэффициенты
После написания любой реакции в ней нужно расставить коэффициенты. Иногда сделать это можно путем обычного математического подбора. В других случаях необходимо использовать специальные методы: метод электронного баланса или метод полуреакции.

Инструкция
Если реакция не является окислительно-восстановительной, т.е. проходит без изменения степеней окисления, то подбор коэффициентов сводится к простым математическим подсчетам. Количество веществ, полученных в результате реакции, должно быть равным количеству веществ, вступающих в нее. Например: BaCl2 + K2SO4 = BaSO4 + KCl. Считаем количества веществ. Ba: 2 в левой части уравнения – 2 в правой. Cl: 2 в левой – 1 в правой. Уравниваем, ставим коэффициент 2 перед KCl. Получаем: BaCl2 + К2SO4 = BaSO4 + 2KCl. Подсчитываем количества остальных веществ, все они совпадают.
В окислительно-восстановительной реакции, т.е. реакции проходящей с изменением степеней окисления, коэффициенты расставляют или методом электронного баланса, или методом полуреакции.
Метод электронного баланса заключается в уравнивании числа электронов, отданных восстановителем и числа электронов принятых окислителем. Следует отметить, что восстановитель – атом, молекула или ион, который отдает электроны, а окислитель – атом, молекула или ион, присоединяющий электроны. Разберем на примере: H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O. Сначала определяем какие вещества поменяли степень окисления. Это Mn(от +7 до +2), S(от -2 до 0). Показываем процесс отдачи и присоединения электронов с помощью электронных уравнений. Коэффициенты находим по правилу наименьшего кратного множителя.
Mn(+7) +5e = Mn(+2) / 2
S(-2) – 2e = S(0) / 5
Далее в уравнение реакции подставляем полученные коэффициенты: 5H2S + 2KMnO4 + H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O. Но уравнивание на этом заканчивается очень редко, необходимо еще подсчитать количества остальных веществ и уравнять их, как мы делали это в реакциях без изменения степеней окисления. После уравнивания получим: 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
Следующий метод заключается в составлении полуреакций, т.е. берутся уже ионы, реально существующие в растворе (например, не Mn(+7), а MnO4(-1)). Затем полуреакции суммируются в общее уравнение и с его помощью расставляются коэффициенты. Для примера возьмем ту же реакцию: H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O.
Составляем полуреакции.
MnO4 (-1) – Mn (+2). Смотрим на среду реакции, в данном случае она кислая, из-за присутствия серной кислоты. Значит уравниваем протонами водорода, не забываем восполнить недостающий кислород водой. Получаем: MnO4 (-1) + 8H(+1) + 5e = Mn (+2) +4H2O.
Другая полуреакция выглядит так: H2S – 2e = S + 2H(+1). Складываем обе полуреакции, предварительно уравняв число отданных и полученных электронов, используя правило наименьшего кратного множителя:
H2S – 2e = S + 2H(+1) / 5
MnO4 (-1) + 8H(+1) + 5e = Mn (+2) +4H2O / 2
5H2S + 2MnO4 (-1) + 16H(+1) = 5S + 10H(+1) + 2Mn (+2) +8H2O
Сократив протоны водорода, получаем:
5H2S + 2MnO4 (-1) + 6H(+1) = 5S + 2Mn (+2) +8H2O.
Переносим коэффициенты в уравнение в молекулярной форме:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
Как вы видите результат такой же, как и при применении метода электронного баланса.
При наличии щелочной среды полуреакции уравниваются с помощью гидроксид-ионов (OH(-1))
Видео по теме
Полезный совет
Внимательно подсчитывайте количества веществ в правой и левой частях уравнения. При несовпадении лучше пересчитать еще раз, вполне вероятно, что это всего лишь математическая ошибка.
Источники:
- “Пособие по химии”, Г.П. Хомченко, 2005.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод электронного баланса
Составляя любое уравнение химической реакции, следует соблюдать закон сохранения масс веществ – кол-во атомов в исходных веществах (левая часть уравнения) и в продуктах реакции (правая часть уравнения) должны совпадать.
Составляя уравнения окислительно-восстановительных реакций, следует также следить за суммой зарядов, которые у исходных веществ и в продуктах реакции должны быть равны.
В уравнениях ОВР в левой части обычно указывают первым вещество-восстановитель (отдает электроны), а затем – вещество-окислитель (принимает электроны); в правой части уравнения первым указывают продукт окисления, затем восстановления, а потом другие вещества, если они имеются.
Главное требование, которое необходимо соблюдать при составлении уравнений окислительно-восстановительных реакций, – кол-во электронов, которое отдал восстановитель, должно быть равно кол-ву электронов, принятых окислителем.
В основе метода электронного баланса лежит сравнение степеней окисления в исходных веществах и продуктах реакции, что подразумевает тот факт, что, составляющий уравнение ОВР методом электронного баланса, должен знать, какие вещества образуются в ходе реакции.
Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al 0 +C 0 → Al4 +3 C3 -4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al 0 → Al +3
1Al 0 -3e – → 1Al +3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C 0 → C +4
1C 0 +4e – → 1C -4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом – в схему реакции алюминия:
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al 0 =4Al 0 - Кол-во атомов углерода, вступающих в реакцию:
3·1C 0 =3C 0 - Окончательный вид уравнения:
4Al 0 +3C 0 = Al4 +3 C3 -4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN +5 O3+I2 0 → HI +5 O3+N +2 O+H2O - Азот меняет степень окисления с +5 на +2 – принимает 3 электрона, и является окислителем:
N +5 → N +2
N +5 +3e – → N +2 - Йод меняет степень окисления с 0 на +5 – отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 0 → 2I +5
I2 0 -10e – → 2I +5 - Уравниваем заряды:
- Было до реакции 10·1N +5 =10N +5 , после реакции образовалось: 10·1N +2 =10N +2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I +5 =6I +5 ;
- Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl -1 +Mn +4 O2 → Cl2 0 +Mn +2 Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца – окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl -1 → Cl2 0
2Cl – -2e – → Cl2 0 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn +4 → Mn +2
Mn +4 +2e – → Mn +2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой – 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 – теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H + +4Cl – +MnO2 = Cl2+Mn 2+ +2Cl – +2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S -2 +KMn +7 O4+H2SO4 → S 0 +Mn +2 SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород – восстановитель):
S -2 → S 0
S -2 -2e – → S 0 - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат – окислитель):
Mn +7 → Mn +2
Mn +7 +5e – → Mn +2 - Электронные уравнения:
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4 – +6H + = 5S+2Mn 2+ +8H2O
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
Алгоритм расстановки коэффициентов методом электронного баланса
учебно-методический материал по химии (9 класс) по теме

Алгоритм расстановки коэффициентов методом электронного баланса.
Скачать:
| Вложение | Размер |
|---|---|
| algoritm_rasstanovki_koeffitsientov_metodom_elektronnogo_balansa.docx | 17.99 КБ |
Предварительный просмотр:
Алгоритм расстановки коэффициентов в уравнениях
методом электронного баланса.
Запишите схему реакции (формулы исходных веществ и продуктов реакции).
NH 3 +CuO → N 2 +Cu+H 2 O
Определите и сравните степени окисления элементов до и после реакции.
N H 3 + Cu O → N 2 + Cu +H 2 O
Выбрать (подчеркнуть) элементы, степени, окисления которых изменяются.
N H 3 + Cu O → N 2 + Cu +H 2 O
Выписать эти элементы (простые вещества выписываются с индексами).
N H 3 + Cu O → N 2 + Cu +H 2 O
Определить отдал или принял элемент электроны и их количество (помнить, что электроны заряжены отрицательно).
Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу.
N H 3 + Cu O → N 2 + Cu +H 2 O
Определите окислитель и восстановитель
(окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается).
N H 3 + Cu O → N 2 + Cu +H 2 O
Выписать то количество электронов, которое определили. Найти для этих чисел наименьшее кратное.
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6
Определить коэффициенты (разделив поочередно наименьшее кратное на количество электронов).
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1
Cu +2 +2℮ → Cu 0 2 3
Определить процесс окисления или восстановления (окислитель в процессе реакции восстанавливается , восстановитель окисляется ).
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса.
Полученные коэффициенты поставить в правой части уравнения (после стрелки) перед теми элементами, напротив которых они стоят в окислительно-восстановительном балансе. Если атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения (в последнем уравнении для кислорода).
N H 3 + Cu O → N 2 +3 Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Число отданных электронов
Число принятых электронов
Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым).
2N H 3 +3 Cu O → N 2 +3 Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Устно проверьте правильность составленного уравнения.
Число молей атомов каждого химического элемента в правой и левой частях уравнения – одинаково.
По теме: методические разработки, презентации и конспекты
Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
В статье обсуждается возможность описания ОВР с участием органических веществ с помощью метода электронного баланса. Также даны рекомендации по составлению уравнений реакций.
Презентация “Упражнение в расстановке коэффициентов методом электронного баланса”
В презентации представлен алгоритм расстановки коэффициентов методом электронного баланса, а также 18 схем реакций для упражнений в расстановке коэффициентов с проверкой.

Алгоритм расстановки коэффициентов в химическом уравнении.
Может быть использована как раздаточный материал.

разработка ЦОРа по теме “Метод электронного баланса”
расстановка коэффициентов с применением метода электронного баланса.

Алгоритм расстановки коэффициентов в химических уравнениях
Алгоритм расстановки коэффициентов в химических уравнениях.
Составление уравнений ОВР методом электронного баланса
Составления ОВР методом электронного баланса. Тест на ОВР.

Алгоритм уравнивания с помощью электронного баланса
Не секрет уравнивание уравнений окислительно-восстановительных реакций у учащихся вызывает особое затруднение. Даже, если всё понял на первых порах нужна подсказка в виде алгоритма. Этот алгорит.
Метод электронного баланса – правила и алгоритмы уравнивания реакций
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.
Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями. Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:

- В уравнении определяют сложные и простые степени окисления.
- Реакцию переписывают с расстановкой степени окисления. При этом вещества, в которых изменяется степень во всех связях, выделяют любым способом, например, подчёркиванием.
- Находят окислитель, восстановитель, и в случае присутствия, нейтральный элемент.
- Составляют уравнение баланса с выделением внутренних коэффициентов.
- Определяют наименьшее общее кратное.
- Подставляют вычисленные коэффициенты в уравнение.
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Например, ионное соединение NaCl = Na 1+ + Cl 1- . Атом натрия имеет один электрон, который в ионном соединении полностью переходит к более отрицательному атому. То есть, электрон натрия отдаётся полностью атому хлора. При этом атом, утратив один ион, приобретает заряд равный один плюс. Хлор же, получая дополнительный электрон, меняет заряд на один минус.
В химии принято заряды обозначать сначала цифрой, а после ставить знак, а степень окисления наоборот. Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na +1 Cl -1 .
Для ковалентной полярной связи, например, молекулы HCl, общая электронная пара лишь смещается в сторону хлора. На атомах возникают частичные дельта-плюс и минус заряды. Но при расстановке значений на это внимания не обращают. Атом водорода полностью отдаёт свой электрон атому хлора. Соответственно, степень будет выглядеть как H +1 Cl -1 .
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:

- Первую — щелочные металлы и фтор.
- Вторую — металлы II группы, главной подгруппы и кислород.
- Третью — алюминий.
Остальные же вещества характеризуются переменной валентностью. При описании реакции характерно выделение и гидроксильной группы. Для соединения ОН значение ионов указывается единым. Например, Na +1 (OH) -1 . Проверку правильности расстановки зарядов можно выполнить по правилу электронейтральности, согласно которому сумма положительных электронов должна быть равна сумме отрицательных.
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + NH3 = Cu + N2 +H2O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
Опираясь на таблицу Менделеева можно утверждать, что правильная степень окисления будет выглядеть для рассматриваемого выражения следующим образом: Cu +2 O -2 + N -3 H +1 3 = Cu 0 + N 0 2 +H +1 2O -2 . Теперь нужно отметить те элементы, которые поменяли свою валентность. Это медь, была +2, а стала 0, и азот, изменивший своё значение с -3 до 0.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
- Cu +2 — Cu 0 . Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.
- 2N -3 — N 0 2. Тут следует обратить внимание на то, что при составлении полуреакций для молекул простых веществ обязательно следует указывать индексы. В рассматриваемом случае это двойка. Соответственно, такие выражения следует тоже уравнять. Поэтому в левой части ставится коэффициент два. Анализируя полуреакцию, можно прийти к выводу, что было -6 атомов, а стало ноль. То есть азот отдал шесть электронов. Записывается это как -6 e.
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
В рассматриваемом примере получается, что два электрона были приняты, а шесть отданы. Так не бывает, поэтому нужно найти, где же потерялась разница. Для полученных чисел ищется наименьший общий знаменатель. Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu +2 O -2 + 2N -3 H +1 3 = 3Cu 0 + N 0 2 +H +1 2O -2 .
Опираясь на полученные значения, проводят стандартную процедуру уравнивания: 3Cu +2 O -2 +2N -3 H +1 3 = 3Cu 0 + N 0 2 + 3H +1 2O -2 . Задача считается выполненной. Пожалуй, ещё можно указать, что медь в уравнении является окислителем, а азот — восстановителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O.
Согласно правилу, нужно расставить ионны для каждого элемента: K +1Br+1 + K +1 Mn +7 O -2 4 + H +1 2S +6 O -2 4 → Mn +2 S +6 O -2 4 + Br02 + K +1 2 S +6 O -2 4 + H +1 2O -2 . В уравнении только два элемента изменили степень. Это марганец, который был +7, а стал +2, и бром, поменявший свою валентность с -1 до нуля.

Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Вторая полуреакция состоит из брома. Был он в степени -1, а стал в нулевой. При этом индекс у него стал два. Значит, первоначально в реакцию должны были вступить два атома брома. Следовательно, в исходном состоянии было 2*(-1) = -2 электрона, а после стало ноль. То есть бром отдал два электрона: — 2e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
Mn +7 — Mn +2 |+5e |5.
2Br -1 — Br 0 2 |-2e |2.
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + H2SO4 → 5 Br2 + 2MnSO4+ K2SO4 + H2O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
В итоге полным правильным уравнением будет следующая химическая формула: 2KBr + 10KMnO4 + 8H2SO4 → 5 Br2 + 2MnSO4+ 6K2SO4 + 8H2O. Полученное выражение дальше править уже не нужно. Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Использование онлайн-калькулятора

В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
[spoiler title=”источники:”]
http://prosto-o-slognom.ru/chimia_ovr/08_metod_elektronnogo_balansa.html
http://nsportal.ru/shkola/khimiya/library/2014/01/01/algoritm-rasstanovki-koeffitsientov-metodom-elektronnogo-balansa
http://nauka.club/khimiya/metod-elektronnogo-balansa.html
[/spoiler]
Правила подбора коэффициентов:
– если число атомов элемента в одной части схемы реакции четное, а в другой нечетное, то перед формулой с нечетным числом атомов надо поставить коэффициент 2, а затем уравнивать число всех атомов.
– расстановку коэффициентов следует начинать с наиболее сложного по составу вещества и делать это в следующей последовательности:
сначала надо уравнять число атомов металлов, затем – кислотных остатков (атомов неметаллов), затем атомов водорода, и последним – атомов кислорода.
– если число атомов кислорода в левой и правой частях уравнения одинаково, то коэффициенты определены верно.
– после этого стрелку между частями уравнения можно заменить знаком равенства.
– коэффициенты в уравнении химической реакции не должны иметь общих делителей.
Пример. Составим уравнение химической реакции между гидроксидом железа (III) и серной кислотой с образованием сульфата железа (III).
1. Составим схему реакции:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. Подберем коэффициенты к формулам веществ. Мы знаем, что надо начать с наиболее сложного вещества и последовательно уравнять во всей схеме сначала атомы металлов, потом кислотных остатков, затем водорода и в конце – кислорода. В нашей схеме наиболее сложное вещество – Fe2(SO4)3. В нем два атома железа, а в составе Fe(OH)3 – один атом железа. Значит, перед формулой Fe(OH)3 надо поставить коэффициент 2:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
Теперь уравниваем число кислотных остатков SO4. В составе соли Fe2(SO4)3 – три кислотных остатка SO4. Значит, в левой части перед формулой H2SO4 ставим коэффициент 3:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
Теперь уравниваем число атомов водорода. В левой части схемы в гидроксиде железа 2Fe(OH)3 – 6 атомов водорода (2
· 3), в серной кислоте 3H2SO4 – тоже 6 атомов водорода. Всего в левой части 12 атомов водорода. Значит, в правой части перед формулой воды H2O ставим коэффициент 6 – и теперь в правой части тоже 12 атомов водорода:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Осталось уравнять число атомов кислорода. Но делать это уже не надо, потому что в левой и правой частях схемы уже одинаковое число атомов кислорода – по 18 в каждой части. Это значит, что схема записана полностью, и мы можем стрелку заменить знаком равенства:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Составление уравнений окислительно-восстановительных реакций.
Глава 8. Окислительно-восстановительные процессы
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4—, SO42-, Cr2O72-. При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
P+HNO3разб. →
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
P+HNO3разб.→ NO +
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
N5+ + 3ē → N2+
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
P0 – 5ē → P+5
Следовательно, молекулярное уравнение реакции имеет следующий вид:
P + HNO3 разб.→ NO + H3PO4
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
![]()
3) Составить электронный баланс
![]()
4) Подставить найденные коэффициенты в уравнение реакции.
5HNO3 + 3P + 2H2O → 5NO + 3H3PO4
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
+2 +7 +3 +2
FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Составляем уравнения электронного баланса
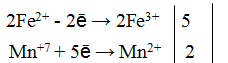
Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4—, а не ионы Mn7+, так как перманганат калия в водном растворе диссоциирует KMnO4↔K++MnO4—. При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H+, OH—, H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O+2 образует с ионами H+ молекулы воды:
Изб. O2–+2H+=H2O
2. В нейтральной или щелочной среде избыток ионов O2- образует с молекулами воды гидроксид – ионы:
Изб. O2–+ H2O=2OH–
3. В щелочной среде недостаток ионов O2– компенсируется двумя ионами OH—, одновременно образуется одна молекула воды:
2OH–H2O+O2–
| Реакция среды | Избыток ионов О2– | Недостаток ионов О2– |
| окислитель | восстановитель | |
| Кислая | Н+ Н2О | Н2O 2Н+ |
| изб. O2– + 2H+ = Н2О | Н2О 2Н+ + O2– | |
| Нейтральная | H2O OH– | Н2O 2Н+ |
| изб. О2– + Н2О 2OН– | Н2О 2Н+ + О2– | |
| Щелочная | Н2O ОН– | 2OН– Н2О |
| изб. О2– + Н2O 2OН– | 2OН– Н2О + О2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
H2S S +2H+
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
H2S – 2 = S+2H+
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО—4 (он имеет малиновую окраску) в ион Mn2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
MnO4– Mn2+
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO—4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
МnО—4 + 8H+ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO—4 + 8H++5e— = Mn2++4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO—4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
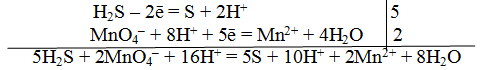
Сократив на 10 Н+, окончательно получим
5Н2S + 2МnО—4 + 6Н+ =5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
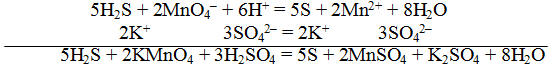
1. Составить схему реакции
K2SO3 + KMnO4 + H2SO4 K2SO4 + MnSO4 + H2O
SO32- + MnO4— + 2H+ SO42- + Mn2+
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4— восстанавливается в кислой среде до Мn2+ (фиолетово-малиновая окраска иона MnO4— становится бесцветной, переходя в Мn2+ — ион), следовательно, ион SO32 — будет являться восстановителем, переходя в ион SO42-.
2. Составить электронно-ионные уравнения
а) для окислителя
MnO4— + 8H+ = Mn2+ + 4H2O
Из ионной схемы видно, что, ион MnO4— – превращается в ион Мn2+, при этом освобождаются ионы О2-, которые по правилу стяжения в кислой среде связываются ионами Н+, образуя молекулы Н2O.
б) для восстановителя
SO32- + H2O = SO42- + 2H+
Из ионной схемы видно, что ион SO32- превращается в ион SO42-. Для этого превращения необходимо добавить ион О2-, который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4— + 8H+ + 5ē = Mn2+ + 4H2O
SO32- + H2O — 2ē = SO42- + 2H+
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
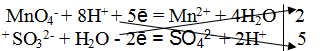
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
2MnO4— + 16H + + 5SO32- + 5H2O =2Mn2+ + 8H2O + 5SO42- + 10H+.
6. Сократить в левой и правой части уравнения 10 Н+ и 5Н2O. Получается ионное уравнение:
2MnO4— + 6H+ + 5SO32- = 2Mn2+ + 5SO42- + 3H2O
7. По ионному уравнению составить молекулярное уравнение реакции:
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
KCrO2 + Br2 + KOH → K2CrO4 + KBr +H2O
CrO2– + Br2 + OH– → CrO42– + Br +H2O
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 –.
2. Составить электронно-ионное уравнение
а) для окислителя
Вr2 → 2Вr –
б) для восстановителя
СrO2– + 4OН– → СrО42– + 2Н2О
Из ионной схемы видно, что ион CrO2– превращается в ион СгО42–. Каждый недостающий ион О2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН—), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
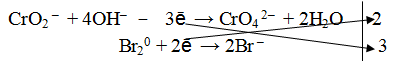
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
2CrO2 – + 8OH– + 3 Br20 → 2CrO4 2– + 6Br + 4H2O
5. По ионному уравнению составить молекулярное уравнение реакции.
2KcrO2 + 8KOH + 3Br2 → 2K2CrO4 + 6KBr + 4H2O
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
K2SO3 + KMnO4 + H2O → MnO2 ↓ + K2SO4
SO32– + MnO4– + H2O → MnO2 + SO42–
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn+7). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
а) для окислителя
МnO4— + 2Н2O→ MnO20 + 4OН—
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
SO32- + Н2O → SO42- + 2Н+
Из ионной схемы видно, что ион SО32- превращается в ион SO42- , для этого необходимо добавить один ион О2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
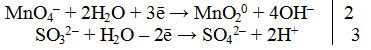
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
2MnO4– + 3SO32– + 7H2O → 2MnO2 + 3SO42– + 8OH + 6H+
или
2MnO4– + 3SO32– + 7H2O → 2MnO2 + 3SO42– + 6H2О + 2OH–
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
2МnO4— + 3SO32- + Н2O 2МnО2 + 3SO42- + 2OН—
5. По ионному уравнению составить молекулярное уравнение реакции.
2КМnO4 + ЗК2SО3 + H2O 2МnО2 + 3K2SO4 + 2КОН
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S), соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn), соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН3, H2S — только восстановители; HNO3, H2SO4, КMnО4 — только окислители; НNО2, Н2SО3, MnO2 — окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
Решение:
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
![]()
![]()
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
2KMnO4 + 5H3PO3 + 2H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:
![]()
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn2+.
