поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,655 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,939 -
разное
16,901
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Страница 1 из 2
6.1. В каких единицах системы СИ выражаются постоянные а и b, входящие в уравнение Ван-дер-Ваальса?
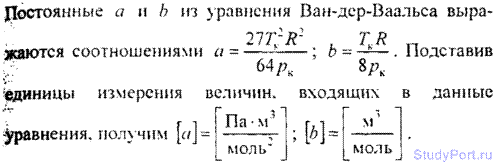
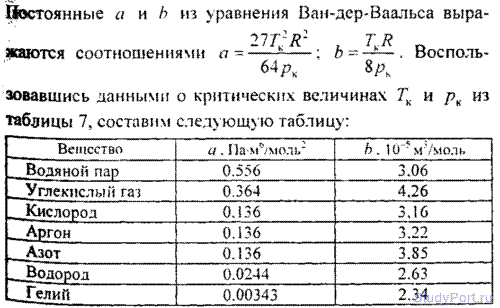
6.2. Пользуясь данными о критических величинах Тк и pк для некоторых газов (смотри таблицу), найти для них постоянные а и b , входящие в уравнение Ван-дер-Ваальса.
6.3. Какую температуру Т имеет масса m = 2 г азота, занимающего объем V = 820cm3 при давлении p = 0,2 МПа? Газ рассматривать как: а) идеальный; б) реальный.

6.4. Какую температуру Т имеет масса m = 3,5 г кислорода занимающего объем F=90cm3 при давлении p = 2,8МПа? Газ рассматривать как: а) идеальный; б) реальный.


6.5. Масса m = 10 г гелия занимает объем V = 100 см3 при давлении p = 100 МПа. Найти температуру Т газа, считая его: а) идеальным; б) реальным.

6.6. Количество v = 1 кмоль углекислого газа находится при температуре t = 100° С. Найти давление p газа, считая его:
а) реальным; б) идеальным. Задачу решить для объемов V1 = 1 м3
и V2= 0,05 м3.


6.7. В закрытом сосуде объемом V = 0,5 м3 находятся коли-
чество v = 0.6 кмоль углекислого газа при давлении p = 3 МПа.
Пользуясь уравнением Ван-дер-Ваальса, найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое.
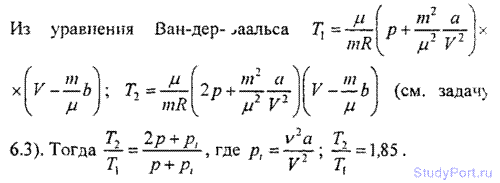
6.8. Количество v = 1 кмоль кислорода находится при температуре t=21°C и давлении p = 10МПа. Найти объем V газа,
считая, что кислород при данных условиях ведет себя как реальный газ.


6.9. Количество v = 1 кмоль азота находится при температуре t = 27°C и давлении p = 5МПа. Найти объем V газа, считая, что азот при данных условиях ведет себя как реальный газ.
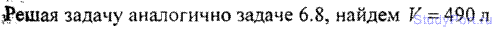
6.10. Найти эффективный диаметр а молекулы кислорода, считая известными для кислорода критические значения Тк и pк.

6.11. Найти эффективный диаметр а молекулы азота двумя способами: а) по данному значению средней длины свободного пробега молекул при нормальных условиях ? = 95 нм; б) по известному значению постоянной b в уравнении Ван-дер-Ваальса.
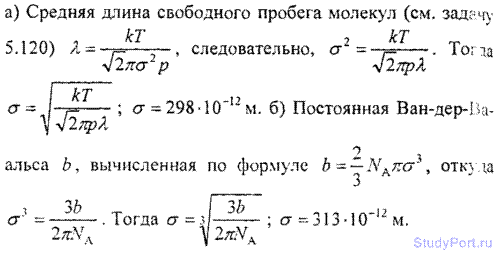
6.12. Найти среднюю длину свободного пробега ? молекул углекислого газа при нормальных условиях. Эффективный диаметр б молекулы вычислить, считая известными для углекислого газа критические значения Tk и pk.

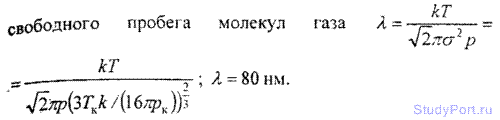
6.1З. Найти коэффициент диффузии D гелия при температуре t = 17° С и давлении p = 150 КПа. Эффективный диаметр атома б вычислить, считая известными для гелия критические значения Тk и pk.

6.14. Построить изотермы p = f(v) для количества v = 1 кмоль углекислого газа при температуре t = 0° С. Газ рассматривать как: а) идеальный; б) реальный. Значения V (в л/моль) для реального газа взять следующие: 0,07, 0,08, 0,10, 0,12, 0,14, 0,16, 0,18, 0,20, 0,25, 0,30, 0,35 и 0,40; для идеального газа — в интервале 0,2 < V < 0,4 л/моль.
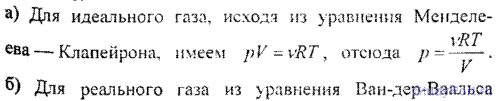
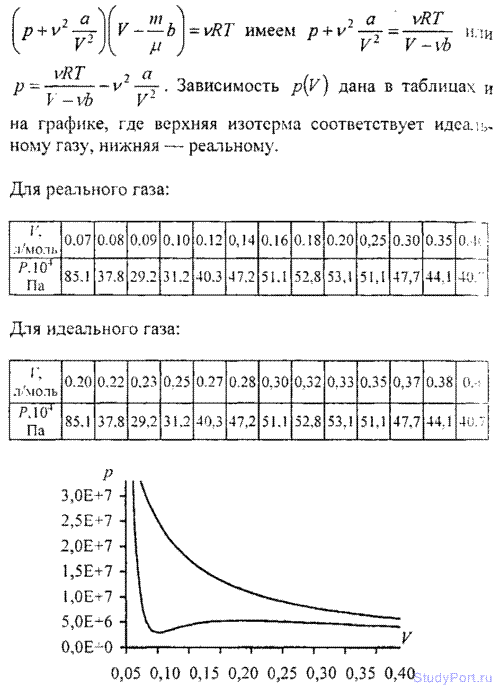
6.15. Найти давление p1, обусловленное силами взаимодействия молекул, заключенных в количестве v = 1 кмоль газа при нормальных условиях. Критическая температура и критическое давление этого газа равны Тk = 417 К и pk = 7,7 МПа.
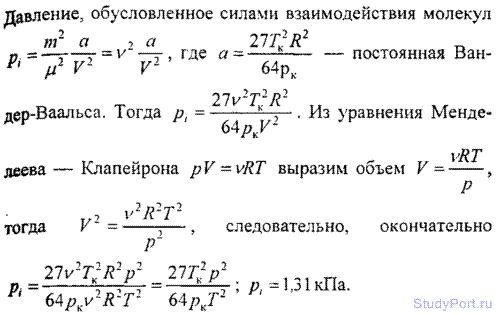
6.16. Для водорода силы взаимодействия между молекулами незначительны; преимущественную роль играют собственные размеры молекул. Написать уравнение состояния такого полуидеального газа. Какую ошибку мы допустим при нахождении количества водорода v, находящегося в некотором объеме при температуре t = 0° С и давлении p = 280 МПа, не учитывая собственного объема молекул?

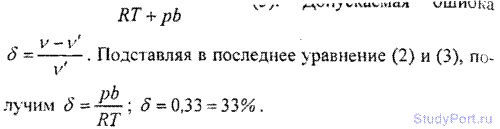
6.17. В сосуде объемом V = 10 л находится масса m = 0,25 кг азота при температуре t = 27° С. Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? Какую часть объема сосуда составляет собственный объем молекул?

6.18. Количество v = 0.5 кмоль некоторого газа занимает объ-ем V1=1m3. При расширении газа до объема V2 = 1.2 м3 была
совершена работа против сил взаимодействия молекул A =5,684 кДж. Найти постоянную а, входящую в уравнение Ван-дер-Ваал ьса.
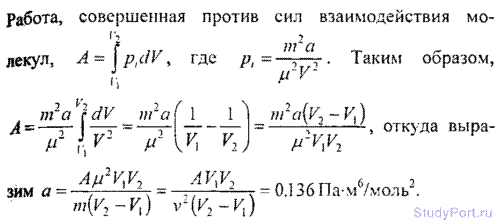
6.19. Масса m = 20 кг азота адиабатически расширяется в вакуум от объема V1 = 1 м3 до объема V2 = 1 м3. Найти понижение
температуры dT при этом расширении, считая известной для азота постоянную а, входящую в уравнение Ван-дер-Ваальса (смотри ответ 6.2).

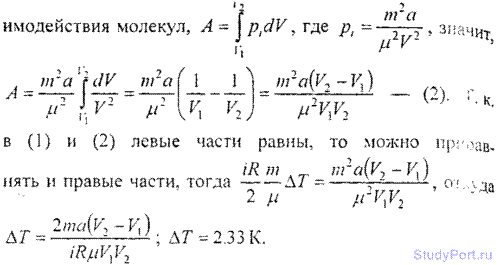
6.20. Количества v = 0,5 кмоль трехатомного газа адиабатически расширяется в вакуум от объема V1 = 0,5 м3 до объема V2 = 3 м3. Температура газа при этом понижается на dT = 122 К. Найти постоянную а. входящую в уравнение Ван-дер-Ваальса.

Эффективный диаметр – молекула
Эффективный диаметр молекулы определяется ее размерами и углом между направлением ее движения и осью вращения. При наложении магнитного поля на парамагнитный газ его молекулы стремятся ориентироваться своими магнитными моментами по направлению поля; при этом возникает прецессия.
Эффективный диаметр молекулы довольно трудно определить, так как он зависит от типа столкновения.
Эффективный диаметр молекулы воды примерно равен 0 27 нм, поэтому молекулы воды могут проникать даже во внутримолекулярные поры электропроводящих полимерных материалов. В случае, когда поглощенная влага образует нити по объему полимерного материала, которые могут пронизывать значительную область объема, уже весьма малые количества поглощенной влаги приводят к резкому повышению электрической, проводимости полимерного материала. Когда влага распределяется по объему материала в виде отдельных, не соединяющихся между собой включений, то влияние влаги на электрическую проводимость незначительно.
Найти эффективный диаметр молекулы кислорода, считая, что критические величины Тк и рк для кислорода известны.
Расстояние, на которое сближаются центры двух молекул, совпадает с диаметром молеку лы d.| Зависимость взаимной потенциальной энергии ер двух молекул от расстояния г между их центрами. Центр одной молекулы помещается в начале координат ( в точке О, центр другой молекулы перемещается вдоль оси г. В скобках проставлена температура Т, соответствующая начальной скорости молекулы. Следовательно, эффективный диаметр молекул уменьшается с повышением температуры.
Дфф – эффективный диаметр молекулы адсорбата, выраженный как диаметр сферы эквивалентного объема, площадь проекции такой сферы на поверхность Я равна тсД 2ФФ / 4, а занимаемая на поверхности суммарная площадка равна Д2 м / 4 ( 1 – ЕЛ) , где Ел – двумерная пористость монослоя.
Расстояние, на которое сближаются центры двух молекул, совпадает с диаметром молекулы d.| Зависимость взаимной потенциальной энергии ер двух молекул от расстояния г между их центрами. Центр одной молекулы помещается в начале координат ( в точке О, центр другой молекулы перемещается вдоль оси г. В скобках проставлена температура Т, соответствующая начальной скорости молекулы. Следовательно, эффективный диаметр молекул уменьшается с повышением температуры.
Из-за уменьшения эффективного диаметра молекул длина свободного пробега при повышении температуры слабо растет.
Из-за уменьшения эффективного диаметра молекул длина свободного пробега при повышении температуры слабо растет.
Стало быть, эффективный диаметр молекул зависит от их средних энергий, а следовательно, и от температуры: с повышением температуры эффективный диаметр молекул уменьшается.
Чем объясняется зависимость эффективного диаметра молекул – газа от температуры.
Пространство, соответствующее эффективному диаметру молекул антикоррозионных присадок, имеющих сложные углеводородные радикалы, нельзя рассматривать как полностью заполненное атомами элементов, входящих в состав присадки. Поэтому между серой или фосфором, входящими в состав присадки, растворенной в масле, и незанятыми атомами металла, находящимися на его поверхности под мономолекулярным слоем защитной пленки, может возникать взаимодействие.
Этот радиус называется эффективным диаметром молекулы. Эффективный диаметр молекулы d определяет то минимальное расстояние между центрами двух молекул, на котором появляются силы отталкивания, производящие действие, подобно удару.
остальное в техническом словаре-открой вкладку: Технический словарь
том 1

d = 3kTk 1/ 316πpk
50
3.5. Примеры решения задач
Задача 1
Какую температуру T имеет масса m=2г азота, занимающего объем V=820см3 при давлении p=0,2МПа? Газ рассматривать как а) идеальный; б)реальный.
Дано:
N2 m=2·10-3кг V=8,2·10-4м3
Р=2·105Па
Та=? Тб=?
Решение:
Μ=2,8·10-2кг/моль а) pV=m/μ·RTa
Ta=μpV/mR=280K
б) Запишем уравнение Ван-Дер-Ваальса:
|
aν |
2 |
m |
. |
||
|
2 |
|||||
|
p + |
V |
(V −νb)=νRTб , ν = |
µ |
||
Значения параметров а и в определим по критическим параметрам для азота согласно формулам (3.9):
|
RT |
27R2T 2 |
||||||||
|
b = |
k , a = |
k |
. |
||||||
|
8 pk |
64 pk |
||||||||
|
Значения рк, Тк |
возьмем из таблицы 3.2: рк=3,4·106Па, Тк=126К |
||||||||
|
Такие действия приведут нас к следующим выводам: |
|||||||||
|
а = |
27 8,32 1262 = 0,136Па м6 / моль. |
||||||||
|
64 3,4 106 |
|||||||||
|
b = |
8,3 126 |
= 3,85 10−5 М 3 / моль. μ=2/28=0,71 моль= |
|||||||
|
8 3,4 106 |
|||||||||
|
аν |
2 |
||||||||
|
2 |
|||||||||
|
Тб = р + |
V |
(V −νb) /(νR) = 280K . |
|||||||
Совпадение Та и Тб в данном случае объясняется малой величиной давления, при котором реальный газ ведет себя как идеальный.
Задача 2
Найти эффективный диаметр d молекулы кислорода, считая известными для кислорода критические значения Tк и pк.
|
Дано: |
Решение: |
||||||
|
О2 |
Постоянная b, входящая в уравнение Ван-Дер- |
||||||
|
d=? |
Ваальса, |
равна |
учетверенному объему Na |
||||
|
Это означает: |
молекул (одного моля газа). |
||||||
|
b = 4 Na |
4 |
d |
3 |
2πd 3 |
. |
||
|
3 |
π |
= Na |
3 |
||||
|
2 |
|||||||
|
С другой стороны, |
согласно формуле (3.9) |
b= RTk . Приравнивая правые |
8 pk
части этих двух соотношений и учитывая, что R/Na=k, получим:
= 2,9 10−10 м3 .

Решение:
В процессе испарения теплота тратится на преодоление сил взаимодействия молекул и на работу расширения против сил внешнего давления.
51
Задача 3
Давление водяного пара, насыщающего пространство при t=50˚C равно p=12302Па. Определить массу воды, содержащуюся в 1м3 воздуха.
|
Дано: |
Решение: |
|
Н2О Т=323К |
При таких температурах пар можно описывать |
|
уравнением Клайперона-Менделеева (см. стр. |
|
|
р=12302Па |
59), поэтому: |
|
V=1м3 |
pV=mRT/μ и m= μpV/(RT)/ |
|
m=? |
Поскольку μ=1,8·10-2кг/моль, получим: |
m = 1,8 10−2 1,2302 104 = 0,083кг. 8,3 323
Задача 4
Какая масса m водяного пара содержится в объеме V=1м3 воздуха в летний день при температуре t=30˚C и относительной влажности w=75%?
|
Дано: |
Решение: |
|
Н2О Е=303К |
Поскольку w=р/рн, то р=рн·w, ф давление |
|
w=0,75, V=1м3 |
насыщающего пара при данной температуре |
|
m=? |
рн=4,23·103Па. |
|
Эту же величину можно выразить из уравнения |
|
|
состояния: |
|
|
р = mRT . |
|
|
µV |
Из этих соотношений найдем:
m = µpRTнωV = 0,0225кг.
Задача 5
Какая часть удельной теплоты парообразования воды r=2,29МДж/кг при температуре t=100˚C идет на увеличение внутренней энергии системы?
Дано:
Н2О Т=373К
R=2,29·106 Дж/кг
U/r=?
Согласно первому началу термодинамики (поскольку Q=r) имеем: r=ΔU+A,
где A – работа, совершаемая единицей массы m1=1кг газа против внешнего давления. Эта работа равна A=p(Vпара-Vж). А, поскольку температура далека от критической, плотность пара рпара=m1/Vпара значительно меньше плотности жидкости рж=m1/Vж, из которой он образован:
рпара<<pж, или Vж<<Vпара.
Поэтому в выражении для работы можно пренебречь величиной Vж по сравнению с Vпара и получить: A≈pV пара. Далее, воспользовавшись уравнением Клайперона – Менделеева для пара:
pVпара = mµ1 RT ,
52
замечаем, что A≈m 1RT/μ. А, поскольку из выражения для первого начала термодинамики можно получить (вычитая A и поделив обе части равенства на r):
∆rU =1− Ar ,
к окончательному результату можно прийти, заменяя работу ее приближенным выражением:
∆rU =1− mr1µRT = 0,924
Таким образом, при испарении воды преобладают затраты энергии на увеличение внутренней энергии, а доля работы против сил внешнего давления мала.
4. Зачетная контрольная работа № 2
4.1.Варианты домашних зачетных заданий
Впредлагаемой ниже таблице приведены варианты зачетной контрольной
работы № 2 по изложенной в данном пособии теме. Каждая строчка таблицы содержит номера задач, входящих в вариант задания, номер которого определяется номером строки. Вам следует выбрать вариант с номером, совпадающим с последней цифрой номера вашей зачетной книжки. Если номер зачетки кончается на 0, нужно выполнять вариант № 10.
Задачи взяты из задачника [4] и приведены в Приложении.
|
Номер варианта |
Номера задач |
|||||
|
1 |
204 |
209 |
225 |
233 |
259 |
269 |
|
2 |
202 |
212 |
226 |
234 |
257 |
270 |
|
3 |
207 |
211 |
227 |
235 |
258 |
268 |
|
4 |
208 |
213 |
228 |
236 |
262 |
272 |
|
5 |
202 |
214 |
230 |
237 |
260 |
269 |
|
6 |
204 |
216 |
229 |
238 |
263 |
268 |
|
7 |
205 |
209 |
230 |
239 |
261 |
266 |
|
8 |
201 |
212 |
232 |
240 |
262 |
265 |
|
9 |
203 |
215 |
231 |
235 |
264 |
267 |
|
10 |
206 |
210 |
232 |
239 |
261 |
271 |
4.2. Приложение. Задачи, включенные в варианты зачетной контрольной работы № 2
201. Определить количество веществаν и число N молекул кислорода массой m=0,5кг.
202. Сколько атомов содержится в ртути: 1) количеством вещества
ν=0,2моль; 2) массой m=1г?
203. Вода при температуре t=4˚C занимает объем V=1см 3. Определить количество вещества ν и число N молекул воды.
204. Найти молярную массу μ и массу m м одной молекулы поваренной соли.
205. Определить массу mм одной молекулы углекислого газа.
53
206. Определить концентрацию n молекул кислорода, находящихся в сосуде объемом V=2 л. Количество вещества кислорода равно ν =0,2моль.
207. Определить количество веществаν водорода, заполняющего сосуд объемом V=3 л, если концентрация молекул газа в сосуде n=2 1018 м-3.
208. В баллоне объемом V=3л содержится кислород массой m=10г. Определить концентрацию молекул газа.
209. Баллон объемом V=20л заполнен азотом при температуре T=400K. Когда часть газа израсходовали, давление в баллоне понизилось на Δp=200 кПа. Определить массу m израсходованного азота. Процесс считать изотермическим.
210. В баллоне объемом V=15л содержится аргон под давлением
p1=600кПа и температуре T1=300K. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до p2=400кПа, а температура установилась T2=260K. Определить массу m аргона, взятого из баллона.
211. Два сосуда одинакового объема содержат кислород. В одном сосуде давление p1=2МПа, и температура T1=800K, в другом p2=2,5МПа, T2=200K. Сосуды соединили трубкой и охладили находящийся в них кислород до температуры T=200K. Определить установившееся в сосудах давление p.
212. Вычислить плотностьρ азота, находящегося в баллоне под давлением p=2МПа и имеющего температуру T=400K.
213. Определить относительную молекулярную массу M газа, если при температуре T=154K и давлении p=2,8МПа он имеет плотность ρ=6,1кг/м3.
214. Найти плотностьρ азота, при температуре T=400K и давлении p=2МПа.
215. В сосуде объемом V=40л находится кислород при температуре T=300K. Когда часть газа израсходовали, давление в баллоне понизилось на Δp=100кПа. Определить массу m израсходованного кислорода. Процесс считать изотермическим.
|
225. Определить суммарную кинетическую энергию Eк |
поступательного |
||||||
|
движения всех молекул газа, находящегося в |
сосуде |
объемом V=3л под |
|||||
|
давлением p=540кПа. |
|||||||
|
226. |
Количество вещества гелияν =1,5 |
моль, |
температура |
T=120K. |
|||
|
Определить суммарную кинетическую энергию Eк поступательного движения |
|||||||
|
всех молекул этого газа. |
|||||||
|
227. Молекулярная внутренняя энергия Um |
некоторого двухатомного газа |
||||||
|
равна 6,02кДж. Определить среднюю кинетическую |
εэнергию |
< вр> |
|||||
|
вращательного движения одной молекулы этого газа. Газ считать идеальным. |
|||||||
|
228. Определить среднюю кинетическую энергиюε><одной мол |
екулы |
||||||
|
водяного пара при температуре T=500K. |
|||||||
|
229. Определить среднюю квадратичную |
скоростьυ |
кв |
молекулы |
газа, |
|||
|
заключенного в сосуд объемом V=2л под давлением p=200кПа. Масса газа |
|||||||
|
m=0,3г. |
|||||||
|
230. |
Водород находится при температуре T=300K. |
Найти |
среднюю |
кинетическую энергию < ε вр > вращательного движения одной молекулы, а также суммарную кинетическую энергию Eк всех молекул этого газа; количество вещества водорода ν=0,5моль.
54
231. При какой температуре средняя кинетическая энергияε < пост > поступательного движения молекулы газа равна 4,14 10-21Дж?
232. В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса m каждой пылинки равна 6 10-10 г. Газ находится при температуре T=400K. Определить средние квадратичные скоростиυ кв, а также средние кинетические энергииε< пост > поступательного движения молекулы азота и пылинки.
233. Определить показатель адиабатыγ идеального газа, который при
температуре T=350K и давлении p=0,4МПа занимает объем V=300л и имеет теплоемкость Cυ=857Дж/K.
234. Определить относительную молекулярную массу Mr и молярную массу μ газа, если разность его удельных теплоемкостей cp-cυ=2,08кДж/(кг K).
235. В сосуде, объемом V=6л находится при нормальных условиях двухатомный газ. Определить теплоемкость Cυ этой массы газа при постоянном объеме.
236. Определить молярные теплоемкости газа, если его удельные теплоемкости cυ=10,4кДж/(кг K) и cp=14,6кДж/(кг K).
237. Найти удельные cp и cυ и молярные С p и Сυ теплоемкости азота и гелия.
238. Вычислить удельные теплоемкости газа, зная, что его молярная масса μ=4 10-3 кг/моль и отношение теплоемкостей Cp/Cυ=1,67.
239. Трехатомный газ под давлением p=240kПа и температуре˚Ct=20 занимает объем V=10л. Определить теплоемкость Cp этого газа при постоянном давлении.
240. Одноатомный газ при нормальных условиях занимает объем V=5л. Определить теплоемкость Cυ этого газа при постоянном объеме.
257. При адиабатическом сжатии давление воздуха было увеличено от p1=50kПа до p2=0,5MПа. Затем при неизменном объеме температура воздуха была понижена до первоначальной. Определить давление p3 газа в конце процесса.
258. Кислород массой m=200г занимает объем V1=100л и находится под давлением p1=200kПа. При нагревании газ расширился при постоянном давлении до объема V2=300л, а затем его давление возросло до p3=500kПа при неизменном объеме. Найти изменение внутренней ΔUэнергиигаза, совершенную им работу A, и теплоту Q, переданную газу. Построить график процесса.
259. Объем водорода при изотермическом расширении (T=300K) увеличился n=3 раза. Определить работу A, совершенную газом и теплоту Q, полученную газом при этом. Масса m водорода равна 200г.
260. Водород массой m=40г, имевший температуру T=300K, адиабатно расширился, увеличив объем в n1=3 раза. Затем при изотермическом сжатии объем газа уменьшился в n2=2 раза. Определить полную работу A, совершенную газом, и его конечную температуру.
261. Азот массой m=0,1кг был изобарно нагрет от температуры T1=200K до температуры T2=400K. Найти изменение внутренней энергииΔU газа, совершенную им работу A, и теплоту Q, переданную газу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
