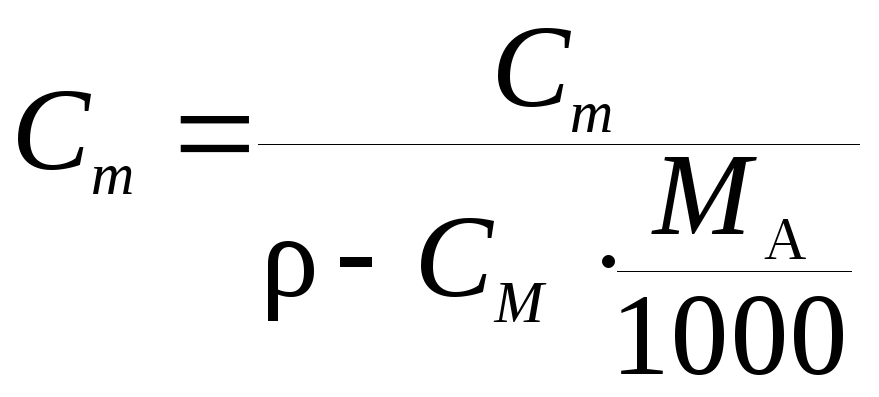Ученик
(95),
закрыт
2 года назад
Вячек
Высший разум
(391245)
4 года назад
Для удобства примем объём раствора за 1 л, плотность – 1,1 г/мл (а не г/моль!):
m(р-ра) = V*p = 1000 мл*1,1 г/мл = 1100 г
m(HNO3) = m()*w = 1100 г*0,25 = 275 г
n(HNO3) = m/M = 275 г/63 г/моль = 4,365 моль
Cm = n/V = 4,365 моль/1 л =
Для азотной кислоты молярность и нормальность раствора
одна и та же (численно) – 4,365 моль/л или 4,365 экв/л
7.1 Способы выражения концентрации растворов
Раствором
называется
гомогенная
система переменного состава, образованная
двумя или несколькими веществами
(компонентами).
В
инженерной практике широко применяют
жидкие растворы (в дальнейшем «растворы»),
состоящие из жидкого растворителя (чаще
всего воды) и одного или нескольких
растворенных веществ, которые до
растворения (смешивания) могли быть
твердыми, жидкими или газообразными.
Важнейшая
характеристика раствора – концентрация,
выражающая относительное содержание
веществ в растворе.
Наиболее
употребительные способы выражения
концентрации вещества в растворе
приведены в таблице 7.1.
Различные
способы выражения концентрации связаны
между собой, что позволяет в каждом
конкретном случае осуществить переход
от одного способа к другому (табл. 7.2).
Так
как вещества взаимодействуют в
эквивалентных количествах (закон
эквивалентов), то растворы одинаковой
нормальности реагируют в равных объемах.
В общем случае, объемы растворов V1
и V2
прореагировавших
веществ обратно пропорциональны их
нормальностям (CN1,
CN2):
|
|
(7.1) |
При
взаимодействии раствора объемом V,
выраженному в мл, и нормальностью СN
c
твердым веществом массой mА
и эквивалентной массой mЭ
закон эквивалентов выражается
соответствием:
|
|
(7.2) |
Рассмотрим решение
типичных задач.
Пример
1. Азотную
кислоту массой 10 г растворили в 40 мл
воды. Плотность полученного раствора
1,115 г/мл. Вычислите массовую долю HNO3
в полученном растворе (HNO3),
молярную CM,
нормальную CN
и моляльную Cm
концентрации азотной кислоты в растворе.
Решение
1
Для определения массовой доли найдем
массу раствора mр
(плотность воды равна 1 г/мл), масса воды
равна 40 г или 0,04 кг):
mр
= mв
+ m(H2O)
= 10 + 40 = 50 г,
и
вычислим массовую долю HNO3
в полученном
растворе:
 .
.
2
Для определения молярной концентрации
найдем количество HNO3,
содержащееся в 1 л раствора.
Для
этого найдем массу 1 л (1000 мл) раствора:
mр
= V
∙ ρ = 1000 ∙ 1,115 = 1115 г,
определим
массу азотной кислоты в этом растворе:
m(HNO3)
= mр
∙ ω = 1115 ∙0,2 = 223 г
и
вычислим молярную концентрацию HNO3
в растворе:
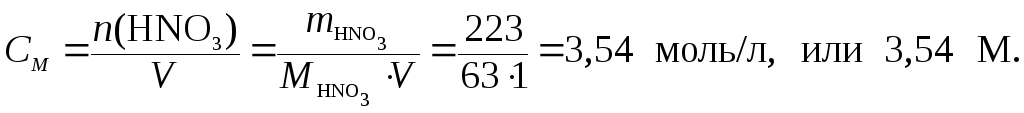
3
Для определения нормальной концентрации
найдем количество моль-эквивалентов
HNO3,
содержащееся в 1 л раствора.
Для
этого найдем эквивалентную массу HNO3:
mэ(HNO3)
= M(HNO3)/1
= 63 г/моль-экв
и
вычислим нормальную концентрацию HNO3
![]() моль-экв/л,
моль-экв/л,
или 3,53 н.
4
Рассчитаем моляльную концентрацию:

Эту
задачу можно решить и с использованием
формул для пересчета концентрации
растворов, приведенных в табл. 7.2.
Молярную
концентрацию HNO3
в растворе найдем исходя из массовой
доли (см. табл. 7.2).

Так
как молярная масса HNO3
равна эквивалентной массе (HNO3
– одноосновная кислота, см. табл. 7.2), то
нормальная (эквивалентная) концентрация
равна молярной концентрации
СN
= СM
= 3,54
моль-экв/л, или 3,54 н.
Таблица
7.1
Способы выражения
концентрации растворов
|
Название и обозначение |
Определение |
Расчетная |
Пример |
Размерность |
|
Массовая доля |
Отношение |
a) б) |
20 % раствор соли
20 |
а) нет б) масс. % |
|
М |
Отношение |
|
нет |
|
|
Молярная |
Отношение |
|
1
раствор
1 |
моль/л |
|
Нормальная |
Отношение |
|
СN(Н2SO4)
раствор |
моль-экв/л |
|
Моляльная |
Отношение
количества |
|
Cm
раствор |
моль/кг |

Таблица
7.2
Формулы для
пересчета концентраций растворов
|
Способ |
ω |
СM, моль/л |
СN, моль-экв/л |
Сm, моль/кг |
|
Массовая доля, |
|
|
|
|
|
М |
|
|
|
|
|
Нормальная |
|
|
|
|
|
Моляльная |
|
|
|
|
|
В |

Моляльную
концентрацию раствора HNO3
можно найти по одной из формул пересчета
концентраций исходя, например, из
массовой доли (нижняя строка табл. 7.2)
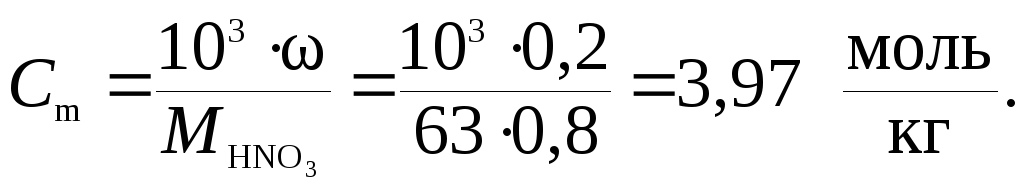
Примеры
расчета эквивалентных масс кислот,
оснований и солей приведены в табл.
7.3.
Таблица
7.3
Примеры
расчета эквивалентных масс кислот,
оснований, солей
|
Класс вещества
определения |
Пример |
|
Кислота
|
|
|
Основание
|
|
|
Соль
|
|
На
практике часто приходится готовить
разбавленный раствор с массовой долей
растворенного вещества ωА′
и массой m′
из концентрированного раствора этого
же вещества (ωА,
m),
разбавляя последний водой массой
m(H2O).
Ясно, что масса растворенного вещества
и в концентрированном, и в разбавленном
растворе постоянна, увеличивается лишь
масса вновь приготовленного раствора:
m′
= m
+ m(H2O).
Все величины
связаны между собой соответствием:
|
ωА′m′ |
(7.3) |
Необходимость
приготовления раствора промежуточого
состава (ω′′, m′′)
появляется при смешивании концентрированного
раствора (ωА,
m)
и разбавленного (ωА′,
m′)
растворов. Масса растворенного вещества
в приготовленном растворе равна сумме
масс этого вещества в концентрированном
и разбавленном растворах. Для этого
случая все величины связаны соотношением:
|
ωА′′ |
(7.4) |
При
выполнении расчетов, связанных с
концентрацией растворов, полезными
могут быть формулы для определения
массы растворенного вещества (mА)
или числа молей растворенного
вещества(υА):
|
mA |
(7.5) |
|
|
mA |
(7.6) |
где
m
– масса (г), V
– объем (мл или см3,
л) и
– плотность (г/мл, г/см3,
кг/л) раствора с массовой долей ω
растворенного вещества.
Пример
2. Вычислить
объем V
(л) разбавленного раствора с массовой
долей Н2SO4
1,0 % и плотностью 1,006 г/мл, приготовленного
добавлением воды к 250 мл концентрированного
раствора с массовой долей Н2SO4
6,0 % и
плотностью 1,041 г/мл. Рассчитать массовую
долю растворенного вещества в разбавленном
растворе.
Решение
При
разбавлении концентрированного раствора
растворителем (водой) увеличивается
масса раствора, но масса растворенного
вещества (Н2SO4)
остается постоянной и во вновь
приготовленном растворе. Следовательно,
изменяется отношение масс растворенного
вещества и раствора, то есть концентрация.
С
учетом равенства массы Н2SO4
в
концентрированном и разбавленном
растворах используем формулу (7.3):
ω′m′
= ω′ (m
+ m(H2O))
= ω∙m,
где
ω, m
– массовая доля, масса концентрированного
раствора;
ω′,
m′
– массовая доля, масса разбавленного
раствора.
Массу
раствора можно выразить через объем
раствора и его плотность:
m
= V∙ρ.
С
учетом этого соотношения преобразуем
формулу (7.6):
ω′V′ρ′
= ωVρ.
Отсюда
 .
.
Для
нахождения молярной доли Н2SO4
необходимо
вычислить массу (m′)
Н2SO4
и массу
Н2О
в разбавленном 1,0 %-ном растворе
m′
= ω′∙mр-ра
= ω′∙V′∙ρ′
= 0,01∙154∙1,006 = 15,553 г;
mр-ра
= V′∙ρ′
= 1546∙1,006 = 1555,276 г;
m(H2O)
= mр-ра
– m′
= 1555,276 – 15,553 = 1539,723 г;
M(H2SO4)
= 2∙1 + 32 + 4∙16 = 98 г/моль; М(Н2О)
= 2∙1 + 16 = 18 г/моль.
Определим
молярную долю Н2SO4
в растворе (см. табл. 7.1).

Пример
3. Рассчитать
массовую долю (ω′′) серной кислоты в
растворе, приготовленном смешением 50
мл разбавленного раствора с молярной
концентрацией 1,1 моль/л и плотностью
1,06 г/мл с 10 мл концентрированного
раствора с массовой долей Н2SO4
98 % и плотностью 1,9 г/мл.
Решение
Вычисляем
массовую долю (ω′) Н2SO4
в разбавленном растворе, воспользовавшись
формулой для пересчета молярной
концентрации (СМ)
в массовую долю из табл. 7.2. Молярная
масса серной кислоты М(H2SO4)
= 98 г/моль.

Для
расчета массовой доли (ω′′) Н2SO4
в приготовленном растворе применим
формулу (7.4), выразив массы исходных
веществ через объем и плотность
ω′′m′′
= ω′m′
+ ωm,

Пример
4. Определить,
до какого объема (л) необходимо выпарить
2 л разбавленного раствора сульфата
магния с массовой долей МgSO4
2,0 % и плотностью 1,011 г/мл, чтобы приготовить
концентрированный раствор с молярной
концентрацией 1,1 моль/л.
Решение
Воспользовавшись
формулой пересчета массовой доли (ω′)
МgSO4
в нормальную концентрацию (см. табл.
7.2), определим СN
разбавленного раствора (М(МgSO4)
= 120 г/моль; ω = 2 % = 0,02):
![]() моль-экв/л,
моль-экв/л,
или 0,33 н.
Объем
концентрированного раствора МgSO4
вычислим из соотношения (7.1). Учтем СN
= СМ∙n(MgSO4)
= 1,1∙2 = 2,2 моль-экв/л.
СN′∙V′
= CN∙V,

Пример
5. Для
нейтрализации 100 мл раствора серной
кислоты потребовалось 20 мл 0,5 н раствора
гидроксида натрия. Вычислите нормальность
раствора Н2SO4
и массу кислоты в этом растворе.
Решение
Согласно закону
эквивалентов:
![]()
![]() моль-экв/л,
моль-экв/л,
или
0,1 н.
Масса кислоты в
растворе составит:
m(H2SO4)
=
CN(H2SO4)
∙
mЭ(H2SO4)
=0,01∙
49
= 0,49 г.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Выполнение проверочного задания по общей и неорганической химии
Задание 2
1) Вычислите: а) молярную; б) нормальную; в) моляльную концентрации и титр 40%-ного раствора HNO3, плотность раствора 1,251 г/см3.
2) При какой температуре будет кипеть и замерзать 40%-ный водный раствор глицерина СЗН8OЗ? К = 1‚86; Е = 0‚52.
3) Концентрация ионов водорода в растворах: [H+] = 10-3; 10-6; 10-12 молъ/л. Определите pH и концентрацию гидроксид-ионов в этих растворах. Укажите характер среды.
4) Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) CaSO4 и Na3PO4; б)Na2S и Pb(NO3)2; в) Na2CO3 и Ca(HCO3)2.
5) Вода, содержащая только гидрокарбонат магния, имеет жесткость 6.0 мэкв/л. Какая масса гидрокарбоната магния содержится в 5 м3 воды? Напишите уравнения реакции для устранения жесткости этой воды.
Решение:
1. Вычисление концентраций и титра раствора HNO3
w% = 40%;
M(HNO3) = 63 г/моль;
p(p-pa) = 1,251 г/см3.
Рассчитаем массу 40%-ного раствора HNO3 плотностью раствора 1,251 г/см3, получим:
m(p-pa) = V9p-pa) . p(p-pa) = 1000 . 1,251 = 1251 г = 1,251 кг.
Определим массу HNO3 в растворе, получим:
m(HNO3) = [m(p-pa) . w%]/100% = 1251 . 40/100% = 500,4 г = 0,5004 кг.
а) Расчет молярной концентрации 40%-ного раствора HNO3
Молярная концентрация показывает количество моль вещества в 1 л его раствора, получим:
СМ = n(HNO3) = m(HNO3)/M(HNO3) = 500,4/63 = 7,94 моль/л или 7,94М.
б) Расчет нормальности 40%-ного раствора HNO3
Нормальность раствора показывает количество эквивалентов вещества в 1 л его раствора, получим:
Учитывая, что азотная кислота одноосновная, то СМ = СН
CH = СМ = m(HNO3) г/M(HNO3) г/моль . 1 л = 7,94 моль/л или 7,94Н.
в) Расчет моляльной концентрации 40%-ного раствора HNO3
Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя.
Моляльность m = (7,94 моль)/(1,251 кг –0,5004 кг) = (7,94 моль)/0.7506 кг = 10,58 моль/кг воды.
в) Расчет титра раствора HNO3, получим:
Титр раствора — число граммов растворённого вещества на 1 см3 раствора.
Тогда
Т = m(HNO3)/1000 = 500,4/1000 = 0,5004 г/см3.
2. Определение температуры кипения и замерзания 40%-ного водного раствор глицерина
М(СЗН8OЗ) = 92 г/моль.
а) Расчет температуры кипения глицерина
По закону Рауля раствор закипает при более высокой температуре, так как концентрация молекул растворителя в нём всегда ниже, чем в чистом растворителе, и давление насыщенного пара раствора достигает атмосферного при более высокой температуре. Выражается это уравнением:
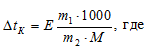
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 40 г; m2 – масса растворителя, 60 г; М – молярная масса растворённого вещества, 92 г/моль; ∆tк – понижение температуры кипения раствора.
Повышение температуры кипения раствора глицерина:
∆tк = (0,52 . 40 . 1000)/(92 . 60) = 20800/5520 = 3,77.
Следовательно, температура кипения раствора t(ра-ра) = t(ра-ля) +∆tк = 3,77 + 100 = 103,77 oС.
Ответ: 103,77 oС.
б) Расчет температуры замерзания глицерина
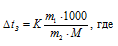
К – криоскопическая константа; m1 – масса растворённого вещества, 40 г; m2 – масса растворителя, 60 г; М – молярная масса растворённого вещества, 92 г/моль; ∆tз – понижение температуры замерзания раствора.
Понижение температуры замерзания раствора глицерина:
∆tз = (1,86 . 40 . 1000)/(92 . 60) = 74400/5520 = 13,48.
Следовательно, температура замерзания раствора t(ра-ра) = t(ра-ля) + ∆tз = 0 + 13,48 = -13,48 oС.
Ответ: -13,48 oС.
3. Определениее pH и концентрации гидроксид-ионов в растворах
а) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 . 10-3 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-3 = 3 – lg1 = 3 – 0 = 3.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 – рН = 14 – 3 = 11
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] = -lgрОН = -lg11 = 1 . 10-11 молъ/л.
Ответ: рН = 3; [OH–] = 1 . 10-11 молъ/л.
б) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 . 10-6 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-6 = 6 – lg1 = 6 – 0 = 6.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 – рН = 14 – 6 = 8
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] = -lgрОН = -lg8 = 1 . 10-8 молъ/л.
Ответ: рН = 6; [OH–] = 1 . 10-8 молъ/л.
в) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 * 10-12 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-12 = 12 – lg1 = 12 – 0 = 12.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 – рН = 14 – 12 = 2
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] = -lgрОН = -lg2 = 1 . 10-2 молъ/л.
Ответ: рН = 12; [OH–] = 1 . 10-2 молъ/л.
4. Ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) CaSO4 и Na3PO4; б)Na2S и Pb(NO3)2; в) Na2CO3 и Ca(HCO3)2.
а) CaSO4 и Na3PO4
3CaSO4 + 2Na3PO4 = Са3(РО4)2↓ + 3Na2SO4 – (молекулярная форма);
3Ca2+ + 3SO42- + 6Na+ + 2PO43- = Са3(РО4)2↓ + 6Na+ + 3SO42- – (ионно-молекулярная форма);
3Ca2+ + 2PO43– = Са3(РО4)2↓ – (сокращенная ионно-молекулярная форма).
б) Na2S и Pb(NO3)2
Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3 – (молекулярная форма);
2Na+ + S2- + Pb2+ + 2NO3– = PbS↓ + 2Na+ + 2NO3– – (ионно-молекулярная форма);
Pb2+ + S2- = PbS↓ – (сокращенная ионно-молекулярная форма).
в) Na2CO3 и Ca(HCO3)2
Na2CO3 + Ca(HCO3)2 = CaCO3↓ + 2NaHCO3 – (молекулярная форма);
2Na+ + CO32- + Ca2+ + 2HCO3– = CaCO3↓ + 2Na+ + 2HCO3– – (ионно-молекулярная форма);
Ca2+ + CO32- = CaCO3↓ – (сокращенная ионно-молекулярная форма).
5. Расчет гидрокарбоната магния в воде. Устранение жесткости воды
а) Расчет массы гидрокарбоната магния в 5 м3 воды
Молярная масса эквивалента Mg(HCO3)2 = M/2 = 146,34 г/моль/2 = 73,17 г/моль. Массу гидрокарбоната магния, содержащуюся в воде находим из формулы:
Ж = m(В)/[MЭ(В).V], где
m – масса вещества В, обуславливающая жёсткость воды, мг; MЭ(В) – молярная масса эквивалента вещества В, мг/моль; V – объём воды, л.
Отсюда
m(В) = Ж . MЭ(В) . V; m[Mg(HCO3)2] = 6 . 73,17 . 5000 = 2195100 мг или 2195,1 г.
Ответ: m[Mg(HCO3)2] = 2195,1 г.
б) Уравнения реакции для устранения жесткости воды
Карбонатную («временную») жёсткость можно устранить введением ионов ОН–. Обычно используют Са(ОН)2 или Na2CO3:
Mg(НСО3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3;
Mg(НСО3)2 + Са(ОН)2 = MgCO3↓ + СаСО3↓ + 2Н2О
…
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов. Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Показать решение »
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
х г — в 150 г
х =30 г
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
х г — в 100 г
х =15,4
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
х г — в 100 г
х = = 23,1
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Показать решение »
Решение.
Согласно закону эквивалентов при нейтрализации в точке эквивалентности действует равенство, называемое Золотым правилом аналитики:
СН1×V1 = СН2×V2
0,1×20 = СН2×6
СН2 = 0,3 н.
Задача 3. Нормальная концентрация раствора KNO3 равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3 и молярную концентрацию раствора KNO3. Плотность раствора принять раной 1 г/мл.
Показать решение »
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
Т.е. 1 н – 101 г
0,2 н. – х г
х = 20,2 г
Теперь вычислим молярную концентрацию
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Т.е. 1 М – 101 г
х – 20,2 г
х = 0,2 моль/л
Таким образом, Сн = См = 0,2 моль/л
Далее находим процентную концентрацию.
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
х = 2,02 г
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента (нормальность) 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Показать решение »
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
х = 235,6 г.
Молярность определим с помощью соотношения:
См = n/V
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Сн = nэ/V
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
nэ = m/ Мэ = 235,6/55,5 = 4,2 моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Показать решение »
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
Найдем Молярную концентрацию эквивалента или нормальность:
M(NaOH) = 23+16+1 = 40 г/моль
Сн = nэ/V
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
nэ = m/ Мэ = 398,4/40 = 9,96 моль
Сн = 9,96/1 = 9,96 н
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
Далее находим процентную концентрацию или массовую долю вещества.
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Показать решение »
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
х1 = 316,2 г
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
х2 = 100,9 г
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
mр-ра (HNO3) = 3162+5045 = 8207 г
Найдем Молярность
См = n/V
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
ω(HNO3) = m (HNO3)/mр-ра = 417,1/8207 = 0,05 или 5 %
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Показать решение »
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10-3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
См = n/V = 0,41/1,5 = 0,274 М
Найдем нормальность:
nэ = m/Мэ = 62,4/76 = 0,82 моль
Сн = nэ/V = 0,82/1,5 = 0,547 н
Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:![]()
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Показать решение »
Решение.
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
![]()
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г — 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Показать решение »
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
![]()
V0.5/V0.1 = 0,1/0,3 = 1/3
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для 0,5 М раствора HNO3
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х1 л — 1 л
х1 = 0,25 л
Для 0,1 М раствора HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х2 л — 1 л
х2 = 0,75 л
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 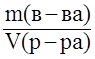 ; (г/мл).
; (г/мл).
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 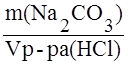 ; г/мл.
; г/мл.
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 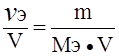 ; моль/л; Сэ = N =
; моль/л; Сэ = N = 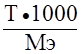 ;
;
См = 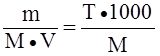 ; моль/л
; моль/л
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ – e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 – 2e – ® 2H+ + O2 ® Мэ(H2O2) = ![]() М(H2O2) = 17,01 г/моль.
М(H2O2) = 17,01 г/моль.
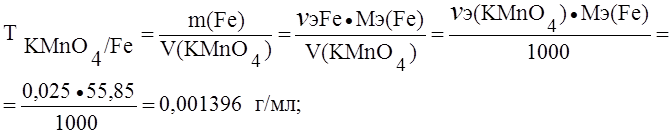
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
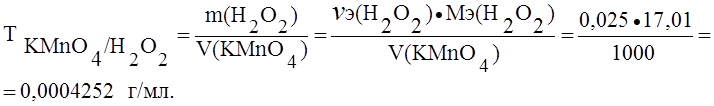
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) = 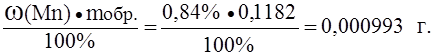
® Т NaAsO2/Mn = 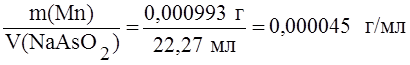 .
.
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e – ® NO + 2H2O.
Решение.
Сэ = 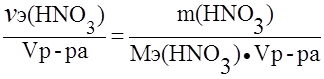 ;
;
M(HNO3) = 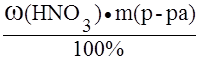 ; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;
; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;
Vр-ра=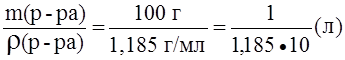 ;
;
Мэ(HNO3) = ![]() М(HNO3) =
М(HNO3) = ![]() · 63 г/моль = 21,01 г/моль;
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) = 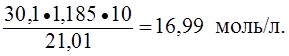

 олярная
олярная олярная
олярная