При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
как можно определить валентность кислотного остатка? химия
саша купцова
Ученик
(131),
закрыт
3 года назад
Тимур Шахин
Мастер
(2311)
12 лет назад
Посчитать количество атомов водорода соответствующей кислоты. Например: PO4, кислота H3PO4, 3 атома Н, остаток PO4 трёхвалентный.
Или сложить степени окисления всех элементов в остатке учитывая индексы. Например SO4 S(+6) O(-2) 6+(-2)*4=-2. Степень окисления в основном равна валентности
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
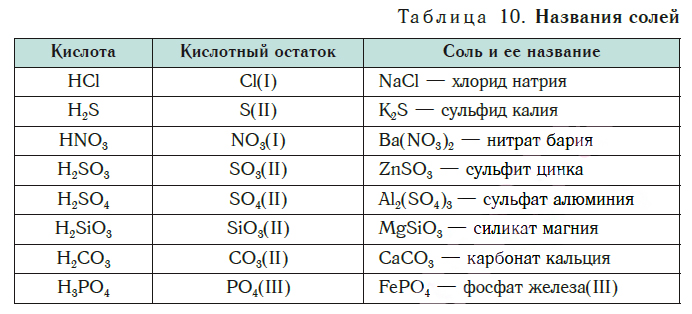
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
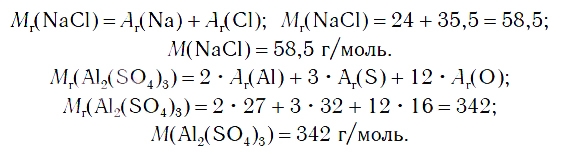
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
| 01 |
Соли — самый разнообразный и многочисленный класс неорганических соединений. Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства. |
||||||||
Средние соли |
|||||||||
| 02 | Наиболее простые среди прочих видов солей — средние:
средние соли — это соединения, состоящие из атомов металлов и кислотных остатков Свое название эти соли получили именно потому, что представляют собой нечто среднее между основанием и кислотой: |
||||||||
| 03 |
Согласно правилам систематической номенклатуры название средней соли состоит из названия кислотного остатка, названия металла и валентности металла, если она не постоянна:
|
| 04 | Чтобы определить неизвестную валентность металла по формуле соли, необходимо:
|
||||||
| 05 | Можно воспользоваться альтернативным способом определения валентности металла:
|
||||||
| 06 | Чтобы написать формулу средней соли по ее названию, например:
необходимо, как и в любых подобных ситуациях:
|
||||||
| 07 |
К средним солям относится и хорошо знакомая нам поваренная соль — это хлорид натрия NaCl. Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). |
Кислые соли |
|||||
| 10 | Кислые соли называются так потому, что при их образовании не все атомы водорода в кислоте были замещены атомами металлов:
кислые соли — это соединения, состоящие из атомов металлов, кислотных остатков и не замещенных металлами атомов водорода Например, серная кислота может образовывать как средние, так и кислые соли:
В то же время бромистоводородная кислота HBr, не может образовывать кислых солей вообще, поскольку имеет лишь один атом водорода: либо он есть, либо его нет. А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4. |
||||
| 11 |
Каждый атом водорода уменьшает валентность кислотного остатка на единицу. Так, если для образования средней соли одному атому двухвалентного кальция требовался один сульфат, то в случае кислой соли их потребуется уже два:
|
||||
| 12 |
Название кислой соли состоит из названия кислотного остатка, к которому добавляется префикс гидро- или дигидро-, в зависимости от того, сколько атомов водорода — один или два, — с ним связано, а также названия металла и его валентности, если она не постоянна:
|
||||
| 13 | Валентность металла в кислой соли, например Cr(HSO3)3, определяется по известному алгоритму:
|
||||
| 14 | Теперь попробуем вывести формулу кислой соли по ее названию, например:
Для этого:
|
||||
Основные соли |
|||||
| 15 | Осно́вные соли называются так потому, что при их образовании не все гидроксилы в соответствующем основании были замещены кислотными остатками:
основные соли — это соединения, состоящие из атомов металлов, незамещенных гидроксилов и кислотных остатков. Так, кальций может образовывать одну основную соль:
а трехвалентное железо — две: Гидроксиды же одновалентных металлов, очевидно, вообще не могут образовывать основных солей. |
||||
| 16 |
Каждый гидроксил уменьшает валентность металла на единицу: в средней соли на один карбонат приходится один атом кальция, а в основной соли — уже два:
|
||||
| 17 |
Название основной соли состоит из названия кислотного остатка, названия металла, к которому добавляется префикс гидроксо-, дигидроксо- или тригидроксо-, в зависимости от того, сколько гидроксилов — один, два или три, — связано с одним атомом металла, а также валентности металла, если она не постоянна:
|
||||
| 18 | Валентность металла в основной соли, например Sn(OH)3NO3, определяется таким же способом, как и в других типах солей: | ||||
| 19 | Чтобы вывести формулу основной соли по ее названию, например
силикат гидроксомеди (II), сделаем следующее:
|
||||
Правила
составления формул кислых солей по
названию.
Чтобы
научиться составлять формулы кислых
солей необходимо уметь составлять
формулы средних солей по кислотным
остаткам соответствующих кислот (см. §
1).
Пример
1:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:




гидрофосфат
калия
KHPO4
Приставка
ГИДРО означает, что соль кислая,
поэтому, в составе кислотного остатка
1 атом Н (атом водорода).Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:






гидрофосфат
калия
I
IIKHPO4
Валентность
калия равна I , так как калий элементI
группы главной подгруппы.Валентность
кислотного остатка HPO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
HPO43
-1 = II
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
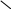




НОК
= 2I
IIK2HPO4
2
: I = 2 2 : II = 1единицу не
пишутСамое
маленькое число, делящаеся на обе
валентностит.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
10 ¾
Пример
2:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:





дигидрофосфат
кальция
СаH2PO4
Приставка
ДИГИДРО означает, что соль кислая и
имеетв
составе кислотного остатка 2 атома Н“ДИ”
означает ДВА (атома водорода)Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:




дигидрофосфат
калия
II
IСаH2PO4
Валентность
кальция равна II , так как кальций
элементII
группы главной подгруппы.Валентность
кислотного остатка H2PO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
H2PO43
-2 = I
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
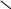





НОК
= 2II
IСа(H2PO4)2
2
: II = 1 2 : I = 2кислотный
остатокнадо
взять в скобки, т.к.результат
делениябольше
1Самое
маленькое число, делящаеся на обе
валентности,т.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
11 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


2.jpg)
3.jpg)



2.jpg)

2.jpg)

2CO3.jpg)
2Br.jpg)
