Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества
распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем
лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K+ (катион) + A– (анион)
NaCl ⇄ Na+ + Cl–

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы
и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4,
H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы.
Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Na3PO4 ⇄ 3Na+ + PO43-
Из одной молекулы ортофосфата натрия образовалось 4 иона.
K2SO4 ⇄ 2K+ + SO42-
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности,
вещества делятся на электролиты и неэлектролиты.

Электролиты – жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический
ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты – вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят
электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми
наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике – остается только то,
что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A – (анион)

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты – жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты – вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике – остается только то, что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Теория электролитической диссоциации
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации?
Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
CaCl2 → Ca 2+ + 2Cl –
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
СH3COOH ⇄ СH3COO – + H +
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
§ 36. Электролитическая диссоциация
Как вы знаете из уроков физики, растворы одних веществ способны проводить электрический ток, а других — нет. Чтобы опытным путём проверить эту способность у растворов различных веществ, воспользуемся следующим прибором (рис. 129).
Он состоит из стакана, в который наливают раствор исследуемого вещества. На стакан ставят пластинку из эбонита с вмонтированными в неё двумя угольными электродами, к клеммам которых присоединены провода. Один из них соединён с лампочкой.

Выходной контакт от лампочки и провод от другой клеммы идут к источнику тока. Если раствор, налитый в стакан, проводит электрический ток, то лампочка загорается, и чем лучше эта способность, тем ярче горит лампочка. Проводят электрический ток растворы солей, щелочей, кислот.
Вещества, растворы которых проводят электрический ток, называют электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называют неэлектролитами.
Почему же растворы электролитов проводят электрический ток?
Шведский учёный Сванте Аррениус, изучая электропроводность растворов различных веществ, пришёл в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называют электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.

Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решёткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита (рис. 130).

Рис. 130.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате химическая связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
- ориентация молекул — диполей воды около ионов кристалла;
- гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
- диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощённо происходящие процессы можно отразить с помощью следующего уравнения:
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, молекулы хлороводорода НСl, рис. 131), только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную, и последовательность процессов, происходящих при этом, будет такая:
- ориентация молекул воды вокруг полюсов молекулы электролита;
- гидратация (взаимодействие) молекул воды с молекулами электролита;
- ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
- диссоциация (распад) молекул электролита на гидратированные ионы.

Рис. 131.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Уравнение диссоциации соляной кислоты:
В растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и объединиться. Этот обратный процесс называют ассоциацией.
Свойства гидратированных и негидратированных ионов различаются. Например, негидратированный ион меди Сu 2+ — бесцветный в безводных кристаллах сульфата меди (II) CuSO4 и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Сu 2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой α («альфа»).

Степень диссоциации электролита определяют опытным путём и выражают в долях или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью распадается на ионы. Электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице в разбавленных растворах.
К сильным электролитам относят:
- практически все соли;
- сильные кислоты, например: H2SO4, НСl, HNO3;
- все щёлочи, например: NaOH, КOН.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относят:
- слабые кислоты, например: H2S, H2CO3, HNO2;
- водный раствор аммиака NH3 • Н2O.
Ключевые слова и словосочетания
- Электролиты и неэлектролиты.
- Электролитическая диссоциация и ассоциация.
- Механизм диссоциации веществ с различным типом связи.
- Степень электролитической диссоциации.
- Сильные и слабые электролиты.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Объясните, почему раствор гидроксида калия проводит электрический ток, а раствор глюкозы С6Н12O6 — нет.
- Почему при разбавлении раствора электролита степень его диссоциации увеличивается?
- Докажите, что деление химических связей на ковалентную полярную и ионную условно.
- Как отличается по своей природе электропроводность металлов и электролитов?
- Как объяснить электрическую проводимость водных растворов электролитов?
[spoiler title=”источники:”]
http://rosuchebnik.ru/material/teoriya-elektroliticheskoy-dissotsiatsii/
http://tepka.ru/himiya_8/36.html
[/spoiler]
Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
Все вещества
делятся на 2 большие группы: электролитыинеэлектролиты.
Электролитами
называются вещества (исключая
металлы), растворы или расплавы которых
проводят электрический ток. К электролитам
относятся соединения, образованные
ионными или ковалентными полярными
связями. Это сложные вещества: соли,
основания, кислоты, оксиды металлов
(проводят электрический ток только в
расплавах).
Неэлектролитаминазываются вещества, растворы или
расплавы которых электрический ток не
проводят. К ним относятся простые и
сложные вещества, образованные
малополярными или неполярными ковалентными
связями.
Свойства растворов
и расплавов электролитов впервые
объяснил в конце XIXвека
шведский учёный Сванте Аррениус. Им
была создана специальнаятеория
электролитической диссоциации,
основные положения которой, доработанные
и развитые другими учёными, в настоящее
время формулируются следующим образом.
1. Молекулы (или
формульные единицы) электролитов в
растворах или расплавах распадаются
на положительно и отрицательно заряженные
ионы. Этот процесс называется
электролитической диссоциацией. Общая
сумма зарядов положительных ионов равна
сумме зарядов отрицательных ионов,
поэтому растворы или расплавы электролитов
в целом остаются электронейтральными.Ионы могут быть какпростые,
состоящие только из одного атома (Na+,Cu2+,Cl–,S2-), так исложные,
состоящие из атомов нескольких элементов
(SO42–,PO43–,NH4+, [Al(OH)4]–).
Простые ионы по
своим физическим, химическим и
физиологическим свойствам существенно
отличаются от нейтральных атомов, из
которых они образовались. В первую
очередь, ионы являются гораздо более
устойчивыми частицами, чем нейтральные
атомы, и могут существовать в растворах
или расплавах неограничено долгое
время, не вступая в необратимое
взаимодействие с окружающей средой.
Такое различие в
свойствах атомов и ионов одного и того
же элемента объясняется разным электронным
строением этих частиц.
Так, простые ионы
s- иp-элементов
находятся в более устойчивом состоянии,
чем нейтральные атомы, потому что имеют
завершённую электронную конфигурацию
внешнего слоя, например:
|
Nao |
– 1ē |
Na+ |
|
1s22s22p63s1 |
1s22s22p6 |
|
|
нейтральный |
положительно |
|
Fo |
+ |
F– |
|
1s22s22p5 |
1s22s22p6 |
|
|
нейтральный |
отрицательно |
Распад
электролитов на ионы в расплавах
осуществляется за счёт действия высоких
температур, а в растворах за счёт действия
молекул растворителя.
Особенностью
ионных соединений является то, что в
узлах их кристаллической решётки имеются
уже готовые ионы и в процессе таких
веществ растворения диполям растворителя
(воды) остаётся только разрушить эту
ионную решётку (рис. 18).
Вещества, образованные
полярными ковалентными связями, переходят
в раствор в виде отдельных молекул,
которые, как и молекулы Н2О,
представляют собой диполи, например:
![]()

![]() + –
+ –
В этом случае
диполи Н2О, ориентируясь
соответствующим образом вокруг
растворенной молекулы электролита,
вызывают в ней дальнейшую поляризацию
ковалентной связи, а затем и её
окончательный гетеролитический разрыв
(рис. 29).
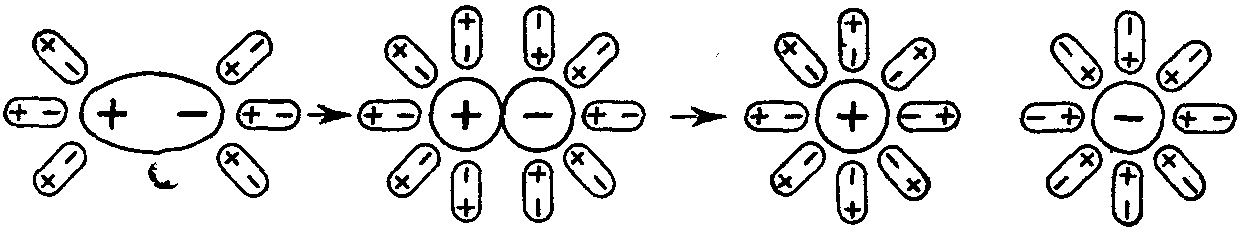
H–ClH++Cl
Рис. 29.Схема электролитической диссоциации
в растворе полярной молекулыHCl
Процесс
электролитической диссоциации протекает
одновременно с процессом растворения
веществ, и поэтому в растворах все ионы
находятся в гидратированном состоянии
(окружены оболочками из молекул Н2О).
Однако для простоты
в уравнениях химических реакций ионы
изображаются без окружающих их гидратных
оболочек: H+,NO3–,K+и т.д.
2. Ионы электролитов
в растворе или расплаве за счёт теплового
движения хаотически перемещаются по
всем направлениям. Но если в раствор
или расплав опустить электроды и
пропустить электрический ток, то
положительно заряженные ионы электролита
начинают двигаться к отрицательно
заряженному электроду – катоду (поэтому
они иначе называются катионами),
а отрицательно заряженные ионы – к
положительно заряженному электроду –
аноду (поэтому они иначе называются
анионами).
Таким образом,
электролиты являются проводниками
второго рода. Они переносят электрический
заряд за счёт направленного движения
ионов. Металлы же являются проводниками
первого рода, т.к. проводят электрический
ток за счёт направленного движения
электронов.
3. Процесс
электролитической диссоциации обратим.
Наряду с распадом молекул на ионы всегда
протекает обратный процесс – соединение
ионов в молекулы или ассоциация. Поэтому
в уравнениях реакций электролитической
диссоциации веществ вместо знака
равенства «=» ставят знак обратимости
«![]() »,
»,
например:
HF ![]()
H+ +
F–
CH3COOH
![]()
CH3COO–
+ H+
Соседние файлы в папке LEKTsII_Obschaya_khimia
- #
- #
- #
- #
- #
- #
- #
При
составлении уравнений электролитической диссоциации следует
поступать следующим образом: в левой части уравнения записать
формулу электролита, затем поставить знак равенства или обратимости в
зависимости от силы электролита. В правой части записать формулы
образующихся положительно и отрицательно заряженных ионов, указав значения и
знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить
сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты
–
это электролиты, при диссоциации которых образуются катионы водорода и
анионы кислотного остатка.
Сильные
кислоты диссоциируют полностью по одной ступени:
HCl
= H+ + Cl–
HNO3
= H+ + NO3–
H2SO4
= 2H+
+ SO42-
При
диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых
кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H+
+ NO2–
Многоосновные
слабые кислоты диссоциируют ступенчато. На каждой стадии
отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3
ступени:
1)
H3PO4 ⇆ H+
+ H2PO4–
2)
H2PO4– ⇆ H+
+ HPO42-
3)
HPO42- ⇆ H+
+ PO43-
Следует
учитывать, что диссоциация, в данном случае, по второй ступени протекает намного
слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях
почти не происходит.
Как
видно, все кислоты при диссоциации образуют катионы водорода, поэтому
они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся
красными.
Основания
– это электролиты, при диссоциации которых образуются катионы металла и в
качестве анионов гидроксид-ионы.
Сильные
электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH
= Na+
+ OH–
Ca(OH)2
= Ca2+
+ 2OH–
Многоосновные
слабые основания диссоциируют ступенчато и вместо знака
равенства ставится знак обратимости. Например, гидроксид меди (II)
диссоциирует по двум ступеням:
1)
Cu(OH)2
⇆ CuOH+
+ OH–
2)
CuOH+ ⇆ Cu2+
+ OH–
Т.к.
при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие
свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус
становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли
– это электролиты, при диссоциации которых образуются катионы металлов (или
аммония) и анионы кислотного остатка.
Соли
диссоциируют по одной ступени, в отличие от кислот и
оснований.
NaCl
= Na+ + Cl–
NH4NO3
= NH4+ + NO3–
Al2(SO4)3
= 2Al3+
+ 3SO42-
Свойства
солей определяются как катионами металла, так и анионами кислотного остатка.
Например, соли аммония имеют общие свойства, обусловленные наличием иона
аммония (NH4+),
так и различные, обусловленные анионами кислотного остатка. Общие свойства
сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а
специфические свойства обусловлены различными катионами.
Кислые
соли, в отличие от средних, диссоциируют ступенчато:
первая ступень сопровождается диссоциацией катиона металла и аниона кислотного
остатка, содержащего ион водорода, вторая ступень – это отщепление иона
водорода и кислотного остатка.
NaHCO3
= Na+ + HCO3–
HCO3–
⇆
H+ + CO32-
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н+. Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:

Слабые многоосновные кислоты (H2SО3, Н2СО3, H2S, Н3РО4 и др.) Диссоциируют ступенчато.
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н+):
![]()
Константа диссоциации по первой ступени:

Вторая ступень диссоциации (отщепление иона водорода Н+ от сложного иона НСО3—):

Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н+ (Н3О+).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН—.
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:![]()
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
![]()
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН—):
![]()

Вторая ступень диссоциации (отщепляется гидроксид-ион ОН— от сложного катиона FeOH+):

Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН—.
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н+ или ОН— от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН—, т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н+ и анионы ОН—.
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:

Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:

Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.![]()
Сложный анион НСО3— (гидрокарбонат-ион) частично диссоциирует по уравнению:
![]()
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН—.
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
![]()
Сложный катион частично диссоциирует по уравнениям:

Для обеих ступеней диссоциации Fe(OH)2+.
