Как найти массовую долю? Как найти массовую долю вещества по формуле
Данный урок посвящен изучению темы «Массовая доля вещества в растворе». С помощью материалов урока Вы научитесь количественно оценивать содержание растворенного вещества в растворе, а также определять состав раствора по данным о массовой доле растворенного вещества.
Тема: Классы неорганических веществ
Урок: Массовая доля вещества в растворе
Масса раствора складывается из масс растворителя и растворенного вещества:
m(р)=m(в)+m(р-ля)
Массовая доля вещества в растворе равна отношению массы растворенного вещества к массе всего раствора:
Решим несколько задач с использованием приведенных формул.
Вычислите массовую долю (в %) сахарозы в растворе, содержащем воду массой 250 г и сахарозу массой 50 г.
Массовую долю сахарозы в растворе можно вычислить по известной формуле:
Подставляем числовые значения и находим массовую долю сахарозы в растворе. Получили в ответе 16,7%.
Преобразуя формулу для вычисления массовой доли вещества в растворе, вы можете находить значения массы растворенного вещества по известной массе раствора и массовой доли вещества в растворе; или массу растворителя по массе растворенного вещества и массовой доли вещества в растворе.
Рассмотрим решение задачи, в которой изменяется массовая доля растворенного вещества при разбавлении раствора.
К 120 г раствора с массовой долей соли 7% прилили 30 г воды. Определите массовую долю соли в образовавшемся растворе.
Проанализируем условие задачи. В процессе разбавления раствора масса растворенного вещества не меняется, а увеличивается масса растворителя, а значит, увеличивается масса раствора и, наоборот, уменьшается массовая доля вещества в растворе.
Во-первых, определим массу растворенного вещества, зная массу начального раствора и массовую долю соли в этом растворе. Масса растворенного вещества равна произведению массы раствора и массовой доли вещества в растворе.
Мы уже выяснили, что масса растворенного вещества при разбавлении раствора не изменяется. Значит, вычислив массу полученного раствора, можно найти массовую долю соли в образовавшемся растворе.
Масса полученного раствора равна сумме масс исходного раствора и добавленной воды. Массовая доля соли в образовавшемся растворе равна отношению массы растворенного вещества и массы образовавшегося раствора. Таким образом, получили массовую долю соли в образовавшемся растворе равную 5,6%.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.111-116)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.111-115)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.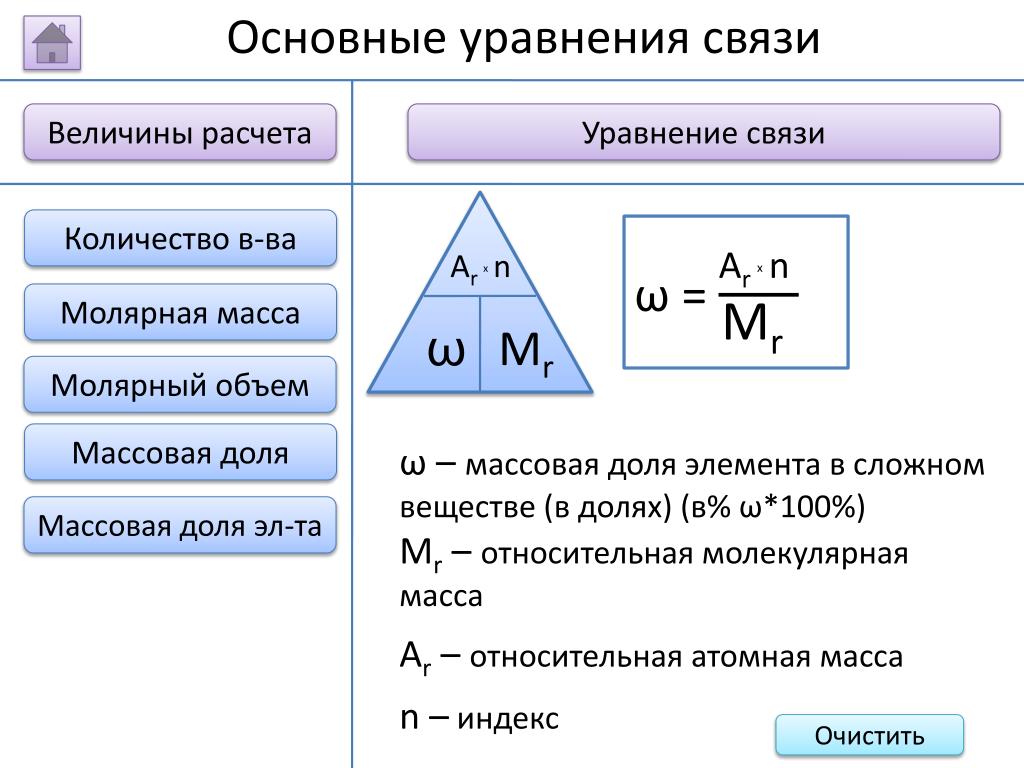 М. Шалашова. – М.:Астрель, 2013. (§35)
М. Шалашова. – М.:Астрель, 2013. (§35)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§41)
5. Химия: неорг. химия: учеб.для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§28)
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
3. Взаимодействие веществ с водой ().
Домашнее задание
1. с. 113-114 №№ 9,10
из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.197 №№ 1,2
из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
1. Что показывает массовая доля вещества в растворе?
Массовая доля – отношение массы растворенного вещества к массе раствора.
2. Как можно приготовить раствор с заданной массовой долей растворенного вещества? Приведите пример.
3. Чем отличаются понятия «насыщенный раствор» и «концентрированный раствор»?
4. В 513 г дистиллированной воды растворили 27 г соли. Вычислите массовую долю (в процентах) растворенного вещества в полученном растворе.
5. При выпаривании 25 г раствора получили 0,25 г соли. Определите массовую долю растворенного вещества и выразите ее в процентах.
6. Дано 500 г раствора с массовой долей гидроксида натрия 0,2. Вычислите массу вещества, которое получится при выпаривании этого раствора.
7. К 200 г раствора, массовая доля вещества в котором 0,3 , добавили 100 г воды. Вычислите массовую долю растворенного вещества в полученном растворе.
8. Рассчитайте массу 5,5 л раствора серной кислоты, если плотность такого раствора при 20°С равна 1,06 г/мл.
9. Рассчитайте плотность раствора соляной кислоты, если 560 г такого раствора занимают объем 500 мл.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите верное утверждение.
1) Раствор, в котором содержится много растворенного вещества, называют концентрированным.
2) Раствор, в котором содержится много растворенного вещества, называют разбавленным.
1)
2. В 325 г воды растворили 25 г соли. Массовая доля соли в полученном растворе равна
1) 0,71% 2) 7,1% 3) 14,2% 4) 1,42%
2)
3. Установите соответствие между физической величиной и формулой для ее расчета.
1) массовая доля элемента в соединении
2) массовая доля вещества в растворе
3) плотность
1) –Б, 2) –В, 3) –А
Инструкция
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же растворено, то выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
При желании массовую долю можно умножить на 100%.
Если в условии задачи не дано значения массы, то его можно рассчитать с помощью нескольких формул, выбрать нужную помогут величины данные в условии. Первая формула для : m = V*p, где m – масса, V – объем, p – плотность. Следующая формула выглядит так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярная масса в свою очередь складывается из атомных масс элементов, входящих в состав вещества.
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком . В результате реакции водород объемом 0,56 л (). Вычислите массовую долю меди в смеси.
В этой задаче проходит , записываем ее уравнение. Из двух веществ с избытком соляной кислоты только магний: Mg + 2HCl = MgCl2 + h3. Чтобы найти массовую долю меди в смеси, необходимо подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, найдем массу меди: m(Cu) = m(см) – m(Mg). Ищем массу : m(Mg) = n(Mg)*M(Mg). Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Найти количество вещества магния поможет уравнение реакции. Находим количество вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 или 60%.
Видео по теме
Обратите внимание
Массовая доля не может быть больше единицы или, если она выражается в процентах, больше 100%.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
- Вычисление доли продаж по региону
Массовая доля показывает в процентах или в долях содержание вещества в каком–либо растворе или элемента в составе вещества. Умение вычислить массовую долю полезно не только на уроках химии, но и когда вы хотите приготовить раствор или смесь, например, в кулинарных целях. Или изменить процентное отношение, в уже имеющемся у вас составе.
Инструкция
К примеру, вам на зиму необходим минимум в 15 куб.
метров березовых дров.
Ищите в справочной плотность березовых дров. Это: 650 кг/м3.
Вычисляйте массу, подставив значения в ту же формулу удельной плотности.
m = 650*15 = 9750 (кг)
Теперь, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и количеством поездок.
Видео по теме
Обратите внимание
Люди постарше больше знакомы с понятием удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Для этого с помощью весов определите массы , составляющих смесь или . Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%.
Если требуется найти или массовую долю элемента в веществе с известной формулой, воспользуйтесь периодической таблицей элементов. По ней найдите атомные массы элементов, которые в вещества. Если один в формуле несколько раз, умножьте его атомную массу на это число и сложите полученные результаты. Это будет молекулярная масса вещества. Чтобы найти массовую долю любого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Результат множьте на 100 % (ω%=(M0/M)∙100%).
Например, определите массовую долю химических элементов в медном купоросе. Медный (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома . Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Медный (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома . Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Задача 3.1.
Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение.
Из w = m в-ва / m р-ра
находим массу хлорида натрия:
m в-ва = w m р-ра = 0,1 250 г = 25 г NaCl
Поскольку m р-ра = m в-ва + m р-ля
, то получаем:
m(Н 2 0) = m р-ра — m в-ва = 250 г — 25 г = 225 г Н 2 0
.
Задача 3.2.
Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение.
Поскольку w = m в-ва / (V ρ)
, то получаем:
m в-ва = w V ρ = 0,262 400 мл 1,13 г/мл = 118 г
Задача 3.3.
К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение.
Находим массу соли в исходном растворе:
m соли = w m р-ра = 0,14 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
m р-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = m соли / m р-ра = 28 г / 280 г = 0,100.
Задача 3.4.
Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,78
и ρ 1 = 1,70 г/мл
.
Для второго раствора имеем:
V 2 = 500 мл, w 2 = 0,12
и ρ 2 = 1,08 г/мл
.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,12 500 мл 1,08 г/мл = 64,8 г.
m 2 = 64,8 г
. Находим
объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 64,8 г / (0,78 1,70 г/мл) = 48,9 мл.
Задача 3.5.
Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,0465
и ρ 1 = 1,05 г/мл
.
Для второго раствора имеем:
V 2 = 50 мл
, w 2 = 0,30
и ρ 2 = 1,33 г/мл
.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,30 50 мл 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m 2 = 19,95 г
.
Находим объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 19,95 г / (0,0465 1,05 г/мл) = 409 мл
.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6.
Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение.
В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
m р-ра = m воды + m соли = 100 г + 8,6 г = 108,6 г
,
а массовая доля соли в растворе равна:
w = m соли / m р-ра = 8,6 г / 108,6 г = 0,0792
.
Задача 3.7.
Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение.
Пусть растворимость соли равна х
г в 100 г воды.
Тогда масса раствора равна:
m р-ра = m воды + m соли = (х + 100) г
,
а массовая доля равна:
w = m соли / m р-ра = х / (100 + х) = 0,256
.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г
на 100 г воды.
Молярная концентрация с
— отношение количества растворенного вещества v (моль)
к объему раствора V (в литрах)
, с = v(моль) / V(л)
, с = m в-ва / (М V(л))
.
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л
) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8.
Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение.
Для растворов с молярной концентрацией имеем:
с = m / (М V)
,
где с
— молярная концентрация,
m
— масса вещества,
М
— молярная масса вещества,
V
— объем раствора в литрах.
Отсюда
m = с М V(л) = 2 моль/л 56 г/моль 4 л = 448 г КОН
.
Задача 3.9.
Сколько мл 98%-ного раствора Н 2 SO 4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w 1 = m 1 / (V 1 (мл) ρ 1)
.
Необходимо найти объем этого раствора V 1 (мл) = m 1 / (w 1 ρ 1)
.
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с 2 = m 2 / (М V 2 (л))
и m 2 = с 2 М V 2 (л)
.
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V 1 (мл) = m / (w 1 ρ 1) = (с 2 М V 2) / (w 1 ρ 1) = (0,25 моль/л 98 г/моль 1,5 л) / (0,98 1,84 г/мл) = 20,4 мл
.
Массовая доля в химии. Вычисление массовой доли химического элемента в веществе
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать методы измерения различных параметров вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
химия перестала быть описательной наукой. Ученые-химики стали широко использовать методы измерения различных параметров вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов для газообразных веществ, помимо массы, измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества входят два или более химических элемента. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества.
Массовая доля элемента в веществе обозначается латинской строчной буквой w (дубль-вэ) и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах (рис. 69). Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина.
Рис. 69.
Диаграмма элементного состава оксида ртути
Например, в состав оксида ртути HgО входят два элемента — ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида ртути:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
Например, для воды (рис. 70):
Давайте потренируемся в решении задач на вычисление массовых долей элементов в сложных веществах.
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH 3 .
Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H 2 SО 4 .
Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества.
То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Задача 3. Из природных минералов — тенорита и куприта (рис. 71) были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде (рис. 72), выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1% . Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.
Рис. 71. Минерал куприт
Рис. 72. Оксид меди черного цвета, выделенный из минерала тенорита
3. Полученное соотношение нужно привести к значениям целых чисел: ведь индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа надо разделить на меньшее из них (в нашем случае они равны).
А теперь немного усложним задачу.
Задача 4. По данным элементного анализа, прокаленная горькая соль имеет следующий состав: массовая доля магния 20,0%, массовая доля серы — 26,7% , массовая доля кислорода — 53,3% .
Вопросы и задания
- Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
- Рассчитайте массовые доли элементов в веществах: а) углекислом газе СО 2 ; б) сульфиде кальция CaS; в) натриевой селитре NaNО 3 ; г) оксиде алюминия А1 2 О 3 .
- В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH 4 C1; б) сульфате аммония (NH 4) 2 SО 4 ; в) мочевине (NH 2) 2 СО?
- В минерале пирите на 7 г железа приходится 8 г серы.
 Вычислите массовые доли каждого элемента в этом веществе и определите его формулу.
Вычислите массовые доли каждого элемента в этом веществе и определите его формулу. - Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода — 69,57%. Определите формулу оксида.
- В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе составляют: калий — 56,6%, углерод — 8,7%, кислород — 34,7%. Определите формулу поташа.
Массовая доля вещества – это отношение массы определенного вещества к массе смеси либо раствора, в котором находится данное вещество. Выражается в долях единицы либо в процентах.
Инструкция
1.
Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же вещество растворено, то формула выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже дозволено обнаружить: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю дозволено умножить на 100%.
При желании массовую долю дозволено умножить на 100%.
2.
Если в условии задачи не дано значения массы, то его дозволено рассчитать с поддержкой нескольких формул, предпочесть надобную помогут величины данные в условии. Первая формула для нахождения массы: m = V*p, где m – масса, V – объем, p – плотность. Дальнейшая формула выглядит так: m = n*M, где m – масса, n – число вещества, M – молярная масса. Молярная масса в свою очередь складывается из ядерных масс элементов, входящих в состав вещества.
3.
Для лучшего понимания данного материала решим задачу. Смесь медных и магниевых опилок массой 1,5 г обработали избытком серной кислоты. В итоге реакции выделился водород объемом 0,56 л (типичные данные). Вычислите массовую долю меди в смеси. В этой задаче проходит реакция, записываем ее уравнение. Из 2-х веществ с избытком соляной кислоты взаимодействует только магний: Mg + 2HCl = MgCl2 + h3. Дабы обнаружить массовую долю меди в смеси, нужно подставить значения в следующую формулу: w(Cu) = m(Cu)/m(см). Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Масса смеси дана, обнаружим массу меди: m(Cu) = m(см) – m(Mg). Ищем массу магния: m(Mg) = n(Mg)*M(Mg). Обнаружить число вещества магния поможет уравнение реакции. Находим число вещества водорода: n = V/Vm = 0,56/22,4 = 0,025 моль. По уравнению видно, что n(h3) = n(Mg) = 0,025 моль. Рассчитываем массу магния, зная что молярная масса магния равна 24 г/моль: m(Mg) = 0,025*24 = 0,6 г. Находим массу меди: m(Cu) = 1,5 – 0,6 = 0,9 г. Осталось вычислить массовую долю: w(Cu) = 0,9/1,5 = 0,6 либо 60%.
Массовая доля показывает в процентах либо в долях оглавление вещества в каком–либо растворе либо элемента в составе вещества. Знание вычислить массовую долю благотворно не только на уроках химии, но и когда вы хотите приготовить раствор либо смесь, скажем, в кулинарных целях. Либо изменить процентное отношение, в теснее имеющемся у вас составе.
Инструкция
1.
Массовая доля вычисляется как отношение массы данного компонента к всеобщей массе раствора. Для приобретения итога в процентах, нужно полученное частное умножить на 100.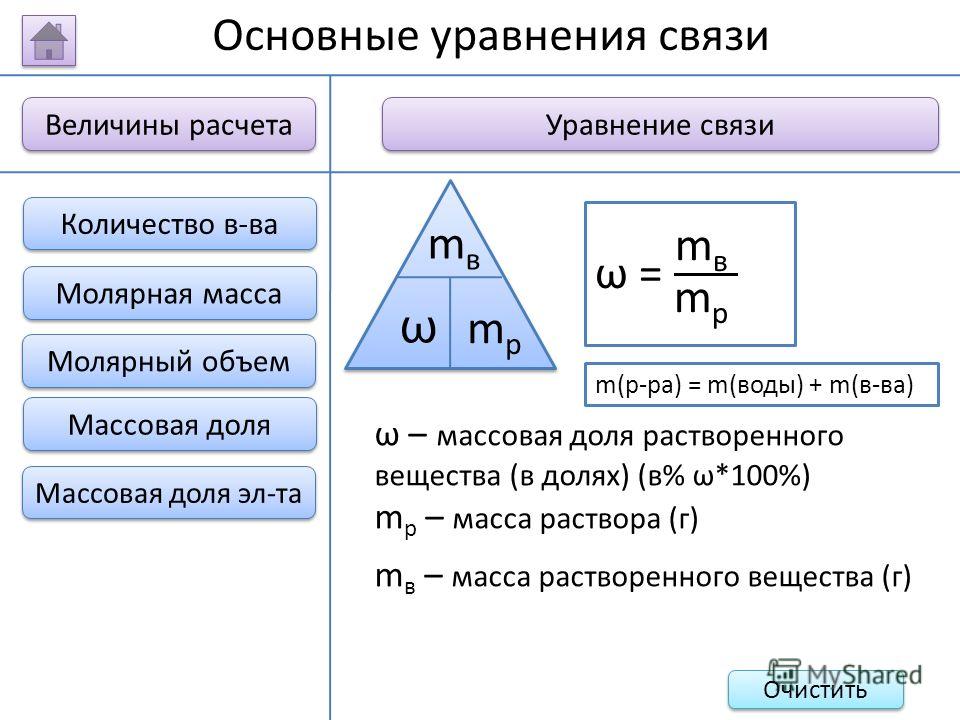 Выглядит формула дальнейшим образом:?=m (растворенного вещества)/m (раствора)?, % = ?*100
Выглядит формула дальнейшим образом:?=m (растворенного вещества)/m (раствора)?, % = ?*100
2.
Разглядим для примера прямую и обратную задачи.Скажем, вы растворили в 100 граммах воды 5 грамм поваренной соли. Какой процентности раствор вы получили? Решение дюже примитивное. Массу вещества (поваренной соли) вы знаете, масса раствора будет равна сумме из масс воды и соли. Таким образом, следует 5 г поделить на 105 г и итог деления умножить на 100 – это и будет результат: 4,7%-ый раствор у вас получится.Сейчас обратная задача. Вы хотите приготовить 200 гр 10%-ого водного раствора чего желательно. Сколько вещества брать для растворения? Действуем в обратном порядке, массовую долю, выраженную в процентах (10%) разделяем на 100. Получим 0,1. Сейчас составим несложное уравнение, где надобное число вещества обозначим x и, следственно, массу раствора как 200 г+x. Наше уравнение будет выглядеть так: 0,1=x/200г+x. Когда мы его решим то получим что х равняется приблизительно 22,2 г. Проверяется итог решением прямой задачи.
3.
Труднее узнать какие числа растворов вестимой процентности нужно взять для приобретения определенного числа раствора с новыми заданными качествами. Тут требуется составить и решить теснее систему уравнений. В этой системе первое уравнение – это выражение знаменитой массы получаемой смеси, через две незнакомые массы начальных растворов. Скажем, если наша цель получить 150 гр раствора, уравнение будет иметь вид x+y=150 г. Второе уравнение – масса растворенного вещества приравненная к сумме этого же вещества, в составе 2-х смешиваемых растворов. Скажем, если хотите иметь 30%-ый раствор, а растворы, которые вы смешиваете 100%-ый, то есть чистое вещество, и 15%-ый, то второе уравнение будет иметь вид: x+0,15y = 45 г. Дело за малым, решить систему уравнение и узнать сколько нужно добавить вещества к 15%-ому раствору, дабы получить 30%-ый раствор. Испробуйте.
Видео по теме
Дабы рассчитать количество
вещества
, узнайте его массу с подмогой весов, выразите ее в граммах и поделите на молярную массу, которую дозволено обнаружить с поддержкой таблицы Менделеева. Для определения числа вещества
Для определения числа вещества
газа в типичных условиях примените закон Авогадро. Если газ находится в иных условиях, измерьте давление, объем и температуру газа, позже чего рассчитайте количество
вещества
в нем.
Вам понадобится
- Вам потребуются весы, термометр, манометр, линейка либо рулетка, периодическая таблица Менделеева.
Инструкция
1.
Определение числа вещества
в твердом теле либо жидкости. Обнаружьте массу исследуемого тела при помощи весов, выразите ее в граммах. Определите, из какого вещества
состоит тело, после этого с поддержкой периодической таблицы Менделеева обнаружьте молярную массу вещества
. Для этого обнаружьте элементы, входящие в состав молекулы вещества
из которого состоит тело. По таблице определите их ядерные массы, если в таблице указывается дробное число, округлите его до целого. Обнаружьте сумму масс всех атомов, входящих в молекулу вещества
, получите молекулярную массу, которая численно равна молярной массе вещества
в граммах на моль. Позже этого, измеренную ранее массу поделите на молярную массу. В итоге получите количество
Позже этого, измеренную ранее массу поделите на молярную массу. В итоге получите количество
вещества
в молях (?=m/M).
2.
Число вещества
газа в типичных условиях. Если газ находится типичных условиях (0 градусов Цельсия и 760 мм рт. ст.), обнаружьте его объем. Для этого измерьте объем помещения, баллона либо сосуда, где он находится, от того что газ занимает каждый объем, ему предоставленный. Дабы получить его значение измерьте геометрические размеры сосуда, где он находится с поддержкой рулетки и с поддержкой математических формул, обнаружьте его объем. Особенно классическим случаем является комната в форме параллелепипеда. Измерьте ее длину, ширину и высоту в метрах, после этого перемножьте их и получите объем газа, тот, что в ней находится в кубических метрах. Дабы обнаружить количество
вещества
газа, полученный объем поделите на число 0,0224 – молярный объем газа при типичных условиях.
3.
Число вещества
газа с произвольными параметрами. Измерьте давление газа манометром в паскалях, его температуру в кельвинах, для чего к градусам Цельсия, в которых измеряет термометр, прибавьте число 273. Определите также объем газа в кубических метрах. Дабы обнаружить количество
Измерьте давление газа манометром в паскалях, его температуру в кельвинах, для чего к градусам Цельсия, в которых измеряет термометр, прибавьте число 273. Определите также объем газа в кубических метрах. Дабы обнаружить количество
вещества
произведение давления и объема поделите на температуру и число 8,31 (универсальную газовую непрерывную), ?=PV/(RT).
Видео по теме
Многие жидкости представляют собой растворы. Именно таковы, в частности, кровь человека, чай, кофе, морская вода. Основой раствора является растворенное вещество. Существуют задачи на нахождение массовой доли этого вещества.
Инструкция
1.
Растворами именуются однородные гомогенные системы, которые состоят из 2-х и больше компонентов. Они делятся на три категории:- жидкие растворы;- твердые растворы;- газообразные растворы.К жидким растворам относится, скажем, разбавленная серная кислота, к твердым – сплав железа и меди, а к газообразным – всякие смеси газов. Самостоятельно от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем почаще каждого обыкновенно является вода, которой разбавляют вещество. Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
Самостоятельно от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем почаще каждого обыкновенно является вода, которой разбавляют вещество. Состав растворов выражается разным образом, особенно зачастую для этого применяют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к всеобщей массе каждого раствора:?в=mв/mМассовую долю выражают в процентах либо десятичных дробях. Дабы вычислить данный параметр в процентах, применяйте следующую формулу:w(вещества)=mв/m (раствора)·100 %.Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
2.
Масса каждого раствора представляет собой сумму масс воды и растворенного вещества. Следственно изредка формулу, указанную выше, записывают несколько другим образом:?в=mв/(mв+m(h3O)), где m (раствора)=mв+m(h3O)Скажем, разбавленная азотная кислота состоит из растворителя – воды, и растворенного вещества -кислоты. Из этого следует, что масса растворенного вещества вычисляется дальнейшим образом:?в=mHNO3/mHNO3+mh3O
Из этого следует, что масса растворенного вещества вычисляется дальнейшим образом:?в=mHNO3/mHNO3+mh3O
3.
Если масса вещества неведома, а дана лишь масса воды, то в таком случае массовая доля находится по несколько другой формуле. Когда знаменит объем растворенного вещества, массу его находите по дальнейшей формуле:mв=V*?Из этого следует, что массовая доля вещества вычисляется дальнейшим образом:?в=V*?/V*?+m(h3O)
4.
Нахождение массовой доли вещества неоднократно осуществляется и в утилитарных целях. Скажем, при отбеливании какого-нибудь материала нужно знать концентрацию пергидроля в растворе перекиси. Помимо того, точное вычисление массовой доли изредка требуется во врачебной практике. Помимо формул и примерного вычисления массовой доли в медицине применяют еще и экспериментальную проверку с подмогой приборов, что дозволяет уменьшить вероятность ошибок.
5.
Существует несколько физических процессов, в ходе которых меняется массовая доля вещества и состав раствора. 1-й из них, называемый упариванием, представляет собой процесс, обратный растворению вещества в воде. При этом, растворенное вещество остается, а вода всецело упаривается. В этом случае массовая доля быть измерена не может – раствор отсутствует. Прямо противоположный процесс – разбавление концентрированного раствора. Чем огромнее он разбавляется, тем крепче уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не каждая вода, а лишь ее часть. Массовая доля вещества в растворе при этом возрастает.
1-й из них, называемый упариванием, представляет собой процесс, обратный растворению вещества в воде. При этом, растворенное вещество остается, а вода всецело упаривается. В этом случае массовая доля быть измерена не может – раствор отсутствует. Прямо противоположный процесс – разбавление концентрированного раствора. Чем огромнее он разбавляется, тем крепче уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не каждая вода, а лишь ее часть. Массовая доля вещества в растворе при этом возрастает.
Видео по теме
Что такое массовая доля элемента
? Из самого наименования дозволено осознать, что это величина, указывающая, в каком соотношении находятся масса элемента
, входящего в состав вещества, и всеобщая масса этого вещества. Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как дозволено вычислить массу какого-нибудь элемента
?
Инструкция
1.
Для наглядности разглядите отлично знаменитый каждому углерод, без которого не было бы органики. Если углерод представляет собою чистое вещество (скажем, алмаз), то его массовую долю
дозволено храбро принять за единицу либо за 100%. Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь мелких числах, что ими дозволено пренебречь. А вот в таких модификациях углерода, как каменный уголь либо графит, оглавление примесей достаточно высокое, и такое игнорирование неприемлемо.
2.
Если же углерод входит в состав трудного вещества, нужно делать дальнейшим образом: запишите точную формулу вещества, после этого, зная молярные массы всякого элемента
, входящего в его состав, вычислите точную молярную массу этого вещества (разумеется, с учетом «индекса» всякого элемента
). Позже этого определить массовую долю
, поделив всеобщую молярную массу элемента
на молярную массу вещества.
3.
Скажем, надобно обнаружить массовую долю
углерода в уксусной кислоте. Напишите формулу уксусной кислоты: СН3СООН. Для упрощения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
Напишите формулу уксусной кислоты: СН3СООН. Для упрощения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
4.
Если надобно исчислить ее в процентном соотношении, соответственно, 0,4 * 100 = 40%. То есть в всяком килограмме уксусной кислоты содержится (примерно) 400 грамм углерода.
5.
Разумеется, абсолютно аналогичным образом дозволено обнаружить массовые доли всех других элементов. Скажем, массовая доля кислорода в той же уксусной кислоте вычисляется так: 32/60 = 0,533 либо приблизительно 53,3%; а массовая доля водорода равна 4/60 = 0,666 либо приблизительно 6,7%.
6.
Для проверки точности вычислений сложите процентные доли всех элементов:40% (углерод) + 53,3% (кислород) + 6,7% (водород) = 100%. Счет сошелся.
У вас есть двухсотлитровая бочка. Вы планируете ее всецело заправить дизельным топливом, которое используете для отопления своей мини-котельной. А сколько она будет весить, наполненная соляром? Теперь вычислим.
А сколько она будет весить, наполненная соляром? Теперь вычислим.
Вам понадобится
- – таблица удельной плотности веществ;
- – знание изготавливать простейшие математические вычисления.
Инструкция
1.
Дабы обнаружить массу вещества по его объему, воспользуйтесь формулой удельной плотности вещества.p = m/vздесь p – удельная плотность вещества;m – его масса;v – занимаемый объем. Массу будем считать в граммах, килограммах и тоннах. Объемы в кубических сантиметрах, дециметрах и мерах. И удельную плотность, соответственно, в г/см3, кг/дм3, кг/м3, т/м3.
2.
Выходит, по условиям задачи, у вас есть двухсотлитровая бочка. Это значит: бочка емкостью 2 м3. Двухсотлитровой ее называют, так как воды, с ее удельной плотностью равной единице, в такую бочку входит 200 литров.Вас волнует масса. Следственно выводите ее в представленной формуле на первое место.m = p*vВ правой части формулы незнакомо значение р – удельная плотность дизельного топлива. Обнаружьте его по справочнику. Еще проще – задать в поиск запрос в интернете «удельная плотность дизельного топлива».
Обнаружьте его по справочнику. Еще проще – задать в поиск запрос в интернете «удельная плотность дизельного топлива».
3.
Обнаружили: плотность летнего дизельного топлива при t = +200 С – 860 кг/м3.Подставляйте значения в формулу:m = 860*2 = 1720 (кг)1 тонна и 720 кг – столько весят 200 литров летнего дизельного топлива. Завесив заблаговременно бочку, дозволено рассчитать всеобщий вес и прикинуть мощность стеллажа под бочку с соляром.
4.
В сельской местности пригодным бывает предварительно рассчитать массу нужных по кубатуре дров, дабы определиться с грузоподъемностью транспорта, на котором будут доставляться эти дрова. К примеру, вам на зиму нужен минимум в 15 куб. метров березовых дров. Ищите в справочной литературе плотность березовых дров. Это: 650 кг/м3.Вычисляйте массу, подставив значения в ту же формулу удельной плотности.m = 650*15 = 9750 (кг)Сейчас, исходя из грузоподъемности и вместимости кузова, вы можете определиться с видом транспортного средства и числом поездок.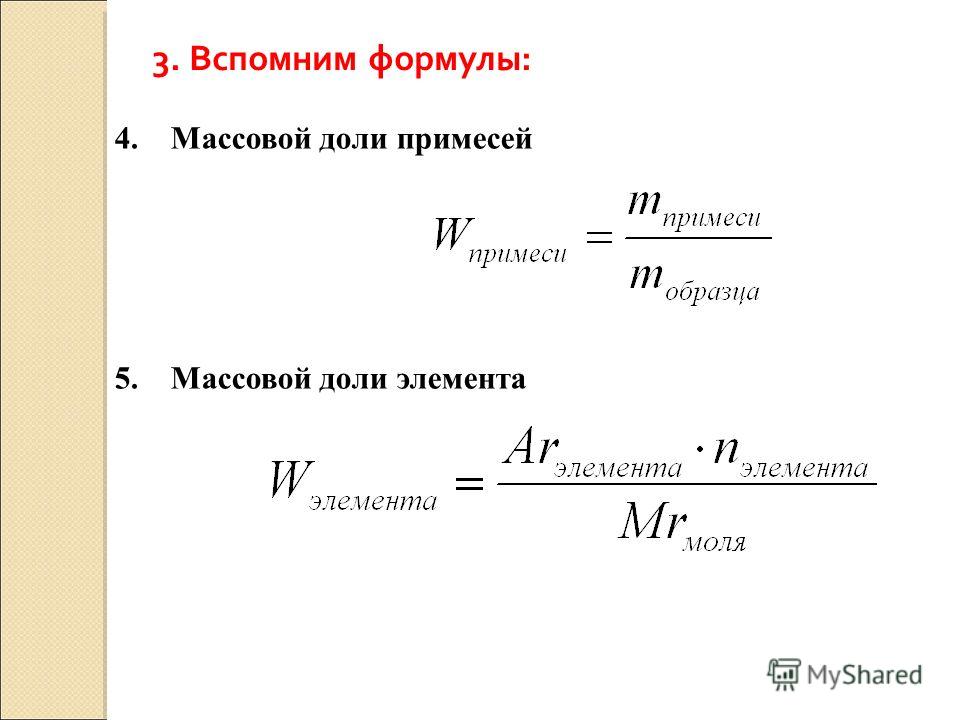
Видео по теме
Обратите внимание!
Люди постарше огромнее знакомы с представлением удельного веса. Удельная плотность вещества – это то же, что и удельный вес.
Массовая доля вещества показывает его оглавление в больше трудной структуре, скажем, в сплаве либо смеси. Если знаменита всеобщая масса смеси либо сплава, то зная массовые доли составляющих веществ дозволено обнаружить их массы. Обнаружить массовую долю вещества, дозволено зная его массу и массу каждой смеси. Эта величина, может выражаться в дольных величинах либо процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
1.
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с поддержкой весов определите массы веществ, составляющих смесь либо сплав. После этого сложите их. Полученную массу примите за 100%. Дабы обнаружить массовую долю вещества в смеси, поделите его массу m на массу смеси M, а итог умножьте на 100% (?%=(m/M)?100%). Скажем, в 140 г воды растворяют 20 г поваренной соли. Дабы обнаружить массовую долю соли, сложите массы этих 2-х веществ М=140+20=160 г. После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
Скажем, в 140 г воды растворяют 20 г поваренной соли. Дабы обнаружить массовую долю соли, сложите массы этих 2-х веществ М=140+20=160 г. После этого обнаружьте массовую долю вещества?%=(20/160)?100%=12,5%.
2.
Если требуется обнаружить оглавление либо массовую долю элемента в веществе с вестимой формулой, воспользуйтесь периодической таблицей химических элементов. По ней обнаружьте ядерные массы элементов, которые входят в состав вещества. Если один элемент встречается в формуле несколько раз, умножьте его ядерную массу на это число и сложите полученные итоги. Это будет молекулярная масса вещества. Дабы обнаружить массовую долю всякого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Итог множьте на 100 % (?%=(M0/M)?100%).
3.
Скажем, определите массовую долю химических элементов в медном купоросе. Медный купорос (сульфат меди II), имеет химическую формулу CuSO4. Ядерные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16?4=64, с учетом того, что в молекуле содержится 4 атома кислорода. Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (?%=(64/160)?100%)=40%. По такому же тезису дозволено определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ?%=(32/160)?100%=20 %, кислорода (О) ?%=(64/160)?100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (?%=(64/160)?100%)=40%. По такому же тезису дозволено определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ?%=(32/160)?100%=20 %, кислорода (О) ?%=(64/160)?100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Массовая доля — это процентное оглавление компонента в смеси либо элемента в веществе. С задачами на вычисление массовой доли сталкиваются не только школьники и студенты. Знание вычислять процентную концентрацию вещества находит абсолютно утилитарное использование и в реальной жизни – там, где требуется составление растворов – начиная со строительства и заканчивая кулинарией.
Вам понадобится
- – таблица Менделеева;
- – формулы для расчета массовой доли.
Инструкция
1.
Рассчитайте массовую долю
по определению. Потому что масса вещества слагается из масс элементов, которые его составляют, то на долю
Потому что масса вещества слагается из масс элементов, которые его составляют, то на долю
всякого составляющего элемента доводится некоторая часть массы вещества. Массовая доля раствора равна отношению массы растворенного вещества к массе каждого раствора.
2.
Масса раствора равна сумме масс растворителя (традиционно воды) и вещества. Массовая доля смеси равна отношению массы вещества к массе смеси, содержащей вещество. Полученный итог умножьте на 100%.
3.
Обнаружьте массовую долю
выхода с поддержкой формулы?=mд/mп, где mп и mд – величина полагаемого и действительного полученного выхода вещества (массы) соответственно. Вычисляйте полагаемую массу из уравнения реакции, пользуясь формулой m=nM, где n – химическое число вещества, M – молярная масса вещества (сумма ядерных масс всех элементов, входящих в вещество), либо формулой m=V?, где V- объем вещества, ? – его плотность. Число вещества в свою очередь при необходимости замените на формулу n=V/Vm либо также находите из уравнения реакции.
4.
Массовую долю
элемента трудного вещества вычислите с подмогой таблицы Менделеева. Сложите ядерные массы всех элементов, входящих в вещество, при необходимости домножая на индексы. Вы получите молярную массу вещества. Обнаружьте молярную массу элемента из таблицы Менделеева. Рассчитайте массовую долю
, поделив молярную массу элемента на молярную массу вещества. Умножьте на 100%.
Полезный совет
Обращайте внимание на физический процесс, тот, что имеет место быть. При упаривании не рассчитывайте массовую долю, потому что раствора (воды либо другой всякий жидкости) нет. Не забывайте, что при концентрировании, напротив называемом частичным упариванием, массовая доля вещества возрастает. Если вы разбавляете концентрированный раствор, массовая доля уменьшается.
Массовая доля какого-нибудь компонента в веществе показывает, которая часть от всеобщей массы доводится на атомы именно этого элемента. Применяя химическую формулу вещества и периодическую таблицу Менделеева, дозволено определить массовую долю всего из входящих в формулу элементов.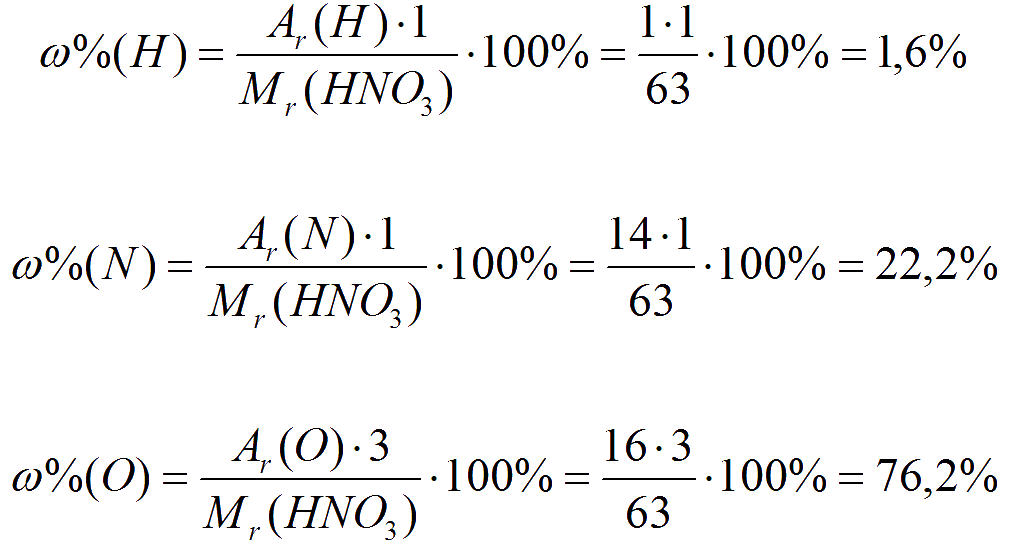 Полученная в итоге величина выражается обычной дробью либо процентами.
Полученная в итоге величина выражается обычной дробью либо процентами.
Инструкция
1.
Если требуется по химической формуле определить массовую долю всякого элемента, составляющего ее, начните с вычисления числа атомов, которое доводится на весь из элементов. Скажем, химическую формулу этанола записывают так: CH?-CH?-OH. А химическая формула диметилового эфира – CH?-O-CH?. Число атомов кислорода (O) в всякой из формул равно единице, углерода (С) – двум, водорода (H) – шести. Обратите внимание, что это различные вещества, потому что идентичное число атомов всего элемента в их молекулах расположено по-различному. Тем не менее, массовые доли всего элемента в диметиловом эфире и этаноле будут идентичны.
2.
С применением периодической таблицы определите ядерную массу всякого элемента, входящего в химическую формулу. Это число умножьте на число атомов всякого элемента, рассчитанное на предыдущем шаге. В использованном выше примере формула содержит каждого один атом кислорода, а его атомарная масса из таблицы равна 15,9994. Атомов углерода в формуле два, его атомарная масса равна 12,0108, значит, суммарный вес атомов составит 12,0108*2=24,0216. Для водорода эти цифры равны соответственно 6, 1,00795 и 1,00795*6=6,0477.
Атомов углерода в формуле два, его атомарная масса равна 12,0108, значит, суммарный вес атомов составит 12,0108*2=24,0216. Для водорода эти цифры равны соответственно 6, 1,00795 и 1,00795*6=6,0477.
3.
Определите всеобщую атомарную массу всей молекулы вещества – сложите полученные на предыдущем шаге числа. Для диметилового эфира и этанола эта величина должна быть равна 15,9994+24,0216+6,0477=46,0687.
4.
Если итог требуется получить в долях единицы, составьте для всякого элемента, входящего в формулу, индивидуальную дробь. В ее числителе должна стоять величина, рассчитанная для этого элемента на втором шаге, а в знаменатель всей дроби поставьте число из третьего шага. Полученную обычную дробь дозволено округлить до надобной степени точности. В использованном выше примере массовая доля кислорода составляет 15,9994/46,0687?16/46=8/23, углерода – 24,0216/46,0687?24/46=12/23, водорода – 6,0477/46,0687?6/46=3/23.
5.
Для приобретения итога в процентах полученные обычные дроби переведите в формат десятичных и увеличьте в сто раз. В использованном примере массовая доля кислорода в процентах выражается числом 8/23*100?34,8%, углерода – 12/23*100?52,2%, водорода – 3/23*100?13,0%.
В использованном примере массовая доля кислорода в процентах выражается числом 8/23*100?34,8%, углерода – 12/23*100?52,2%, водорода – 3/23*100?13,0%.
Видео по теме
Обратите внимание!
Массовая доля не может быть огромнее единицы либо, если она выражается в процентах, огромнее 100%.
В статье рассматривается такое понятие, как массовая доля. Приводятся способы ее вычисления. Также описаны определения сходных по звучанию, но отличных по физическому смыслу величин. Это массовые доли для элемента и выхода.
Колыбель жизни — раствор
Вода — источник жизни на нашей прекрасной голубой планете. Это выражение можно встретить довольно часто. Однако мало кто, кроме специалистов, задумывается: на самом деле субстратом для развития первых биологических систем стал раствор веществ, а не химически чистая вода. Наверняка в популярной литературе или передаче читатель встречал выражение «первичный бульон».
Об источниках, давших толчок развитию жизни в виде сложных органических молекул, до сих пор спорят. Некоторые даже предполагают не просто естественное и весьма удачное стечение обстоятельств, а космическое вмешательство. Причем речь идет вовсе не о мифических пришельцах, а о специфических условиях для создания этих молекул, которые могут существовать только на поверхности малых космических тел, лишенных атмосферы, — кометах и астероидах. Таким образом, было бы правильнее говорить, что раствор органических молекул — колыбель всего живого.
Некоторые даже предполагают не просто естественное и весьма удачное стечение обстоятельств, а космическое вмешательство. Причем речь идет вовсе не о мифических пришельцах, а о специфических условиях для создания этих молекул, которые могут существовать только на поверхности малых космических тел, лишенных атмосферы, — кометах и астероидах. Таким образом, было бы правильнее говорить, что раствор органических молекул — колыбель всего живого.
Вода как химически чистое вещество
Несмотря на огромные соленые океаны и моря, пресные озера и реки, в химически чистом виде вода встречается крайне редко, в основном в специальных лабораториях. Напомним, в отечественной научной традиции химически чистое вещество — это субстанция, которая содержит не более десяти в минус шестой степени массовой доли примесей.
Получение абсолютно свободной от посторонних компонентов массы требует невероятных затрат и редко себя оправдывает. Применяется только в отдельных производствах, где даже один посторонний атом может испортить эксперимент. Отметим, что полупроводниковые элементы, которые составляют основу сегодняшней миниатюрной техники (в том числе смартфоны и планшеты), к примесям очень чувствительны. В их создании как раз и нужны совершенно незагрязненные растворители. Однако по сравнению со всей жидкостью планеты это ничтожно мало. Как же так получается, что распространенная, пронизывающая нашу планету насквозь вода так редко встречается в чистом виде? Объясним чуть ниже.
Отметим, что полупроводниковые элементы, которые составляют основу сегодняшней миниатюрной техники (в том числе смартфоны и планшеты), к примесям очень чувствительны. В их создании как раз и нужны совершенно незагрязненные растворители. Однако по сравнению со всей жидкостью планеты это ничтожно мало. Как же так получается, что распространенная, пронизывающая нашу планету насквозь вода так редко встречается в чистом виде? Объясним чуть ниже.
Идеальный растворитель
Ответ на поставленный в предыдущем разделе вопрос невероятно прост. Вода имеет полярные молекулы. Это значит, что в каждой мельчайше частице этой жидкости положительный и отрицательный полюсы не намного, но разнесены. При этом структуры, возникающие даже в жидкой воде, создают дополнительные (так называемые водородные) связи. И в общей сложности это дает следующий результат. Попадающее в воду вещество (не важно, какой заряд оно имеет) растаскивается молекулами жидкости. Каждая частичка растворенной примеси обволакивается либо отрицательными, либо положительными сторонами молекул воды. Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
Таким образом, эта уникальная жидкость способна растворять очень большое количество самых разнообразных веществ.
Понятие массовой доли в растворе
Получающийся раствор содержит некоторую часть примеси, имеющей название «массовая доля». Хотя такое выражение встречается не часто. Обычно используется другой термин — «концентрация». Массовая доля определяется конкретным соотношением. Формульное выражение приводить не будем, оно достаточно простое, объясним лучше физический смысл. Это соотношение двух масс — примеси к раствору. Массовая доля — величина безразмерная. Выражается по-разному в зависимости от конкретных задач. То есть в долях единицы, если в формуле есть только соотношение масс, и в процентах — если результат умножается на 100%.
Растворимость
Помимо Н 2 О применяются и другие растворители. Кроме того, есть вещества, которые принципиально не отдают свои молекулы воде. Зато с легкостью растворяются в бензине или горячей серной кислоте.
Существуют специальные таблицы, которые показывают, сколько того или иного материала останется в жидкости. Этот показатель называется растворимостью, и он зависит от температуры. Чем она выше, тем активнее двигаются атомы или молекулы растворителя, и тем больше примеси он способен поглотить.
Этот показатель называется растворимостью, и он зависит от температуры. Чем она выше, тем активнее двигаются атомы или молекулы растворителя, и тем больше примеси он способен поглотить.
Варианты определения доли растворенного вещества в растворе
Так как задачи у химиков и технологов, а также инженеров и физиков могут быть разными, часть растворенного вещества в воде определяется по-разному. Объемная доля вычисляется как объем примеси к общему объему раствора. Используется другой параметр, однако принцип остается тем же.
Объемная доля сохраняет безразмерность, выражаясь либо в долях единицы, либо в процентах. Молярность (по-другому еще называется «молярная объемная концентрация») — это число молей растворенного вещества в заданном объеме раствора. В этом определении участвуют уже два различных параметра одной системы, и размерность у данной величины другая. Она выражается в молях на литр. На всякий случай напомним, что моль — это количество вещества, содержащего примерно десять в двадцать третьей степени молекул или атомов.
Понятие массовой доли элемента
Эта величина имеет лишь косвенное отношение к растворам. Массовая доля элемента отличается от рассмотренного выше понятия. Любое сложное химическое соединение состоит из двух или более элементов. Каждый обладает своей относительной массой. Эту величину можно найти в химической системе Менделеева. Там она указана в нецелых числах, но для приблизительных задач значение можно округлить. В состав сложного вещества входит определенное количество атомов каждого вида. Например, в воде (Н 2 О) два атома водорода и один кислорода. Соотношение между относительной массой всего вещества и данного элемента в процентах и будет составлять массовую долю элемента.
Для неискушенного читателя эти два понятия могут показаться близкими. И достаточно часто их путают между собой. Массовая доля выхода относится не к растворам, а к реакциям. Любой химический процесс всегда протекает с получением конкретных продуктов. Их выход рассчитывается по формулам в зависимости от реагирующих веществ и условий процесса. В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
В отличие от просто массовой доли, эту величину не так просто определить. Теоретические расчеты предлагают максимально возможное количество вещества продукта реакции. Однако практика всегда дает немного меньшее значение. Причины такого расхождения кроются в распределении энергий среди даже сильно нагретых молекул.
Таким образом, всегда найдутся наиболее «холодные» частицы, которые не смогут вступить в реакцию и останутся в первоначальном состоянии. Физический смысл массовой доли выхода состоит в том, какой процент составляет реально полученное вещество от теоретически рассчитанного. Формула невероятно проста. Масса практически полученного продукта делится на массу практически рассчитанного, все выражение умножается на сто процентов. Массовая доля выхода определяется по количеству молей реагирующего вещества. Не стоит забывать об этом. Дело в том, что один моль вещества — определенное количество его атомов или молекул. По закону сохранения вещества из двадцати молекул воды не может получиться тридцать молекул серной кислоты, поэтому задачи вычисляются именно так. Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Из количества молей исходного компонента выводят массу, которая теоретически возможна для результата. Затем, зная, сколько продукта реакции на самом деле было получено, по описанной выше формуле определяют массовую долю выхода.
Даже в одном грамме вещества может содержаться до тысячи различных соединений. Каждое соединение отвечает за определенное свойство вещества, а бывает так, что это не определенное вещество, а смесь. В любом случае на производстве часто возникает ситуация утилизации химических отходов и задача использования вторичного сырья. Именно химические реакции, позволяющие найти и выделить определенное вещество являются главенствующими. Но для этого надо сначала узнать как найти массовую долю.
Понятие массовой доли вещества отражает его содержание и концентрацию в сложной химической структуре, будь то смесь или сплав. Зная общую массу сплава или смеси, можно найти массы составляющих их веществ, при условии, что известны их массовые доли. Как найти массовую долю, формула обычно выражается в виде дроби: массовая доля вещества масса вещества/масса всей смеси.
Давайте проведем небольшой эксперимент! Для этого нам понадобятся периодическая таблица химических элементов им. Менделеева, весы и калькулятор.
Как найти массовую долю вещества
Необходимо определить массовую долю вещества, вещество находится в виде смеси. Первоначально кладем на весы само вещество. Получили массу вещества. Зная определенную массу вещества в смеси мы с легкостью получим его массовую долю. К примеру есть 170г. воды. В них находится 30 грамм вишневого сока. Общая масса=170+30=230 грамм. Поделим массу вишневого сока к общей массе смеси: 30/200=0.15 или 15% .
Как найти массовую долю раствора
Решение данной проблемы может понадобиться при определении концентрации пищевых растворов(уксус) или лекарственных препаратов. Дана масса раствора KOH, он же гидроксид калия, массой в 400 грамм. KOH (масса самого вещества) составляет 80 грамм. Необходимо найти массовую долю желчи в полученном растворе. Формула нахождения решения: KOH (масса раствора гидроксида калия) 300 г, масса растворенного вещества (KOH) 40 г. Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствора гидроксида калия): t (KOH) = 80 г /400 г х 100% = 20 %.
Как найти массовую долю углерода в углеводороде
Для этого используем таблицу Менделеева. Ищем вещества в таблице. В таблице приведена атомная масса элементов. 6 углеродов с атомной массой 12 и 12 водородов с атомной массой равной 1. m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль, ω (С) = 6 m1(С) / m (C6h22) = 6 х 12 / 84 = 85%
Определение массовой доли на производствах производится в специальных химических лабораториях. Для начала берется небольшой образец, на который испытывают различные химические реакции. Или внедряют лакмусовые бумажки, которые могут показать наличие того или иного компонента. После выяснения первоначальной структуры вещества можно начинать выделение компонентов. Это достигается за счет простых химических реакций, когда одно вещество контактирует с другим и получается новое, возможен осадок. Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
Существуют и более продвинутые способы, такие как электролиз, нагревание, охлаждение, выпаривание. Для подобных реакций нужно большое промышленное оборудование. Производство, конечно, тяжело назвать экологически чистым, тем не менее современные технологии обработки отходов позволяют минимизировать нагрузку на природу.
Mathway | Популярные задачи
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Определение, примеры, задачи, расчет ~ ChemistryGod
Массовая доля – это свойство смеси. Смесь – это физическое соединение двух или более различных веществ. Смеси бывают растворы, суспензии и коллоиды.
Смесь – это физическое соединение двух или более различных веществ. Смеси бывают растворы, суспензии и коллоиды.
Рисунок 1: Типы смесей: растворы (соль и вода), суспензии (почва и вода) и коллоиды (молоко) (слева направо)
[Источники изображений: Wikimedia, Flickr и Public Domain]
В химии, большинство смесей являются растворами, гомогенной смесью растворенного вещества и растворителя. Но приведенное ниже определение массовой доли применимо и к другим типам.
Определение и формула
Массовая доля вещества в смеси представляет собой отношение массы вещества к общей массе смеси. Он также известен как массовый процент или процент по массе при выражении в процентах. Поскольку массовая доля представляет собой отношение массы к массе, она является безразмерной величиной.
Для смеси,
Здесь w i — массовая доля компонента i th , m i — масса компонента i th , а m T — общая масса смеси.
Общая масса смеси равна сумме масс каждого компонента.
Используя два приведенных выше уравнения,
Примечание: Сумма всех массовых долей равна единице.
Пример 1: Вино
Утверждение: Бокал вина содержит 24 г спирта, а остальное — вода. Масса воды в вине 211 г. Рассчитайте массовые доли спирта и воды?
Рисунок 2: Бокал вина
[Источник изображения: PixaBay]
Решение: масса воды составляет 211 г, а спирта — 24 г.
Массовая доля воды и спирта w вода и w спирт .
Для воды,
Для спирта,
Примечание. Массовая доля вещества не зависит от давления, температуры и местоположения; это интенсивное количество. Он остается постоянным, если не происходит химического изменения или чистого физического переноса какого-либо вещества. Итак, массовые проценты вина (в приведенном выше примере) постоянны во всем мире.
Массовая доля растворенного вещества в растворе определяется как отношение массы растворенного вещества к массе раствора.
Пусть м растворенного вещества будет массой растворенного вещества и м раствора , массой раствора. Массовая доля растворенного вещества следующая:
Пример 2: Раствор хлорида натрия
Утверждение: 23 г хлорида натрия растворяют в 125 г воды. Найдите массовую долю растворенного вещества.
Рисунок 3: Стакан с раствором хлорида натрия
[Источник изображения: Калифорнийский университет, Лос-Анджелес]
Решение: масса хлорида натрия (растворенного вещества) составляет 23 г. А масса воды (растворителя) 125 г.
Массовая доля NaCl w NaCl .
Процент по массе
Массовая доля также известна как процент по массе, процент по массе, процент по массе или процент по массе, когда выражается в процентах. Сокращенно обозначается массовым % или массовым %.
Пример 3: Сталь
Утверждение: блок из высокоуглеродистой стали содержит 104 г углерода и 5 100 г железа. Рассчитайте массовую долю каждого из них.
Рассчитайте массовую долю каждого из них.
Рисунок 4: Нож из высокоуглеродистой стали
[Источник изображения: Кухонный нож Mercer]
Решение: Масса углерода составляет 104 г углерода и железа, 5100 г.
Теперь массовый процент углерода и железа рассчитывается как:
Для раствора
Пример 4: Сульфат марганца (II)
Заявление: Колба с раствором сульфата марганца (II) содержит 86 г MnSO 4 и остальное H 2 O. Количество воды 74 г.
Рисунок 5: Сульфат марганца (II)
[Источник изображения: Wikimedia]
Решение. Масса сульфата марганца составляет 86 г, а воды – 74 г.
Весовой процент MnSO 4 и H 2 O рассчитывается следующим образом:
Связь с другими величинами
Массовая доля является одной из величин, используемых для выражения состава смеси. Но есть и другие величины, такие как мольная доля, молярность, массовая концентрация и другие. Некоторые из них обсуждаются ниже.
Соотношение смешивания
Соотношение смешивания компонента — это содержание этого компонента в смеси по отношению к другим компонентам. Пусть m 1 будет массой чистого вещества 1 и m 2 чистого вещества 2. Соотношение смеси равно r m .
Теперь мы можем выразить w 1 и w 2 через r m .
Мольная доля
Мольная доля – широко используемая величина в химии и технике. Это также безразмерная величина и представляет собой отношение моля компонента к общему молю смеси. Обычно он обозначается как x i .
Пусть n i — моль i -го -го компонента смеси. Общее количество молей в смеси составляет
. Мольная доля компонента i th составляет x i .
Мы также знаем, что моль вещества представляет собой отношение массы ( m i ) к молярной массе ( M i ).
Используя два приведенных выше уравнения,
Здесь
— это средняя молярная масса смеси. Но мы также знаем, что.
Подставив
,
Таким образом, мы установили связь между мольной долей и массовой долей.
Объемная доля
Объемная доля ( v i ) – это объем компонента ( V i ) по отношению к общему объему смеси ( V смесь ).
Объем – это масса, деленная на плотность.
Массовая концентрация
Массовая концентрация растворенного вещества ( ρ i ) представляет собой отношение массы растворенного вещества ( m i ) к объему раствора ( V ).
Здесь
– плотность раствора ( р ).
Из приведенного выше уравнения массовая концентрация растворенного вещества равна массовой доле растворенного вещества, умноженной на плотность раствора.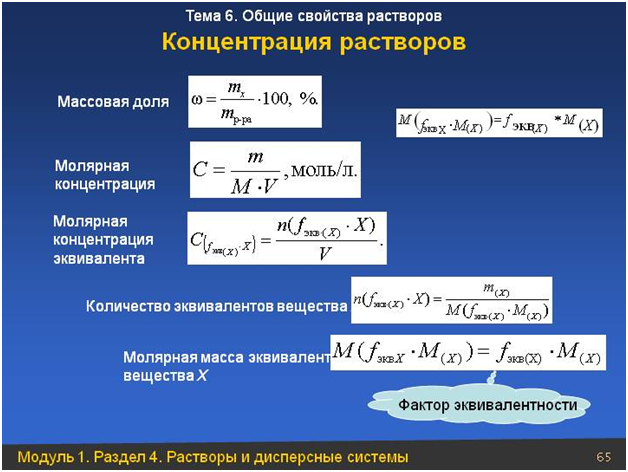
Молярность или молярная концентрация
Молярность или молярная концентрация ( C i ) — это моль растворенного вещества ( n i ) на единицу объема раствора ( V ). Объем раствора обычно выражается в кубических дециметрах (дм 3 ).
Моль вещества – это масса, деленная на молярную массу. А плотность — это масса, деленная на объем.
Процентный состав
Соединение состоит из различных элементов. Когда рассчитывают массовую долю элемента, ее называют процентным составом этого элемента. Короче говоря, массовая доля и процентный состав совпадают, когда речь идет об элементах соединения.
Решенные проблемы
Проблема 1: Воздух
Утверждение: Воздух содержит 21 % кислорода и 79 % азота. Молярная масса кислорода и азота составляет 15,999 г моль 90 020 -1 9.0021 и 14,007 г моль -1 .
Решение: Указанные проценты указаны не в массе, а в молях. Так, в 100 моль воздуха содержится 21 моль кислорода и 79 моль азота.
Преобразование моля в грамм,
Пусть w O 2 и w N 2 — массовая доля кислорода и азота соответственно.
Таким образом, массовая доля кислорода и азота составляет 23 % и 77 %.
Задача 2: Газопровод
Заявление: газовая труба содержит 2 моль углекислого газа, 10 моль кислорода, 52 моль азота и 1,3 моль метана. Молярная масса водорода, углерода, азота и кислорода составляет 1,008 г моль -1 , 12,011 г моль -1 , 14,007 г моль -1 и 15,999 г моль -1 .
Решение: Молярная масса диоксида углерода, кислорода, азота и метана равна M CO 2 , M O 2 , M N 2 и M CH 4 .
Преобразование молей в граммы,
Массовая доля рассчитывается как:
Задача 3: Серная кислота
Утверждение: Молярная концентрация серной кислоты составляет 2,0 М или 2 моль дм −3 .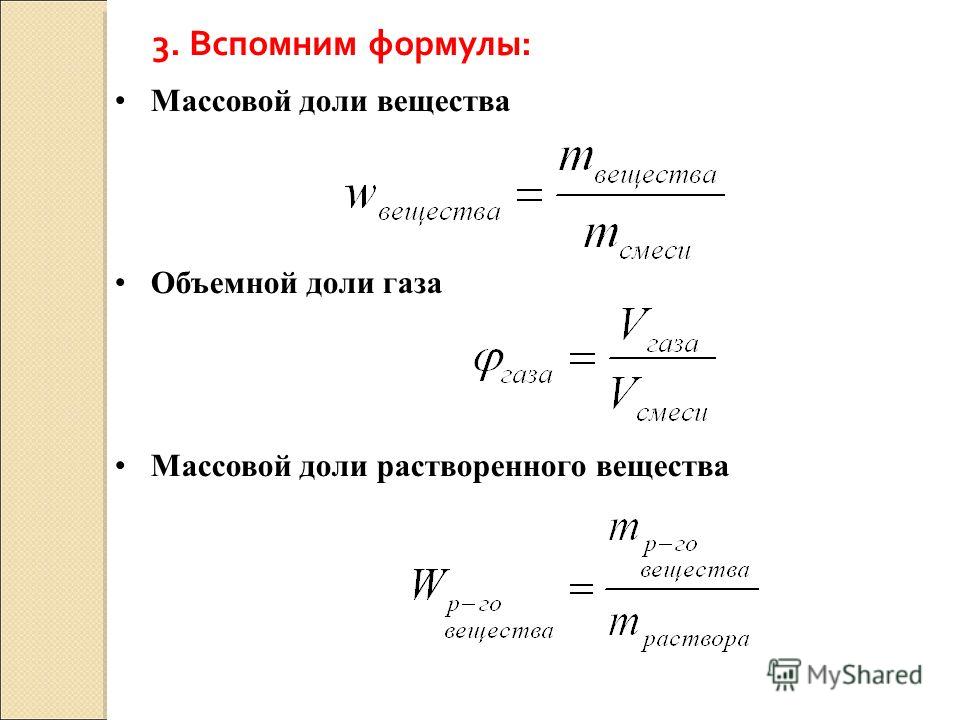 Молярная масса серной кислоты составляет 98,08 г моль -1 . Плотность раствора 1,19 г см -3 .
Молярная масса серной кислоты составляет 98,08 г моль -1 . Плотность раствора 1,19 г см -3 .
Решение: Рассмотрим 1 л (или 1 дм −3 ) раствора.
Моль серной кислоты в 1 л раствора составляет
Преобразование моля в грамм:
Таким образом, 1 л раствора содержит 196,16 г серной кислоты.
Плотность раствора 1,19 г см -3 . Для 1 л раствора масса раствора равна
Массовая доля серной кислоты в 1190 г раствора составляет
Практические задачи
Найдите массовую долю в следующих задачах.
Задача 1: изопропиловый спирт
Раствор изопропилового спирта содержит 40 г изопропилового спирта и 20 г воды. Молярная масса изопропилового спирта и воды составляет 60 г моль -1 и 18 г моль -1 .
Задача 2: Гидроксид натрия
Молярность раствора гидроксида натрия равна 0,51 М. Молярная масса гидроксида натрия составляет 40 г моль −1 . Плотность раствора 1,02 г см -3 .
Плотность раствора 1,02 г см -3 .
Проблема 3: Выхлоп из дымохода
Выхлоп из дымохода содержит 10 молей кислорода (O 2 ), 53 моля азота (N 2 ) и 37 молей углекислого газа (CO 2 ). Молярная масса кислорода, азота и диоксида углерода составляет 32 г моль -1 , 28 г моль -1 и 44 г моль -1 .
- 0,67 изопропилового спирта и 0,33 воды.
- 0,020 гидроксида натрия.
- 0,09 кислорода, 0,43 азота и 0,48 углекислого газа.
Резюме
- Массовая доля – это отношение массы компонента в смеси к общей массе смеси.
- Для раствора это отношение массы растворенного вещества к массе раствора.
- Сумма массовых долей каждого компонента всегда равна единице.
- Это интенсивная собственность. Таким образом, он не будет меняться в зависимости от количества образца. Кроме того, он не зависит от температуры, давления и местоположения.

Связанные статьи
- Мольные доли
- Проценты состава
- Моль
Проценты по массе и массовой доле Учебное пособие по химии
Проценты по массовой и массовой доле Учебное пособие по химии
Ключевые понятия
- Массовая доля также известна как массовая доля.
массовая доля обозначается символом m/m 1
массовая доля обозначается символом w/w - Процент по массе также известен как процент по массе.
90 437 процентов по массе обозначаются символом m/m % (или %) по массе.
процента по массе обозначают символом масс.% (или масс.%). - Массовая доля (массовая доля) и массовые проценты (проценты по массе) являются мерами концентрации растворенного вещества.
- Массовая доля (массовая доля) — отношение массы одного компонента раствора к общей массе раствора. 2
- Массовая доля (а) = масса (а) ÷ (масса (а) + масса (б) + масса (в) + .
 ..)
..)
масса (а) = масса компонента а
масса (b) = масса компонента b
масса (с) = масса компонента сДля двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
массовая доля (растворенного вещества) = масса (раствор) ÷ (масса (раствор) + масса (растворитель) )
- При суммировании массовая доля (массовая доля) каждого компонента в растворе должна равняться единице:
массовая доля (а) + массовая доля (б) + массовая доля (в) + …. = 1
Для двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
массовая доля (растворенное вещество) + массовая доля (растворитель) = 1
- Массы (веса) могут быть выражены в любых единицах, если они одинаковы для всех компонентов.

- Процент по массе (процент по массе) — это процент от общей массы раствора, который является одним компонентом.
Процент по массе = массовая доля × 100
ИЛИ
Массовые проценты = массовая доля × 100Это также может быть выражено как:
% масс.
вес. % а = вес (а) ÷ (вес (а) + вес (б) + вес (в) + …) × 100 - При суммировании процент по массе (или весу) всех компонентов в растворе равен 100:
% по массе а + % по массе b + % по массе с + …. = 100
ИЛИ
вес. % a + вес. % b + вес. % c + …. = 100Для двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
масс. % (растворенное вещество) + масс. % (растворитель) = 100
ИЛИ
мас.% (растворенное вещество) + мас.% (растворитель) = 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Массовая доля (массовая доля) Расчеты концентрации
Вопрос 1. Чему равна массовая доля (массовая доля) хлорида натрия в водном растворе, содержащем 560 мг хлорида натрия и 10,4 г воды?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaCl) и растворителя (H 2 O)
масса (NaCl) = 560 мг
масса (H 2 O) = 10,4 г - Преобразование всех единиц массы в одни и те же единицы (например, все массы в граммах):
масса (NaCl) = 560 мг = 560 × 10 -3 г = 0,560 г
масса (H 2 O) = 10,4 г - Напишите уравнение для расчета массовой доли (массовой доли) хлорида натрия:
массовая доля (NaCl) = масса (NaCl) ÷ (масса (NaCl) + масса (H 2 O) )
- Подставьте значения в уравнение и решите:
массовая доля (NaCl) = 0,560 ÷ (0,560 + 10,4) = 0,051
Вопрос 2. Если в 500 г водного раствора сахарозы содержится массовая доля воды 0,65, какая масса сахарозы присутствует?
Если в 500 г водного раствора сахарозы содержится массовая доля воды 0,65, какая масса сахарозы присутствует?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (сахароза) и растворителя (вода).
масса (водный раствор) = 500 г
массовая доля (вода) = 0,65
масса (сахароза) = ? грамм - Рассчитайте массовую долю сахарозы:
массовая доля (сахароза) + массовая доля (вода) = 1
массовая доля (сахароза) = 1 — массовая доля (вода) = 1 — 0,65 = 0,35
- Рассчитайте массу присутствующей сахарозы:
массовая доля (сахароза) = масса (сахароза) ÷ общая масса (раствор)
масса (сахароза) = массовая доля (сахароза) × масса масса сахарозы 5 (раствор)
16 6 ) = 0,35 х 500 = 175 г
Проценты по массе (проценты по массе) Расчет концентрации
Вопрос 1. Водный раствор хлорида калия имеет массовую долю воды 78%.
Водный раствор хлорида калия имеет массовую долю воды 78%.
Какова массовая доля хлорида калия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества, хлорида калия (KCl), и растворителя, воды (H 2 О)
мас.% (вода) = 78 %
мас.% (KCl) = ? % - Напишите уравнение для расчета массовых % (KCl):
% масс. (KCl) + % масс. (H 2 O) = 100
Измените уравнение, чтобы найти массовый % KCl:
масс.% (KCl) = 100 — масс.% (H 2 O) - Подставьте значения в уравнение и решите:
мас.% (KCl) = 100 — 78 = 22%
Вопрос 2. Водный раствор содержит 700 г воды и 45 г гидроксида натрия.
Какова массовая доля гидроксида натрия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaOH) и растворителя (H 2 O).

масса (H 2 O) = 700 г
масса (NaOH) = 45 г
мас.% (NaOH) = ? % - Напишите уравнение для определения массового процента:
% масс. NaOH = масса (NaOH) ÷ (масса (NaOH) + масса (H 2 O) ) × 100
- Подставьте значения (все массы должны иметь одинаковые единицы измерения) в уравнение и решите:
мас.% NaOH = 45 ÷ (45 + 700) × 100 = 6,04%
Вопрос 3. Водный раствор содержит 42% этанола по массе.
Какая масса этанола содержится в 250 г раствора?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (этанол) и растворителя (вода).
мас. % этанола = 42 %
масса (раствор) = масса (этанол) + масса (вода) = 250 г
масса (этанол) = ? грамм - Напишите уравнение для определения массовой доли этанола:
масс.
 % этанола = масс. (этанол) ÷ масс. (раствор) × 100
% этанола = масс. (этанол) ÷ масс. (раствор) × 100
Переформулируйте уравнение, чтобы найти массу этанола:
масса (этанол) = масс.% этанола × масса (раствор) ÷ 100
- Подставьте значения в уравнение и решите:
масса (этанол) = 42 × 250 ÷ 100 = 105 г
1. НЕ путайте м/м с м/м
м/м относится к массовой доле
м/м относится к расчету молей, моль = масса ÷ молярная масса
2. НЕ путайте концентрацию в процентах по массе (или весу) с концентрацией в процентах по весовому соотношению.
процента по массовой концентрации = масса (растворенного) ÷ масса (раствор) × 100
массовое отношение процентная концентрация = масса (растворенного вещества) ÷ масса (растворителя) × 100
©AUS-e-TUTE
www.ausetute.com.au
2.10: Процентный состав — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50438
- Роберт Белфорд
- Университет Арканзаса в Литл-Роке
Цели обучения
- Введение массовых процентов и мольных долей
- Расчет массовых процентов по химическим формулам
Введение
Процент и дробь, по сути, говорят вам об одном и том же, они описывают отношение части к целому.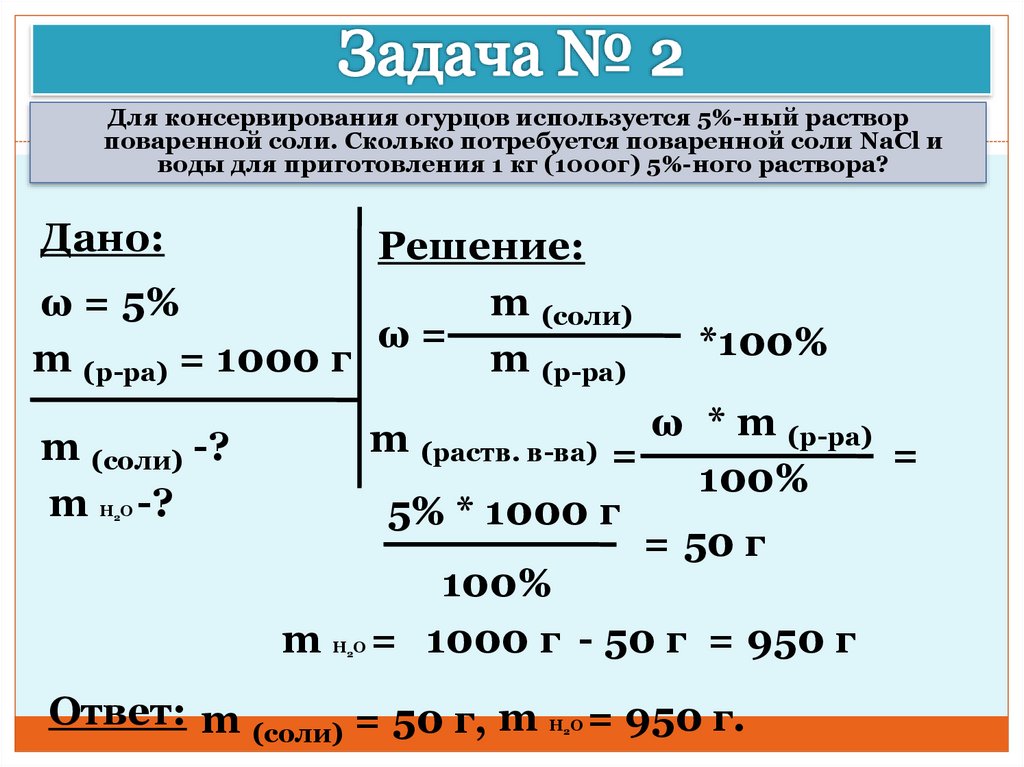 Поскольку химическое соединение имеет постоянный состав, который определяется его молекулярной формулой или формулой соединения, доля каждого типа элемента должна быть постоянной. Например, вода состоит из 3 атомов, одного водорода и двух атомов кислорода. Таким образом, доля кислорода составляет 1/3 (33,3%), а доля водорода составляет 2/3 (66,7%), как показано на левой круговой диаграмме рисунка (PageIndex{1}). Но вода весит в 16 раз больше, чем водород, поэтому, если бы вы могли взвесить молекулу воды, масса кислорода составила бы 16 дальтонов, а масса двух атомов водорода — 2 дальтона, поэтому по массе вода равна 88,9.% кислорода и 11,1% водорода. Поэтому, когда мы говорим о дробном или процентном составе, нам нужно определить, как мы его определяем. Обычно, но не всегда, химики используют проценты для массы и доли для молей (количества частиц).
Поскольку химическое соединение имеет постоянный состав, который определяется его молекулярной формулой или формулой соединения, доля каждого типа элемента должна быть постоянной. Например, вода состоит из 3 атомов, одного водорода и двух атомов кислорода. Таким образом, доля кислорода составляет 1/3 (33,3%), а доля водорода составляет 2/3 (66,7%), как показано на левой круговой диаграмме рисунка (PageIndex{1}). Но вода весит в 16 раз больше, чем водород, поэтому, если бы вы могли взвесить молекулу воды, масса кислорода составила бы 16 дальтонов, а масса двух атомов водорода — 2 дальтона, поэтому по массе вода равна 88,9.% кислорода и 11,1% водорода. Поэтому, когда мы говорим о дробном или процентном составе, нам нужно определить, как мы его определяем. Обычно, но не всегда, химики используют проценты для массы и доли для молей (количества частиц).
| Молярная доля/процент воды | Массовая доля/процент воды |
Рисунок (PageIndex{1}): Молярные (слева) и массовые (справа) доли (или проценты) кислорода и водорода в воде.
Итак, вода в основном кислород или водород? Ну, это как посмотреть. Если считать атомы, то это в основном водород. Если вы измеряете массу, это в основном кислород.
Массовый процент
Массовый процент любого элемента в соединении равен 100-кратной массе элемента, деленной на общую массу
[mathrm{Масса: %: element=dfrac{масса: элемент }{масса: соединение}times100%}]
Один моль воды весит 18 граммов, где 2 грамма приходится на водород, а 16 на кислород, поэтому доля водорода составляет 2/18 (0,1111), а доля кислорода составляет 16/18 (0,8889), и обратите внимание, что сумма дробей равна 1. Процент элемента в соединении в 100 раз больше доли, поэтому для воды массовый процент водорода составляет 11,11%, а массовый процент кислорода составляет 88,89%.
[mathrm{Масса: %H=dfrac{масса: H}{масса: соединение}times100%}]
[mathrm{Масса: %O= dfrac{масса: O}{масса: соединение}times100%}]
для воды
[mathrm{Масса: %H=dfrac{2g}{18g}times100% }=11,11%]
[mathrm{Масса: %O=dfrac{16g}{18g}times100%}=89. 99%]
99%]
Уравнения 2.10.4 и 2.10.5 описывают правую круговую диаграмму на рисунке (PageIndex{1}), и обратите внимание, что их сумма составляет 100%.
В видеоролике (PageIndex{1}) показан метод вычисления процентного состава формулы, который минимизирует объем необходимой работы.
Видео (PageIndex{1}): Расчет массового % состава элементов в уксусной кислоте.
ПРИМЕЧАНИЕ: Несмотря на то, что масса имеет единицы измерения, массовые проценты безразмерны, поэтому необходимо соблюдать осторожность, чтобы определить, к чему относится процент или доля. Кроме того, поскольку образец чистого вещества состоит из молекул или ионных соединений одной и той же формулы, процентное или дробное значение не зависит от размера образца. Таким образом, одна молекула воды имеет тот же процентный состав, что и галлон [чистой] воды.
Следует также отметить, что, как показывают следующие два видеоролика, некоторые формулы имеют одинаковый процентный состав, даже если они представляют собой разные молекулы, например, ацетилен (C 2 H 2 ) и бензол (C 6 H 6 ).
Видео (PageIndex{2}): сравнение % состава ацетилена с бензолом.
Упражнение (PageIndex{1})
Какова массовая доля кислорода в семиокиси дихлора?
- Ответ
-
Масса Cl в 1 моль Cl 2 O 7 , 2 Cl : 2 x 35,45 г = 70,90 г
Масса O в 1 моль Cl 2 O 7 , 7 O: 7 x 16,00 г = 112,00 г
Молярная масса Cl 2 O 7 = 182,90 г/моль
[% : ce{O} = frac{112,00 : text{g} : ce{O}}{182,90 : text{g}} times 100% = 61,24 % : ce{O} номер]
Мольная доля
Мольная доля каждого элемента в образце – это число молей этого элемента в образце, деленное на общее число молей в образце, и это можно определить по химической формуле, где это число атомов этого элемента в формуле, деленное на общее число атомов в формуле.
[mathrm{моль: дробь: из: ан: элемент:=dfrac{моли: из: эт: элемент}{всего: моли: в: соединение}} ]
показывает количество элементов каждого типа, поэтому один моль воды (H 2 O) содержит два моля водорода и один моль воды. То есть мольная доля водорода составляет 2/3 (0,6667), а мольная доля кислорода составляет 1/3 (0,3333), что означает, что мольная доля воды составляет 67% водорода и 33% кислорода.
[mathrm{моль: дробь: H=dfrac{моль: H}{всего: моль: дюймы: соединение}}]
[mathrm{моль: дробь: O=dfrac{моль: O}{всего: моль: дюйм: соединение}}]
для воды
[mathrm{моль : дробь: H=dfrac{2: моль: H}{3: моль}: =: 0,667}]
[mathrm{моль: дробь: O=dfrac {1: моль: O}{3: моль}: =: 0,333}]
Уравнения 2.10.9 и 2.10.10 описывают правую круговую диаграмму на рисунке (PageIndex{1}) .
Упражнение (PageIndex{2})
Какова молярная доля кислорода в семиокиси дихлора?
- Ответить
-
моль Cl в 1 моль Cl 2 O 7 = 2 моль Cl
моль O в 1 моль Cl 2 O 7 = 7 моль
Всего молей в Cl 2 O 7 = 9
[моль : дробь : ce{O} = frac{7 : text{моль O}}{9 text{общее число молей}} = .

При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#
Что такое массовая доля в химии? Знаете ли вы ответ? Как находить массовую долю элемента в веществе? Сам процесс вычисления вовсе не так сложен. А вы еще испытываете затруднения в подобных задачах? Тогда вам улыбнулась удача, вы нашли эту статью! Интересно? Тогда скорее читайте, сейчас вы все поймете.
Что такое массовая доля?
Итак, для начала выясним, что такое массовая доля. Как находить массовую долю элемента в веществе, ответит любой химик, так как они часто употребляют этот термин при решении задач или во время пребывания в лаборатории. Конечно, ведь ее расчет – их повседневная задача. Чтобы получить определенное количество того или иного вещества в лабораторных условиях, где очень важен точный расчет и все возможные варианты исхода реакций, необходимо знать всего пару простых формул и понимать суть массовой доли. Поэтому эта тема так важна.

Этот термин обозначается символом “w” и читается как “омега”. Он выражает отношение массы данного вещества к общей массе смеси, раствора или молекулы, выражается дробью или в процентах. Формула расчета массовой доли:
w = m вещества / m смеси.
Преобразуем формулу.
Мы знаем, что m=n*M, где m – масса; n – количество вещества, выраженное в единицах измерения моль; M – молярная масса вещества, выраженная в грамм/моль. Молярная масса численно равна молекулярной. Только молекулярная масса измеряется в атомных единицах масс или а. е. м. Такая единица измерения равна одной двенадцатой доле массы ядра углерода 12. Значение молекулярной массы можно найти в таблице Менделеева.
Количество вещества n нужного объекта в данной смеси, равно индексу, умноженному на коэффициент при данном соединении, что очень логично. Например, чтобы рассчитать количество атомов в молекуле, надо узнать, сколько атомов нужного вещества находится в 1 молекуле = индекс, и умножить это число на количество молекул = коэффициент.
Не стоит бояться таких громоздких определений или формул, в них прослеживается определенная логика, поняв которую, можно даже сами формулы не учить. Молярная масса M равна сумме атомных масс Ar данного вещества. Напомним, что атомная масса – масса 1 атома вещества. То есть исходная формула массовой доли:
w = ( n вещества*M вещества)/m смеси.
Из этого можно сделать вывод, что если смесь состоит из одного вещества, массовую долю которого надо вычислить, то w=1, так как масса смеси и масса вещества совпадают. Хотя смесь априори не может состоять из одного вещества.
Так, с теорией разобрались, но как находить массовую долю элемента в веществе на практике? Сейчас все покажем и расскажем.

Проверка усвоенного материала. Задача легкого уровня
Сейчас мы разберем две задачи: легкого и среднего уровня. Читайте далее!
Необходимо узнать массовую долю железа в молекуле железного купороса FeSO4*7 H2O. Как решить эту задачу? Рассмотрим решение далее.
Решение:
Возьмем 1 моль FeSO4*7 H2O, тогда узнаем количество железа, умножив коэффициент железа на его индекс: 1*1=1. Дан 1 моль железа. Узнаем его массу в веществе: из значения в таблице Менделеева видно, что атомная масса железа 56 а. е. м. = 56 грамм/моль. В данном случае Ar=M. Следовательно, что m железа = n*M = 1 моль* 56 грамм/моль = 56 г.
Теперь нужно найти массу всей молекулы. Она равна сумме масс исходных веществ, то есть 7 моль воды и 1 моль сульфата железа.
m= (n воды* M воды) + (n сульфата железа*M сульфата железа) = (7 моль*(1*2+16) грамм/моль) + (1 моль* (1 моль*56 грамм/моль+1 моль*32 грамм/моль + 4 моль*16 грамм/моль) = 126+152=278 г.
Остается лишь разделить массу железа на массу соединения:
w=56г/278 г=0.20143885~0.2=20%.
Ответ: 20%.
Задача среднего уровня
Решим более сложную задачу. В 500 г воды растворено 34 г нитрата кальция. Нужно найти массовую долю кислорода в полученном растворе.
Решение
Так как при взаимодействии Ca(NO3)2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
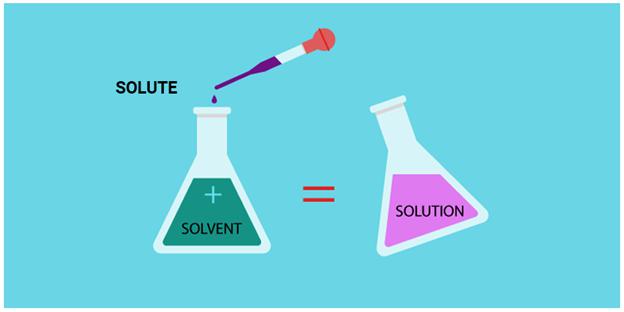
Нам нужно найти массовую долю кислорода в растворе. Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде. Для этого посчитаем моль воды по формуле n=m/M.
n воды=500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H2O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO3)2. Для этого узнаем количество самого вещества:
n Ca(NO3)2=34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O= 29.2 моль*16 грамм/моль=467.2 г.
m раствора=m воды + m Ca(NO3)2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O=467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
