Ученик
(148),
закрыт
10 лет назад
Екатерина
Гуру
(3248)
10 лет назад
Число электронов, содержащихся в одном моле
N(e) = 1моль*Na = 6,02*10^23 электронов
где Na = 6,02*10^23 1/моль – число Авогадро
Масса одного моля электронов равна массе одного электрона, умноженной на число электронов, содержащихся в одном моле
m = m(e)*N(e) = 9,1*10^(-31)*6,02*10^23 = 54,782*10^(-8) кг = 54,782*10^(-5) г
m(e) = 9,1*10^(-31) кг – масса одного электрона
ЛЕКЦИИ ДЛЯ УЧИТЕЛЕЙ
Элементы научного поиска
при решении нестандартных
химических задач*
Основной способ активного освоения любой новой
области деятельности – тренировка. В химии и
других естественных науках тренировка сводится
к решению задач. Принципиально разных типов
химических задач сравнительно немного, особенно
в школьном курсе [1]. Все они известны и четко
классифицированы по содержанию и способам
решения [2]. Поэтому в принципе не представляет
больших проблем натренировать школьников решать
стандартные задачи, включающие, например,
расчеты по уравнениям химических реакций или
определение молекулярной формулы по элементному
составу.Другое дело – задачи нестандартные. Любое
малейшее отклонение от проторенной дорожки
приводит большинство учащихся в ступор,
переходящий в полный паралич умственной
деятельности. Они просто не знают, что делать.
Результатом является чистый лист.В этих случаях для выхода из тупиковой ситуации
можно привлечь в помощь элементы научного
способа познания мира. Ведь наука – это, по
определению, поиск нового, создание информации,
отличающейся от уже имеющейся. Поэтому она может
помочь найти новый способ решения задачи.
Элементарные представления о том, как вести себя
в незнакомой ситуации, какие использовать методы
для поиска решения, любому школьнику не повредят.Научная работа как способ деятельности – это
не перманентное творчество, она включает в себя и
повседневный, причем иногда утомительный труд.
Наука – это профессия, поэтому у научных
работников есть много профессиональных приемов
и рецептов, как добиваться своих целей.
Некоторыми из этих приемов мы и хотим поделиться:
они оказываются полезными при решении школьных
химических задач. Каждый рецепт будет
проиллюстрирован примерами.Разумеется, эти рецепты не универсальны: они
годятся для решения одних задач и совершенно
непригодны для других, требующих иных, может
быть, еще неизвестных подходов. Именно поэтому в
науке всегда было, есть и будет место творчеству.
![]() Р е ц е п т 1.
Р е ц е п т 1.
Пробовать
Дмитрий Иванович Менделеев, рассказывая о том,
как он открыл периодический закон, утверждал:
«Искать же что-либо, хотя бы грибы или
какую-нибудь зависимость, нельзя иначе, как
смотря и пробуя». Пробовать – это главный
научный рецепт. Для этого надо предложить любой
(пусть совсем неправильный) способ решения и
посмотреть, к чему он приводит. Можно попытаться
понять, в каком месте возникает отклонение от
условия задачи, и в этом месте подправить способ.
Так, путем проб и ошибок, методом
последовательных приближений иногда можно
решить задачу.
Пример 1. Установите возможную формулу
органического соединения, которое содержит 40%
углерода по массе.
Р е ш е н и е. Дана массовая доля углерода, а
больше про вещество ничего не известно. Давайте
пробовать разные варианты – будем
самостоятельно «назначать» дополнительную
информацию.
Самые простые органические вещества –
углеводороды CxHy. Пусть
неизвестное вещество содержит 40% углерода и 60%
водорода. Найдем его эмпирическую формулу
стандартным способом:
![]()
Углеводород CH18 не существует.
Пробуем дальше. Добавим в формулу вещества
символ кислорода: CxHyOz.
С помощью стандартного приема мы формулу найти
не можем, т.к. массовые доли кислорода и водорода
неизвестны. Попробуем принять наименьшее
возможное значение числа атомов углерода: x =
1. Тогда молярная масса вещества составляет:
M(CHyOz) = 12/0,4 = 30
г/моль.
Из 30 г на углерод приходится 12 г, а на водород и
кислород – 18 г, что соответствует H2O. Таким
образом, эмпирическая формула вещества – CH2O.
Этой формуле соответствуют, например, все
углеводы.
О т в е т. Возможная формула соединения
– CH2O.
Пример 2. Два углеводорода – A и B
– имеют одинаковый элементный состав: каждый
содержит по 92,3% мас. углерода. Образец
углеводорода A может присоединить в 6 раз
большее количество брома, чем равный по массе
образец углеводорода B. Определите возможные
структурные формулы веществ A и B.
Р е ш е н и е. Из элементного состава следует:
![]() (C) :
(C) : ![]() (H) = (92,3/12) : (7,7/1) = 1:1.
(H) = (92,3/12) : (7,7/1) = 1:1.
Эмпирическая формула обоих углеводородов – CH.
Кроме того, они содержат кратные связи, т.к.
способны присоединять бром.
Попробуем рассмотреть несколько простейших
углеводородов такого состава и рассчитаем
количество брома, способное присоединиться к
одной и той же массе каждого углеводорода. В
качестве ограничения выберем 104 г – массу 1 моль
самого тяжелого из рассматриваемых веществ: C8H8
(таблица).
Таблица
| Формула углеводорода |
Структура | Kоличество вещества Br2 на 1 моль углеводорода, моль |
Kоличество вещества Br2 на 104 г углеводорода, моль |
|---|---|---|---|
| C2H2 (Mr = 26) | HC |
2 | 2•4 = 8 |
| C4H4 (Mr = 52) | HC |
3 | 3•2 = 6 |
| C6H6 (Mr = 78) | HC |
4 | 4•4/3 = 16/3 |
| C8H8 (Mr = 104) | C6H5CH=CH2 | 1 | 1 |
Из таблицы видно, что условию задачи
удовлетворяют винилацетилен (A) и стирол (B).
Молярные массы у них отличаются в 2 раза, а
количества вещества присоединяемого брома на 1
моль углеводорода – в 3 раза, итого при равных
массах получаем искомый коэффициент 6.
Уравнения реакций:
HC![]() C–CH=CH2 + 3Br2
C–CH=CH2 + 3Br2
![]() CHBr2CBr2CHBrCH2Br,
CHBr2CBr2CHBrCH2Br,
C6H5CH=CH2 + Br2 ![]() C6H5CHBrCH2Br.
C6H5CHBrCH2Br.
Эта задача имеет бесконечно много решений, тем
она и трудна. Мы привели лишь самое простое
решение, найденное небольшим перебором.
О т в е т. Возможные структурные формулы
веществ: A – HC![]() C–CH=CH2, B
C–CH=CH2, B
– C6H5–CH=CH2.
![]() Р е ц е п т 2.
Р е ц е п т 2.
Правильно выбирать переменные
Решение многих расчетных задач значительно
облегчается правильным выбором переменных –
тех, которые характеризуют наиболее
существенные свойства изучаемых объектов. При
этом надо стараться обходиться минимальным
числом переменных.
Пример 3. В каком оксиде массовая доля
кислорода наибольшая?
Р е ш е н и е. Общая формула бинарных
кислородсодержащих соединений – RxOy.
Если ограничиться оксидами элементов с
постоянной валентностью, то число неизвестных
переменных можно сократить – R2On,
где n – степень окисления элемента R (n
изменяется от 1 до 8).
В задаче осталось две переменных – атомная
масса элемента R (обозначим ее через X) и
степень окисления n. Запишем выражение для
массовой доли кислорода:
![]()
Надо найти максимальное ее значение. С двумя
переменными это сделать очень трудно, но в данном
случае их можно объединить в одну. Поделим
числитель и знаменатель дроби на 16n:
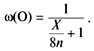
Для того чтобы выражение было максимальным,
знаменатель должен быть минимальным. Значит,
надо найти элемент, у которого отношение атомной
массы к степени окисления (это отношение иногда
называют эквивалентом) наименьшее: X/n = min.
Очевидно, что это водород: X = 1, n = 1. Искомый
оксид – вода.
О т в е т. Массовая доля кислорода
наибольшая в H2O.
Пример 4. 1000 г вещества содержат 0,3227 г
электронов. Определите формулу вещества (масса
электрона равна 1/1823 а.е.м.).
Р е ш е н и е. По данным задачи можно сразу найти
количество вещества электронов:
![]()
Количество самого вещества неизвестно, т.к. мы
не знаем его молярную массу. Обозначим ее через M
– это первая переменная, которую мы вводим.
Теперь находим количество вещества:
![]()
Как связаны между собой две указанные величины?
Для ответа на этот вопрос придется ввести еще
одну переменную n – число электронов в одной
молекуле. Тогда число молей электронов ровно в n
раз превышает число молей вещества:
![]()
Откуда M = 1,7n г/моль.
Предположим, что молярная масса выражается
почти целым числом, тогда n кратно 10. При n =
10 имеем M = 17 г/моль. Этой молярной массе
соответствует аммиак, его молекула содержит как
раз 10 электронов.
О т в е т. Формула вещества – NH3.
![]() Р е ц е п т 3.
Р е ц е п т 3.
Строить модели с разумными допущениями
Многие химические объекты – молекулы,
коллоидные частицы, кристаллы, растворы и т.д. –
исследуют путем построения моделей. Модель – это
идеализированное представление объекта, которое
отражает некоторые его существенные свойства и
пренебрегает всеми остальными. Хорошая модель
содержит лишь небольшое число параметров.
Правильность моделей подтверждается сравнением
с экспериментальными данными. Искусство
научного работника состоит в том, чтобы выбрать
главное в модели и пренебречь несущественным.
Пример 5. Радиус наночастицы золота
равен 1,5 нм, а радиус атома – 0,15 нм. Оцените,
сколько атомов входит в состав наночастицы и
какая их доля находится на поверхности.
Р е ш е н и е. Судя по условию задачи, наночастица
представляет большой шар, заполненный
маленькими шарами – атомами золота.
Шарообразные формы наночастицы и атома – это
первое допущение.
Предлагается определить число атомов по
порядку величины, т.е. получить ответ с невысокой
точностью. В таком грубом приближении можно
пренебречь свободным объемом между атомами в
наночастице и считать, что шары заполняют все
пространство. Это дает ошибку около 20%. Общее
число атомов равно отношению объема наночастицы
к объему атома:
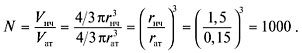
В случае гетерогенных катализаторов реакция
происходит на поверхности частиц. Поэтому, чтобы
оценить каталитические возможности наночастиц,
надо знать долю атомов на поверхности. Для этого
найдем объем поверхностного слоя Vпов и
разделим его на объем наночастицы Vнч.
Объем поверхностного слоя равен разности между
объемами самой наночастицы и «внутреннего» шара,
радиус которого меньше радиуса наночастицы на
диаметр атома (рис.).
Доля атомов на поверхности:
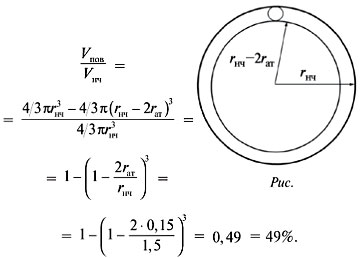
О т в е т. Число атомов золота в составе
наночастицы – 1000;
их доля на поверхности – 49%.
![]() Р е ц е п т 4.
Р е ц е п т 4.
Угадать и доказать, что правильно
Во многих задачах – преимущественно тех, в
которых зашифрованы цепочки превращений с
неизвестными веществами, – ответ можно угадать.
Но надо еще доказать, что он отвечает условиям
задачи.
Пример 6. После пропускания
электрического разряда через смесь газов А и
Б произошла реакция и образовалась смесь газов В
и Г с молярными массами, равными молярным
массам исходных газов. Определите формулы
исходных веществ А и Б.
Р е ш е н и е. Ключ к решению – равенство
молярных масс продуктов и реагентов. Известно
несколько газов с молярной массой 28 г/моль. Это CO,
C2H4, N2, B2H6. Другая
распространенная молярная масса – 44 г/моль, ей
отвечают CO2, N2O, C3H8, CH3CHO.
Числа 44 и 28 отличаются на 16 – это относительная
атомная масса кислорода. Поэтому реакция между
газами A и Б может сводиться к переходу кислорода
от одного вещества к другому. Такие вещества
среди перечисленных выше есть: N2O
(окислитель) и CO (восстановитель). Уравнение
реакции:
![]()
О т в е т. Формулы исходных
веществ – N2O и CO.
Мы рассмотрели лишь некоторые из большого
числа рецептов решения научных задач. Это очень
малая часть «технологии науки».На самом деле самое трудное в науке – не решать
задачи, а придумывать их. Ведь правильно заданный
вопрос содержит в себе большую часть ответа.
Самыми выдающимися считают не тех ученых,
которые решили какую-то проблему, а тех, которые
ее поставили. Самые крупные открытия начинаются
с правильной постановки задачи. Решение задачи –
зачастую дело техники, а вот формулировка
проблемы требует глубокого понимания скрытой
сути явлений. Подробно о том, как делались многие
открытия в химии и физике, можно прочитать в
книге [3].В заключение предлагаем несколько задач, при
решении которых можно использовать описанные
выше рецепты.
![]() Задачи для
Задачи для
самостоятельного решения
1. При количественном окислении 5 г
оптически активного вещества А
перманганатом калия в кислой среде получено 5 г
вещества Б, которое взаимодействует с
веществом А с образованием жидкости В
состава C15H14O2. Установите
структуры веществ А–В.
О т в е т. A – C6H5CH(OH)CH3,
Б – C6H5COОH, В – сложный эфир,
образованный веществами А и Б.
2. Оксид неметалла массой 10,16 г добавили к
124 г 10%-го раствора гидроксида натрия и получили
раствор, в котором массовая доля соли равна 11,27%.
Определите формулы оксида и соли.
О т в е т. SeO3, Na2SeO4.
3. Константа изомеризации некоторого
вещества A = Б равна 0,8. Смешали 5 г вещества A и
10 г его изомера Б и смесь выдержали до
установления равновесия. Вычислите массовую
долю изомера Б в полученной смеси. Зависит ли
результат от количества изомеров в исходной
смеси?
О т в е т. 0,44; не зависит.
4. В cлучае гетерогенных катализаторов
реакция происходит на поверхности частиц. Пусть
частица состоит из атомов металла радиусом r.
Определите долю атомов на поверхности
катализатора, если его частицы имеют форму: а)
шара радиуса R; б) куба со стороной L. В каком
случае – шара или куба – доля атомов на
поверхности больше, если куб и шар имеют
одинаковый объем?
О т в е т. а) 6r/R; б) 12r/L.
В случае куба доля атомов больше.
5. Два газообразных простых вещества,
состоящих из двухатомных молекул, смешали в
объемном соотношении 1 : 9 в закрытом
реакционном сосуде при температуре 20 °С и
высоком давлении. Сосуд нагрели до 215 °С; при
этом с количественным выходом образовалось
газообразное сложное вещество, а давление по
окончании реакции оказалось равным
первоначальному. Определите формулу продукта
реакции.
О т в е т. ClF5.
6. Для полного гидролиза 7,4 г смеси двух
сложных эфиров потребовалось 70 г 8%-го раствора
гидроксида калия. При добавлении к такому же
количеству смеси избытка аммиачного раствора
оксида серебра выделилось 6,48 г осадка.
Определите строение сложных эфиров и их
содержание в исходной смеси (в мольных %).
О т в е т. 30% HCOOC2H5, 70% CH3COOCH3.
7. При нагревании до 170 °С смеси двух
твердых при обычных условиях веществ, взятых в
мольном соотношении 1 : 41, образовались
твердое и газообразное вещества в мольном
соотношении 40 : 41. Определите все вещества.
О т в е т. C40H82, S, C, H2S.
* По материалам лекции для
учителей, прочитанной на Фестивале науки в МГУ
им. М.В.Ломоносова в октябре 2006 г.
Л и т е р а т у р а
1. Еремин В.В., Кузьменко Н.Е. Сборник задач и
упражнений по химии. Школьный курс. М.: Экзамен,
2006.
2. Олейников Н.Н., Муравьева Г.П. Химия.
Основные алгоритмы решения задач. М.: УНЦ ДО, 2003.
3. Краткий миг торжества. О том, как делаются
научные открытия (библиотека журнала «Химия и
жизнь»). М.: Наука, 1988.
В.В.ЕРЕМИН,
профессор химического факультета МГУ
Download Article
Download Article
Atomic mass is the sum of all the protons, neutrons, and electrons in a single atom or molecule. However, the mass of an electron is so small, it is considered negligible and not included in the calculation.[1]
Though technically incorrect, the term is also often used to refer to the average atomic mass of all of the isotopes of one element. This second definition is actually the relative atomic mass, also known as the atomic weight, of an element.[2]
The atomic weight takes into account the average of the masses of naturally occurring isotopes of the same element. Chemists need to distinguish between these two types of atomic mass to guide their work – an incorrect value for atomic mass can, for instance, lead to an incorrect calculation of an experiment’s yield.
-

1
Understand how atomic mass is represented. Atomic mass, the mass of a given atom or molecule, can be expressed in standard SI mass units – grams, kilograms, etc. However, because atomic masses, when expressed in these terms, are incredibly small, atomic mass is often expressed in unified atomic mass units (usually shortened to “u” or “amu”) or in Dalton’s (Da). The standard for one atomic mass unit is equal to 1/12th of the mass of a standard carbon-12 isotope.[3]
- The atomic mass is the number of grams of the element in one mole of atoms of the element. This is a very useful property when it comes to practical calculations, as it allows easy conversion between the mass and moles of a given quantity of atoms or molecules of the same type.
-

2
Locate atomic mass on the periodic table. Most standard periodic tables list the relative atomic masses (atomic weights) of each element. This is almost always written as a number at the bottom of the element’s square on the table, under its one or two letter chemical symbol. This number is usually expressed as a decimal rather than as a whole number.
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
Thus, the relative atomic mass listed on the periodic table is suitable as an average value for atoms of a certain element, but not as the mass of a single atom of that element. - Relative atomic masses, as listed on the periodic table, are used to calculate molar masses for atoms and molecules. Atomic masses, when expressed in amu, as on the periodic table, are technically unitless. However, by simply multiplying an atomic mass by 1 g/mol, a workable quantity is obtained for an element’s molar mass – the mass (in grams) of one mole of an element’s atoms.
- For example, the atomic mass of iron is 55.847 amu, which means one mole of iron atoms would weigh 55.847 grams.
Advertisement
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
-

3
Understand that periodic table values are an average atomic mass for an element. As has been noted, the relative atomic masses listed for each element on the periodic table are average values of all of an atom’s isotopes. This average value is valuable for many practical calculations – like, for instance, calculating the molar mass of a molecule comprised of several atoms. However, when dealing with individual atoms, this number is sometimes insufficient.
- Because it’s an average of several different types of isotopes, the value on the periodic table isn’t the exact value for any single atom’s atomic mass.
- The atomic masses for individual atoms must be calculated by taking into account the exact number of protons and neutrons in a single atom.
Advertisement
-

1
Find the atomic number of the element or isotope. The atomic number is the number of protons in an element, and never varies.[5]
For example, all hydrogen atoms, and only hydrogen atoms, have 1 proton. Sodium has an atomic number of 11 because its nucleus has 11 protons, while oxygen has an atomic number of 8 because its nucleus has 8 protons. You can find the atomic number of any element on the periodic table – in nearly all standard periodic tables: it’s the number above an element’s 1 or 2-letter chemical symbol. This number will always be a positive whole number.- Let’s say that we’re working with the carbon atom. Carbon always has 6 protons, so we know its atomic number is 6. We can also see on the periodic table that the square for carbon (C) has a “6” at the top, signifying that carbon’s atomic number is 6.
- Note that an element’s atomic number doesn’t have any direct bearing on its relative atomic mass as listed on the periodic table. Though, especially among elements at the top of the periodic table, it may seem that an atoms’ atomic mass is about twice its atomic number, atomic mass isn’t ever calculated by doubling an element’s atomic number.
-

2
Find the number of neutrons in the nucleus. The number of neutrons can vary among atoms of a certain element. While 2 atoms with the same number of protons and differing numbers of neutrons are both the same element, they are different isotopes of that element. Unlike the number of protons in an element, which never changes, the number of neutrons in atoms of a certain element can vary often enough that the average atomic mass of the element must be expressed as a decimal value between two whole numbers.
- The number of neutrons can be determined by the isotope designation of the element. For example, carbon-14 is a naturally occurring radioactive isotope of carbon-12. You will often see an isotope designated with the number as a superscript before the element symbol: 14C. The number of neutrons is calculated by subtracting the number of protons from the isotope number: 14 – 6 = 8 neutrons.
- Let’s say the carbon atom we’re working with has six neutrons (12C). This is by far the most common isotope of carbon, accounting for nearly 99% of all carbon atoms.[6]
However, about 1% of carbon atoms have 7 neutrons (13C). Other types of carbon atoms with more or less than 6 or 7 neutrons exist in very small amounts.
-

3
Add the proton and neutron count. This is the atomic mass of that atom. Don’t worry about the number of electrons orbiting the nucleus – their combined mass is very, very small, so, in most practical cases, it won’t significantly affect your answer.[7]
- Our carbon atom has 6 protons + 6 neutrons = 12. The atomic mass of this specific carbon atom is 12. If it was a carbon-13 isotope, on the other hand, we would know that it has 6 protons + 7 neutrons = an atomic weight of 13.
- The actual atomic weight of carbon-13 is 13.003355[8]
, and is more precise because it was determined experimentally. - Atomic mass is very close to the isotope number of an element. For basic calculation purposes, isotope number is equal to atomic mass. When determined experimentally, the atomic mass is slightly higher than the isotope number due to the very small mass contribution from electrons.
Advertisement
-

1
Determine which isotopes are in the sample. Chemists often determine the relative proportions of isotopes in a given sample by using a special tool called a mass spectrometer. However, at student-level chemistry, this information is often provided for you on school tests, etc., in the form of established values from scientific literature.
- For our purposes, let’s say we’re working with the isotopes carbon-12 and carbon-13.
-

2
Determine the relative abundance of each isotope in the sample. Within a given element, different isotopes appear in different proportions. These proportions are almost always expressed as percentages. Some isotopes will be very common, while others will be very rare – at times, so rare that they can barely be detected. This information can be determined through mass spectrometry or from a reference book.
- Let’s say that the abundance of carbon-12 is 99% and the abundance of carbon-13 is 1%. Other carbon isotopes do exist, but they exist in quantities so small that, for this example problem, they can be ignored.
-

3
Multiply the atomic mass of each isotope by its proportion in the sample. Multiply the atomic mass of each isotope by its percent abundance (written as a decimal). To convert a percentage to a decimal, simply divide it by 100. The converted percentages should always add up to 1.
- Our sample contains carbon-12 and carbon-13. If carbon-12 makes up 99% of the sample and carbon-13 makes up 1% of the sample, multiply 12 (the atomic mass of carbon-12) by 0.99 and 13 (the atomic mass of carbon-13) by 0.01.
- A reference book will give percent proportions based on all the known amounts of an element’s isotopes. Most chemistry textbooks include this information in a table at the end of the book. A mass spectrometer can also yield the proportions for the sample being tested.
-

4
Add the results. Sum the products of the multiplications you performed in the previous step. The result of this addition is the relative atomic mass of your element – the average value of the atomic masses of your element’s isotopes. When discussing an element in general, and not specific isotopes of that element, this value is used.
- In our example, 12 x 0.99 = 11.88 for carbon-12, while 13 x 0.01 = 0.13 for carbon-13. The relative atomic mass of our example is 11.88 + 0.13 = 12.01.
Advertisement
Add New Question
-
Question
How do I find the mass number of an atom?

Add the protons and neutrons together to find the mass, or add the masses of the isotopes multiplied by the atom’s natural abundance.
-
Question
If 1 amu is 1/12 of a carbon 12 atom, why is it that when I add the masses of the individual parts of a carbon 12 atom, I get more than 12 amu?

1 u = 1/12 the mass of carbon 12 by definition. You’re adding the masses of uncombined protons and neutrons, 1.0073 u and 1.0087 u respectively. But when those particles fuse together to form an atom, some of the mass is converted into energy according to E=mc^2. The lost mass is called the “mass defect”, and the equivalent amount of energy is the “binding energy.”
-
Question
How can I find the mass of any atom to convert it in a.m.u.?

We can find the mass of any atom by adding the electrons, protons and neutrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Things You’ll Need
- Chemistry reference book
- Calculator
References
About This Article
Article SummaryX
To calculate atomic mass, start by finding the atomic number of the element, which is the number above the element on the periodic table. Next, find the number of neutrons in the nucleus by subtracting the atomic number from the isotope number. Finally, add the atomic number and the number of neutrons to get the atomic mass. To learn how to locate an element’s atomic mass on the periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 953,287 times.
Reader Success Stories
-

“I couldn’t do my homework for my science teacher without this article, it has helped me understand the topic…” more
Did this article help you?
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 949 885 раз.
Была ли эта статья полезной?
|
|
Макеты страниц
Удельный заряд электрона (т. е. отношение  ) был впервые измерен Томсоном в 1897 г. с помощью разрядной трубки, изображенной на рис. 74.1. Выходящий из отверстия в аноде А электронный пучок (катодные лучи; см. § 85) проходил между пластинами плоского конденсатора и попадал на флуоресцирующий экран, создавая на нем светящееся пятно.
) был впервые измерен Томсоном в 1897 г. с помощью разрядной трубки, изображенной на рис. 74.1. Выходящий из отверстия в аноде А электронный пучок (катодные лучи; см. § 85) проходил между пластинами плоского конденсатора и попадал на флуоресцирующий экран, создавая на нем светящееся пятно.
Подавая напряжение на пластины конденсатора, можно было воздействовать на пучок практически однородным электрическим полем. Трубка помещалась между полюсами электромагнита, с помощью которого можно было создавать на том же участке пути электронов перпендикулярное к электрическому однородное магнитное поле (область этого поля обведена на рис. 74.1 пунктирной окружностью). При выключенных полях пучок попадал на экран в точке О. Каждое из полей в отдельности вызывало смещение пучка в вертикальном направлении. Величины смещений определяются полученными в предыдущем параграфе формулами (73.3) и (73.4).
Включив магнитное поле и измерив вызванное им смещение следа пучка

Томсон включал также электрическое поле и подбирал его значение так, чтобы пучок снова попадал в точку О. В этом случае электрическое и магнитное поля действовали на электроны пучка одновременно с одинаковыми по величине, но противоположно направленными силами. При этом выполнялось условие

Решая совместно уравнения (74.1) и (74.2), Томсон вычислял  .
.
Буш применил для определения удельного заряда электронов метод магнитной фокусировки. Суть этого метода заключается в следующем. Допустим, что в однородном магнитном поле вылетает из некоторой точки слегка расходящийся симметричный относительно направления поля пучок электронов, имеющих одинаковую по величине скорость v. Направления, по которым вылетают электроны, образуют с направлением В небольшие углы а. В § 72 было выяснено, что электроны движутся в этом случае по спиральным траекториям, совершая за одинаковое время

полный оборот и смещаясь вдоль направления поля на расстояние  , равное
, равное


Рис. 74.1.
Вследствие малости угла а расстояния (74.3) для разных электронов оказываются практически одинаковыми и равными  (для малых углов
(для малых углов  ). Следовательно, слегка расходящийся пучок сфокусируется в точке, отстоящей от точки вылета электронов на расстояние
). Следовательно, слегка расходящийся пучок сфокусируется в точке, отстоящей от точки вылета электронов на расстояние

В опыте Буша электроны, испущенные раскаленным катодом К (рис. 74.2), ускоряются, проходя разность потенциалов U, приложенную между катодом К и анодом А. В результате они приобретают скорость и, значение которой может быть найдено из соотношения

Вылетев затем из отверстия в аноде, электроны образуют узкий пучок, направленный вдоль оси эвакуированной трубки, вставленной внутрь соленоида. На входе в соленоид помещается конденсатор, на который подается переменное напряжение. Поле, создаваемое конденсатором, отклоняет электроны пучка от оси прибора на небольшие изменяющиеся со временем углы а. Это приводит к «завихрению» пучка — электроны начинают двигаться по различным спиральным траекториям. На выходе из соленоида ставится флуоресцирующий экран. Если подобрать магнитную индукцию В так, чтобы расстояние Г от конденсатора до экрана удовлетворяло условию

(l — шаг спирали,  — целое число), то точка пересечения траекторий электронов попадет на экран — электронный пучок окажется сфокусированным в этой точке и возбудит на экране резкое светящееся пятно. Если условие (74.6) не соблюдается, светящееся пятно на экране будет размытым. Решив совместно уравнения (74.4), (74.5) и (74.6), можно найти
— целое число), то точка пересечения траекторий электронов попадет на экран — электронный пучок окажется сфокусированным в этой точке и возбудит на экране резкое светящееся пятно. Если условие (74.6) не соблюдается, светящееся пятно на экране будет размытым. Решив совместно уравнения (74.4), (74.5) и (74.6), можно найти 
Наиболее точное значение удельного заряда электрона, установленное с учетом результатов, полученных разными методами, равно

Величина (74.7) дает отношение заряда электрона к его массе покоя  . В опытах Томсона, Буша и других аналогичных опытах определялось отношение заряда к релятивистской массе, равной
. В опытах Томсона, Буша и других аналогичных опытах определялось отношение заряда к релятивистской массе, равной


Рис. 74.2
В опытах Томсона скорость электронов составляла примерно 0,1 с. При такой скорости релятивистская масса превышает массу покоя на 0,5%. В последующих опытах скорость электронов достигала очень больших значений. Во всех случаях было обнаружено уменьшение измеряемых значений  с ростом v, происходившее в точном соответствии с формулой (74.8).
с ростом v, происходившее в точном соответствии с формулой (74.8).
Заряд электрона был определен с большой точностью Милликеном в 1909 г. В закрытое пространство между горизонтально расположенными пластинами конденсатора (рис. 74.3) Милликен вводил мельчайшие капельки масла. При разбрызгивании капельки электризовались, и их можно было устанавливать неподвижно, подбирая величину и знак напряжения на конденсаторе.
Равновесие наступало при условии

здесь  — заряд капельки, Р — результирующая силы тяжести и архимедовой силы, равная
— заряд капельки, Р — результирующая силы тяжести и архимедовой силы, равная
 (74.10)
(74.10)
( — плотность капельки,
— плотность капельки,  — ее радиус,
— ее радиус,  — плотность воздуха).
— плотность воздуха).
 Из формул (74.9) и (74.10), зная
Из формул (74.9) и (74.10), зная  , можно было найти
, можно было найти  . Для определения радиуса измерялась скорость
. Для определения радиуса измерялась скорость  равномерного падения капельки в отсутствие поля. Равномерное движение капельки устанавливается при условии, что сила Р уравновешивается силой сопротивления
равномерного падения капельки в отсутствие поля. Равномерное движение капельки устанавливается при условии, что сила Р уравновешивается силой сопротивления  (см. формулу (78.1) 1-го тома;
(см. формулу (78.1) 1-го тома;  — вязкость воздуха):
— вязкость воздуха):
 (74.11)
(74.11)
Движение капельки наблюдалось с помощью микроскопа. Для измерения  определялось время, за которое капелька проходила расстояние между двумя нитями, видимыми в поле зрения микроскопа.
определялось время, за которое капелька проходила расстояние между двумя нитями, видимыми в поле зрения микроскопа.
Точно зафиксировать равновесие капельки очень трудно. Поэтому вместо поля, отвечающего условию (74.9), включалось такое поле, под действием которого капелька начинала двигаться с небольшой скоростью вверх. Установившаяся скорость подъема  определяется из условия, что сила Р и сила
определяется из условия, что сила Р и сила  в сумме уравновешивают силу
в сумме уравновешивают силу 
 (74.12)
(74.12)
Исключив из уравнения (74.10), (74.11) и (74.12) Р и  , получим выражение для
, получим выражение для 

(в эту формулу Милликен вносил поправку, учитывающую, что размеры капелек были сравнимы с длиной свободного пробега молекул воздуха).

Рис. 74.3.
Итак, измерив скорость свободного падения капельки  и скорость ее подъема
и скорость ее подъема  известном электрическом поле
известном электрическом поле  , можно было найти заряд капельки е. Произведя измерение скорости
, можно было найти заряд капельки е. Произведя измерение скорости  при некотором значении заряда
при некотором значении заряда  , Милликен вызывал ионизацию воздуха облучая пространство между пластинами рентгеновскими лучами. Отдельные ионы, прилипая к капельке, изменяли ее заряд, в результате чего скорость
, Милликен вызывал ионизацию воздуха облучая пространство между пластинами рентгеновскими лучами. Отдельные ионы, прилипая к капельке, изменяли ее заряд, в результате чего скорость  также менялась. После измерения нового значения скорости снова облучалось пространство между пластинами и т. д.
также менялась. После измерения нового значения скорости снова облучалось пространство между пластинами и т. д.
Измеренные Милликеном изменения заряда капельки  и сам заряд
и сам заряд  каждый раз получались целыми кратными одной и той же величины
каждый раз получались целыми кратными одной и той же величины  . Тем самым была экспериментально доказана дискретность электрического заряда, т. е. тот факт, что всякий заряд слагается из элементарных зарядов одинаковой величины.
. Тем самым была экспериментально доказана дискретность электрического заряда, т. е. тот факт, что всякий заряд слагается из элементарных зарядов одинаковой величины.
Значение элементарного заряда, установленное с учетом измерений Милликена и данных, полученных другими методами, равно
 (74.13)
(74.13)
Такую же величину имеет заряд электрона.
Из (74.7) и (74.13) получается для массы покоя электрона значение
 (74.14)
(74.14)
приблизительно в 1840 раз меньшее массы самого легкого из атомов — атома водорода.
В обнаружении дискретной природы электричества сыграли большую роль законы электролиза, установленные экспериментально Фарадеем в 1836 г. Согласно этим законам масса  вещества, выделяющегося при прохождении тока через электролит, пропорциональна переносимому током заряду
вещества, выделяющегося при прохождении тока через электролит, пропорциональна переносимому током заряду 
 (74.15)
(74.15)
Здесь М — масса моля выделяющегося вещества,  — валентность этого вещества, F — постоянная Фарадея (число Фарадея) равная
— валентность этого вещества, F — постоянная Фарадея (число Фарадея) равная
 (74.16)
(74.16)
Разделив обе части равенства (74.15) на массу иона, получим

 – число Авогадро,
– число Авогадро,  — количество ионов, содержащихся в массе m). Отсюда для заряда одного иона получается значение
— количество ионов, содержащихся в массе m). Отсюда для заряда одного иона получается значение

Следовательно, заряд иона оказывается целым кратным величины
 (74.17)
(74.17)
«угорая представляет собой элементарный заряд.
Таким образом, из анализа законов электролиза вытекает дискретность зарядов, которыми могут обладать ионы в электролитах.
Подстановка в (74.17) значения (74.16) для F и найденного из зпытов Перрена (см. §  тома) значения NA дает для
тома) значения NA дает для  вели
вели  хорошо согласующуюся со значением, найденным Миллионом.
хорошо согласующуюся со значением, найденным Миллионом.
Поскольку точность, с которой определяется постоянная Фарадея F, и точность значения  , полученного Милликеном, намного превосходят точность опытов Перрена по определению
, полученного Милликеном, намного превосходят точность опытов Перрена по определению  соотношение (74.17) было использовано для определения числа Авогадро. При этом было взято значение F, найденное из опытов по электролизу, и значение
соотношение (74.17) было использовано для определения числа Авогадро. При этом было взято значение F, найденное из опытов по электролизу, и значение  , полученное Милликеном.
, полученное Милликеном.
Оглавление
- ПРЕДИСЛОВИЕ
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- ЧАСТЬ 1. ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ
- § 1. Электрический заряд
- § 2. Закон Кулона
- § 3. Системы единиц
- § 4. Рационализованная запись формул
- § 5. Электрическое поле. Напряженность поля
- § 6. Потенциал
- § 7. Энергия взаимодействия системы зарядов
- § 8. Связь между напряженностью электрического поля и потенциалом
- § 9. Диполь
- § 10. Поле системы зарядов на больших расстояниях
- § 11. Описание свойств векторных полей
- Дивергенция.
- Циркуляция.
- Теорема Стокса.
- § 12. Циркуляция и ротор электростатического поля
- § 13. Теорема Гаусса
- § 14. Вычисление полей с помощью теоремы Гаусса
- Поле двух разноименно заряженных плоскостей.
- Поле заряженной сферической поверхности.
- Поле объемно-заряженного шара.
- ГЛАВА II. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ В ДИЭЛЕКТРИКАХ
- § 15. Полярные и неполярные молекулы
- § 16. Поляризация диэлектриков
- § 17. Поле внутри диэлектрика
- § 18. Объемные и поверхностные связанные заряды
- § 19. Вектор электрического смешения
- § 20. Примеры на вычисление поля в диэлектриках
- § 21. Условия на границе двух диэлектриков
- § 22. Силы, действующие на заряд в диэлектрике
- § 23. Сегнетоэлектрики
- ГЛАВА III. ПРОВОДНИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- § 24. Равновесие зарядов на проводнике
- § 25. Проводник во внешнем электрическом поле
- § 26. Электроемкость
- § 27. Конденсаторы
- ГЛАВА IV. ЭНЕРГИЯ ЭЛЕКТРИЧЕСКОГО ПОЛЯ
- § 28. Энергия заряженного проводника
- § 29. Энергия заряженного конденсатора
- § 30. Энергия электрического поля
- ГЛАВА V. ПОСТОЯННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- § 31. Электрический ток
- § 32. Уравнение непрерывности
- § 33. Электродвижущая сила
- § 34. Закон Ома. Сопротивление проводников
- § 35. Закон Ома для неоднородного участка цепи
- § 36. Разветвленные цепи. Правила Кирхгофа
- § 37. Мощность тока
- § 38. Закон Джоуля — Ленца
- ГЛАВА VI. МАГНИТНОЕ ПОЛЕ В ВАКУУМЕ
- § 39. Взаимодействие токов
- § 40. Магнитное поле
- § 41. Поле движущегося заряда
- § 42. Закон Био — Савара
- § 43. Сила Лоренца
- § 44. Закон Ампера
- § 45. Магнитное взаимодействие как релятивистский эффект
- § 46. Контур с током в магнитном поле
- § 47. Магнитное поле контура с током
- § 48. Работа, совершаемая при перемещении тока в магнитном
- § 49. Дивергенция и ротор магнитного поля
- § 50. Поле соленоида и тороида
- ГЛАВА VII. МАГНИТНОЕ ПОЛЕ В ВЕЩЕСТВЕ
- § 51. Намагничение магнетика
- § 52. Напряженность магнитного поля
- § 53. Вычисление поля в магнетиках
- § 54. Условия на границе двух магнетиков
- § 55. Виды магнетиков
- § 56. Магнитомеханические явления
- § 57. Диамагнетизм
- § 58. Парамагнетизм
- § 59. Ферромагнетизм
- ГЛАВА VIII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- § 60. Явление электромагнитной индукции
- § 61. Электродвижущая сила индукции
- § 62. Методы измерения магнитной индукции
- § 63. Токи Фуко
- § 64. Явление самоиндукции
- § 65. Ток при замыкании и размыкании цепи
- § 66. Взаимная индукция
- § 67. Энергия магнитного поля
- § 68. Работа перемагничивания ферромагнетика
- ГЛАВА IX. УРАВНЕНИЯ МАКСВЕЛЛА
- § 69. Вихревое электрическое поле
- § 70. Ток смещения
- § 71. Уравнения Максвелла
- ГЛАВА X. ДВИЖЕНИЕ ЗАРЯЖЕННЫХ ЧАСТИЦ В ЭЛЕКТРИЧЕСКИХ И МАГНИТНЫХ ПОЛЯХ
- § 72. Движение заряженной частицы в однородном магнитном поле
- § 73. Отклонение движущихся заряженных частиц электрическим и магнитным полями
- § 74. Определение заряда и массы электрона
- § 75. Определение удельного заряда ионов. Масс-спектрографы
- § 76. Ускорители заряженных частиц
- ГЛАВА XI. КЛАССИЧЕСКАЯ ТЕОРИЯ ЭЛЕКТРОПРОВОДНОСТИ МЕТАЛЛОВ
- § 77. Природа носителей тока в металлах
- § 78. Элементарная классическая теория металлов
- § 79. Эффект Холла
- ГЛАВА XII. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
- § 80. Несамостоятельная и самостоятельная проводимость
- § 81. Несамостоятельный газовый разряд
- § 82. Ионизационные камеры и счетчики
- § 83. Процессы, приводящие к появлению носителей тока при самостоятельном разряде
- § 84. Газоразрядная плазма
- § 85. Тлеющий разряд
- § 86. Дуговой разряд
- § 87. Искровой и коронный разряды
- ГЛАВА XIII. ЭЛЕКТРИЧЕСКИЕ КОЛЕБАНИЯ
- § 88. Квазистационарные токи
- § 89. Свободные колебания в контуре без активного сопротивления
- § 90. Свободные затухающие колебания
- § 91. Вынужденные электрические колебания
- § 92. Переменный ток
- ЧАСТЬ 2. ВОЛНЫ
- § 93. Распространение волн в упругой среде
- § 94. Уравнения плоской и сферической волн
- § 95. Уравнение плоской волны, распространяющейся в произвольном направлении
- § 96. Волновое уравнение
- § 97. Скорость упругих волн в твердой среде
- § 98. Энергия упругой волны
- § 99. Стоячие волны
- § 100. Колебания струны
- § 101. Звук
- § 102. Скорость звука в газах
- § 103. Эффект Доплера для звуковых волн
- ГЛАВА XV. ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ
- § 104. Волновое уравнение для электромагнитного поля
- § 105. Плоская электромагнитная волна
- § 106. Экспериментальное исследование электромагнитных волн
- § 107. Энергия электромагнитных волн
- § 108. Импульс электромагнитного поля
- § 109. Излучение диполя
- ЧАСТЬ 3. ОПТИКА
- § 110. Световая волна
- § 111. Представление гармонических функций с помощью экспонент
- § 112. Отражение и преломление плоской волны на границе двух диэлектриков
- § 113. Световой поток
- § 114. Фотометрические величины и единицы
- § 115. Геометрическая оптика
- § 116. Центрированная оптическая система
- § 117. Тонкая линза
- § 118. Принцип Гюйгенса
- ГЛАВА XVII. ИНТЕРФЕРЕНЦИЯ СВЕТА
- § 119. Интерференция световых волн
- § 120. Когерентность
- § 121. Способы наблюдения интерференции света
- § 122. Интерференция света при отражении от тонких пластинок
- § 123. Интерферометр Майкельсона
- § 124. Многолучевая интерференция
- ГЛАВА XVIII. ДИФРАКЦИЯ СВЕТА
- § 126. Принцип Гюйгенса—Френеля
- § 127. Зоны Френеля
- § 128. Дифракция Френеля от простейших преград
- § 129. Дифракция Фраунгофера от щели
- § 130. Дифракционная решетка
- § 131. Дифракция рентгеновских лучей
- § 132. Разрешающая сила объектива
- § 133. Голография
- ГЛАВА XIX. ПОЛЯРИЗАЦИЯ СВЕТА
- § 134. Естественный и поляризованный свет
- § 135. Поляризация при отражении и преломлении
- § 136. Поляризация при двойном лучепреломлении
- § 137. Интерференция поляризованных лучей
- § 138. Прохождение плоскополяризованного света через кристаллическую пластинку
- § 139. Кристаллическая пластинка между двумя поляризаторами
- § 140. Искусственное двойное лучепреломление
- § 141. Вращение плоскости поляризации
- ГЛАВА XX. ВЗАИМОДЕЙСТВИЕ ЭЛЕКТРОМАГНИТНЫХ ВОЛН С ВЕЩЕСТВОМ
- § 142. Дисперсия света
- § 143. Групповая скорость
- § 144. Элементарная теория дисперсии
- § 145. Поглощение света
- § 146. Рассеяние света
- § 147. Эффект Вавилова — Черенкова
- ГЛАВА XXI. ОПТИКА ДВИЖУЩИХСЯ СРЕД
- § 148. Скорость света
- § 149. Опыт Физо
- § 150. Опыт Майкельсона
- § 151. Эффект Доплера
- ПРИЛОЖЕНИЯ
- I. Единицы электрических и магнитных величин в СИ и в гауссовой системе
- Приложение II. Основные формулы электромагнетизма в СИ и в гауссовой системе
- Приложение III. Векторный потенциал

