2.1 Основные расчетные формулы в гравиметрических методах анализа.
Содержание
определяемого вещества обычно вычисляют
в граммах или процентах. Расчет ведут
с помощью аналитического фактора F
– отношения молекулярной массы
определяемого вещества (МА)
к молекулярной массе его гравиметрической
(весовой) формы (Мгр.ф.)
![]() (29)
(29)
При вычислении
гравиметрического фактора в числителе
указывают формулу определяемого
вещества, в знаменателе- формулу его
весовой(гравиметрической формы),
m,n-стехиометрические
коэффициенты. Например,
![]()
Расчет определяемого
вещества в граммах
qA
= mгр.ф∙F
(30)
Расчет определяемого
вещества в процентах
![]() (31)
(31)
2.1.1 Расчет навески
определяемого вещества
При определении
кристаллических осадков
![]() ,
,
(32)
где МА
и Мгр.ф.
– молекулярные веса определяемого
вещества и
гравиметрической
формы соответственно;
m,n-
стехиометрические коэффициенты.
При определении
аморфных осадков
![]() (33)
(33)
Опытным путем было
найдено, что 0,5 – 0,3 – практически удобная
масса весовой формы вещества для
кристаллических осадков (г); 0,1-0,2-
практически удобная масса весовой формы
вещества для аморфных осадков(г).
Объем осадителя
находим по формуле
![]() ,
,
![]() (34)
(34)
где 1,5- const-
коэффициент, найденный практическим
путем
(берется
с учетом того, что осадитель по обыкновению
является
летучим веществом);
МВ–
молекулярный вес осадителя;
МА–
молекулярный вес определяемого вещества;
а- навеска
определяемого вещества, г;
С- процентная
концентрация;
ρ- плотность
г/см3.
Примеры решения
задач.
Пример 1
Из навески глины
0,5340 г. после соответствующей обработки
получено 0,2345 г CaO.
Рассчитать массовую долю CaCO3
в глине.
Решение
Найдем аналитический
фактор
![]()
Зная аналитический
фактор, можем найти % содержание
![]()
![]()
![]()
![]()
Пример 2
При определении
Fe
в препарате сульфата железа (III)
взвешивали BaSO4
.Написать
выражение для гравиметрического фактора.
Решение
Между Fe
и BaSO4
существует стехиометрическое соотношение
2M(Fe)
![]() 1MFe2(SO4)3
1MFe2(SO4)3
![]() 3M(SO42-)
3M(SO42-)![]() 3M(BaSO4)
3M(BaSO4)
![]()
Пример 3
Навеску алюминиевого
сплава массой 0,14252 г растворили в колбе
вместимостью 200 мл. Из 20,00 мл этого
раствора получили осадок оксихинолината
алюминия Al(C9H6ON)3,массой
0,2012 г. Вычислить массовую долю (%) алюминия
в сплаве.
Решение
Найдем аналитический
фактор
![]()
Преобразуя несколько
формул, найдем % содержание алюминия в
сплаве
![]()
![]()
Тогда
![]()
Пример 4
Вычислить число
молекул воды в кристаллогидрате хлорида
магния, если из навески его массой 0,5000
г. получается 0,2738 г Mg2P2
O7.
Решение
Кристаллогидрат
магния:![]()
Определяемое
вещество
![]()
Гравиметрическая
форма
![]()
Считаем фактор
пересчета
![]()
![]()
Здесь навеска –
это q.
Значит
![]()
2M(![]() )
)
=
![]()
M(![]() )=
)=![]()
Число молекул в
кристаллогидрате находим
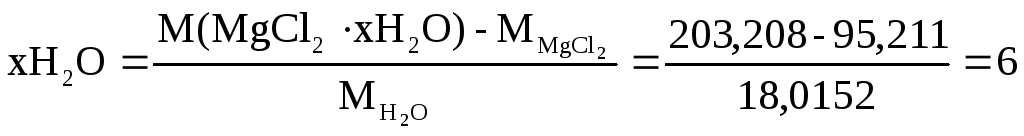
Значит соль
![]()
Пример 5
Рассчитать массу
навески апатито- нефелиновой руды,
содержащей 30 % P2O5
необходимую для получения 0,9 г осадка.![]()
Решение
Определяемое
вещество
![]()
Гравиметрическая
форма
![]()
Рассчитаем фактор
пересчета
![]()
![]()
![]()
![]()
![]()
Пример 6
Из навески каменного
угля массой 2,6248 г. после соответствующей
обработки получили 0,3248 г. BaSO4
. Вычислить
массовую долю (%) серы в угле. Пересчитать
массовую долю серы на сухое вещество,
если содержание влаги составило 2,58%.
Решение
![]()
![]()
Считаем
![]()
Тогда
![]()
Массовая доля (%)
серы в сухом веществе
![]() ,
,
где b
– содержание влаги в %.
![]()
Пример 7
Какой объем раствора
карбоната натрия (массовая доля 17,7%
ρ=1,19г/см3)
требуется для осаждения 0,2 г. кальция
при полуторакратном избытке осадителя?
Решение
![]()
![]() ,
,
где 105,988 – молекулярный
вес
![]()
;
40,08 – молекулярный
вес кальция.
Пример 8
Какой объем 4% (по
массе) раствора оксихинолина C9H7NO
, плотностью 1 г/см3.
Необходим для осаждения Al3+
из раствора, содержащего 100 мг
![]() (достаточен
(достаточен
избыток осадителя в 10 %)
Решение
![]()
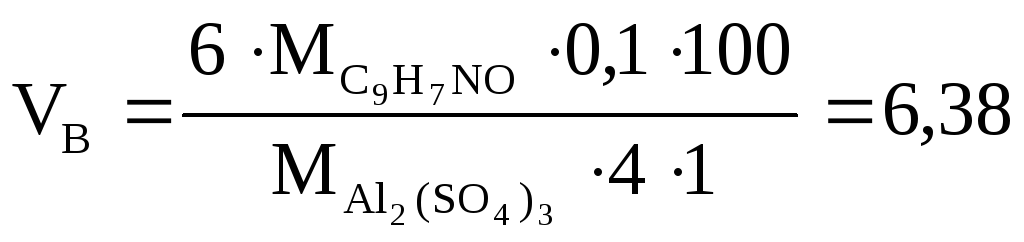 мл
мл
![]() X=0,638
X=0,638
![]() мл
мл
Пример 9
При определении
оксидов щелочных металлов из образца
силикатной породы массой 1,2505 г выделили
смесь NaCl
и КCl
массой 0,1500 г. После многократной обработки
этой смеси серной кислотой получили
сульфаты Na2SO4
и К2SO4
массой
0,1800 г. Вычислить массовые доли (%) Na2O
и К2O
в силикатной породе.
Решение
ωх
– массовая доля Na2O
в образце
ωу
– массовая доля К2O
I
уравнение
![]()
II
уравнение
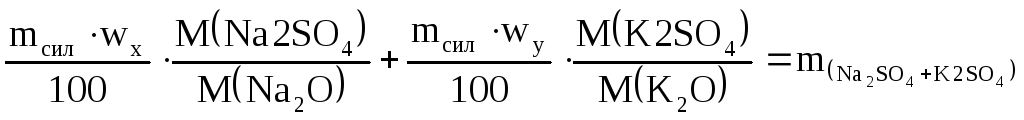
Подставляем
числовые значения
в I
уравнение
![]()
во II
уравнение
![]()
Решаем систему
уравнений и находим
ω![]() =
=
ωх
= 4,28 %
ω![]() =
=
ωу
= 2,48 %
Пример 10
Образец содержит
2% К2SO4
и 5% КNO3.
Рассчитать массу навески образца,
необходимую для получения 0,3 г KClO4.
Решение
Содержание в виде
доли
![]()
К2SO4
= 0,02 КNO3
= 0,05
Масса навески
mобр.
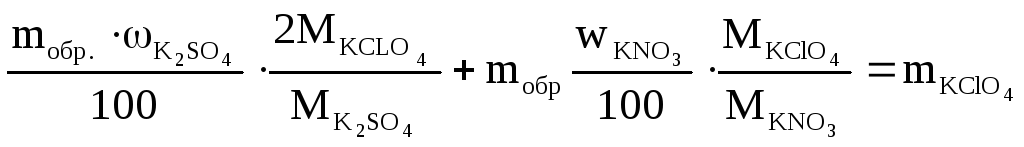
Подставим
числовые значения, получаем
mобр
=ассчитатРасчитать
![]()
Отсюда
mобр
= 2,992 = 3,0 г
Пример 11
Навеску
инсектицида массой 0,2795 г, содержащую
линдан С6Н6Сl6
(M
= 290,8 г/моль) и ДДТ С14Н9Сl5
(М = 354,5 г/моль), сожгли в токе кислорода
до СО2,
Н2О
и HCl.
Из поглотительного
раствора получили осадок AgCl
массой 0,7161 г. Вычислить
массовые доли (%) линдана и ДДТ в препарате.
Решение
Обозначим mx
– масса линдана,
(mинсект
– mx)
– масса ДДТ
Составляем расчетное
уравнение
![]()
Подставляем
числовые значения
![]()
Решая уравнение,
находим
mx
= 0.1615 г
И далее
ω![]() =
=![]()
ω![]() =
=![]()
Пример 12
Вычислить
эмпирическую формулу фосфорита, если
в результате анализа получили содержание:
54,58% СаО; 1,86% F;
3,44% Cl;
41,61% P2O5.
Решение
Находим молярное
соотношение (%) компонентов
СаО : F
: Cl
: P2O5
=
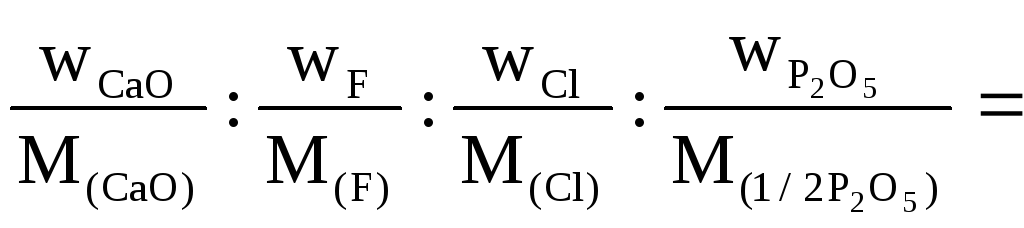
=![]()
Наименьшее число
0,09703 принимаем за единицу и выражаем
полученное соотношение целыми числами,
учитывая, что n
(Ca)
= n(CaO)
n(PO4)3-
= n(1/2 P2O5)
:Ca : F : Cl : PO![]() = 10:
= 10:
1 : 1 : 6
Эмпирическая
формула фосфорита
Са10(РО4)6
ClF
или 3Са3(РО4)2
· Са · Cl
· F
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Нахождение массы соли в составе кристаллической соды
Какова масса карбоната натрия и воды, содержащихся в 11,44 г кристаллической соды (Na2CO3 ∙ 10 H2O)?
Решение задачи
Рассчитаем молярные массы карбоната натрия (Na2CO3), воды (H2O) и кристаллической соды (Na2CO3 ∙ 10 H2O):
M (Na2CO3) = 106 (г/моль)
M (H2O) = 18 (г/моль)
M (Na2CO3 ∙ 10 H2O) = 106+ 10 ∙ 18 = 286 (г/моль).
Учитывая, что в 1 моль кристаллической соды (Na2CO3 ∙ 10 H2O) содержится 1 моль карбоната натрия (Na2CO3) и 10 моль воды (H2O), найдем массы данных веществ по формуле:
![]()

Получаем:
m (Na2CO3) = 1 моль ∙ 106 г/моль = 106 (г)
m (H2O) = 10 моль ∙ 18 г/моль = 180 (г)
m (Na2CO3 ∙ 10 H2O) = 1 моль ∙ 286 г/моль = 286 (г).
Следовательно, 286 г кристаллической соды содержит 106 г карбоната натрия (Na2CO3) и 180 г воды (H2O). Найдем массы Na2CO3 и H2O в 11,44 г Na2CO3 ∙ 10 H2O. Составим пропорцию:
в 286 г Na2CO3 ∙ 10 H2O содержится 106 г Na2CO3
в 11,44 г Na2CO3 ∙ 10 H2O содержится ![]() г Na2CO3
г Na2CO3
Откуда:
![]()
Массу воды можно вычислить по разности:
![]()

Ответ: масса карбоната натрия = 4,24 г; масса воды = 7,2 г.
Вы уже познакомились с несколькими уроками, основная тема которых — это явление плавления: “Плавление и отвердевание кристаллических тел”, “График плавления и отвердевания кристаллических тел”, “Удельная теплота плавления”.
В данном уроке для решения задач вам пригодятся вышеупомянутые материалы. Также мы будем использовать данные формулы:
- $Q = cm(t_2 — t_1)$
- $Q = qm$
- $eta = frac{A_п}{A_з}$
- $A = Fs$
Табличные значения различных величин вы можете найти в следующих уроках:
- Плотность
- Удельная теплоемкость
- Энергия топлива. Удельная теплота сгорания
- Удельная теплота плавления
Задача №1
Кусок алюминия массой $10 space кг$, взятый при температуре плавления $660 degree C$, полностью расплавился. Какое для этого потребовалось количество теплоты?
Дано:
$m = 10 space кг$
$t = 660 degree C$
$lambda = 8.9 cdot 10^5 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Так как тело взято при его температуре плавления $t = 660 degree C$, нужно рассчитать количество теплоты, необходимое для плавления кристаллического тела, по формуле:
$Q = lambda m$,
$Q = lambda = 8.9 cdot 10^5 frac{Дж}{кг} cdot 10 space кг = 8.9 cdot 10^6 space Дж = 8.9 space МДж$.
Ответ: $Q = 8.9 space МДж$.
Задача №2
Во сколько раз больше теплоты идет на плавление $2 space кг$ чугуна, чем на нагревание чугуна той же массы на $1 degree C$? Удельная теплота плавления чугуна $96 frac{кДж}{кг}$.
Дано:
$lambda = 96 frac{кДж}{кг}$
$m = 2 space кг$
$Delta t = 1 degree C$
$c = 540 frac{Дж}{кг cdot degree C}$
СИ:
$lambda = 96 cdot 10^3 frac{Дж}{кг}$
$frac{Q_1}{Q_2} — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала рассчитаем количество теплоты, необходимое для того, чтобы расплавить $2 space кг$ чугуна:
$Q_1 = lambda m$,
$Q_1 = 96 cdot 10^3 frac{Дж}{кг} cdot 2 space кг = 192 cdot 10^3 space Дж$.
Теперь рассчитаем количество теплоты, необходимое для нагревания на $1 degree C$ чугуна той же массы:
$Q_2 = cm(t_2 — t_1) = cm Delta t$,
$Q_2 = 540 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot 1 degree C = 1080 space Дж = 1.08 cdot 10^3 space Дж$.
Теперь мы можем сравнить эти энергии:
$frac{Q_1}{Q_2} = frac{192 cdot 10^3 space Дж}{1.08 cdot 10^3 space Дж} approx 178$.
Значит, количество теплоты, необходимое для плавления $2 space кг$ чугуна, в 178 раз больше количества теплоты, необходимого для нагревания чугуна той же массы на $1 degree C$.
Ответ: в 178 раз.
Задача №3
На рисунке 1 дан график изменения температуры твердого тела при нагревании.
Определите по этому графику:
- При какой температуре плавится это тело?
- Как долго длилось нагревание от $60 degree C$ до точки плавления?
- Как долго длилось плавление?
- До какой температуры было нагрето вещество в жидком состоянии?
Показать решение и ответ
Скрыть
Решение:
- Из графика видно, что тело нагревается до $80 degree C$. С этой температуры последующий участок графика параллелен оси времени. При этом температура так и остается равной $80 degree C$.
Значит, на этом участке графика идет процесс плавления с температурой $80 degree C$ - Тело достигает температуры $60 degree C$ в момент времени $T_1 = 2 space мин$. Температуры плавления в $80 degree C$ тело достигает в момент времени $T_2 = 6 space мин$.
Тогда нагревание длилось $T_2 — T_1 = 6 space мин — 2 space мин = 4 space мин$ - Вернемся к участку плавления (он параллелен оси времени). Плавление началось в момент времени $T_1 = 6 space мин$, а закончилось в момент времени $T_2 = 8 space мин$.
Значит, плавление длилось $T_2 — T_1 = 8 space мин — 6 space мин = 2 space мин$ - После завершения процесса плавления вещество, из которого состояло тело, перешло в жидкое состояние. График снова пошел наверх — это означает, что жидкость нагревается. Самая верхняя точка графика соответствует наивысшей температуре жидкости $t approx 87.5 degree C$.
Ответ: 1. $80 degree C$,
2. $4 space мин$,
3. $2 space мин$,
4. $87.5 degree C$.
Задача №4
Определите объем глицерина, если при его кристаллизации выделилось $240 space кДж$ энергии. Плотность глицерина $1200 frac{кг}{м^3}$, удельная теплота плавления $1.99 cdot 10^5 frac{Дж}{кг}$.
Дано:
$Q = 240 space кДж$
$lambda = 1.99 cdot 10^5 frac{Дж}{кг}$
$rho = 1200 frac{кг}{м^3}$
СИ:
$Q = 240 cdot 10^3 space Дж$
$V — ?$
Показать решение и ответ
Скрыть
Решение:
Известно, что кристаллизация (отвердевание) и плавление происходят при одинаковой температуре для одного и того же вещества. Если при плавлении требуется сообщить телу определенную энергию, то при кристаллизации она выделяется.
Соответственно, для того, чтобы вычислить количество энергии, которое выделится при отвердевании тела, мы используем ту же формулу, что и для ситуаций с плавлением:
$Q = lambda m$.
Выразим массу через объем и плотность и подставим ее в формулу:
$m = rho V$,
$Q = lambda rho V$.
Выразим отсюда объем и рассчитаем его:
$V = frac{Q}{lambda rho}$,
$V = frac{240 cdot 10^3 space Дж}{1.99 cdot 10^5 frac{Дж}{кг} cdot 1200 frac{кг}{м^3}} approx 0.1 cdot 10^{-2} space м^3 approx 1 cdot 10^{-3} space м^3 approx 1 space л$.
Ответ: $V approx 1 space л$.
Задача №5
Определите плотность льда при температуре $0 degree C$, если известно, что для плавления льда объемом $1 space дм^3$ требуется количество теплоты, равное $301.5 space кДж$.
Дано:
$V = 1 space дм^3$
$Q = 301.5 space кДж$
$t = 0 degree C$
$lambda = 3.4 cdot 10^5 frac{Дж}{кг}$
СИ:
$V = 1 cdot 10^{-3} space м^3$
$Q = 301.5 cdot 10^3 space Дж$
$rho — ?$
Показать решение и ответ
Скрыть
Решение:
Количество теплоты, необходимое для плавления льда:
$Q = lambda m$.
В задаче говорится, что «для плавления требуется количество теплоты». Это означает, что лед уже находится при температуре плавления, т. е. при $0 degree C$. Значит, мы будем искать плотность того самого льда, для которого у нас есть все необходимые данные.
Выразим массу льда через плотность и объем и подставим в вышеприведенную формулу:
$m = rho V$,
$Q = lambda rho V$.
Выразим отсюда плотность льда и рассчитаем ее:
$rho = frac{Q}{lambda V}$,
$rho = frac{301.5 cdot 10^3 space Дж}{3.4 cdot 10^5 frac{Дж}{кг} cdot 1 cdot 10^{-3} space м^3} approx 887 frac{кг}{м^3}$.
Ответ: $rho approx 887 frac{кг}{м^3}$.
Задача №6
На рисунке 2 изображены графики зависимости температуры от времени для слива свинца (I) и плитка олова (II) одинаковой массы. Количество теплоты, получаемой каждым телом в единицу времени, одинаково.
Определите по графику:
- У какого слитка температура плавления выше?
- Какой металл обладает большей удельная теплоемкость?
- У какого металла больше удельная теплота плавления?
Показать решение и ответ
Скрыть
Решение:
- Определим из графика температур плавления для обоих слитков. Обратите внимание, что участку плавления соответствует участок графика, параллельный оси времени. Так, для свинца (I) температура плавления равна $327 degree C$, а для олова (II) — $232 degree C$.
Значит, температура плавления свинца выше, чем температура плавления олова - В условии задачи сказано, что количество теплоты, получаемое каждым телом в единицу времени, одинаково. Удельная теплоемкость же определяется количеством энергии, которую нужно сообщить телу, чтобы изменить его температуру на $1 degree C$.
Взгляните на участки графиков, когда тела нагреваются, например, до температуры $232 degree C$. Отчетливо видно, что свинец (I) достигнет этой температуры быстрее.
Это означает, что ему потребовалось меньше энергии, чтобы достигнуть этой температуры. Следовательно, и для изменения температуры на $1 degree C$ ему требуется меньшее количество теплоты, чем олову (II). Значит, удельная теплоемкость свинца меньше, чем удельная теплоемкость олова - Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить телу при температуре плавления, чтобы полностью перевести его из твердого в жидкое состояние.
Значит, нам нужно обратиться к участкам графиков, на которых происходит плавление (они параллельны оси времени). Видно, что участок плавления олова (II) намного длиннее такого же участка для свинца (I).
Так как тела имеют одинаковую массу и получают одинаковое количество теплоты в единицу времени, очевидно, что олову для перехода в жидкое состояние потребовалось больше энергии, чем свинцу.
Это означает, что удельная теплота плавления олова больше удельной теплоты плавления свинца
Ответ:1. у свинца, 2. у олова, 3. у олова.
Задача №7
В $5 space кг$ воды при температуре $40 degree C$ опустили $3 space кг$ льда. Сколько льда растает?
Дано:
$m_в = 5 space кг$
$t_1 = 40 degree C$
$m_л = 3 space кг$
$c_в = 4200 frac{Дж}{кг cdot degree C}$
$rho_в = 1000 frac{кг}{м^3}$
$lambda_л = 3.4 cdot 10^5 frac{Дж}{кг}$
$m_{л1} — ?$
Показать решение и ответ
Скрыть
Решение:
Когда лед опустили в воду, между двумя этими телами начался теплообмен. Он будет продолжаться до тех пор, пока их температуры не станут равны друг другу. В этот момент между телами установится равновесие.
Вода будет охлаждаться и выделять некоторое количество теплоты, которое будет идти на плавление льда при $0 degree C$. Так будет продолжаться до тех пор, пока температура воды не станет равной $ degree C$. Теплообмен завершится.
Далее, если воде не будет сообщаться никакой энергии, она начнет отвердевать. Избыточная энергия будет идти на поддержание температуры на одном уровне до окончания процесса кристаллизации.
Итак, давайте рассчитаем, какое количество энергии выделится при охлаждении воды с $t_1 = 40 degree C$ до $0 degree C$:
$Q_в = c_в m_в(t_2 — t_1)$,
$Q_в = 4200 frac{Дж}{кг cdot degree C} cdot 5 space кг cdot (40 degree C — 0 degree C = 21 cdot 10^3 frac{Дж}{degree C} cdot 40 degree C = 840 cdot 10^3 space Дж$.
А теперь рассчитаем количество теплоты, которое необходимо сообщить льду, чтобы он полностью расплавился:
$Q_л = lambda_л m_л$,
$Q_л = 3.4 cdot 10^5 frac{Дж}{кг} cdot 3 space кг = 10.2 cdot 10^5 space Дж = 1020 cdot 10^3 space Дж$.
Получается, что $Q_в < Q_л$. Это означает, что лед не сможет полностью расплавиться.
Но какая-то его часть расплавится. Теперь нам нужно рассчитать, какая масса льда расплавится, если ей сообщить количество теплоты $Q_в$:
$Q = Q_в = lambda_л m_{л1}$.
Выразим отсюда массу льда и рассчитаем ее:
$m_{л1} = frac{Q_в}{lambda_л}$,
$m_{л1} = frac{840 cdot 10^3 space Дж}{3.4 cdot 10^5 frac{Дж}{кг}} approx 2.47 space кг$.
Ответ: $m_{л1} approx 2.47 space кг$.
В медный калориметр весом $200 space г$ налито $100 space г$ воды при $16 degree C$ для обоих тел. В воду бросили кусочек льда при $0 degree C$ весом $9.3 space г$, который целиком расплавился. Окончательная температура воды и калориметра после этого установилась $9 degree C$. Определите на основании этих данных удельную теплоту плавления льда.
Дано:
$m_м = 200 space г$
$m_в = 100 space г$
$m_л = 9.3 space г$
$t_в = 16 degree C$
$t_л = 0 degree C$
$t = 9 degree C$
$c_м = 400 frac{Дж}{кг cdot degree C}$
$c_в = 4200 frac{Дж}{кг cdot degree C}$
СИ:
$m_м = 0.2 space кг$
$m_в = 0.1 space кг$
$m_л = 0.0093 space кг$
$lambda_л — ?$
Показать решение и ответ
Скрыть
Решение:
Изначально медный калориметр и вода находились в равновесии и имели одинаковую температуру $16 degree C$. Когда в воду опустили кусочек льда, между всеми этими телами начался теплообмен.
Калориметр и вода начали охлаждаться и выделять энергию. За счет этой энергии лед начал плавится. Когда лед полностью расплавился, теплообмен еще не закончился. Вода и калориметр продолжили охлаждаться до какой-то температуры, которой достиг бывший лед в виде жидкости. Температура выровнялась и стала равна $9 degree C$.
Таким образом, медный калориметр и вода при охлаждении с $16 degree C$ до $9 degree С$ выделили такое количество теплоты, которого хватило на плавление льда и его нагревание от $0 degree C$ до $9 degree C$. Так как вода и калориметр выделяли энергию, разницу температур запишем наоборот $(t_в — t)$, чтобы компенсировать отрицательный знак количества теплоты.
Запишем это формулой:
$Q_м + Q_в = Q_{пл} + Q_л$,
$c_м m_м (t_в — t) + c_в m_в (t_в — t) = lambda_л m_л + c_в m_л (t — t_л)$.
Обратите внимание, что $Q_л$ определяется через удельную теплоемкость воды, ведь лед к этому моменту находится в жидком состоянии.
Теперь постепенно выразим отсюда удельную теплоту плавления льда:
$lambda_л m_л = c_м m_м (t_в — t) + c_в m_в (t_в — t) — c_в m_л (t — t_л)$,
$lambda_л = frac{c_м m_м (t_в — t) + c_в m_в (t_в — t) — c_в m_л (t — t_л)}{m_л}$, или
$ lambda_л = frac{Q_м + Q_в — Q_л} {m_л}$.
Сначала рассчитаем величины $Q_м$, $Q_в$ и $Q_л$ по отдельности, а затем подставим их значения в формулу для расчета удельной теплоты плавления льда.
Количество теплоты, которое выделит медный калориметр при охлаждении:
$Q_м = c_м m_м (t_в — t) = 400 frac{Дж}{кг cdot degree C} cdot 0.2 space кг cdot (16 degree C — 9 degree C) = 80 frac{Дж}{degree C} cdot 7 degree = 560 space Дж$.
Количество теплоты, которое выделит вода при охлаждении:
$Q_в = c_в m_в (t_в — t) = 4200 frac{Дж}{кг cdot degree C} cdot 0.1 space кг cdot (16 degree C — 9 degree C) = 420 frac{Дж}{degree C} cdot 7 degree C = 2940 space Дж$.
Количество теплоты, затраченное на нагревание воды (растаявшего льда):
$Q_л = c_в m_л (t — t_л) = 4200 frac{Дж}{кг cdot degree C} cdot 0.0093 space кг cdot (9 degree C — 0 degree C) = 39.06 frac{Дж}{degree C} cdot 9 degree C = 351.54 space Дж$.
Теперь можем рассчитать удельную теплоту плавления льда:
$lambda_л = frac{560 space Дж + 2940 space Дж — 351.54 space Дж} {0.0093 space кг} = frac{3148.46 space Дж}{0.0093 space кг} approx 338 space 544 frac{Дж}{кг} approx 3.4 cdot 10^5 frac{Дж}{кг}$.
Так мы рассчитали удельную теплоту плавления льда. Она оказалась равна табличному значению, значит, расчеты выполнены верно.
Ответ: $lambda_л approx 3.4 cdot 10^5 frac{Дж}{кг}$.
Задача №9
Сколько требуется сжечь каменного угля в печи, чтобы расплавить $100 space т$ чугуна, взятого при температуре $20 degree C$, если КПД печи составляет $40 %$? Удельная теплота плавления чугуна $0.96 cdot 10^5 frac{Дж}{кг}$
Дано:
$m_ч = 100 space т$
$lambda_ч = 0.96 cdot 10^5 frac{Дж}{кг}$
$c_ч = 540 frac{Дж}{кг cdot degree C}$
$t_1 = 20 degree C$
$t_{пл} = t_2 = 1200 degree C$
$q_у = 2.7 cdot 10^7 frac{Дж}{кг}$
$eta = 40 % = 0.4$
Показать решение и ответ
Скрыть
Решение:
Для того,чтобы расплавить чугун, сначала его нужно нагреть до температуры плавления, а потом уже сообщить какое-то количество теплоты, необходимое для его плавления:
$Q_ч = Q_1 + Q_2 = c_ч m_ч (t_2 — t_1) + lambda_ч m_ч$.
Рассчитаем это количество теплоты:
$Q_ч = 540 frac{Дж}{кг cdot degree C} cdot 100 cdot 10^3 space кг cdot (1200 degree C — 20 degree C) + 0.96 cdot 10^5 frac{Дж}{кг} cdot 100 cdot 10^3 space кг = 637.2 cdot 10^8 space Дж + 96 cdot 10^8 space Дж = 733.2 cdot 10^8 space Дж$.
Запишем формулу для КПД:
$eta = frac{A_п}{A_з} = frac{Q_ч}{Q_у}$,
где $Q_ч$ — это количество теплоты, необходимое для того, чтобы нагреть и расплавить чугун, а $Q_у$ — количество теплоты, которое выделится при сгорании каменного угля.
Выразим отсюда $Q_у$:
$Q_у = frac{Q_ч}{eta}$.
С другой стороны, у нас есть формула для расчета количества теплоты, которое выделится при сгорании топлива:
$Q_у = q_у m_у$.
Выразим отсюда массу каменного угля и подставим найденные выражения для количества теплоты через формулу для КПД:
$m_у = frac{Q_у}{q_у} = frac{frac{Q_ч}{eta}}{q_у} = frac{Q_ч}{eta cdot q_у}$.
Рассчитаем эту массу:
$m_у = frac{733.2 cdot 10^8 space Дж}{0.4 cdot 2.7 cdot 10^7 frac{Дж}{кг}} = 6789 space кг approx 6.8 space т$.
Ответ: $m_у approx 6.8 space т$.
Задача №10
В водопаде высотой $32 space м$ ежесекундно падает $3.5 space м^3$ воды. Какое количество энергии можно получить в час от этого водопада? Какое количество каменного угля нужно сжигать каждый час, чтобы получить то же самое количество энергии?
Дано:
$t = 1 space ч$
$V = 3.5 space м^3$
$h = 32 space м$
$q = 2.7 cdot 10^7 frac{Дж}{кг}$
$rho = 1000 frac{кг}{м^3}$
$g = 9.8 frac{Н}{кг}$
СИ:
$t = 3600 space с$
$Q — ?$
$m — ?$
Показать решение и ответ
Скрыть
Решение:
Количество теплоты (энергия) является эквивалентом работы. Работа же по определению:
$A = Fs$.
Вода падает вниз под действием силы тяжести. Значит, сила тяжести = это та сила, которая совершает работу по перемещению воды на некоторое расстояние. Расстояние $s$ в нашем случае — это высота водопада $h$.
Тогда мы можем записать:
$Q = A = F_{тяж}h = mgh$.
По этой формуле мы рассчитаем энергию, которую можно получить в одну секунду. Чтобы узнать энергию за час, добавим множитель времени 3600:
$Q = mgh cdot 3600$.
Масса воды нам неизвестна. Выразим ее через объем и плотность и подставим в нашу формулу:
$m = rho V$,
$Q = rho Vgh cdot 3600$.
Рассчитаем эту энергию:
$Q = 1000 frac{кг}{м^3} cdot 3.5 space м^3 cdot 9.8 frac{Н}{кг} cdot 32 space м cdot 3600 approx 3.95 cdot 10^9 space Дж approx 3.95 space ГДж$.
Теперь рассчитаем, какая масса каменного угля при сжигании дает столько же энергии:
$Q = qm$,
$m = frac{Q}{q}$,
$m = frac{3.95 cdot 10^9 space Дж}{2.7 cdot 10^7 frac{Дж}{кг}} approx 146 space кг$.
Ответ: $Q approx 3.95 space ГДж$, $m approx 146 space кг$.
Кристаллическая масса
Cтраница 1
Кристаллическая масса и находящаяся над ней бурая жидкость при соприкосновении с ледяной водой быстро вспыхивают. Кристаллы плавятся при О С, причем получается красно-бурый раствор, теряющий двуокись хлора. Темно-бурый раствор образуется также при добавлении хлората калия к безводной кислоте, а перхлорат калия может быть перекристаллизован без изменений как из безводной, так и из 70 % – нон кислоты.
[1]
Кристаллическая масса, растворимая в четыреххлористом углероде и петролеином эфире.
[2]
Кристаллическая масса лактата передается плунжерным насосом 12 на чугунный фильтрпресс, где лактат отжимается от-маточника, промывается холодной водой и подсушивается сжатым воздухом, нагнетаемым под давлением 2 ати.
[3]
Сырая кристаллическая масса выгружается из кристаллизаторов на транспортер вручную лопатами, через борт кристаллизатора.
[4]
Коричнево-желтая кристаллическая масса, хорошо растворимая в воде, этиловом спирте и диэтиловом эфире. Растворы реактива окрашены в желтый цвет, кислые на лакмус.
[5]
Кристаллическая масса лактата передается плунжерным насосом 12 на чугунный фильтрпресс, где лактат отжимается от маточника, промывается холодной водой и подсушивается сжатым воздухом, нагнетаемым под давлением 2 ати.
[6]
Снежно-белая искристая кристаллическая масса; чрезвычайн гигроскопичная.
[7]
Кристаллическая масса глауберовой соли, выгружаемая из центрифуг, все еще содержит жидкую фазу со значительным содержанием сульфата цинка, который можв. Промывные воды, содержащие цинковые соединения, отводятся в канализацию.
[8]
Белая, слоистая кристаллическая масса, по эластичности напоминающая изделия из рога, лишь с трудом поддается растиранию в порошок.
[9]
Кристаллическую массу отделяют и промывают небольшим количеством метилового спирта. Выход продукта 1 8 г; при разбавлении маточного раствора водой получают еще 0 2 г продукта. После перекристаллизации из 4 – 5 частей метилового спирта получают соединение, плавящееся при 90; при дальнейшем нагревании происходит слабый взрыв.
[10]
Кристаллическую массу разбивают стеклянной палочкой и фильтруют через фильтр из стеклянной ткани ( примечание 4) на воронке Бюхнера диаметром 18 см. Твердую массу отжимают почти досуха большой плоской стеклянной пробкой или дном конической колбы емкостью 125 мл. Когда большая часть маточного раствора будет отделена ( примечание 5), твердый осадок переносят по частям в 4-литровый стакан, на три четверти заполненный мелко наколотым льдом. После прибавления каждой порции лед перемешивают, чтобы облегчить растворение вещества. Перемешивание рекомендуется производить деревянной палочкой с плоским концом. Вся операция должна занимать не более 10 мин.
[11]
Кристаллическую массу высушивают на глиняной тарелке, растворяют в теплом эфире и, добавляя лигроин, дают медленно охлаждаться. Так, получают бензоилпроизводное хлоргептиламина. Для отщеплении бензоила продукт нагревают в течение 5 час.
[12]
Кристаллическую массу размешивают с водой и подщелачивают 10 % – ным-раствором едкого натра до совсем слабой реакции на фенолфталеин. Нужно перемешивать продолжительное время и внимательно следить, чтобы не оставалось комочков. Бели раствор после длительного размешивания все еще остается щелочным, то его отфильтровывают от нерастворимого в щелочи остатка.
[13]
Кристаллическую массу отфильтровывают и перекрнсталлизовывают.
[14]
Кристаллическую массу отделяют на воронке Бюхнера, промывают охлажденным изопропиловым спиртом и сушат в вакуум-шкафу при 20 С до постоянной массы.
[15]
Страницы:
1
2
3
4
Выделить растворённое вещество из раствора можно путём выпаривания воды. В некоторых случаях образуются гидраты в кристаллическом виде или кристаллогидраты. Они содержат молекулы воды, которые называются кристаллизационной водой.

Общее описание
Кристаллогидраты образуются благодаря взаимодействию катионов кристаллической решётки вещества с молекулами воды. Это возможно, если связь между катионами и анионами кристалла более слабая.
К кристаллогидратам в первую очередь относятся соли. Типичными кристаллогидратами являются природные минералы – гипс, карналлит, алебастр, бура. Также кристаллогидраты образуют кислоты и основания.

Рис. 1. Кристаллогидраты.
Название вещества зависит от количества молекул воды. Для этого используют приставки, обозначающие число:
- 1 – моно;
- 2 – ди;
- 3 – три;
- 4 – тетра;
- 5 – пента;
- 6 – гекса;
- 7 – гепта;
- 8 – окта;
- 9 – нона;
- 10 – дека.

Рис. 2. Строение молекулы кристаллогидрата.
Например, кристаллогидрат FeSO4, содержащий одну молекулу воды, называется моногидрат сульфата железа (II). Если в кристаллогидрате семь молекул воды, он называется гептагидрат сульфата железа (II).
Вода из кристаллогидрата в большинстве случаев удаляется ступенчато. Например, при нагревании медного купороса, он переходит в тригидрат, затем в моногидрат. При нагревании до 250°С медный купорос полностью обезвоживается до сульфата меди (II).
Формула кристаллогидрата состоит из двух частей. Сначала записывается формула вещества. Через точку (знак умножения) указывается количество молекул воды. Например, ZnSO4 ∙ 7H2O, CuSO4 ∙ H2O, Na2CO3·10H2O, H2SO4 · H2O.

Рис. 3. Пентагидрат сульфата меди (II) и сульфат меди (II).
Расчёт массы вещества
При прокаливании кристаллогидраты разлагаются на сухое вещество и воду. Чтобы вычислить массовую долю вещества используется следующая формула:
ω(сух. в-ва) = m(сух. в-ва) / m(кр-та).
Для расчёта массовой доли воды применяется схожая формула:
ω(H2O) = m(H2O) / m(кр-та).
Рассмотрим решение задачи с применением формулы.
Необходимо вычислить массовую долю кристаллизационной воды в тригидрате нитрата меди (II) (Cu(NO3)2 ∙ 3H2O).
Решение:
Сначала запишем молярные массы воды и нитрата меди (II):
- M (Cu(NO3)2) = 187,5 г/моль;
- M (H2O) = 18 г/моль.
В 1 моле кристаллогидрата содержится 1 моль нитрата меди (II) и 3 моль воды, поэтому получаем по формуле m = n ∙ M массу воды и массу соли в кристаллогидрате:
- m (H2O) = 3 ∙ 18 = 54 г;
- m (Cu(NO3)2) = 1 ∙ 187,5 = 187,5 г.
Высчитаем общую массу вещества:
m (Cu(NO3)2 ∙ 3H2O) = 187,5 + 54 = 241,5 г.
Остаётся вычислить массовую долю воды:
ω(H2O) = m(H2O) / m(кр-та) = 54 / 241,5 = 0,22 или 22 %.
Ответ: массовая доля воды в тригидрате нитрата меди (II) 22 %.
Некоторые вещества невозможно обезводить без разложения. Например, соединение BeC2O4·H2O устойчиво только в форме кристаллогидрата.
Что мы узнали?
Кристаллогидратами называются вещества, содержащие молекулы воды за счёт их притяжения катионами кристаллической решётки. В формуле кристаллогидратов, а также в названии вещества указывается количество воды. Например, CuSO4 ∙ H2O – моногидрат сульфата меди (II). Если известны массы воды и сухого вещества, можно вычислить их массовую долю.
