Физические свойства азота
Азот – инертный двухатомный газ без цвета и запаха, химическая формула двухатомной молекулы N2, молярная масса 28,01 кг/кмоль, самый распространённый элемент на Земле. Содержание азота в атмосферном воздухе составляет около 78,09% по объёму.
Применяется в технологических процессах в качестве инертной затворной среды, например, для сухих газовых торцовых уплотнений и уплотнительных комплексов, в химической промышленности для синтеза аммиака.
Жидкий азот используется как хладагент, в машиностроении для сборки неразъемных соединений с натягом [охлаждение охватываемой детали].
Азот находит применение в специальных технологических процессах для нанесения на поверхности стальных деталей тонкого слоя износостойкого покрытия – нитрида титана; в соединении с кремнием образует износостойкий перспективный керамический материал нитрид кремния Si3N4.
Плотность азота при нормальном атмосферном давлении 101,325 кПа (1 атм) и различной температуре
| Температура азота | Плотность азота, ρ |
| оС | кг/м3 |
| -23 | 1,3488 |
| 27 | 1,1233 |
| 77 | 0,9625 |
| 127 | 0,8425 |
| 177 | 0,7485 |
| 227 | 0,6739 |
| 277 | 0,6124 |
Динамическая и кинематическая вязкость азота при нормальном атмосферном давлении и различной температуре
| Температура | Динамическая вязкость азота, μ | Кинематическая вязкость азота, ν |
| оС | (Н • c / м2) x 10-7 | (м2 / с) x 10-6 |
| -73 | 129,2 | 7,65 |
| -23 | 154,9 | 11,48 |
| 27 | 178,2 | 15,86 |
| 77 | 200,0 | 20,78 |
| 127 | 220,4 | 26,16 |
| 177 | 239,6 | 32,01 |
| 227 | 257,7 | 38,24 |
Основные физические свойства азота при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Теплопроводность, λ | Кинематическая вязкость, ν | Число Прандтля, Pr |
| K | кг/м3 | Дж / (кг • К) | Вт / (м • К) | (м2 / с) x 10-6 | – |
| 200 | 1,6883 | 1043 | 0,0183 | 7,65 | 0,736 |
| 300 | 1,1233 | 1041 | 0,0259 | 15,86 | 0,716 |
| 400 | 0,8425 | 1045 | 0,0327 | 26,16 | 0,704 |
| 500 | 0,6739 | 1056 | 0,0389 | 38,24 | 0,700 |
| 600 | 0,5615 | 1075 | 0,0446 | 51,79 | 0,701 |
| 700 | 0,4812 | 1098 | 0,0499 | 66,71 | 0,706 |
* Табличные данные подготовлены по материалам зарубежных справочников
Формулы физических свойств азота
При выполнении инженерных расчетов удобнее использовать приближённые формулы для оценки физических свойств азота N2⋆:
Плотность азота N2
⋆ [ кг/м3 ]

Теплоёмкость азота N2
⋆ [ Дж/(кг • К) ]

Теплопроводность азота N2
⋆ [ Вт/(м • K) ]

Динамическая вязкость азота N2
⋆ [ Па • c ]

Кинематическая вязкость азота N2
⋆ [ м2/с ]

Температуропроводность азота N2
[ м2/с ]

Число Прандтля азота N2
[ – ]

⋆ Приближённые формулы физических свойств азота получены авторами настоящего сайта.
Размерность величин: температура – градусы Цельсия. Формула плотности азота приведена для атмосферного давления.
Приближённые формулы действительны в диапазоне температур азота от -23 до 277 oC.
Температура – термодинамическая макроскопическая характеристика, которая играет важную роль практически во всех физических процессах. В данной статье сосредоточим свое внимание на освещении вопросов, что такое абсолютная температура газа идеального и как ее можно вычислить.
Абсолютная шкала температур
Для начала познакомимся со шкалой, которая используется в физике для описания температуры. Она называется абсолютной или шкалой Кельвина. Впервые ее ввел в использование английский физик лорд Кельвин в 1848 году. При этом ученый основывался на завоевавшей популярность шкале Цельсия.

Абсолютная температура так называется потому, что она имеет нижний предел – 0 кельвин, при котором считается “замороженным” любой вид движения (на самом деле при 0 К существуют так называемые нулевые колебания). Верхнего предела у этой шкалы нет.
С градусами Цельсия C абсолютная шкала T связана следующим простым равенством:
T = C + 273,15.
В отличие от других температурных шкал, например, от шкалы Фаренгейта, кельвин имеет точно такой же масштаб, что и градус Цельсия. Последнее означает, что для перевода в абсолютную любой температуры по Цельсию достаточно добавить к ней число 273,15. Так, по шкале Кельвина вода замерзает при 273,15 К, а кипит при 373,15 К.

Краткое понятие о газе идеальном
Поскольку далее будет рассмотрена формула для определения абсолютной температуры газа идеального, то будет полезным познакомиться с этим понятием поближе. Под идеальным понимают такой газ, молекулы которого практически не взаимодействуют друг с другом, обладают большой кинетической энергией по сравнению с потенциальной, и расстояния между которыми значительно превышают их собственные размеры.
Все реальные газы проявляют поведение идеальных при небольших давлениях и высоких температурах. Примерами могут служить благородные газы, воздух, метан и другие. В то же время пар H2O даже при низких давлениях сильно отличается от идеального газа, поскольку в нем всегда присутствуют значительные водородные связи между полярными молекулами воды.
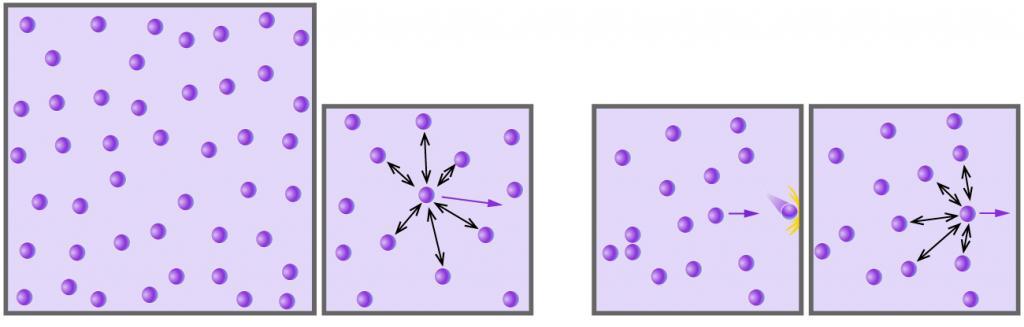
Температура абсолютная идеального газа
Существует два подхода к определению температуры в газах. Рассмотрим каждый из них.
Первый подход заключается в привлечении положений молекулярно-кинетической теории (МКТ) и физического смысла самой температуры T. Последний заключается в кинетической энергии частиц газа. Чем больше эта энергия, тем выше температура, причем зависимость является прямо пропорциональной. Используя формулу из механики для энергии кинетической и постоянную Больцмана kB можно записать следующее равенство МКТ:
m*v2/2 = 3/2*kB*T.
Где m – масса движущейся поступательно частицы. Выражая из этого равенства величину T, получаем формулу:
T = m*v2/(3*kB).
Чем меньше масса частицы и чем больше ее скорость, тем выше абсолютная температура.
Второй подход в определении величины T заключается в использовании универсального уравнения Клапейрона-Менделеева. Это уравнение было записано в XIX веке Эмилем Клапейроном (впоследствии модифицировано Д. И. Менделеевым) как результат обобщения открытых экспериментально в XVII-XIX веках газовых законов (Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро). Математически универсальное уравнение записывается так:
P*V = n*R*T.
Как видно, оно связывает три основных термодинамических величины системы: давление P, объем V и температуру абсолютную T. Две другие величины, присутствующие в уравнении, – это n – количество вещества и R – газовая постоянная.
Не представляет особого труда получить формулу для температуры из Клапейрона-Менделеева закона:
T = P*V/(n*R).
В закрытой системе (n = const) температура газа прямо пропорциональна произведению объема на давление.
Пример задачи
Воздух, которым мы дышим, является смесью газов идеальных. Известно, что молярная масса воздуха составляет 29 г/моль. Необходимо определить температуру воздуха, если средняя скорость его молекул составляет 530 м/с.
Очевидно, что решение этой задачи можно получить, если воспользоваться следующим выражением:
T = m*v2/(3*kB).
Массу одной молекулы m воздуха можно получить, если поделить величину M на число Авогадро NA. Произведение же числа NA на константу Больцмана kB – это не что иное, как газовая постоянная R, которая равна 8,314 Дж/(К*моль). Учитывая эти рассуждения, получаем рабочую формулу:
T = M*v2/(3*R ) = 0,029*6002/(3*8,314) = 326,60 К.

В градусах Цельсия найденной температуре соответствует значение 53,45 oC. На нашей планете такие температуры характерны для жарких песчаных пустынь в полдень.
На основании сказанного, можно сделать вывод: для измерения температуры необходима такая термометрическая величина, изменение которой при изменении температуры было бы независимо (или слабо зависимо) от химической природы вещества.
Такой термометрической величиной описывается газообразное состояние вещества, подчиняющееся уравнению Клапейрона – Менделеева:
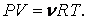 |
(2.3.1) |
Как видно из (2.3.1), давление газа при постоянном объеме и объем газа при постоянном давлении могут быть взяты в качестве термометрической величины, однако и здесь возникают те же трудности, так как реальные газы лишь приближенно могут рассматриваться как идеальные, т. е. удовлетворяющие уравнению (2.3.1).
Поэтому для устранения снова возникающей неоднозначности принято все термометры градуировать по эталонному газовому термометру с термометрическим телом Не (гелий) и термометрической величиной P (давление газа) при постоянном объеме. Этот выбор обосновывают следующим:
1. Гелий, после водорода, в наименьшей степени отклоняется от законов идеального газа (для воздуха, азота, углекислого газа и т. п. эти отклонения больше, чем для гелия). Исключение водорода связано с тем, что при высоких температурах он начинает химически действовать на материал сосуда (как правило, стекло), в котором он находится.
2. Измерение давления газа при постоянном объеме производится с большей точностью, чем измерение объема при постоянном давлении.
Однако и здесь возникают трудности: в области высоких температур применение эталонного гелиевого термометра ограничивается практическими осложнениями, а именно: гелий проникает через стенки сосуда, в котором он находится, при этом уменьшается число N молекул гелия в сосуде. В этих условиях гелий заменяют на азот. При низких температурах становятся заметными отступления от простого закона (2.3.1). Ввиду этого газовый термометр используют в качестве эталонного только для такого интервала температур, где с высокой степенью точности выполняется закон (2.3.1).
Для опытного определения вида функции f(х) уже до опыта необходимо уметь измерять температуру, так как для этого надо знать значения термометрической величины х, соответствующие ряду последовательных температур. Поэтому вид функциональной зависимости между температурой и термометрической величиной первоначально можно выбрать только произвольно. Простоты ради ее выбирают линейной, т. е. полагают
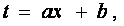 |
(*) |
Таким образом, в идеально-газовой шкале температур в качестве термометрического тела выбирают газообразный гелий (азот), а термометрической величиной – его давление при постоянном объеме. Температуру в этой шкале обозначают буквой Т, а термометрическую величину х – буквой P. Зависимость между ними выбирают линейной, вида (*) с b = 0, т. е.
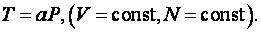 |
(2.3.2) |
Как видно из (2.3.2), температура в этой шкале равна нулю, когда давление газа Р = 0. Шкала, а также температура, измеренная в этой шкале, называется абсолютными, если в нуле температурной шкалы термометрическая величина обращается в нуль.
В абсолютной идеально-газовой шкале так же, как и в шкале Цельсия, разность температур между двумя реперными точками (температурой Т1 плавления льда и температурой Т2 кипения воды при нормальном атмосферном давлении) принимается равной 100, т. е. один градус в шкале Цельсия равен одному градусу в абсолютной шкале по определению. Таким образом, в абсолютной шкале
Второе уравнение для определения значений температур в реперных точках абсолютной шкалы находится измерением давлений P1 и P2 соответствующих температурам Т1 и Т2 в реперных точках. Эти измерения дают
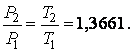 |
(2.3.4) |
Решая уравнения (2.3.3)–(2.3.4), находим
| Т1=273,15 К, Т2 = 373,15 К. |
Tемпература Т в абсолютной шкале определяется по формуле
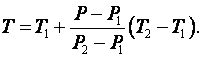 |
(2.3.5) |
Разделим обе части выражения (2.3.5) на T1, получим
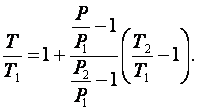 |
(2.3.6) |
Подставив (2.3.4) в (2.3.6), находим
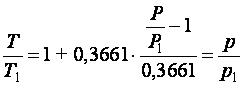 |
(2.3.7) |
или
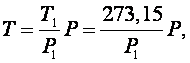 |
(2.3.8) |
где P1 – давление в газовом термометре, находящемся в тающем льду. Чтобы при помощи газового термометра измерить температуру тела, необходимо это тело привести в тепловой контакт с газовым термометром и измерить манометром давление газа в нем. Тогда температура Т вычисляется по формуле (2.3.8).
Ввиду того, что так называемая тройная точка воды (одновременное сосуществование в равновесии трех фаз воды твердой, жидкой и газообразной) значительно лучше воспроизводится на опыте, чем точки плавления льда и кипения воды, в 1954 г. по международному соглашению абсолютная шкала или шкала Кельвина строится по одной реперной точке – тройной точке воды температуре которой приписываются точно Ттр= 273,16 К (или 0,01 0С).
Тогда любая температура Т, измеряемая газовым термометром определяется по формуле, аналогичной (2.3.8):
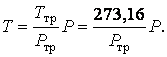 |
(2.3.9) |
Указанный выше выбор численного значения температуры тройной точки воды сделан для того, чтобы промежуток между точками плавления льда и кипения воды с максимально возможной точностью составлял 100 К. Тем самым устанавливается преемственность температурной шкалы Кельвина с абсолютной шкалой, определяемой двумя реперными точками. Измерения показали, что температуры точек плавления льда и кипения воды в шкале, Кельвина с одной реперной точкой равны приблизительно 273,15 К и 373,15 К. Единица температуры в этой шкале – Кельвин – 1/273,16 температурного интервала между тройной точкой воды и точкой абсолютного нуля температуры.
Для шкал Кельвина и Цельсия
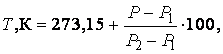 |
(2.3.10) |
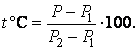 |
(2.3.11) |
Вычитая из (2.3.10) выражение (2.3.11), получим связь между шкалами Кельвина и Цельсия:
| Т,К = t 0С+273,15. | (2.3.12) |
|
В баллоне, вместимость которого равна 25,6 л, находится 1,04 кг азота (7N 14) при давлении 3,55 МПа. Определите температуру газа. Ответ округлите до десятых. Ответ выразите в (К).
Задачка тупо на уравнение Менделеева-Клапейрона. Надо просто подставить в него все известные величины – и найти неизвестную (Т). В выражении pV/T = m/μR известно абсолютно всё, кроме Т, включая R и μ, так что это задачка на умение умножать и делить. Знаете ответ? |
Смотрите также: РЦОИ результаты ЕГЭ: где и как посмотреть работы 11-х классов, когда? Где можно научиться решать задачи по физике 10-11 класс? Что делать, если ребенку 18 лет и его нельзя записать в 11 класс? Геометрия 11 класс учебник Мерзляк, где читать онлайн, краткое содержание? Как найти слова утешения выпускнику? Как решить: у Красной Шапочки в корзине было 14 пирожков (2 класс)? ВПР по физике 11 класс 2021, задания, ответы, демоверсии, где найти? Стоит ли идти в 11 класс, если есть несколько троек? Сдам ли ЕГЭ? ВПР по физике 11 класс 2020, задания, ответы, демоверсии, где найти? ВПР по физике 11 класс с ответами 2019 год все варианты -где найти/скачать? |
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
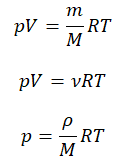
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
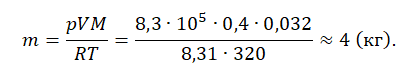
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
Важна только та масса, что осталась в сосуде. Поэтому:
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | 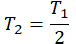 |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул | 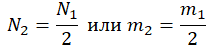 |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | 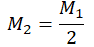 |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
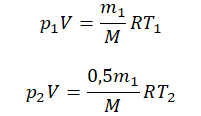
Преобразим уравнения и получим:
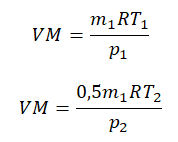
Приравняем правые части и выразим искомую величину:
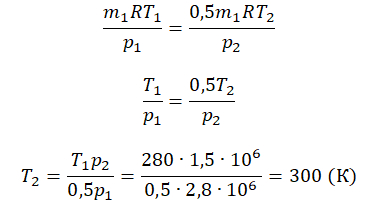
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Уравнение менделеева клапейрона для азота
Уравнение Менделеева-Клапейрона – уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.

С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров – давление, объем или температура – остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.

Изотермический процесс – процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля – Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой – термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.

Изобарный процесс – процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.

Изохорный процесс – процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.

Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей – Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление – это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.

Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
Уравнение Клапейрона-Менделеева
Что такое уравнение Клапейрона-Менделеева
Идеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой.
Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород.
Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре.
Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа.
Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть:
p V = c o n s t * T
В представленном выше уравнении состоянии газа под const подразумевается количество молей.
Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона.
p V = m M R T = n R T , где m — масса газа, M — молярная масса газа, R = 8 , 314 Д ж / ( м о л ь * К ) — универсальная газовая постоянная, T — температура (К), n — количество молей газа.
Таким образом давление и объем прямо пропорциональны количеству молей и температуре.
Также уравнение Клапейрона-Менделеева можно записать в ином виде:
p V = N k T , где N — это количество молекул газа массой m , k = 1 , 38 * 10 – 23 Д ж / К — постоянная Больцмана, которая определяет «долю» газовой постоянной, приходящуюся на одну молекулу и определяется по формуле:
N = m N A M , где
N A = 6 . 02 * 10 23 м о л ь – 1 ; — это постоянная Авогадро.
Какое значение имеет универсальная газовая постоянная
Универсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K.
Значение данной константы находится как произведение постоянной Больцмана ( k = 1 , 38 * 10 – 23 Д ж / К ) на число Авогадро ( N A = 6 . 02 * 10 23 м о л ь – 1 ) . Таким образом универсальная газовая постоянная принимает следующее значение: R = 8 , 314 Д ж / ( м о л ь * К ) .
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
Связь с другими законами состояния идеального газа
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры.
Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным.
В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа:
- изотермический процесс (T=const);
- изохорный процесс (V=const);
- изобарный процесс (p=const).
Изотермический процесс (T=const)
Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно:
Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта.
Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха).
Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу.
Рис.1. Изотерма в pV — координатах.
Изохорный процесс (V=const)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур:
p 1 p 2 = T 1 T 2
Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда
p = p 0 T T 0 = p 0 γ T
Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов.
Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2).
Рис.2 Изображение изохоры в pT-координатах.
Изобарный процесс (p=const)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур.
V 1 V 2 = T 1 T 2
Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует:
V = V 0 T T 0 = V 0 α T
Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Коэффициент α называют температурным коэффициентом объемного расширения газов.
Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3).
Рис. 3. Изобара в VT-координатах.
Использование универсального уравнения для решения задачи
В реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач.
Определить давление кислорода в баллоне объемом 1 м 3 при температуре t = 27 C o . Масса кислорода 1 кг.
Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева:
p V = n R T = m M R T
Не забываем перевести температуру в Кельвины:
T = t + 273 = 27 + 273 = 300 K
Молярная масса кислорода известна из таблицы Менделеева:
M ( O 2 ) = 2 * 16 = 32 г / м о л ь = 32 * 10 – 3 к г / м о л ь
Выразим из уравнения состояния давления и поставим все имеющиеся данные:
p = n R T V = m R T M V = 1 * 8 . 31 * 300 32 * 10 – 3 * 1 = 77 . 906 П а = 78 к П а
Ответ: p = 78 кПа.
Каким может быть наименьший объем баллона, содержащего кислород массой 6,4 кг, если его стенки при t = 20 C o выдерживают p = 1568 Н / с м 2 ?
Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти:
p = n R T V = m R T M V
Молярная масса кислорода предполагается равной:
M ( O 2 ) = 2 * 16 = 32 г / м 3
Не забываем перевести температуру в Кельвины:
T = t + 273 = 20 + 273 = 293 K
Переводим давление: p = 15680000 Па
Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи:
V = n R T p = m R T M p = 6 . 4 * 8 . 31 * 293 15680000 * 32 * 10 – 3 = 3 . 1 * 10 – 2 м 3 = 31 л .
Используя уравнение состояния идеального газа, доказать, что плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Согласно уравнению Менделеева-Клапейрона:
p = n R T V = m R T M V
Плотность — это величина, характеризующая массу некоторого объема и находится по формуле:
ρ = m V и л и V = m ρ
Тогда p m ρ = n R T = m R T M
Откуда выражаем плотность газа:
Для водорода эта формула запишется следующим образом:
ρ H 2 = p M H 2 R T
По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что:
ρ H 2 M H 2 = p R T
Поставим последнее выражение в выражение для плотности любого газа:
ρ = M * ρ H 2 M H 2
Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе.
ρ = M r * ρ H 2 2
Вывод: плотность любого газа равна половине плотности водорода ( ρ Н 2 ) , взятого при тех же условиях, умноженной на относительную молекулярную массу этого газа M_r, то есть ρ = ρ Н 2 * M r 2 .
Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы.
При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной?
По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта.
p 1 V 1 = p 2 V 2 , г д е p 1 – давление газа в начальном состоянии (до расширения), V 1 — объем газа в начальном состоянии, p 2 = p 1 2 . 5 — давление газа в конечном состоянии (после расширения), V 2 = V 1 + ∆ V — объем газа в конечном состоянии.
Откуда можем найти начальный объем:
p 1 V 1 = p 1 2 . 5 ( V 1 + ∆ V ) = p 1 2 . 5 V 1 + p 1 2 . 5 ∆ V
V 1 ( p 1 – p 1 2 . 5 ) = p 1 2 . 5 ∆ V
p 1 2 . 5 V 1 ( 2 . 5 – 1 ) = p 1 2 . 5 ∆ V
V 1 = ∆ V 1 , 5 = 8 л
Ответ: первоначальный объем газа был равен 8 л.
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс.
При изохорном процессе:
p 1 T 1 = p 2 T 2
T 2 = p 2 T 1 p 1
p 2 p 1 = 1 . 5 T 2 = 1 . 5 * T 1 = 1 . 5 * 400 = 600 K
При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным?
Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака.
V 1 V 2 = T 1 T 2
V_2 – искомый объем
Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины:
T 1 = 273 + 27 = 300 K
T 2 = 273 + 57 = 330 K
T 2 V 1 T 1 = V 2
V 2 = ( 600 * 330 ) / 300 = 660 м л
Газ в трубе плавильной печи охлаждается от температуры t 1 = 1150 ° С д о t 2 = 200 ° С . Во сколько раз увеличивается плотность газа при этом? Давление газа не меняется.
Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака:
V 1 V 2 = T 1 T 2
Перейдем к абсолютной температуре:
T 1 = 1150 + 273 = 1423 K
T 2 = 200 + 273 = 473 K
Масса газа: m = ρ 1 V 1 = ρ 2 V 2
Использование этих формул приводит к следующему:
[spoiler title=”источники:”]
http://www.sites.google.com/site/opatpofizike/uravnenie-mendeleeva-klapejrona
http://wika.tutoronline.ru/fizika/class/10/uravnenie-klapejronamendeleeva
[/spoiler]
