Ирина Рудерфер
Высший разум
(120406)
13 лет назад
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы) . Единица измерения количества вещества в СИ — моль.
[править] Применение
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют не зависимо от их массы в количествах, кратных целым числам.
Например для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода) . Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках» , их меряют в молях. Фактическое количество единиц вещества в 1 моле называется число Авогадро (NA = 6,022 141 79(30)×1023 моль-1)(правильнее – постоянная Авогадро, так как в отличие от числа эта величина имеет единицы измерения) .
Количество вещества обозначается греческой буквой ν(ню) или, упрощённо, латинской n (эн) . Для вычисления количества вещества на основании его массы пользуются понятием молярная масса: ν = m / M где m — масса вещества, M — молярная масса вещества. Молярная масса — это суммарная масса одного моля молекул данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: ν = V / Vm — где V — объём газа (при нормальных условиях) , Vm — молярный объём газа при Н. У. , равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:

диана тангатова
Ученик
(236)
7 лет назад
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов) Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Основные формулы для решения задач по химии
Т. е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Основные формулы для решения задач по химии
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н. у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т. е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
ОбозначениеФормулыЧисло АвогадроNA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mMr
n=V22.4 (лмоль)
Масса веществаm (г)
m=n•Mr
Объем веществаМ (л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Основные формулы для решения задач по химии
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
Количество вещества. Постоянная Авогадро
Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода (~^{12}_6C).
Количество вещества ν — величина, равная отношению числа молекул (атомов) N в данном теле к числу атомов NA в 0,012 кг изотопа углерода (~^{12}_6C):
(~nu = frac{N}{N_A} . qquad (2))
В СИ единицей количества вещества является моль. 1 моль — количество вещества, в котором содержится столько же структурных элементов (атомов, молекул, ионов), сколько атомов в 0,012 кг изотопа углерода (~^{12}_6C).
Число частиц в одном моле вещества называется постоянной Авогадро.
(~N_A = frac{0,012}{m_{0C}}= frac{0,012}{1,995 cdot 10^{-26}}) = 6,02·1023 моль-1. (3)
Таким образом, 1 моль любого вещества содержит одно и то же число частиц — NA частиц. Так как масса m0 частицы у разных веществ различна, то и масса NA частиц у различных веществ различна.
Массу вещества, взятого в количестве 1 моль, называют молярной массой М:
(~M = m_0 N_A . qquad (4))
В СИ единицей молярной массы является килограмм на моль (кг/моль).
Между молярной массой Μ и относительной молекулярной массой Mr существует следующая связь:
(~M = M_r cdot 10^{-3} .)
Так, молекулярная масса углекислого газа 44, молярная 44·10-3 кг/моль.
Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества) в теле[~nu = frac{m}{M}].
Тогда из формулы (2) число частиц в теле
(~N = nu N_A = frac{m}{M} N_A .)
Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы:
(~m_0 = frac{M}{N_A} = frac{m}{N} .)
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 124-125.
Формулы молекулярной физики
Формула концентрации молекул
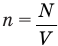
Здесь n — концентрация  , N — количество молекул (безразмерное), V — объем
, N — количество молекул (безразмерное), V — объем  .
.
Формула плотности
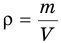
Здесь 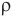 — плотность вещества
— плотность вещества 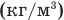 , m — масса вещества (кг), V — объем
, m — масса вещества (кг), V — объем  .
.
Формула относительной молекулярной массы
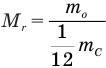
Здесь  — относительная молекулярная масса (безразмерная),
— относительная молекулярная масса (безразмерная), 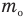 — масса одной молекулы (кг),
— масса одной молекулы (кг), 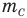 — масса атома углерода (кг).
— масса атома углерода (кг).
Формула количества вещества (количества молей)
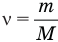
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
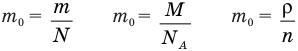
Здесь 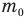 — масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль),
— масса одной молекулы (кг), т — масса вещества (кг), N — количество молекул (безразмерное), М — молярная масса (кг/моль), 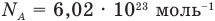 — число Авогадро,
— число Авогадро, 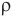 — плотность вещества
— плотность вещества 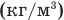 , n — концентрация молекул
, n — концентрация молекул  .
.
Формулы количества молекул
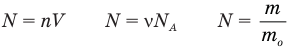
Здесь A — количество молекул (безразмерное), п — концентрация молекул  , V— объем
, V— объем  , v — количество вещества (количество молей) (моль),
, v — количество вещества (количество молей) (моль), 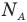 — число Авогадро
— число Авогадро 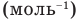 , m — масса вещества (кг),
, m — масса вещества (кг), 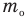 — масса одной молекулы.
— масса одной молекулы.
Формулы средней квадратичной скорости молекул
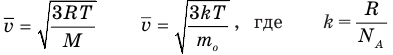
Здесь 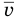 — средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль),
— средняя квадратичная скорость молекул (м/с), R = 8,31 Дж/(моль • К) — молярная газовая постоянная, Т — абсолютная температура (К), М — молярная масса (кг/моль), 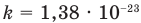 Дж/К — постоянная Больцмана,
Дж/К — постоянная Больцмана, 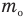 — масса одной молекулы (кг).
— масса одной молекулы (кг).
Основное уравнение кинетической теории идеального газа

Здесь р — давление газа (Па), 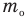 — масса одной молекулы (кг), n — концентрация молекул
— масса одной молекулы (кг), n — концентрация молекул  ,
, 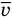 — средняя квадратичная скорость молекул (м/с),
— средняя квадратичная скорость молекул (м/с), 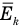 — средняя кинетическая энергия молекул (Дж).
— средняя кинетическая энергия молекул (Дж).
Формула средней кинетической энергии молекул
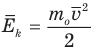
Здесь 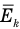 — средняя кинетическая энергия молекул (Дж),
— средняя кинетическая энергия молекул (Дж), 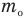 — масса одной молекулы (кг),
— масса одной молекулы (кг), 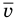 — средняя квадратичная скорость молекул (м/с).
— средняя квадратичная скорость молекул (м/с).
Связь шкал Цельсия и Кельвина
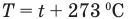
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
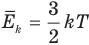
Здесь 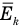 — средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
— средняя кинетическая энергия молекул (Дж), k — постоянная Больцмана (Дж/К), Т — абсолютная температура (К).
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
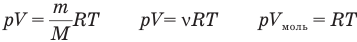
Здесь р — давление газа (Па), V — объем  , т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль),
, т — масса газа (кг), М — молярная масса (кг/моль), R — молярная газовая постоянная (ДжДмоль • К), Т — абсолютная температура (К), v — количество вещества (количество молей) (моль), 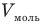 — объем моля
— объем моля 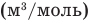 .
.
Объединенный газовый закон — уравнение Клапейрона
при 
Здесь 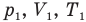 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 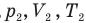 — давление (Па), объем
— давление (Па), объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Бойля — Мариотта (изотермический процесс)
при 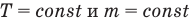
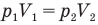
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 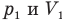 — давление (Па) и объем газа
— давление (Па) и объем газа  в первом состоянии,
в первом состоянии, 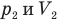 — давление (Па) и объем
— давление (Па) и объем  газа во втором состоянии.
газа во втором состоянии.
Закон Гей-Люссака (изобарный процесс)
при 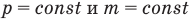
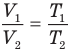
Здесь р — давление газа (Па), m — масса газа (кг), 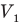 и
и 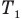 — объем
— объем  и абсолютная температура (К) газа в первом состоянии,
и абсолютная температура (К) газа в первом состоянии, 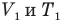 — объем
— объем  и абсолютная температура (К) газа во втором состоянии.
и абсолютная температура (К) газа во втором состоянии.
Закон Шарля
при 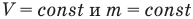
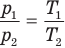
Здесь V — объем газа  , m — масса газа (кг),
, m — масса газа (кг), 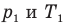 — давление (Па) и абсолютная температура (К) газа в первом состоянии,
— давление (Па) и абсолютная температура (К) газа в первом состоянии, 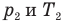 — давление (Па) и абсолютная температура (К) газа во втором состоянии.
— давление (Па) и абсолютная температура (К) газа во втором состоянии.
Связь давления идеального газа с концентрацией его молекул и температурой
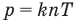
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа  , абсолютная температура Т (К).
, абсолютная температура Т (К).
Формулы относительной влажности
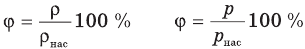
Здесь 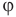 — относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре
— относительная влажность (безразмерная или в %), р — плотность водяного пара в воздухе при данной температуре 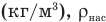 — плотность насыщенного водяного пара при той же температуре
— плотность насыщенного водяного пара при той же температуре 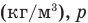 — давление водяного пара в воздухе при данной температуре (Па),
— давление водяного пара в воздухе при данной температуре (Па), 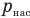 — давление насыщенного водяного пара в воздухе при той же температуре (Па).
— давление насыщенного водяного пара в воздухе при той же температуре (Па).
Работа при изобарном изменении объема газа
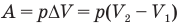
Здесь А — работа (Дж), р — давление газа (Па), 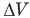 — изменение объема газа
— изменение объема газа 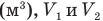 — соответственно начальный и конечный объемы газа
— соответственно начальный и конечный объемы газа  .
.
Внутренняя энергия идеального одноатомного газа
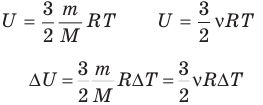
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 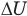 — изменение внутренней энергии (Дж),
— изменение внутренней энергии (Дж), 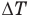 — изменение температуры (К).
— изменение температуры (К).
Первый закон термодинамики
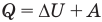
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 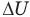 — изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
— изменение внутренней энергии системы (Дж), А — работа против внешних сил (Дж)
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при 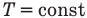
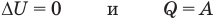
к изохорному: при V = const
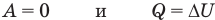
к изобарному: при р = const
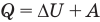
к адиабатному: при Q = 0

Здесь Т — абсолютная температура (К), 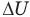 — изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем
— изменение внутренней энергии (Дж), Q — количество теплоты (Дж), А — работа (Дж), V — объем 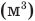 , р — давление (Па).
, р — давление (Па).
Формулы количества теплоты при нагревании или охлаждении тел
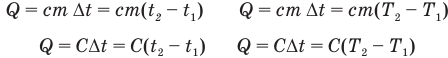
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 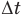 — изменение температуры тела по шкале Цельсия,
— изменение температуры тела по шкале Цельсия, 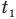 и
и 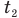 — температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия,
— температуры тела в начале и в конце процесса передачи теплоты по шкале Цельсия, 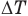 — изменение абсолютной температуры тела (К),
— изменение абсолютной температуры тела (К), 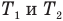 — абсолютные температуры тела в начале и в конце процесса передачи теплоты (К),
— абсолютные температуры тела в начале и в конце процесса передачи теплоты (К), 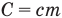 — теплоемкость тела (Дж/К).
— теплоемкость тела (Дж/К).
Формула количества теплоты при плавлении или кристаллизации
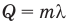
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 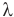 — удельная теплота плавления вещества (Дж/кг).
— удельная теплота плавления вещества (Дж/кг).
Формула количества теплоты при парообразовании или конденсации
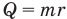
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
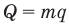
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
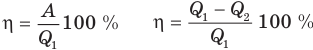
Здесь 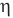 — коэффициент полезного действия (безразмерный или в %),
— коэффициент полезного действия (безразмерный или в %), 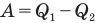 — работа, совершенная двигателем (Дж),
— работа, совершенная двигателем (Дж), 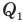 — количество теплоты, полученное рабочим веществом от нагревателя (Дж),
— количество теплоты, полученное рабочим веществом от нагревателя (Дж), 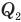 — количество теплоты, отданное рабочим веществом холодильнику (Дж).
— количество теплоты, отданное рабочим веществом холодильнику (Дж).
Коэффициент полезного действия идеального теплового двигателя
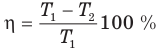
Здесь 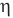 — коэффициент полезного действия идеального теплового двигателя (безразмерный или в %),
— коэффициент полезного действия идеального теплового двигателя (безразмерный или в %), 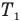 — абсолютная температура нагревателя (К),
— абсолютная температура нагревателя (К), 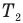 — абсолютная температура холодильника(К).
— абсолютная температура холодильника(К).
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:

И молекулярная физика, и термодинамика изучают свойства вещества, но при этом пользуются разными методами.
Молекулярная физика рассматривает свойства вещества с точки зрения его внутренней структуры (движение молекул вещества, их взаимодействие).
Термодинамика не рассматривает внутреннюю структуру вещества, а интересуется его энергией, передачей энергии. Так, она рассматривает как за счёт тепла, полученного при сгорании топлива, можно получить работу (работа тепловой машины). О термодинамике будем говорить позднее, а пока речь пойдёт о молекулярной физике, которую ещё называют молекулярно-кинетической теорией или статистической физикой.
Молекулярная физика говорит о том, что любое вещество состоит из молекул. Металлы, имеющие кристаллическое строение,
состоят из атомов, но атомы можно считать одноатомными молекулами. Молекулы вещества находятся в непрерывном хаотическом движении (обладают кинетической энергией) и взаимодействуют друг с другом – одновременно притягиваются и отталкиваются (обладают потенциальной энергией взаимодействия).
На рисунке показан график зависимости силы взаимодействия молекул от расстояния между ними. Пунктирные линии относятся к силам притяжения и отталкивания, сплошная линия даёт результирующую силу взаимодействия молекул. При
эта сила равна нулю, что соответствует наиболее устойчивому состоянию молекул (наименьшему значению потенциальной энергии их взаимодействия).
Агрегатные состояния вещества определяются соотношением потенциальной и кинетической энергий молекул.
В газах молекулы находятся далеко друг от друга, их потенциальная энергия мала, а кинетическая велика., то есть
В кристаллических телах молекулы (атомы) располагаются вплотную друг к другу, их потенциальная энергия взаимодействия очень велика. Они обладают и кинетической энергией, совершая колебания около своих положений равновесия, но для них
В жидкостях, плотность которых меньше плотности твёрдых тел, молекулы и колеблются около положений равновесия, и время от времени совершают и поступательное движение. Кинетическая и потенциальная энергии молекул жидкости соизмеримы между собой
Так как молекулярная физика говорит о молекулах, то надо ввести понятия, связанные с молекулой – это масса молекулы, концентрация молекул и другие.
Один кг (или грамм) очень крупные для молекулы единицы массы, поэтому в молекулярной физике за единичную массу приняли 1/12 часть массы атома углерода (раньше единичную массу связывали с атомом водорода, кислорода):
Количество единичных масс в атоме назвали относительной атомной массой или просто атомной массой А, а количество единичных масс в молекуле – молекулярной массой М. Тогда молекула углерода содержит 12 единичных масс, так как
Для водорода А = 1, для кислорода А = 16 и так далее (см. таблицу Менделеева).
Молекулярная масса М складывается из атомных масс А. Так,
Атомная и молекулярная массы – безразмерные величины.
Единицей количества вещества в молекулярной физике является моль. Моль – это количество вещества, в котором содержится число молекул (атомов), равное числу атомов в 0,012 кг изотопа углерода.
Таким образом, молярная масса углерода равна 0,012 кг/моль.
Масса моля водорода (молярная масса водорода):
Молярная масса воды:
то есть если взять 0,018 кг воды, то это будет моль воды.
Моль любого вещества содержит одинаковое количество молекул, названное числом Авогадро
Объём моля для твёрдых и жидких тел находится путём деления молярной массы вещества на его плотность:
Объём моля любого газа при нормальных условиях равен
Задачи
Подписывайтесь на канал и сообщите о нём своим друзьям, одноклассникам. Здесь непременно найдёте много полезного для себя.
Посмотрите занятия 32 и 33.
Ссылки на другие занятия даны в Занятии 1.
Недавно
мы говорили о размерах молекул и выяснили, что они очень малы. Как вы
понимаете, измерять массу молекул в обычных единицах массы, таких как
килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную
молекулярную массу. Относительная молекулярная (или атомная) масса вещества —
это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело
в том, что углерод входит в множество веществ, и по международному соглашению
было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться,
что относительная молекулярная масса — это безразмерная величина, поскольку
она показывает во сколько раз масса данной молекулы (или атома) больше массы
одной двенадцатой атома углерода. Тем не менее, молекулярную массу
условились измерять в атомных единицах массы (а. е. м.).
Относительные
массы всех химических элементов измерены с высокой точностью, и их можно найти
в таблице Менделеева.
Например,
относительная атомная масса водорода равна 1, относительная атомная масса гелия
равна 4 и так далее.
Зная
атомные массы можно вычислить и молекулярную массу. Например, относительная
молекулярная масса соляной кислоты равна
Аналогичным
способом можно вычислить массы других молекул. Например, молекула серной кислоты
состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Таким образом, относительная молекулярная масса серной кислоты равна .
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
Эта величина так и называется «количество вещества» и обозначается буквой ν.
Единицей измерения количества вещества является моль: .
1
моль — это количество вещества, в котором содержится столько же молекул или
атомов, сколько содержится атомов в 12 г углерода.
Это
число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества
содержит 6,02 х 1023 молекул. Это число называется числом
Авогадро или постоянной Авогадро.
Таким
образом, зная число молекул в теле, можно определить количество вещества:
С
постоянной Авогадро связана и другая величина, которая называется молярной
массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя
из этого, можно заключить, что молярная масса вещества равна .
Как
видно из этого уравнения, молярная масса измеряется .
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе:
Тогда
можно записать:
Необходимо
отметить, что молярную массу можно также взять из таблицы Менделеева, как и
молекулярную массу. Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Пример
решения задачи.
Задача
1. Определите
массу 3 моль углекислого газа.
