Ответы Mail.ru
Наука, Техника, Языки
Гуманитарные науки
Естественные науки
Лингвистика
Техника
Вопросы – лидеры.
Где у скамьи право,а где лево? Я знаю,какие руки у меня))) Вопрос в другом…
1 ставка
Чем очистить ракушку от верхнего слоя, от органики?
1 ставка
Лидеры категории
Лена-пена
Искусственный Интеллект
М.И.
Искусственный Интеллект
Y.Nine
Искусственный Интеллект
•••
Анна Носова
Ученик
(79),
закрыт
2 года назад
Лучший ответ
Иван Натальин
Мастер
(1196)
12 лет назад
Количество теплоты (Q) = удельная теплоёмкость*массу (m) (с) * на разность температур (t2-t1)
Отсюда вырази m
m=Q/(c*(t2-t1))
Остальные ответы
укукм уцкуцкуцкуцк
Гуру
(4688)
12 лет назад
Q = c*m*(t2-t1)
Формула
Dimas444423
Знаток
(342)
2 года назад
m=Q/c(t2-t1)
Каиров Тимур
Мыслитель
(5412)
7 месяцев назад
не5
Сузуя Джузо
Знаток
(284)
5 месяцев назад
m = Q/c△t
Q = cm△t
Похожие вопросы
Алгоритм 8
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты
Пример. По термохимическому уравнению
С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи
Дано:
Q = 82,4 кДж
Qр-ции = 412кДж
—————–
m(С) = ? г
М(С) = 12 г/моль
Запишем термохимическое уравнение реакции. Обозначим вопросительным знаком количество вещества, массу которого надо
найти, и надпишем количество теплоты, записанное в условии задачи. Под формулой вещества обозначим молярное соотношение, вытекающее из уравнения реакции. Вычислим количество вещества, массу которого требуется найти.
Решение:
?моль 82,4 кДж
С + О2 = СО2 + 412 кДж
1 моль
Для этого составим пропорцию
х/1=82,4/412, откуда х= 0,2.
Следовательно, n(С)=0,2 моль
Перейдем от количества вещества к массе вещества. Для этого используем молярную массу вещества
m=n•М
m(С)=n(C)•М(С)
m(C)=0,2моль•12г/моль=2,4
Запишем ответ
Ответ: m(С) = 2,4 г
Как найти массу по термохимическому уравнению
Алгоритм 8
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты
Пример. По термохимическому уравнению
С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи
Запишем термохимическое уравнение реакции. Обозначим вопросительным знаком количество вещества, массу которого надо
найти, и надпишем количество теплоты, записанное в условии задачи. Под формулой вещества обозначим молярное соотношение, вытекающее из уравнения реакции. Вычислим количество вещества, массу которого требуется найти.
Решение:
Для этого составим пропорцию
х/1=82,4/412, откуда х= 0,2.
Следовательно, n(С)=0,2 моль
Перейдем от количества вещества к массе вещества. Для этого используем молярную массу вещества
химэко
Меню сайта
Категории каталога
| 8 класс [27] |
| 9 класс [16] |
| 10 класс [30] |
| 11 класс [5] |
| Экзамен [4] |
| Лаборатория [7] |
| Опорные конспекты [0] |
| Переменка [6] |
| НОТ школьника [9] |
| Решение задач [9] |
| Творческие работы учащихся [3] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос




Статистика

Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
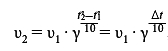
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://himekoscho.ucoz.ru/load/termokhimicheskie_uravnenija/27-1-0-130
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html
Найдите правильный ответ на вопрос ✅ «Как найти массу (m) зная температуру (t) и количество теплоты (Q) ? …» по предмету 📘 Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Физика » Как найти массу (m) зная температуру (t) и количество теплоты (Q) ?
Уровень: базовый. В ЕГЭ данные задачи встречаются в заданиях номера 28.
Многие химические реакции сопровождаются выделением или поглощением тепла. Они называются экзотермическими (если тепло выделяется) или эндотермическими (если поглощается). Количество этого тепла называется тепловым эффектом, обозначается Qи измеряется в джоулях (Дж).
Если тепловой эффект включен в уравнение реакции, то такое уравнение называется термохимическим.
Что нужно знать до разбора решения:
– что такое количество вещества и как его использовать (ссылка)
– как решать задачи с расчетом по уравнению реакции (ссылка)
Как узнать такой тип задач: требуется найти количество теплоты и указаны объем или масса одного из участников реакции (исходного вещества или продукта, неважно).
Пример задачи:
Рассчитайте количество теплоты, которое выделится при реакции 6.72 л (н.у.) водорода с кислородом, если термохимическое уравнение образования воды
Какие этапы есть в решении
1. Рассчитать количество вещества, для которого известны масса или объем:
n = V/Vm
n (H2) = 6.72 л : 22.4 л/моль = 0.3 моль
2. Составить пропорцию. Первая ее строчка состоит из коэффициента перед веществом, для которого мы считали количество, и теплового эффекта, указанного в уравнении. Во второй строчке – рассчитанное в первом действии количество вещества и искомое количество теплоты (х).
2 – 484 кДж
0.3 – х кДж
Отсюда х = 72.6 кДж
Ответ: Q = 72.6 кДж.
