Расчеты изменений
энтропии в различных процессах основаны
на использовании неравенства Клаузиуса,
которое связывает изменение энтропии
![]() с количеством теплоты
с количеством теплоты![]()
![]() ,
,
которым система обменивается с окружающей
средой при температуре![]()
![]() .
.
(3.1)
В данном случае
знак равенства имеет место при обратимых,
а неравенства – при необратимых
процессах.
Величину энтропии
данной системы нельзя измерить
непосредственно на опыте, но ее можно
вычислить, пользуясь формулой
![]() .
.
(3.2)
Эта формула
позволяет найти не абсолютную величину
энтропии, а разности энтропий в двух
состояниях системы, т.е. изменение
энтропии при переходе системы из
состояния 1 в состояние 2.
Изменение энтропии
при постоянном давлении можно найти
интегрированием частной производной
энтропии по температуре при постоянном
давлении
![]() ,
,
(3.3)
где
![]()
изобарная теплоемкость системы, Дж/К.
 .
.
(3.4)
При решении
уравнения (3.4) возможно два случая.
Случай 1.
Теплоемкость вещества в интервале
температур
![]() −
−![]() не зависит от температуры. Тогда после
не зависит от температуры. Тогда после
интегрирования (3.4) имеем:
 .
.
(3.5)
Случай 2.
Теплоемкость является некоторой
функцией температуры, например для
мольной изобарной теплоемкости известны
так называемые температурные ряды
![]() ,
,
(3.6)
где
![]()
эмпирически найденные коэффициенты.
Их значения приводятся в справочной
литературе.
Подстановка
выражения (3.6) в (3.4) позволяет после
интегрирования получить следующее
выражение
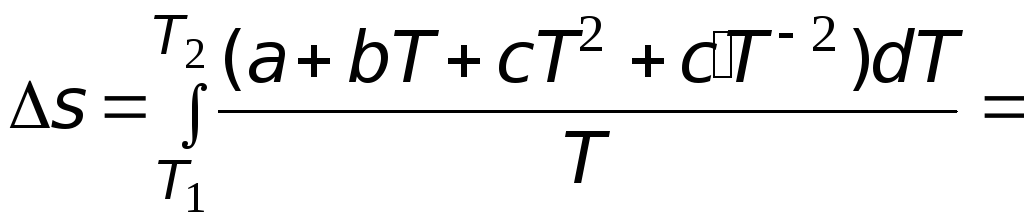
![]() .
.
(3.7)
Разность энтропий
в двух состояниях вычисляется просто,
если обратимый переход из одного
состояния в другое происходит при
постоянной температуре. Это имеет
место, например, при переходах из одного
агрегатного состояния в другое, при
фазовых переходах. Равновесные фазовые
превращения (испарение, плавление,
возгонка и т.д.) происходят в условиях
постоянства температуры и давления.
Они возможны только при подведении
(или отводе) теплоты, затрачиваемой на
проведения фазового превращения. Тогда
формула (3.4) принимает вид
![]() ,
,
(3.8)
где
![]()
скрытая теплота фазового превращения.
При постоянном
давлении скрытая теплота превращения
равна изменению энтальпии, т.е. например,
для фазового превращения
испарения − формула (3.8) примет вид
![]() ,
,
(3.9)
где
![]()
энтальпия испарения, Дж;
![]() температура
температура
кипения, К.
Если вещество в
указанном диапазоне температур
претерпевает фазовое превращение, то
общее изменение энтропии будет
складываться из нескольких слагаемых.
Например, пусть некое условное вещество
А
переходит из твердого состояния при
температуре
![]() в жидкое состояние при температуре
в жидкое состояние при температуре![]() .
.
Из условия задачи видно, что при
определенной температуре имеет место
фазовое превращение (фазовый переход)
плавление. Находим в справочнике эту
температуру, обозначим ее в общем виде
![]()
![]() .
.
Общее изменение энтропии будет равно
сумме трех слагаемых (так называемых
вкладов).
![]() .
.
(3.10)
Первый вклад в
общее изменение энтропии
это изменение энтропии при нагреве
твердого вещества от температуры
![]() до температуры плавления
до температуры плавления
 .
.
(3.11)
При температуре
плавления твердое состояние переходит
в жидкое, при этом наблюдается изменение
энтропии. Изменение энтропии при
фазовом превращении:
![]() .
.
(3.12)
И, наконец,
последний вклад в общее изменение
энтропии внесет изменение энтропии
при дальнейшем нагреве уже образовавшейся
жидкости от температуры плавления до
температуры
![]()
 .
.
(3.13)
Абсолютная мольная
энтропия газообразного вещества в
стандартном
состоянии при температуре Т
может быть найдена как сумма изменений
мольной энтропии в следующих процессах:
нагрев исследуемого вещества в твердом
состоянии от нуля до температуры
плавления; процесс плавления; нагрев
жидкого вещества до температуры кипения;
испарение жидкости; нагрев полученного
газообразного вещества до нужной
температуры.

+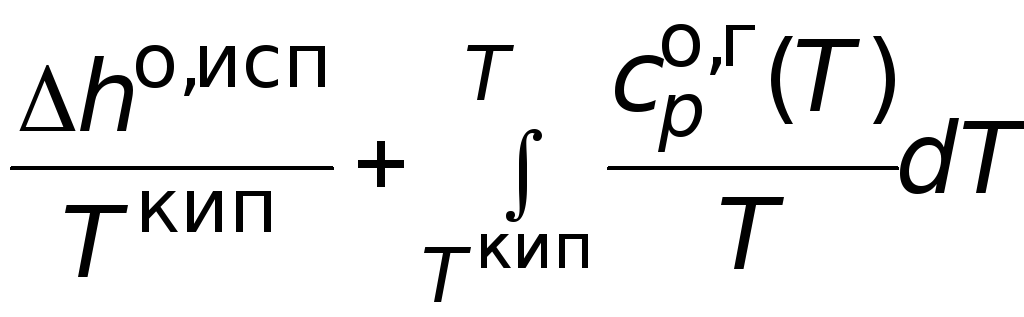 .
.
(3.14)
В справочных
термодинамических таблицах обычно
приводят значения абсолютной энтропии
в стандартном состоянии при температуре
298 К
![]() .
.
Тогда расчет абсолютного значения
энтропии при какой-либо другой температуре
можно произвести исходя из значения
энтропии при 298 К, используя формулу
(3.14) и учитывая агрегатное состояние
исследуемого вещества при 298 К.
Для расчета
изменения энтальпии системы, в которой
нет химической реакции, а только
происходит изменение температуры,
например, при постоянном давлении,
воспользуемся определительным
выражением изобарной теплоемкости
![]() ,
,
отсюда
![]() .
.
(3.15)
Так же как и при
расчете энтропии, тут возможно два
случая.
Случай 1.
Теплоемкость
вещества в интервале температур
![]() −
−![]()
не
зависит от температуры. Тогда после
интегрирования (3.15) имеем:
 .
.
(3.16)
Случай 2.
Теплоемкость является некоторой
функцией температуры. Подстановка
выражения (3.6) в (3.16) позволяет после
интегрирования получить следующее
выражение

![]() .
.
(3.17)
Если в указанном
диапазоне температур возможно фазовое
превращение, как это было рассмотрено
в вышеприведенном примере с нагревом
твердого вещества А,
то все изменение энтальпии
![]() будет равно сумме
будет равно сумме
![]() ,
,
(3.18)
где
![]()
вклад в общее изменение энтальпии за
счет процесса нагрева
твердого вещества от температуры
![]() до температуры плавления
до температуры плавления
 ,
,
(3.19)
![]() изменение
изменение
энтальпии за счет фазового превращения,
это энтальпия фазового перехода,
находится в справочниках;
![]() изменение энтальпии
изменение энтальпии
за счет дальнейшего нагрева системы
от температуры фазового перехода до
нужной температуры. Очевидно, что форма
уравнения для расчета
![]() будет аналогичной (3.19), только
будет аналогичной (3.19), только
коэффициенты температурного ряда
теплоемкости нужно брать для жидкого
вещества А.
 .
.
Для расчета
изменения энергии Гиббса чистого
вещества при переходе его из состояния
I
в состояние II
удобно использовать расчетную формулу:
![]() .
.
(3.20)
Более подробно
расчет изменения энергии Гиббса будет
рассмотрен при решении задачи.
Примеры задач
Пример 1.
Вычислите
изменение энтропии 1 кг этиленгликоля
при его нагреве от температуры 100 до
300 оС.
Решение. Используя
справочную литературу,
определим
коэффициенты температурных зависимостей
теплоемкостей жидкого и газообразного
этиленгликоля, температуру фазового
превращения
![]() и величину мольной энтропии фазового
и величину мольной энтропии фазового
превращения.
 =
=
151,0 Дж/(мольК).
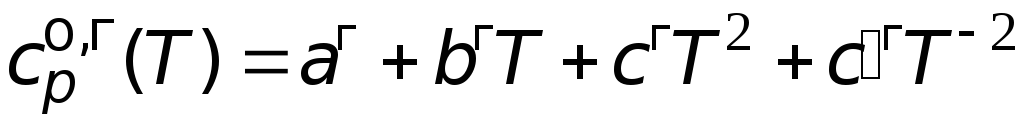 =
=
=
46,26 + 0,2005T
77,90106
T
2
Дж/(мольК).
![]() =
=
479,4 К.
Мольная энтропии
испарения
![]()
= 103,4 Дж/(моль·К).
Производим расчеты.
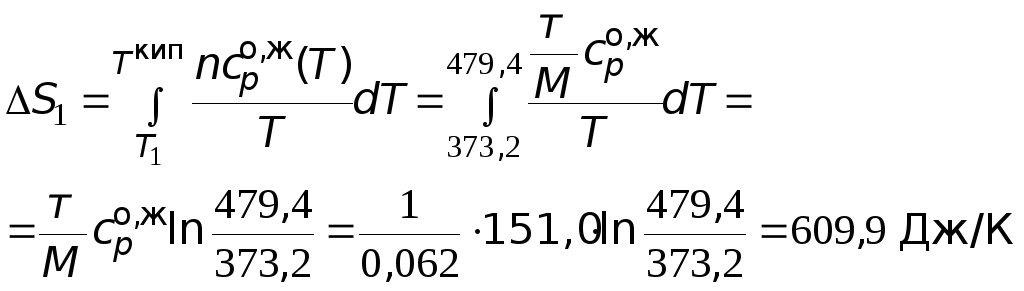
![]() =
=![]() 1667,7Дж/К.
1667,7Дж/К.

![]() =
=

![]() = 2652,2 Дж/К = 2,65
= 2652,2 Дж/К = 2,65
кДж/К.
Пример
2.
Чему
равна мольная энтропия этиленгликоля
при температуре 350 К?
Решение.
Формула
(3.14) для расчета абсолютного значения
энтропии при определенной температуре
в рассматриваемом примере упрощается.
В качестве
нижнего уровня отсчета можно использовать
абсолютное значение энтропии при 298 К
и давлении 1 атм. Это справочная величина,
она равна
![]() = 167,32 Дж/(мольК).
= 167,32 Дж/(мольК).
Выражение для расчета абсолютного
значения мольной энтропии этиленгликоля
при 350 К будет иметь вид
![]() .
.
И при 298 К, и при
350 К этиленгликоль находится в одинаковом
фазовом состоянии − жидком − т.е. в
температурном интервале 298−350 К нет
фазовых превращений. Мольная изобарная
теплоемкость жидкого этиленгликоля в
исследуемом температурном интервале
постоянна и равна
![]() =
=
151,0 Дж/(мольК).
![]() 191,6
191,6
Дж/(мольК).
Пример
3. Чему
равно изменение энтальпии при нагреве
1 моля этиленгликоля от 350 К до 500 К?
Решение.
В
указанный в условии диапазон температур
попадает температура фазового превращения
479,4 К, следовательно, до этой температуры
изменение энтальпии происходит за счет
нагревания жидкости, затем следует
изменение энтальпии при фазовом
превращении, а далее изменение энтальпии
связано с нагреванием газа. Расчет
проводим по формуле (3.18), перейдя к
мольным величинам, температурные
зависимости теплоемкости нам известны.
Мольную энтальпию фазового перехода
находим в справочной литературе, она
равна
![]() 48,6103
48,6103
Дж/моль.
![]() ;
;
 =
=
= 19 539,4 Дж/моль;
![]() 48,6103
48,6103
Дж/моль;

![]() =
=

![]() 70
70
702,2 Дж/моль = 70,7 кДж/моль.
Пример 4.
Вывести уравнение зависимости мольной
энтропии от температуры для газообразного
бензола при давлении 1 атм. Определить
величину стандартной мольной изобарной
теплоемкости бензола при 500 К двумя
способами.
Решение.
Зависимость мольной энтропии вещества
от температуры можно найти после
интегрирования выражений
 .
.
(3.21)
Слева в уравнении
(3.21) стоит разность
![]() .
.
Если в качестве первого состояния
вещества выбрать его состояние при 298
К и 1 атм, то величину мольной энтропии
(![]() )
)
этого вещества легко найти в справочнике.
Тогда из уравнения
(3.21) имеем
![]() .
.
(3.22)
Уравнения (3.22) −
это уже зависимость мольной энтропии
от температуры, но её нужно обязательно
преобразовать, учитывая, что известно
числовое значение
![]() ,
,
а также значениеТ1
= 298 К.
Необходимо учитывать, что уравнение
(3.22) написано в общем виде, поэтому
включает и эмпирический коэффициент
![]() ,
,
и эмпирический коэффициент ![]() .
.
Когда уравнение будет записано для
конкретного вещества, тогда в зависимости
от природы этого вещества в уравнении
будет слагаемое или с коэффициентом
![]()
(для органических веществ), или с
коэффициентом ![]()
(для
неорганических веществ).
В рамках данной
задачи имеем следующие данные:
|
Вещество |
кДж / моль |
Дж/(моль∙К) |
Коэффициенты уравнения
|
|||
|
а |
|
|
|
|||
|
C6H6 |
82,93 |
269,2 |
21,09 |
400,12 |
169,87 |
|
Следовательно,
энтропия газообразного бензола при
любой произвольной температуре Т
![]() .
.
После подстановки
числовых значений и преобразований
имеем выражение температурной зависимости
мольной энтропии газообразного бензола
![]() .
.
(3.23)
Используя уравнение
(3.23), можно графически изобразить
зависимость мольной энтропии газообразного
бензола от температуры (рис. 3.1), а далее
по этой зависимости определить величину
изобарной теплоемкости бензола при
температуре 500 К. Мольная изобарная
теплоемкость связана с частной
производной энтропии по температуре
![]() .
.
С
1
 ледовательно,
ледовательно,
для того чтобы графически найти
теплоемкость, нужно определить частную
производную зависимости
зависимости
энтропии от температуры в точке,
соответствующей 500 К. Графически
производную находят, проводя к
интересующей нас точке на кривой
касательную, а затем определяя угловой
коэффициента
этой касательной. Чтобы
найти угловой коэффициент касательной,
нужно взять на прямой две достаточно
удаленные друг от друга точки и определить
их координаты. Угловой коэффициент
численно равен тангенсу угла наклона
прямой (для рассматриваемого случая):
![]() .
.
Затем находим
изобарную теплоемкость
![]() .
.
Из анализа рис.
3.1 видно, что зависимость энтропии от
температуры имеет слабо выраженную
кривизну, и если точек для построения
кривой мало, то кажется, что такую
зависимость можно описать прямой
линией. Однако зависимость мольной
энтропии от температуры − это все-таки
кривая линия, и к ней можно провести
касательную. Рекомендованный шаг по
температуре для построения зависимости
составляет 50 К. В случае если какой-то
участок зависимости носит явно линейный
характер, угловой коэффициент касательной
будет совпадать с угловым коэффициентом
самой линии.
Следующий способ
определения мольной изобарной
теплоемкости газообразного бензола
расчетный, по формуле температурной
зависимости изобарной теплоемкости,
которая имеет вид:
![]() = −21,09 +
= −21,09 +
0,4T
− 0,000 169Т
2
.
По этому способу
мольная изобарная теплоемкость бензола
при 500 К равна 136,66 Дж/(моль∙К). Значения
теплоемкости,
вычисленные разными способами, должны
быть близки.
Пример 5.
Углекислый
газ массой 200 г находится в состоянии
1 при температуре 600 К и давлении 2,5 атм.
Его перевели в состояние 2, при котором
температура равна 298 К, а давление 1 атм.
Принимая
свойства углекислого газа близкими к
свойствам идеального газа, найти
изменения мольных и полных 1) объема;
2) энтропии; 3) энтальпии; 4) внутренней
энергии и 5) энергии Гиббса системы
при этом переходе.
Решение.
Из
справочных таблиц определяем форму
уравнения и значения коэффициентов
температурной зависимости мольной
изобарной теплоемкости углекислого
газа
|
Вещество |
кДж / моль |
Дж/(моль∙К) |
Коэффициенты
|
|||
|
а |
|
|
|
|||
|
CО2 |
−393,51 |
213,66 |
44,14 |
9,04 |
− |
−8,54 |
![]()
= a
+ bT
+ c’T
−2
= 44,14 + 9,04∙10−3
T
8,54∙105
T
−2
.
1. Используя
уравнение состояния идеального газа,
находим изменение мольного объема
следующим образом:
![]() =
=
= 4,74 ∙10−3
м3/моль.
Полное изменение
объёма углекислого газа при рассматриваемом
переходе составит
![]() .
.
Число молей находим
по формуле
![]() 4,55
4,55
моль.
![]() 4,55∙4,74∙10−3
4,55∙4,74∙10−3
= 2,16∙10−2
м3.
2. Расчет мольного
изменения энтропии углекислого газа
при переходе из состояния 1 в состояние
2 производится по формуле

![]()
 =
=
![]() =
=
=
−46,89 Дж/(мольК).
Полное изменение
энтропии равно
![]() −213,32 Дж/К.
−213,32 Дж/К.
3. Для идеального
газа изменение энтальпии не зависит
от давления, поэтому формула для расчета
мольного изменения энтальпии имеет
вид:
![]()
![]()
=
![]() Дж/моль.
Дж/моль.
Полное изменение
энтальпии равно
![]() =
=
4,55∙(−15998,5) = −72793,18 Дж.
4. Для идеального
газа мольное изменение внутренней
энергии связано с мольным изменением
энтальпии
![]()
Следовательно,
![]() = −15998,5−8,314(298−600)=
= −15998,5−8,314(298−600)=
−13487,7 Дж/моль.
Полное изменение
внутренней энергии найдем как
![]() =4,55(−13487,7)
=4,55(−13487,7)
= − 61369 Дж.
5. Мольное изменение
энергии Гиббса при переходе углекислого
газа из состояния 1 в состояние 2 определим
как
![]() .
.
Но известно, что
![]() ,
,
а![]() .
.
Кроме того,![]() .
.
Тогда
![]() =
=
=
![]() =
=![]() .
.
Мольные изменения
энтальпии и энтропии определены ранее,
значение мольной энтропии в состоянии
2 можно найти по справочнику, т.к. это
состояние 298 К и 1 атм:
![]() 213,66
213,66
Дж/(моль∙К).
![]() −15998,5
−15998,5
−213,66(298−600)−600∙(−46,89) =76660,8 Дж/моль.
4.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Для характеристики
раствора применяют следующие виды
концентраций.
![]() −мольная
−мольная
доля компонента k
(часто – молярная доля),
 .
.
![]() −массовая
−массовая
доля компонента,
 .
.
![]() −молярная
−молярная
концентрация (c),
другое название − плотность числа
молей,
![]() . [c
. [c
] = моль/м3
.
![]() −массовая
−массовая
концентрация, другое название –
плотность массы компонента k,
![]() .
.
[![]() ]
]
= кг/м3.
![]() −моляльная
−моляльная
концентрация раствора, или мольно-массовая
концентрация, другое название –
мольно-массовое отношение,
![]() . [ d
. [ d
] = моль/кг.
Состояние компонента
k
в растворе нельзя описать функциями,
отвечающими чистому компоненту k.
Для описания свойств компонента в
растворе вводится понятие
парциальных
мольных свойств
компонента.
Если обозначить полное экстенсивное
свойство раствора, образованного
компонентами в общем виде, как
![]() ,
,
то мольное экстенсивное свойство
раствора, состоящего из компонентовk,
будет
обозначаться как
![]() ,
,
причем![]() .
.
Вклад компонентаk
в любое экстенсивное свойство E
раствора определяется его парциальной
мольной (ПМ) величиной
![]() ,
,
которая равна
![]() .
.
(4.1)
Следует отметить,
что парциальные мольные величины
отражают изменение
свойств и их нельзя уподоблять
соответствующим мольным величинам.
Парциальные мольные величины могут
принимать значения, которые немыслимы
для мольных величин; например, парциальный
мольный объем может быть отрицательным.
Парциальные мольные величины могут
быть образованы от любой экстенсивной
величины. В общем случае экстенсивное
свойство Е
однородной системы, состоящей из k
компонентов,
можно представить в виде функции
температуры, давления и чисел молей
компонентов, т.е.
![]() .
.
Если зафиксировать постоянными давление
и температуру, то получим![]() .
.
Образуем полный
дифференциал этого выражения:
![]() .
.
(4.2)
С учетом (4.1) из
уравнения (4.2) можно получить
![]()
или
![]() .
.
(4.3)
Учитывая, что E
− однородная
функция первой степени от независимых
аргументов nk,
и
привлекая теорему Эйлера об однородных
функциях, получаем из (4.3) выражение
![]() .
.
(4.4)
Если раствор
двухкомпонентный, или как еще говорят,
бинарный, т.е. число компонентов k
= 2, то соотношения, получающиеся в этом
случае, имеют вид:
![]() .
.
(4.5)
При делении
выражения (4.5) на общее число молей
получим
![]() ,
,
(4.6)
с учетом
определительного выражения для мольной
доли компонента k
(4.6) можно записать как
![]() .
.
(4.7)
Используем эти
же выражения для объема
![]() .
.
![]() ,
,
![]() ,
,
где V
– полный объем раствора;
![]() 1
1
и
![]() 2
2
парциальные мольные объемы 1 и 2
компонентов раствора; n1
и n2
– числа молей компонентов 1 и 2; N1
и N2
– мольные доли компонентов 1 и 2 в
растворе;
![]() – мольный объем раствора.
– мольный объем раствора.
Способы определения
парциальных мольных величин рассмотрим
на примере определения парциальных
мольных объемов в бинарном растворе.
Первый способ.
Определение парциального мольного
объема по зависимости полного объема
раствора от числа молей одного из
компонентов.
С огласно
огласно
определительному выражению для
парциальной мольной величины (4.1),
парциальный мольный (ПМ) объем второго
компонента − это величина![]() 2
2
=![]() ,
,
а ПМ объем первого компонента − это
![]() 1
1
=![]() .
.
Если известно уравнение зависимости,
например
![]() ,
,
то для получения![]() 2
2
=![]()
нужно продифференцировать его.
Если
зависимость дана в форме таблицы или
в виде графика, то нужно определить
угловой коэффициент касательной к
кривой зависимости
![]()
в той точке, в которой нам требуется
определить ПМ объем. При графическом
определении частной производной нужно
найти угловой коэффициент касательной,
проведенной к кривой зависимости в
определенной точке (рис. 4.1).
Рис. 4.1. Зависимость
полного
объема раствора
от числа молей
второго компонента
(p,T,
n1
– const)
Частная производная
полного объема по числу молей второго
компонента в условиях постоянства
давления, температуры и остального
состава равна
![]() .
.
Угловой коэффициент
касательной находится

Второй способ.
Определение
ПМ объемов по зависимости мольного
объема раствора от состава.
Парциальные
мольные объемы компонентов бинарной
смеси следующим образом связаны с
мольным объемом смеси
![]() 1
1
=
![]()
N2
![]() .
.
(4.8)
![]() 2
2
=
![]()
+ (1 N2)![]() .
.
(4.9)
Из данных выражений
следует, что для вычисления парциальных
мольных объемов по этому методу
необходимо по зависимости мольного
объема от мольной доли второго компонента
определить частную производную мольного
объема раствора по мольной доле второго
компонента при постоянных давлении и
температуре
![]() в
в
интересующем нас растворе. Для
определения производной, например,
графическим способом, нужно к зависимости
мольного объема раствора от состава
(см. рис. 4.2, линия ВАС)
в соответствующей точке провести
касательную и определить угловой
коэффициент этой касательной по
координатам двух достаточно удаленных
друг от друга точек, лежащих на
касательной
![]()
 .
.
Далее по уравнениям
(4.8) и (4.9) вычислить парциальные мольные
объемы обоих компонентов.

Рис. 4.2. Зависимость
мольного объема раствора от состава
раствора
Третий способ.
Определение
ПМ объемов по методу Розебома
(метод отрезков).
Из анализа рис.
4.2 и уравнений (4.8−4.9) видно, что
касательная к зависимости
![]() =f
=f
(N2)
отсекает на левой оси ординат отрезок,
равный парциальному мольному объему
первого компонента в растворе концентрации
N2,
а на правой оси
отрезок, равный парциальному мольному
объему второго компонента в растворе
той же концентрации.
Примеры
задач
Пример 1
Жидкий бензол
массой 500 г занимает объем 568,8 см3
(293 К, 1 атм). Вычислить его мольный и
удельный объемы и плотность массы.
Дано:
Чистое вещество
– бензол
M
= 0,078 кг/моль
m
= 500 г = 0,5 кг
V
= 568,8 см3 =
5,688∙10−4
м3.
Найти:
![]() .
.
Решение
![]() = 8,887∙10−5
= 8,887∙10−5
м3/моль
![]() =
=
1,138∙10-4
м3/кг
![]() =
=![]() =8,787∙102
=8,787∙102
кг/м3.
Пример
2.
Общее
число молей в водно-ацетоновом растворе
составляет 12,58 моль. Плотность массы
раствора и плотность числа молей ацетона
в нем равны соответственно 916 кг/м3
и 7897 моль/м3
при 298 К и 1 атм. Определить массу и объем
раствора, его мольную массу и удельное
число молей.
Дано:
двухкомпонентный раствор. Компонент
1 – вода, H2O.
Компонент 2 – ацетон, (CH3)2CO.
M1 = 0,018
кг/моль; M2 = 0,058
кг/моль; n2
=
12,58 моль; ρ = 918 кг/м3;
c2 = 7897
моль/м3.
Найти:
m,
V,
M,
nуд.
Решение. Решение
основано на взаимосвязи между
концентрационными шкалами.
Масса раствора:
 =
=
=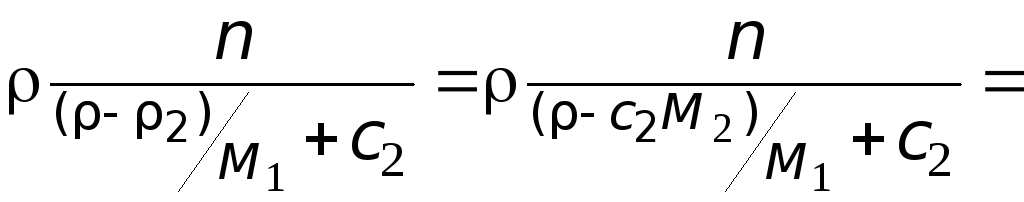
![]() .
.
Объем раствора:
![]() =
=
=![]() м3.
м3.
Мольная масса
раствора:
 =
=
=
![]() кг/моль.
кг/моль.
Удельное число
молей раствора:
![]() =
=
=
![]() моль/кг.
моль/кг.
Пример 3. Для
двухкомпонентного водно-аммиачного
раствора приведена в табличной форме
зависимость объема раствора от числа
молей аммиака при постоянных параметрах:
температуре 293 К, давлении 1 атм и числе
молей воды 5,556 моль.
|
|
0 |
0,392 |
0,682 |
1,498 |
2,521 |
|
|
1,00 |
1,10 |
1,17 |
1,34 |
1,48 |
Вычислите
парциальные мольные объемы обоих
компонентов при мольной доле аммиака,
равной 0,15.
Дано: двухкомпонентный
раствор. Компонент 1 − вода, H2O.
M1
= 0,018 кг/моль.
Компонент 2 – аммиак, NH3.
M2
= 0,017 кг/моль. n1=
5,556 моль. N2
= 0,15. Найти:
![]() .
.
Решение. Изобразим
графически данную в условии задачи
зависимость объема системы от числа
молей второго компонента.
П о
о
определению парциальный мольный объем
компонента 2 – это частная производная
полного объема по числу молей второго
компонента в условиях постоянства
температуры, давления и числа молей
первого компонента, т.е.![]() =
=![]() .
.
Полный объем
бинарного раствора может быть найден
как
![]() .
.
По рис. 4.3 найдем
частную производную объема по числу
молей второго компонента
![]() .
.
Для этого определим угловой коэффициент
касательной, проведенной к нашей
зависимости в определенной точке.
Данная точка должна показывать число
молей второго компонента в растворе
при мольной доле его, равной 0,15. Найдем
значение
n2
из
соотношения
![]() .
.
![]() =
=
![]() моль.
моль.
При числе молей
второго компонента 0,98 восстанавливаем
перпендикуляр к кривой и проводим к
точке пересечения перпендикуляра с
кривой касательную. Затем находим
угловой коэффициент касательной
![]() м3/моль,
м3/моль,
![]() = 2,210
= 2,210
−5 м3/моль.
Примечание.
Если зависимость полного объема от
числа молей второго компонента
представляет собой прямую линию, то
касательная будет совпадать с ходом
этой прямой.
Чтобы найти
![]() ,
,
воспользуемся соотношением![]() ,
,
причем значение полного объема системы
при числе молей второго компонента,
которое соответствует мольной доле
его 0,15, определим по графику.V
= 1,2510
−4
м3.
![]() =
=
![]() = 1,8610−5
= 1,8610−5
м3/моль.
|
N2 |
0,0 |
0,255 |
0,424 |
0,617 |
0,870 |
1,000 |
|
|
7,600 |
7,982 |
8,359 |
8,790 |
9,378 |
9,800 |
Пример
4.
Для
двухкомпонентного жидкого раствора
ацетон (1-й компонент)
трихлорметан (2-й компонент) представлена
в табличной форме (Т
= 298 К, р
= 1 атм) зависимость мольного объема
раствора
![]()
от мольной доли второго компонента
N2
.
Определите
для обоих компонентов парциальные
мольные объемы
![]() 1
1
и
![]() 2
2
при мольной доле второго компонента
N2
= 0,6.
Решение.
Изображаем
данные, приведенные в условии задачи,
в виде графической зависимости мольного
объема от состава (мольная доля второго
компонента). Проводим касательную к
точке на кривой, при к оторой
оторой
мольная доля трихлорметана (компонент
2) равна 0,6. Касательную проводим до
пересечения с осями ординат и по
величине, отсекаемой на каждой из осей,
находим значения парциальных мольных
объемов.
![]() 1
1
= 7,3∙10−5
м3/моль;
![]() 2
2
= 9,6∙10−5
м3/моль.
Пример
5.
Для
двухкомпонентного жидкого раствора
вода Н2О
(1-й компонент)
уксусная кислота С2Н4О2
(2-й компонент) имеется полученная на
опыте в табличной форме зависимость
изобарной теплоемкости Ср
от массы кислоты m2
(Т
= 298 К, р
= 1 атм) при постоянной массе воды m1
=
0,5 кг:
|
m2 |
0,0 |
0,057 |
0,088 |
0, 103 |
0,161 |
0,260 |
|
Сp, |
2090 |
2238 |
2314 |
2352 |
2476 |
2682 |
Удельные
изобарные теплоемкости чистых компонентов
1 и 2 (![]() )равны
)равны
4180 и 2056 Дж/(Кмоль).
Требуется
1) построить график зависимости изобарной
теплоемкости смешения раствора Срm
от числа молей кислоты n2;
2) определить для обоих компонентов их
парциальные мольные изобарные
теплоемкости смешения ср1m
и
ср2m
при мольной доле второго компонента
N2
= 0,05; 3) вычислить для тех же компонентов
при той же N2
парциальные мольные изобарные
теплоемкости ср1
и ср2.
Решение
1. Для
получения зависимости изобарной
теплоемкости смешения раствора Срm
от числа молей кислоты n2
(Срm
= f(n2))
в табличной и графической формах
необходимо преобразовать
табличные данные по зависимости
изобарной
теплоемкости Ср
от массы второго компонента
(Ср=
f
(m2))
. Используя определительные выражения
для понятий число молей и функция
смешения, получим:
![]() ;
;
![]() .
.
Пример расчета:
![]() моль;
моль;
![]() 2238
2238
− (4180∙0,5 +
2056∙0,057)
= 30,81 Дж/К.
|
n2 |
0 |
0,95 |
1,47 |
1,72 |
2,68 |
4,33 |
|
Срm, |
0 |
30,81 |
43,07 |
50,23 |
54,98 |
57,44 |
Данные расчетов
приведены ниже
Г рафический
рафический
образ зависимостиСрm
= f
(n2)
приведен на рис.4.5.
Рис.
4.5. Зависимость изобарной теплоемкости
смешения раствора Срm
от числа молей кислоты n2
2. В
основе определения
![]()
и
![]() лежит система вида
лежит система вида
![]() ,
,
 .
.
По
заданной мольной доле найдем координаты
точки на кривой Срm
=f(n2)
(рис.4.5),
к которой нужно проводить касательную):
![]() и
и
![]() (А)
(А)
в точке А
на кривой :
![]() =
=![]() =1,46
=1,46
моль.
![]() (А)
(А)
= 43 Дж/К (определили по графику при n2
=1,46 моль).
Примечание.
Следует отметить, что числовые значения,
которые в этой задаче определяются по
графику, при приближенном построении
графика, конечно, не являются точными.
При графических решениях нужно
использовать миллиметровую бумагу и
достаточно крупный масштаб, тогда
значения получатся более точными.
Определим по
угловому коэффициенту касательной
тангенсу угла наклона касательной tg
2
в точке А величину парциальной мольной
изобарной теплоемкости смешения второго
компонента
 =
=![]() Дж/(моль∙К).
Дж/(моль∙К).
Затем
можно найти
![]() :
:
![]() =
=![]() =0,496Дж/(моль∙К).
=0,496Дж/(моль∙К).
3).
Каждую из величин ср1
и ср2
находим
с помощью выражения для
![]() :
:![]() ;
;
![]() = 0,496 +4180∙ 0,018
= 0,496 +4180∙ 0,018
=75,736 Дж/(моль∙К).
![]() = 20+ 2056∙ 0,060= 143,36Дж/(моль∙К).
= 20+ 2056∙ 0,060= 143,36Дж/(моль∙К).
Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
- физике;
- химии;
- билогии;
- космологии;
- теории информации.
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Определение 1
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
$dS=frac{delta Q}{T}left( 1 right)$,
где $delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Замечание 1
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW, left( 2 right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
$S_{2}-S_{1}=klnfrac{W_{2}}{W_{1}}left( 2.1 right)$).
«Изменение энтропии» 👇
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$delta Q=dU+pdV, left( 3 right)$,
где $dU$ – изменение внутренней энергии идеального газа; $pdV$=$delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
$frac{delta Q}{T}=C_{V}frac{dT}{T}+frac{p}{T}dVleft( 4 right)$.
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$pV=RTto frac{p}{T}=frac{R}{V}left( 5 right)$.
Учтем:
$frac{dT}{T}=dleft( ln T right),, frac{dV}{V}=dleft( ln V right)left( 6 right)$.
в этом случае мы можем записать для уравнения (4):
$frac{delta Q}{T}=dleft( C_{V}lnT+RlnV right)left( 7 right)$.
По определению (1), и принимая во внимание (7), запишем:
$dS=dleft( C_{V}lnT+RlnV right)left( 8 right)$.
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=dleft( C_{V}lnT+RlnV right)=d(C_{V}lnT)left( 9 right)$.
После интегрирования (9), получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)left( 10 right)$.
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)+Rln {left( frac{V_{2}}{V_{1}} right)left( 11 right).}$
Запишем уравнение адиабатного процесса в параметрах $T,V$:
$T_{1}V_{1}^{gamma -1}=T_{2}V_{2}^{gamma -1}left( 12 right)$.,
где $gamma =frac{C_{p}}{C_{V}}-$ показатель адиабаты. Возьмем натуральные логарифмы от обеих частей выражения (12), имеем:
$ln left( frac{T_{2}}{T_{1}} right)=left( gamma -1 right)ln left( frac{V_{1}}{V_{2}} right)=-left( gamma -1 right)ln left( frac{V_{2}}{V_{1}} right)left( 13 right)$.
Преобразуем выражение (11), приняв во внимание формулу (13):
$S_{2}-S_{1}=C_{V}left[ -left( gamma -1 right)ln left(frac{V_{2}}{V_{1}} right) right]+Rln left( frac{V_{2}}{V_{1}} right)=-C_{V}left( frac{C_{p}}{C_{V}}-1 right)ln left( frac{V_{2}}{V_{1}}right)$
$+Rln {left( frac{V_{2}}{V_{1}} right)=left[ -C_{V}left(frac{C_{p}}{C_{V}}-1 right)+R right]ln {left( frac{V_{2}}{V_{1}}right)=left[ C_{V}-C_{p}+R right]ln left( frac{V_{2}}{V_{1}} right)}}left( 14 right)$.
Вспомним соотношение Майера:
$R=C_{p}-C_{V}left( 15 right)$
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
$S_{2}-S_{1}=0.$
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $frac{T_{1}+T_{2}}{2}$. Найдем изменение энтропии каждого из газов по отдельности:
$Delta S_{1}=intlimits_a^b frac{dT}{T} =nu c_{p}ln left(frac{T_{1}+T_{2}}{2T_{1}} right)left( 16 right)$,
где $a=T_{1};b=frac{T_{1}+T_{2}}{2}$ $c_p$ – молярная теплоемкость газа при постоянном давлении.
Изменение энтропии второго газа запишем аналогично:
$Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{2}} right)left( 17right)$.
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
$Delta S_{2}=Delta S_{1}+Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{1}} right)+c_{p}ln left(frac{T_{1}+T_{2}}{2T_{2}} right)=nu c_{p}ln frac{left( T_{1}+T_{2} right)^{2}}{4T_{1}T_{2}}=2nu$ $c_{p}lnleft( frac{T_{1}+T_{2}}{2sqrt {T_{1}T_{2}} } right)$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
From Wikipedia, the free encyclopedia
In classical thermodynamics, entropy (from Greek τρoπή (tropḗ) ‘transformation’) is a property of a thermodynamic system that expresses the direction or outcome of spontaneous changes in the system. The term was introduced by Rudolf Clausius in the mid-19th century to explain the relationship of the internal energy that is available or unavailable for transformations in form of heat and work. Entropy predicts that certain processes are irreversible or impossible, despite not violating the conservation of energy.[1] The definition of entropy is central to the establishment of the second law of thermodynamics, which states that the entropy of isolated systems cannot decrease with time, as they always tend to arrive at a state of thermodynamic equilibrium, where the entropy is highest. Entropy is therefore also considered to be a measure of disorder in the system.
Ludwig Boltzmann explained the entropy as a measure of the number of possible microscopic configurations Ω of the individual atoms and molecules of the system (microstates) which correspond to the macroscopic state (macrostate) of the system. He showed that the thermodynamic entropy is k ln Ω, where the factor k has since been known as the Boltzmann constant.
Concept[edit]

Figure 1. A thermodynamic model system
Differences in pressure, density, and temperature of a thermodynamic system tend to equalize over time. For example, in a room containing a glass of melting ice, the difference in temperature between the warm room and the cold glass of ice and water is equalized by energy flowing as heat from the room to the cooler ice and water mixture. Over time, the temperature of the glass and its contents and the temperature of the room achieve a balance. The entropy of the room has decreased. However, the entropy of the glass of ice and water has increased more than the entropy of the room has decreased. In an isolated system, such as the room and ice water taken together, the dispersal of energy from warmer to cooler regions always results in a net increase in entropy. Thus, when the system of the room and ice water system has reached thermal equilibrium, the entropy change from the initial state is at its maximum. The entropy of the thermodynamic system is a measure of the progress of the equalization.
Many irreversible processes result in an increase of entropy. One of them is mixing of two or more different substances, occasioned by bringing them together by removing a wall that separates them, keeping the temperature and pressure constant. The mixing is accompanied by the entropy of mixing. In the important case of mixing of ideal gases, the combined system does not change its internal energy by work or heat transfer; the entropy increase is then entirely due to the spreading of the different substances into their new common volume.[2]
From a macroscopic perspective, in classical thermodynamics, the entropy is a state function of a thermodynamic system: that is, a property depending only on the current state of the system, independent of how that state came to be achieved. Entropy is a key ingredient of the Second law of thermodynamics, which has important consequences e.g. for the performance of heat engines, refrigerators, and heat pumps.
Definition[edit]
According to the Clausius equality, for a closed homogeneous system, in which only reversible processes take place,
With T being the uniform temperature of the closed system and delta Q the incremental reversible transfer of heat energy into that system.
That means the line integral 
A state function S, called entropy, may be defined which satisfies
Entropy measurement[edit]
The thermodynamic state of a uniform closed system is determined by its temperature T and pressure P. A change in entropy can be written as
The first contribution depends on the heat capacity at constant pressure CP through
This is the result of the definition of the heat capacity by δQ = CP dT and T dS = δQ. The second term may be rewritten with one of the Maxwell relations
and the definition of the volumetric thermal-expansion coefficient
so that
With this expression the entropy S at arbitrary P and T can be related to the entropy S0 at some reference state at P0 and T0 according to
In classical thermodynamics, the entropy of the reference state can be put equal to zero at any convenient temperature and pressure. For example, for pure substances, one can take the entropy of the solid at the melting point at 1 bar equal to zero. From a more fundamental point of view, the third law of thermodynamics suggests that there is a preference to take S = 0 at T = 0 (absolute zero) for perfectly ordered materials such as crystals.
S(P, T) is determined by followed a specific path in the P-T diagram: integration over T at constant pressure P0, so that dP = 0, and in the second integral one integrates over P at constant temperature T, so that dT = 0. As the entropy is a function of state the result is independent of the path.
The above relation shows that the determination of the entropy requires knowledge of the heat capacity and the equation of state (which is the relation between P,V, and T of the substance involved). Normally these are complicated functions and numerical integration is needed. In simple cases it is possible to get analytical expressions for the entropy. In the case of an ideal gas, the heat capacity is constant and the ideal gas law PV = nRT gives that αVV = V/T = nR/p, with n the number of moles and R the molar ideal-gas constant. So, the molar entropy of an ideal gas is given by
In this expression CP now is the molar heat capacity.
The entropy of inhomogeneous systems is the sum of the entropies of the various subsystems. The laws of thermodynamics hold rigorously for inhomogeneous systems even though they may be far from internal equilibrium. The only condition is that the thermodynamic parameters of the composing subsystems are (reasonably) well-defined.
Temperature-entropy diagrams[edit]

Fig.2 Temperature–entropy diagram of nitrogen. The red curve at the left is the melting curve. The red dome represents the two-phase region with the low-entropy side the saturated liquid and the high-entropy side the saturated gas. The black curves give the TS relation along isobars. The pressures are indicated in bar. The blue curves are isenthalps (curves of constant enthalpy). The values are indicated in blue in kJ/kg.
Entropy values of important substances may be obtained from reference works or with commercial software in tabular form or as diagrams. One of the most common diagrams is the temperature-entropy diagram (TS-diagram). For example, Fig.2 shows the TS-diagram of nitrogen,[3] depicting the melting curve and saturated liquid and vapor values with isobars and isenthalps.
Entropy change in irreversible transformations[edit]
We now consider inhomogeneous systems in which internal transformations (processes) can take place. If we calculate the entropy S1 before and S2 after such an internal process the Second Law of Thermodynamics demands that S2 ≥ S1 where the equality sign holds if the process is reversible. The difference Si = S2 − S1 is the entropy production due to the irreversible process. The Second law demands that the entropy of an isolated system cannot decrease.
Suppose a system is thermally and mechanically isolated from the environment (isolated system). For example, consider an insulating rigid box divided by a movable partition into two volumes, each filled with gas. If the pressure of one gas is higher, it will expand by moving the partition, thus performing work on the other gas. Also, if the gases are at different temperatures, heat can flow from one gas to the other provided the partition allows heat conduction. Our above result indicates that the entropy of the system as a whole will increase during these processes. There exists a maximum amount of entropy the system may possess under the circumstances. This entropy corresponds to a state of stable equilibrium, since a transformation to any other equilibrium state would cause the entropy to decrease, which is forbidden. Once the system reaches this maximum-entropy state, no part of the system can perform work on any other part. It is in this sense that entropy is a measure of the energy in a system that cannot be used to do work.
An irreversible process degrades the performance of a thermodynamic system, designed to do work or produce cooling, and results in entropy production. The entropy generation during a reversible process is zero. Thus entropy production is a measure of the irreversibility and may be used to compare engineering processes and machines.
Thermal machines[edit]
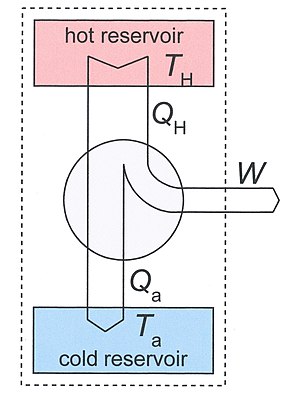
Figure 3: Heat engine diagram. The system, discussed in the text, is indicated by the dotted rectangle. It contains the two reservoirs and the heat engine. The arrows define the positive directions of the flows of heat and work.
Clausius’ identification of S as a significant quantity was motivated by the study of reversible and irreversible thermodynamic transformations. A heat engine is a thermodynamic system that can undergo a sequence of transformations which ultimately return it to its original state. Such a sequence is called a cyclic process, or simply a cycle. During some transformations, the engine may exchange energy with its environment. The net result of a cycle is
- mechanical work done by the system (which can be positive or negative, the latter meaning that work is done on the engine),
- heat transferred from one part of the environment to another. In the steady state, by the conservation of energy, the net energy lost by the environment is equal to the work done by the engine.
If every transformation in the cycle is reversible, the cycle is reversible, and it can be run in reverse, so that the heat transfers occur in the opposite directions and the amount of work done switches sign.
Heat engines[edit]
Consider a heat engine working between two temperatures TH and Ta. With Ta we have ambient temperature in mind, but, in principle it may also be some other low temperature. The heat engine is in thermal contact with two heat reservoirs which are supposed to have a very large heat capacity so that their temperatures do not change significantly if heat QH is removed from the hot reservoir and Qa is added to the lower reservoir. Under normal operation TH > Ta and QH, Qa, and W are all positive.
As our thermodynamical system we take a big system which includes the engine and the two reservoirs. It is indicated in Fig.3 by the dotted rectangle. It is inhomogeneous, closed (no exchange of matter with its surroundings), and adiabatic (no exchange of heat with its surroundings). It is not isolated since per cycle a certain amount of work W is produced by the system given by the first law of thermodynamics
We used the fact that the engine itself is periodic, so its internal energy has not changed after one cycle. The same is true for its entropy, so the entropy increase S2 − S1 of our system after one cycle is given by the reduction of entropy of the hot source and the increase of the cold sink. The entropy increase of the total system S2 – S1 is equal to the entropy production Si due to irreversible processes in the engine so
The Second law demands that Si ≥ 0. Eliminating Qa from the two relations gives
The first term is the maximum possible work for a heat engine, given by a reversible engine, as one operating along a Carnot cycle. Finally
This equation tells us that the production of work is reduced by the generation of entropy. The term TaSi gives the lost work, or dissipated energy, by the machine.
Correspondingly, the amount of heat, discarded to the cold sink, is increased by the entropy generation
These important relations can also be obtained without the inclusion of the heat reservoirs. See the article on entropy production.
Refrigerators[edit]
The same principle can be applied to a refrigerator working between a low temperature TL and ambient temperature. The schematic drawing is exactly the same as Fig.3 with TH replaced by TL, QH by QL, and the sign of W reversed. In this case the entropy production is
and the work needed to extract heat QL from the cold source is
The first term is the minimum required work, which corresponds to a reversible refrigerator, so we have
i.e., the refrigerator compressor has to perform extra work to compensate for the dissipated energy due to irreversible processes which lead to entropy production.
See also[edit]
- Entropy
- Enthalpy
- Entropy production
- Fundamental thermodynamic relation
- Thermodynamic free energy
- History of entropy
- Entropy (statistical views)
References[edit]
- ^ Lieb, E. H.; Yngvason, J. (1999). “The Physics and Mathematics of the Second Law of Thermodynamics”. Physics Reports. 310 (1): 1–96. arXiv:cond-mat/9708200. Bibcode:1999PhR…310….1L. doi:10.1016/S0370-1573(98)00082-9. S2CID 119620408.
- ^ Notes for a “Conversation About Entropy”
- ^ Figure composed with data obtained with RefProp, NIST Standard Reference Database 23
Further reading[edit]
- E.A. Guggenheim Thermodynamics, an advanced treatment for chemists and physicists North-Holland Publishing Company, Amsterdam, 1959.
- C. Kittel and H. Kroemer Thermal Physics W.H. Freeman and Company, New York, 1980.
- Goldstein, Martin, and Inge F., 1993. The Refrigerator and the Universe. Harvard Univ. Press. A gentle introduction at a lower level than this entry.


















