Вычисление приближенных значений коэффициентов активности ионов, ионное произведение воды
Задача 535.
Найти приближенные значения коэффициентов активности ионов Cl–, SO42-, PO43- и [Fe(CN)6]4- в растворе с ионной силой 0,0001.
Решение:
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:  (ион) = fCM, где f – коэффициент активности иона.
(ион) = fCM, где f – коэффициент активности иона.
Значение коэффициента активности иона рассчитаем по формуле 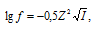 получим:
получим:
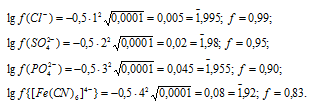
Ответ: f(Cl–) = 0,99; f(SO42-) = 0,95; f(PO43-) = 0,90; f{[Fe(CN)6]4-} = 0,83.
Задача 536.
Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а) 10-4; б) 3,2 . 10-6; в) 7,4 . 10-11.
Решение:
Ионное произведение воды – это произведение концентрации ионов водорода и гидроксид-ионов, образующихся при диссоциации воды:
K(H2O) = [H+] . [OH–] = 10-14. .
Подставляя в это уравнение е данные задачи, рассчитаем молярную концентрацию ионов водорода, получим:
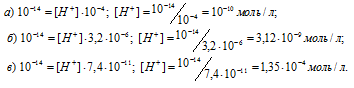
Ответ: а) 10-3 моль/л; б) 6,5 . 10-8 моль/л; в) 1,4 . 10-12 моль/л.
Задача 537.
Найти молярную концентрацию ионов OH– в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а) 10-3; б) 6,5 . 10-8; в) 1,4 . 10-12.
Решение:
Ионное произведение воды – это произведение концентрации ионов водорода и гидроксид-ионов, образующихся при диссоциации воды:
K(H2O) = [H+] . [OH–] = 10-14. .
Подставляя в это уравнение е данные задачи, рассчитаем молярную концентрацию ионов водорода, получим:
Ответ: а) 10-11 моль/л; б) 1,54 . 10-7 моль/л; в) 7,14 . 10-3 моль/л.
Вычислите концентрации гидроксид ионов (OH—) в растворе, pH которого равен 3,28.
Решение задачи
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
По значению pH определяем концентрацию ионов водорода ([H+]) в растворе:
-lg[H+] = -lg х = 3,28
lg х = -3,28
х = 5,25 ⋅ 10-4 (моль/л).
Ионное произведение воды (KH2O) – произведение концентраций ионов водорода ([H+]) и гидроксид-ионов ([OH—]):
Исходя из ионного произведения воды, найдем концентрацию гидроксид ионов ([OH—]):
![]()
Концентрацию гидроксид ионов ([OH—]) в растворе определяют по значению ионного произведения воды:
[OH—] = 10-14 /5,25 ⋅ 10-4=0,19 ⋅ 10-10 (моль/л).
Ответ:
концентрация гидроксид ионов равна 0,19 ⋅ 10-10 моль/л.
Уравнение
диссоциации бинарного электролита в
общем виде:
AaBb
aAz+
+ bBz−
Степень диссоциации,
по определению, равна отношению числа
моль AaBb,
распавшегося на ионы, к общему числу
моль AaBb.
Пусть объём раствора
равен одному литру. Тогда общее число
моль AaBb
− это молярная концентрация электролита
c.
При распаде одного
моля AaBb
образуется «a»
моль ионов Az+.
Следовательно, число моль электролита
AaBb,
распавшегося на ионы, в «a»
раз меньше, чем молярная концентрация
ионов Az+,
т.е. равна
![]() (концентрацию ионов принято обозначать
(концентрацию ионов принято обозначать
в квадратных скобках).
Используя определение
степени диссоциации, получаем:
![]() ;
;
![]() .
.
Поскольку, по
определению, степень диссоциации равна
отношению числа моль электролита,
распавшегося на ионы, к общему числу
моль электролита, а для одного литра
раствора это, как мы установили, величины,
соответственно равные
![]() иc,
иc,
то:
![]() ;
;
![]() .
.
Таким образом,
концентрация
ионов связана с молярной концентрацией
электролита следующим
образом:
![]() ;
;
![]() .
.
Эти формулы
применимы и к слабым, и к сильным
электролитам.
Рассмотрим примеры.
Найдём
концентрацию ионов в 0,1 М растворе
Cr2(SO4)3,
если степень диссоциации 60 %.
Cr2(SO4)3
2Cr3+
+ 3SO42−
[Cr3+]
= 2c
= 2∙0,1∙0,6 = 0,12 моль/л.
[SO42−]
= 3c
= 3∙0,1∙0,6 = 0,18 моль/л.
В указанные
соотношения входит именно молярная
концентрация. Если в условии задачи
приведены другие способы выражения
концентрации раствора, то необходимо
сначала определить молярную концентрацию.
Например, в условии
данной задачи могла быть дана нормальность
раствора сульфата хрома (III),
равная 0,6 г-экв/л, или же сказано, что
концентрация составляет 39,2 г/л (проверьте
самостоятельно, что это 0,1 М раствор).
Для
растворов кислот и оснований
приведённые соотношения особенно важны
для определения молярных концентраций
соответственно ионов водорода и
гидроксид-ионов.
Например, для
раствора серной кислоты
H2SO4
2H+
+ SO42−
[H+]
= 2c;
Для раствора
аммиака
NH3∙H2O
NH4+
+ OH−
[OH−]
= c;
Рассмотрим пример
ещё одного задания.
Найдем
степень диссоциации гидрата аммиака в
его 0,23 М растворе, если в трех литрах
раствора содержится 0,0045 моль ионов
аммония.
В формуле
![]() известно значениеc.
известно значениеc.
Молярную концентрацию ионов NH+
найдем, составив пропорцию:
в
3 л содержится 0,0045 моль NH4+
в
1 л » x
моль NH4+
[NH4+]
= x
= 0,0015 моль/л
Вычислим:
![]() ,
,
или 0,65 %.
3) Водородный показатель (рН) растворов, ионное произведение воды, шкала рН.
Ионное
произведение воды Kв
− постоянная при данной температуре
величина. При стандартной температуре
Kв
= [H+][OH−]
= 10−14.
Произведение
концентраций ионов H+
и OH−
не меняется, следовательно, во сколько
раз увеличивается концентрация ионов
H+,
во столько же раз уменьшается концентрация
OH−,
и наоборот.
Водородный
показатель рН = −lg[H+].
В нейтральной
среде, когда [H+]
= [OH−],
[H+]
= 10−7
и рН = 7;
В кислой среде
[H+]
> 10−7
и рН < 7;
В щелочной среде
[H+]
< 10−7
и рН > 7.
Пусть рН = 10. Тогда
[H+]
= 10−10 моль/л,
а
![]() .
.
В данном растворе
концентрация ионов OH−
больше
концентрации ионов H+
в
![]() раз, или в миллион раз. Концентрация
раз, или в миллион раз. Концентрация
ионовOH−
больше, чем в нейтральной среде в
![]() раз, или в тысячу раз.
раз, или в тысячу раз.
Рассмотрим схему
решения задач,
в которых требуется найти
рН в растворах кислоты или основания.
Не забывайте, что в растворах оснований
рН > 7.
I.
В условии даны «c»
и
«».
а) Написать уравнения
диссоциации.
б) Вычислить для
кислоты [H+]
= a∙c;
для основания
[OH−]
= b∙c.
Здесь «a»
− число ионов водорода и «b»
число гидроксид-ионов, которые образуются
при диссоциации одной молекулы
соответственно кислоты и основания
(см. примеры в пункте 2).
в) Для основания
вычислить
![]() .
.
г) Зная [H+],
определить рН.
II.
В условии нет значения «».
Тогда для слабых электролитов «»
определяется через константу диссоциации
![]() ,
,
а для разбавленных растворов сильных
электролитов принимается, что
равно 1.
Например, определим
рН в 0,001 М растворе NaOH.
Концентрация гидроксид-ионов совпадает
с молярной концентрацией щелочи:
[OH−]
= c
= c∙1=
c
= 0,001 = 10−3
моль/л.
Найдём:
![]() ;
;
рН = −lg[H+]
= −lg10−11
= 11.
III.
Если в условии задачи нет значения «c»,
то там содержится вся необходимая
информация для определения молярной
концентрации. Например, может быть
приведена нормальность, или процентная
концентрация и плотность раствора, или
число моль электролита в известном
объёме раствора (см. комментарии к
решению задач №1 ВКР-2).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Найдите молярную концентрацию
Елена Устинова
Ученик
(215),
закрыт
9 лет назад
Найдите молярную концентрацию гидроксид-ионов OH- в водном растворе, в котором концентрация ионов Н+ равна 10^ -3 моль/л.
Лучший ответ
Руслан Андрианов
Гуру
(3450)
9 лет назад
Ионное произведение воды (при 25°С) К (Н2О) равно 10^(-14) (моль/л) ^2. Но К (Н2О) = [Н+][ОН-], отсюда [OH-] = K(H2O)/[H+] = 10^(-14)/10^(-3) = 10^(-11) моль/л.
Остальные ответы
Вася Иванов
Оракул
(70404)
9 лет назад
Молярная концентрация гидроксид-ионов OH- в водном растворе, в котором концентрация ионов Н+ равна 10^ -3 моль/л будет в сто миллионов раз меньше.
Похожие вопросы
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
