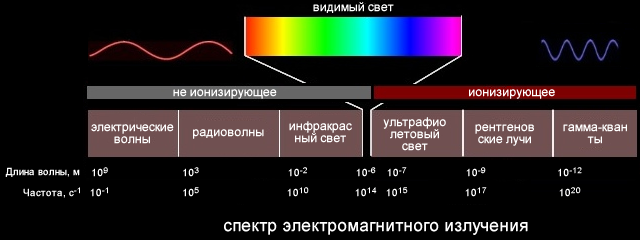
Спектр (лат. spectrum «виде́ние») в физике — скалярная функция частоты 

Обычно под спектром подразумевается электромагнитный (или акустический) спектр, задающий распределение частот / длин волн электромагнитного излучения (или упругих колебаний). Форма спектра показывает, в какой мере в сигнале представлены синие, зеленые и другие цвета (или ультразвуковые, слышимые и другие волны). Размерность такого спектра есть размерность объёмной плотности энергии или поверхностной плотности мощности, делённая на размерность аргумента: если это частота то будет (Дж/м3)/Гц или (Вт/м2)/Гц, а если длина волны то (Дж/м3)/м или (Вт/м2)/м. Нередко приводится в относительных безразмерных единицах.
Иногда под спектром понимают не распределение целиком, а просто набор или диапазон возможных в конкретной системе частот, длин волн, энергий, масс без указания вероятностей их реализации (например, говорят о спектре энергий частицы в квантовой яме).

В научный обиход термин «спектр» ввёл Исаак Ньютон в 1671—1672 годах для обозначения многоцветной полосы, похожей на радугу, получающейся при прохождении солнечного луча через треугольную стеклянную призму[1]. В те годы это была просто фиксация факта наличия электромагнитных волн разных длин в солнечном излучении, но позднее были получены и распределения по длинам волн.
Типы спектров[править | править код]

По характеру распределения значений физической величины спектры могут быть дискретными (линейчатыми), непрерывными (сплошными), а также представлять комбинацию (наложение) дискретных и непрерывных спектров.
Примерами линейчатых спектров могут служить масс-спектры и спектры связанно-связанных электронных переходов атома; примерами непрерывных спектров — спектр электромагнитного излучения нагретого твердого тела и спектр свободно-свободных электронных переходов атома; примерами комбинированных спектров — спектры излучения звёзд, где на сплошной спектр фотосферы накладываются хромосферные линии поглощения или большинство звуковых спектров.
Другим критерием типизации спектров служат физические процессы, лежащие в основе их получения. Так, по типу взаимодействия излучения с материей, спектры делятся на эмиссионные (спектры излучения), абсорбционные (спектры поглощения) и спектры рассеяния.
- Электромагнитный спектр — совокупность всех диапазонов частот электромагнитных волн.
- Эмиссионный спектр — набор частот электромагнитного излучения, испускаемого атомом или молекулой при переходе на более низкий энергетический уровень.
- Спектр масс — набор значений масс элементарных частиц.
- Энергетический спектр — набор или диапазон возможных значений энергии частицы в конкретной (обычно квантовой) системе.
- Спектр нейтронов — функция, описывающая распределение нейтронов по энергии.
Спектры произвольных сигналов[править | править код]
В 1822 году Фурье, занимавшийся теорией распространения тепла в твёрдом теле, опубликовал работу «Аналитическая теория тепла», сыгравшую значительную роль в последующей истории математики. В этой работе он описал метод разделения переменных (преобразование Фурье), основанный на представлении функций тригонометрическими рядами (ряды Фурье). Фурье также сделал попытку доказать возможность разложения в тригонометрический ряд любой произвольной функции, и, хотя его попытка оказалась неудачной, она, фактически, стала основой современной цифровой обработки сигналов.
Оптические спектры, например, ньютоновский, количественно описываются функцией зависимости интенсивности излучения от его длины волны 


В случае акустики или аналоговых электрических сигналов ситуация другая: результатом измерения является функция зависимости интенсивности от времени 

Именно преобразование Фурье однозначно определяет соответствие между временны́м 

Исторические сведения[править | править код]
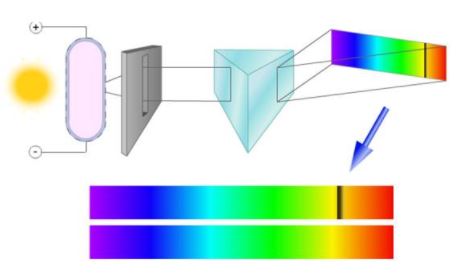
Исторически раньше всех прочих спектров было начато исследование оптических спектров. Первым был Исаак Ньютон, который в своём труде «Оптика», вышедшем в 1704 году, опубликовал результаты своих опытов разложения с помощью призмы белого света на отдельные компоненты различной цветности и преломляемости, то есть получил спектры солнечного излучения, и объяснил их природу, показав, что цвет есть собственное свойство света, а не вносится призмой, как утверждал Роджер Бэкон в XIII веке. Фактически, Ньютон заложил основы оптической спектроскопии: в «Оптике» он описал все три используемых поныне метода разложения света — преломление, интерференцию и дифракцию, а его призма с коллиматором, щелью и линзой была первым спектроскопом.
Следующий этап наступил через 100 лет, когда Уильям Волластон в 1802 году наблюдал тёмные линии в солнечном спектре, но не придал своим наблюдениям значения. В 1814 году эти линии независимо обнаружил и подробно описал Фраунгофер (сейчас линии поглощения в солнечном спектре называются линиями Фраунгофера), но не смог объяснить их природу. Фраунгофер описал свыше 500 линий в солнечном спектре и отметил, что положение линии D близко к положению яркой жёлтой линии в спектре пламени.
В 1854 году Кирхгоф и Бунзен начали изучать спектры пламени, окрашенного парами металлических солей, и в результате ими были заложены основы спектрального анализа, первого из инструментальных спектральных методов — одних из самых мощных методов экспериментальной науки.
В 1859 году Кирхгоф опубликовал в журнале «Ежемесячные сообщения Берлинской академии наук» небольшую статью «О фраунгоферовых линиях».
выдержка из труда Кирхгофа

Спектроскоп Кирхгофа-Бунзена, Annalen der Physik und der Chemie (Poggendorff), Vol. 110 (1860)
В связи с выполненным мною совместно с Бунзеном исследованием спектров окрашенных пламен, благодаря которому стало возможным определить качественный состав сложных смесей по виду их спектров в пламени паяльной лампы, я сделал некоторые наблюдения, приводящие к неожиданному выводу о происхождении фраунгоферовых линий и позволяющие по ним судить о вещественном составе атмосферы Солнца и, возможно, также ярких неподвижных звезд…
…окрашенные пламена, в спектрах которых наблюдаются светлые резкие линии, так ослабляют проходящие через них лучи того же света, что на месте светлых линий появляются темные, если только за пламенем находится источник света достаточно большой интенсивности, в спектре которого эти линии обычно отсутствуют. Я далее заключаю, что темные линии солнечного спектра, не обязанные своим появлением земной атмосфере, возникают из-за присутствия в раскаленной атмосфере Солнца таких веществ, которые в спектре пламени на том же самом месте дают светлые линии. Следует принять, что совпадающие с D светлые линии в спектре пламени всегда вызываются находящимся в нём натрием, поэтому темные линии D солнечного спектра позволяют заключить, что в атмосфере Солнца имеется натрий. Брюстер нашёл в спектре пламени селитры светлые линии на месте фраунгоферовых линий А, а, В; эти линии указывают на присутствие калия в солнечной атмосфере
![]()
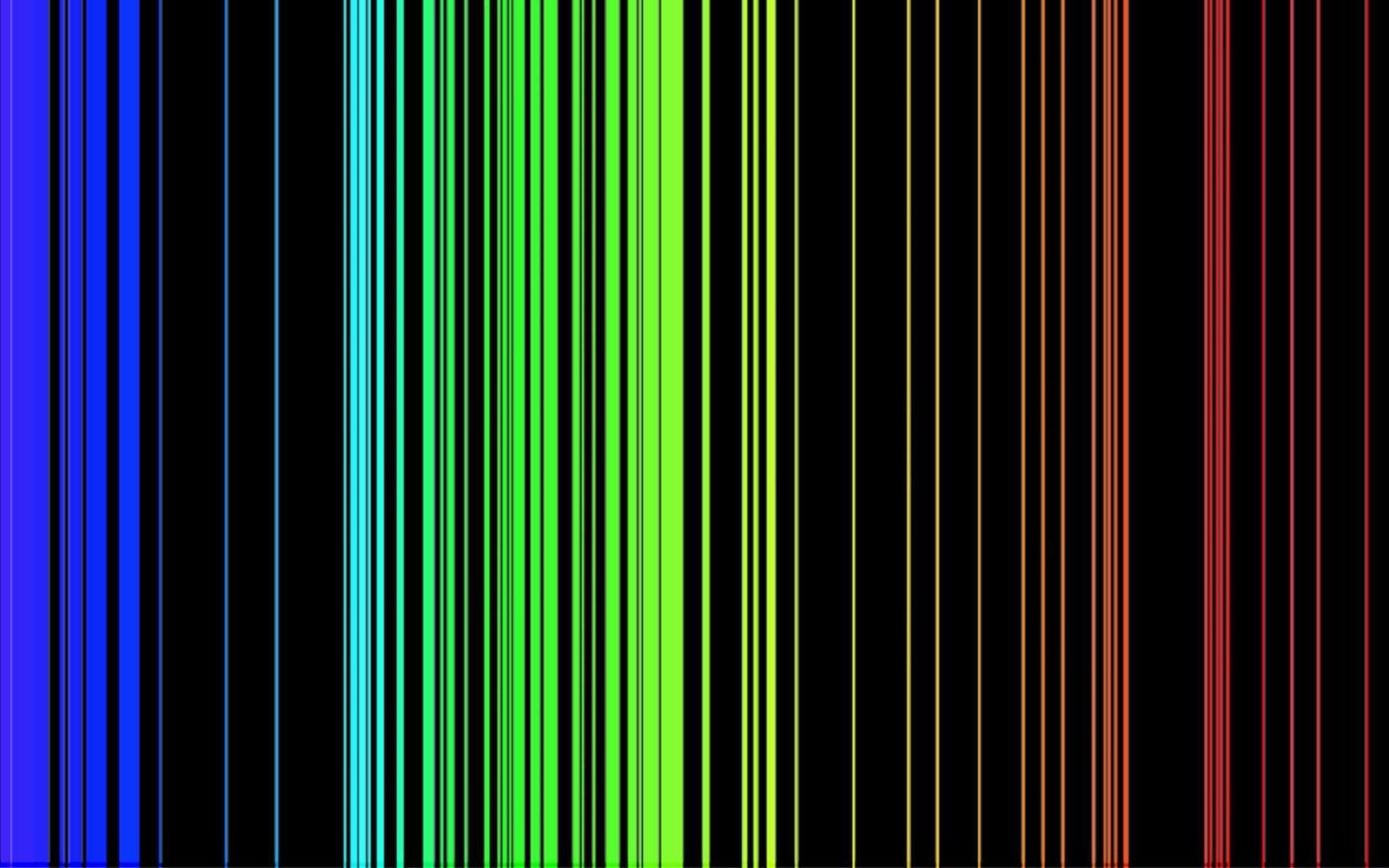
Оптический линейчатый эмиссионный спектр азота
Примечательно, что эта работа Кирхгофа неожиданно приобрела и философское значение: ранее, в 1842 году, основоположник позитивизма и социологии Огюст Конт в качестве примера непознаваемого привёл именно химический состав Солнца и звёзд:
Мы понимаем, как определить их форму, расстояния до них, их массу и их движения, но мы никогда не сможем ничего узнать об их химическом и минералогическом составе
— Огюст Конт, «Курс позитивной философии», Книга II, Глава I (1842)
Работа Кирхгофа позволила объяснить природу фраунгоферовых линий в спектре Солнца и определить химический (или, точнее, элементный) состав его атмосферы.
Фактически, спектральный анализ открыл новую эпоху в развитии науки — исследование спектров как наблюдаемых наборов значений функции состояния объекта или системы оказалось чрезвычайно плодотворным и, в конечном итоге, привело к появлению квантовой механики: Планк пришёл к идее кванта в процессе работы над теорией спектра абсолютно чёрного тела.
В 1910 году были получены первые неэлектромагнитные спектры: Дж. Дж. Томсон получил первые масс-спектры, а затем в 1919 году Астон построил первый масс-спектрометр.
С середины XX века, с развитием радиотехники, получили развитие радиоспектроскопические, в первую очередь магнитно-резонансные методы — спектроскопии ядерного магнитного резонанса (ЯМР-спектроскопия, являющаяся сейчас одним из основных методов установления и подтверждения пространственной структуры органических соединений), электронного парамагнитного резонанса (ЭПР), циклотронного резонанса (ЦР), ферромагнитного (ФР) и антиферромагнитного резонанса (АФР).
Другим направлением спектральных исследований, связанным с развитием радиотехники, стала обработка и анализ первоначально звуковых, а потом и любых произвольных сигналов.
См. также[править | править код]
- Спектроскопические методы
- Электронная спектроскопия
- Колебательная спектроскопия
- Атомно-эмиссионная спектрометрия
- Анализатор спектра
Примечания[править | править код]
- ↑ Isaac Newton. Draft of «A Theory Concerning Light and Colors» Архивная копия от 8 марта 2012 на Wayback Machine. Конец 1671 — начало 1672 годов
Литература[править | править код]
- Вавилов С. И. Принципы и гипотезы оптики Ньютона. Собрание сочинений. — М.: Изд-во АН СССР, 1956. — Т. 3.
- Тарасов К. И. Спектральные приборы. — Л.: Машиностроение, 1968.
- Gustav Kirchhoff, Robert Bunsen. Chemical Analysis by Observation of Spectra / Engl. translation from Annalen der Physik und der Chemie (Poggendorff), Vol. 110 (1860).
Ссылки[править | править код]
- Перенос излучения и спектры небесных тел
- Спектр Flash-приложение
Спектр излучения – это спектр излучения, испускаемого источником (этот термин также может обозначать характеристическую кривую, которая строится на его основе). Он представляет вклад различных излучений, составляющих это излучение, в зависимости от их длины волны.
С помощью спектрографа можно записать спектр излучения для последующего изучения. Излучающий спектр характерен для вида, который является его источником, и поэтому он позволяет идентифицировать его.
Непрерывные спектры
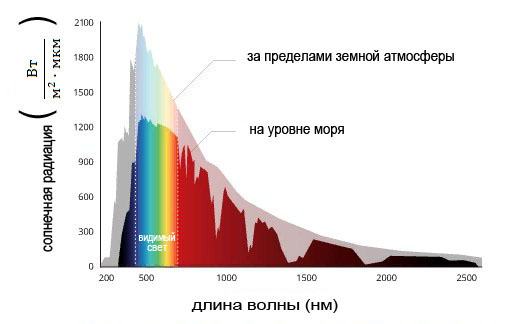
Спектр, полученный при разложении света, излучаемого Солнцем, называется “непрерывным спектром”. Он предлагает палитру всех цветов радуги, не прерываясь между ними. В более общем случае, свет, излучаемый телами под высоким давлением и при высокой температуре, имеет непрерывный спектр. Однако непрерывный спектр обычно содержит длину волны, для которой интенсивность сильнее, чем для остальных.
Определение этой конкретной длины волны позволяет установить температуру излучающего тела. Фактически, непрерывные спектры являются результатом излучения электронов, ускоренных тепловым возбуждением. Это называется “тепловым излучением”. Чем короче длина волны, тем выше температура.
Линейчатые спектры, полосные спектры
Свет, излучаемый газом при низком давлении, но при высокой температуре, со своей стороны, приводит к формированию линейчатого спектра. Он состоит из тонких и интенсивных линий, соответствующих определенным длинам волн и выделяющихся на черном фоне. Благодаря цвету и положению этих линий можно охарактеризовать атомы газа, излучающие анализируемый свет, поскольку они соответствуют переходам электронов между энергетическими уровнями атома.
Аналогично, спектры полос соответствуют переходам между полосами энергетических уровней. Они, в свою очередь, показывают природу молекул, из которых состоит излучающий газ.
Применение, связанное со спектром излучения: изучение звезд
Изучение спектров излучения, а также спектров поглощения позволяет получить информацию (температура, химический состав, физические характеристики) об источниках света. Так обстоит дело, например, со звездами, которые напрямую недоступны для экспериментов.
1.
Спектр излучения — это электромагнитное излучение всякого нагретого тела, наблюдаемое с помощью спектральных приборов.
Спектр поглощения — спектр, получающий при прохождении и поглощении электромагнитного излучения в веществе.
Спектральный анализ — метод исследования химического состава и физических характеристик небесных объектов, основанный на изучении их спектров.
Спектрограмма — фотографический снимок спектра небесного тела или график зависимости интенсивного изучения в зависимости от длины волны или частоты.
2.
Непрерывный (сплошной) спектр испускают все твёрдые тела, расплавленные металлы, светящиеся газы и пары, находящиеся под очень большим давлением.
Линейчатый спектр образуется при нахождении газа в атомарном состоянии и когда его давление мало отличается от нормального.
Спектральными линиями называют узкие участки спектра, на которых интенсивность излучения усилена либо ослаблена.
3.
- а) по спектру можно определить температуру звезды;
- б) по спектру можно определить химический состав звезды;
- в) по спектру можно определить характер рельефа поверхности планеты;
- г) по спектру можно определить звёздную величину и светимость звезды.
4.
Непрерывный спектр образует фотосфера, спектр поглощения — атмосфера.
5.
Закон смещения Вина записывается в виде формулы:
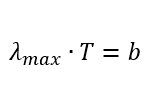
где буквами обозначены: λ — длина волны, которой соответствует максимум в распространении энергии; T — абсолютная температура; b — постоянная Вина.
Закон Вина можно применять не только для оптического диапазона электромагнитного излучения, но и для любого другого диапазона волн.
Мощность излучения абсолютно чёрного тела определяется законом Стефана—Больцмана, который записывается следующим образом:
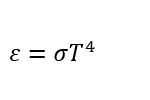
где буквами обозначены: ε — мощность излучения единицы поверхности нагретого тела; σ — постоянная Стефана—Больцмана; T — абсолютная температура.
При движении источника излучения относительно относительно наблюдателя возникает эффект Доплера. Сущность эффекта состоит в следующем: если источник излучения движется по лучу зрения наблюдателя со скоростью v (лучевая скорость), то вместо длины волны λ(0) (её излучает источник) наблюдатель фиксирует длину волны λ.
Лучевой скоростью называют проекцию пространственной скорости небесного объекта на луч зрения (на направление от объекта к наблюдателю).
Лучевая скорость связана со сдвигом спектральных линий формулой
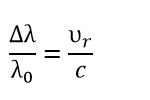
где λ0 — длина волны, которую излучает источник; Δλ — разность между λ и λ0; υr — лучевая скорость; c — скорость света.
6.

7.

Присоединяйтесь к Telegram-группе @superresheba_11,
делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!
From Wikipedia, the free encyclopedia

Emission spectrum of a ceramic metal halide lamp.

A demonstration of the 589 nm D2 (left) and 590 nm D1 (right) emission sodium D lines using a wick with salt water in a flame
The emission spectrum of a chemical element or chemical compound is the spectrum of frequencies of electromagnetic radiation emitted due to an electron making a transition from a high energy state to a lower energy state. The photon energy of the emitted photon is equal to the energy difference between the two states. There are many possible electron transitions for each atom, and each transition has a specific energy difference. This collection of different transitions, leading to different radiated wavelengths, make up an emission spectrum. Each element’s emission spectrum is unique. Therefore, spectroscopy can be used to identify elements in matter of unknown composition. Similarly, the emission spectra of molecules can be used in chemical analysis of substances.
Emission[edit]
In physics, emission is the process by which a higher energy quantum mechanical state of a particle becomes converted to a lower one through the emission of a photon, resulting in the production of light. The frequency of light emitted is a function of the energy of the transition.
Since energy must be conserved, the energy difference between the two states equals the energy carried off by the photon. The energy states of the transitions can lead to emissions over a very large range of frequencies. For example, visible light is emitted by the coupling of electronic states in atoms and molecules (then the phenomenon is called fluorescence or phosphorescence). On the other hand, nuclear shell transitions can emit high energy gamma rays, while nuclear spin transitions emit low energy radio waves.
The emittance of an object quantifies how much light is emitted by it. This may be related to other properties of the object through the Stefan–Boltzmann law.
For most substances, the amount of emission varies with the temperature and the spectroscopic composition of the object, leading to the appearance of color temperature and emission lines. Precise measurements at many wavelengths allow the identification of a substance via emission spectroscopy.
Emission of radiation is typically described using semi-classical quantum mechanics: the particle’s energy levels and spacings are determined from quantum mechanics, and light is treated as an oscillating electric field that can drive a transition if it is in resonance with the system’s natural frequency. The quantum mechanics problem is treated using time-dependent perturbation theory and leads to the general result known as Fermi’s golden rule. The description has been superseded by quantum electrodynamics, although the semi-classical version continues to be more useful in most practical computations.
Origins[edit]
When the electrons in the atom are excited, for example by being heated, the additional energy pushes the electrons to higher energy orbitals. When the electrons fall back down and leave the excited state, energy is re-emitted in the form of a photon. The wavelength (or equivalently, frequency) of the photon is determined by the difference in energy between the two states. These emitted photons form the element’s spectrum.
The fact that only certain colors appear in an element’s atomic emission spectrum means that only certain frequencies of light are emitted. Each of these frequencies are related to energy by the formula:
where 


This concludes that only photons with specific energies are emitted by the atom. The principle of the atomic emission spectrum explains the varied colors in neon signs, as well as chemical flame test results (described below).
The frequencies of light that an atom can emit are dependent on states the electrons can be in. When excited, an electron moves to a higher energy level or orbital. When the electron falls back to its ground level the light is emitted.

The above picture shows the visible light emission spectrum for hydrogen. If only a single atom of hydrogen were present, then only a single wavelength would be observed at a given instant. Several of the possible emissions are observed because the sample contains many hydrogen atoms that are in different initial energy states and reach different final energy states. These different combinations lead to simultaneous emissions at different wavelengths.

Emission spectrum of iron
Radiation from molecules[edit]
As well as the electronic transitions discussed above, the energy of a molecule can also change via rotational, vibrational, and vibronic (combined vibrational and electronic) transitions. These energy transitions often lead to closely spaced groups of many different spectral lines, known as spectral bands. Unresolved band spectra may appear as a spectral continuum.
Emission spectroscopy[edit]
Light consists of electromagnetic radiation of different wavelengths. Therefore, when the elements or their compounds are heated either on a flame or by an electric arc they emit energy in the form of light. Analysis of this light, with the help of a spectroscope gives us a discontinuous spectrum. A spectroscope or a spectrometer is an instrument which is used for separating the components of light, which have different wavelengths. The spectrum appears in a series of lines called the line spectrum. This line spectrum is called an atomic spectrum when it originates from an atom in elemental form. Each element has a different atomic spectrum. The production of line spectra by the atoms of an element indicate that an atom can radiate only a certain amount of energy. This leads to the conclusion that bound electrons cannot have just any amount of energy but only a certain amount of energy.
The emission spectrum can be used to determine the composition of a material, since it is different for each element of the periodic table. One example is astronomical spectroscopy: identifying the composition of stars by analysing the received light.
The emission spectrum characteristics of some elements are plainly visible to the naked eye when these elements are heated. For example, when platinum wire is dipped into a sodium nitrate solution and then inserted into a flame, the sodium atoms emit an amber yellow color. Similarly, when indium is inserted into a flame, the flame becomes blue. These definite characteristics allow elements to be identified by their atomic emission spectrum. Not all emitted lights are perceptible to the naked eye, as the spectrum also includes ultraviolet rays and infrared radiation.
An emission spectrum is formed when an excited gas is viewed directly through a spectroscope.

Emission spectroscopy is a spectroscopic technique which examines the wavelengths of photons emitted by atoms or molecules during their transition from an excited state to a lower energy state. Each element emits a characteristic set of discrete wavelengths according to its electronic structure, and by observing these wavelengths the elemental composition of the sample can be determined. Emission spectroscopy developed in the late 19th century and efforts in theoretical explanation of atomic emission spectra eventually led to quantum mechanics.
There are many ways in which atoms can be brought to an excited state. Interaction with electromagnetic radiation is used in fluorescence spectroscopy, protons or other heavier particles in Particle-Induced X-ray Emission and electrons or X-ray photons in Energy-dispersive X-ray spectroscopy or X-ray fluorescence. The simplest method is to heat the sample to a high temperature, after which the excitations are produced by collisions between the sample atoms. This method is used in flame emission spectroscopy, and it was also the method used by Anders Jonas Ångström when he discovered the phenomenon of discrete emission lines in the 1850s.[1]
Although the emission lines are caused by a transition between quantized energy states and may at first look very sharp, they do have a finite width, i.e. they are composed of more than one wavelength of light. This spectral line broadening has many different causes.
Emission spectroscopy is often referred to as optical emission spectroscopy because of the light nature of what is being emitted.
History[edit]
In 1756 Thomas Melvill observed the emission of distinct patterns of colour when salts were added to alcohol flames.[2] By 1785 James Gregory discovered the principles of diffraction grating and American astronomer David Rittenhouse made the first engineered diffraction grating.[3][4] In 1821 Joseph von Fraunhofer solidified this significant experimental leap of replacing a prism as the source of wavelength dispersion improving the spectral resolution and allowing for the dispersed wavelengths to be quantified.[5]
In 1835, Charles Wheatstone reported that different metals could be distinguished by bright lines in the emission spectra of their sparks, thereby introducing an alternative to flame spectroscopy.[6][7]
In 1849, J. B. L. Foucault experimentally demonstrated that absorption and emission lines at the same wavelength are both due to the same material, with the difference between the two originating from the temperature of the light source.[8][9]
In 1853, the Swedish physicist Anders Jonas Ångström presented observations and theories about gas spectra.[10] Ångström postulated that an incandescent gas emits luminous rays of the same wavelength as those it can absorb. At the same time George Stokes and William Thomson (Kelvin) were discussing similar postulates.[8] Ångström also measured the emission spectrum from hydrogen later labeled the Balmer lines.[11][12]
In 1854 and 1855, David Alter published observations on the spectra of metals and gases, including an independent observation of the Balmer lines of hydrogen.[13][14]
By 1859, Gustav Kirchhoff and Robert Bunsen noticed that several Fraunhofer lines (lines in the solar spectrum) coincide with characteristic emission lines identified in the spectra of heated elements.[15][16] It was correctly deduced that dark lines in the solar spectrum are caused by absorption by chemical elements in the solar atmosphere.[17]
Experimental technique in flame emission spectroscopy[edit]
The solution containing the relevant substance to be analysed is drawn into the burner and dispersed into the flame as a fine spray. The solvent evaporates first, leaving finely divided solid particles which move to the hottest region of the flame where gaseous atoms and ions are produced through the dissociation of molecules. Here electrons are excited as described above, and the spontaneously emit photon to decay to lower energy states. It is common for a monochromator to be used to allow for easy detection.
On a simple level, flame emission spectroscopy can be observed using just a flame and samples of metal salts. This method of qualitative analysis is called a flame test. For example, sodium salts placed in the flame will glow yellow from sodium ions, while strontium (used in road flares) ions color it red. Copper wire will create a blue colored flame, however in the presence of chloride gives green (molecular contribution by CuCl).
Emission coefficient[edit]
Emission coefficient is a coefficient in the power output per unit time of an electromagnetic source, a calculated value in physics. The emission coefficient of a gas varies with the wavelength of the light. It has units of ms−3sr−1.[18] It is also used as a measure of environmental emissions (by mass) per MWh of electricity generated, see: Emission factor.
Scattering of light[edit]
In Thomson scattering a charged particle emits radiation under incident light. The particle may be an ordinary atomic electron, so emission coefficients have practical applications.
If X dV dΩ dλ is the energy scattered by a volume element dV into solid angle dΩ between wavelengths λ and λ + dλ per unit time then the Emission coefficient is X.
The values of X in Thomson scattering can be predicted from incident flux, the density of the charged particles and their Thomson differential cross section (area/solid angle).
Spontaneous emission[edit]
A warm body emitting photons has a monochromatic emission coefficient relating to its temperature and total power radiation. This is sometimes called the second Einstein coefficient, and can be deduced from quantum mechanical theory.
See also[edit]
- Absorption spectroscopy
- Absorption spectrum
- Atomic spectral line
- Electromagnetic spectroscopy
- Gas-discharge lamp, Table of emission spectra of gas discharge lamps
- Isomeric shift
- Isotopic shift
- Luminous coefficient
- Plasma physics
- Rydberg formula
- Spectral theory
- The Diode equation includes the emission coefficient (which is not related to the one discussed here)
- Thermionic emission
References[edit]
- ^ Incorporated, SynLube. “Spectroscopy Oil Analysis”. www.synlube.com. Retrieved 2017-02-24.
- ^ Melvill, Thomas (1756). “Observations on light and colours”. Essays and Observations, Physical and Literary. Read Before a Society in Edinburgh. 2: 12–90. ; see pp. 33–36.
- ^ See:
- Frauhofer. Jos. (1821) “Neue Modifikation des Lichtes durch gegenseitige Einwirkung und Beugung der Strahlen, und Gesetze derselben” (New modification of light by the mutual influence and the diffraction of [light] rays, and the laws thereof), Denkschriften der Königlichen Akademie der Wissenschaften zu München (Memoirs of the Royal Academy of Science in Munich), 8: 3–76.
- Fraunhofer, Jos. (1823) “Kurzer Bericht von den Resultaten neuerer Versuche über die Gesetze des Lichtes, und die Theorie derselben” (Short account of the results of new experiments on the laws of light, and the theory thereof) Annalen der Physik, 74(8): 337–378.
- ^ Parker AR (March 2005). “A geological history of reflecting optics”. Journal of the Royal Society, Interface. 2 (2): 1–17. doi:10.1098/rsif.2004.0026. PMC 1578258. PMID 16849159.
- ^ OpenStax Astronomy, “Spectroscopy in Astronomy”. OpenStax CNX. Sep 29, 2016 http://cnx.org/contents/1f92a120-370a-4547-b14e-a3df3ce6f083@3

- ^ Brian Bowers (2001). Sir Charles Wheatstone FRS: 1802-1875 (2nd ed.). IET. pp. 207–208. ISBN 978-0-85296-103-2.
- ^ Wheatstone (1836). “On the prismatic decomposition of electrical light”. Report of the Fifth Meeting of the British Association for the Advancement of Science; Held at Dublin in 1835. Notices and Abstracts of Communications to the British Association for the Advancement of Science, at the Dublin Meeting, August 1835. London, England: John Murray. pp. 11–12.
- ^ a b Brand, pp. 60-62
- ^ See:
- Foucault, L. (1849). “Lumière électrique” [Electric light]. Société Philomatique de Paris. Extraits des Procès-Verbaux de Séances. (in French). 13: 16–20.
- Foucault, L. (7 February 1849). “Lumière électrique” [Electric light]. L’Institut, Journal Universel des Sciences (in French). 17 (788): 44–46.
- ^ See:
- Ångström, A.J. (1852). “Optiska undersökningar” [Optical investigations]. Kongliga Vetenskaps-Akademiens Handlingar [Proceedings of the Royal Academy of Science] (in Swedish). 40: 333–360.
- Ångström, A.J. (1855a). “Optische Untersuchungen” [Optical investigations]. Annalen der Physik und Chemie (in German). 94: 141–165.
- Ångström, A.J. (1855b). “Optical researches”. Philosophical Magazine. 4th series. 9: 327–342. doi:10.1080/14786445508641880.
- ^ Wagner, H. J. (2005). “Early Spectroscopy and the Balmer Lines of Hydrogen”. Journal of Chemical Education. 82 (3): 380. Bibcode:2005JChEd..82..380W. doi:10.1021/ed082p380.1.
- ^ (Ångström, 1852), p. 352 ; (Ångström, 1855b), p. 337.
- ^ Retcofsky, H. L. (2003). “Spectrum Analysis Discoverer?”. Journal of Chemical Education. 80 (9): 1003. Bibcode:2003JChEd..80.1003R. doi:10.1021/ed080p1003.1.
- ^ See:
- Alter, David (1854). “On certain physical properties of light, produced by the combustion of different metals, in the electric spark, refracted by a prism”. The American Journal of Science and Arts. 2nd series. 18: 55–57.
- Alter, D. (1855). “On certain physical properties of the light of the electric spark, within certain gases, as seen through a prism”. The American Journal of Science and Arts. 2nd series. 19: 213–214. Alter’s observations of hydrogen’s optical spectrum appear on p. 213.
- ^ See:
- Gustav Kirchhoff (1859) “Ueber die Fraunhofer’schen Linien” (On Fraunhofer’s lines), Monatsbericht der Königlichen Preussische Akademie der Wissenschaften zu Berlin (Monthly report of the Royal Prussian Academy of Sciences in Berlin), 662–665.
- Gustav Kirchhoff (1859) “Ueber das Sonnenspektrum” (On the sun’s spectrum), Verhandlungen des naturhistorisch-medizinischen Vereins zu Heidelberg (Proceedings of the Natural History / Medical Association in Heidelberg), 1 (7) : 251–255.
- ^ G. Kirchhoff (1860). “Ueber die Fraunhofer’schen Linien”. Annalen der Physik. 185 (1): 148–150. Bibcode:1860AnP…185..148K. doi:10.1002/andp.18601850115.
- ^ G. Kirchhoff (1860). “Ueber das Verhältniss zwischen dem Emissionsvermögen und dem Absorptionsvermögen der Körper für Wärme und Licht”. Annalen der Physik. 185 (2): 275–301. Bibcode:1860AnP…185..275K. doi:10.1002/andp.18601850205.
- ^ Carroll, Bradley W. (2007). An Introduction to Modern Astrophysics. CA, USA: Pearson Education. p. 256. ISBN 978-0-8053-0402-2.
External links[edit]
- Emission spectra of atmospheric gases
- NIST Physical Reference Data—Atomic Spectroscopy Databases
- Color Simulation of Element Emission Spectrum Based on NIST data
- Hydrogen emission spectrum
Ни один из источников не дает монохроматического света, т.е. света строго определенной длины волны. В этом можно убедиться на опытах по разложению света в спектр с помощью призмы, а также опыты по интерференции и дифракции.
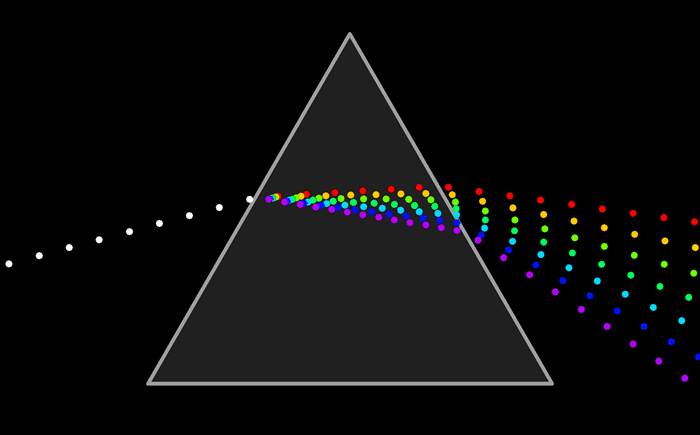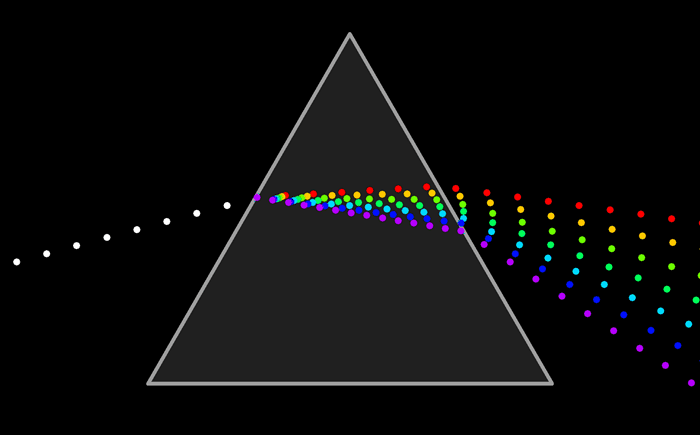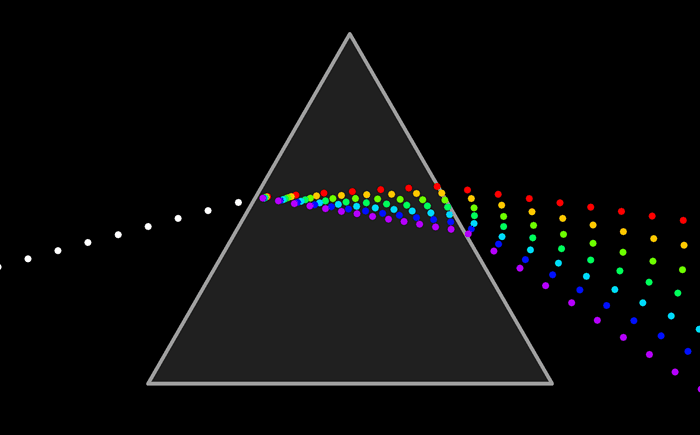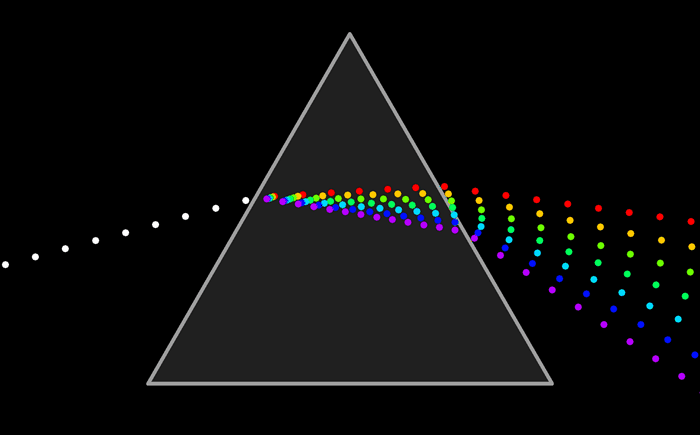
Та энергия, которую несет с собой свет от источника, определенным образом распределена по волнам всех длин, входящим в состав светового пучка.
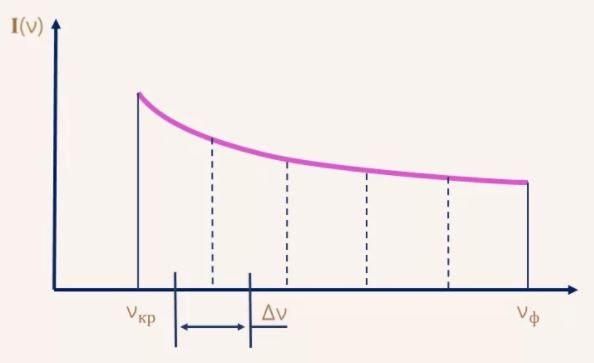
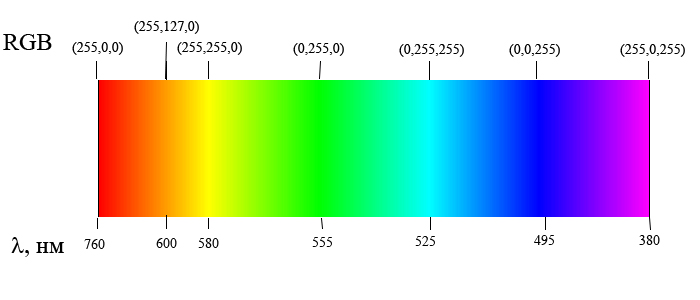
Для характеристики распределения излучения по частотам нужно ввести новую величину: интенсивность, приходящуюся на единичный интервал частот. Эту величину называют спектральной плотностью интенсивности излучения.
Спектральную плотность потока излучения можно найти экспериментально. Для этого надо с помощью призмы получить спектр излучения, например, электрической дуги, и измерить плотность потока излучения, приходящегося на небольшие спектральные интервалы шириной Δν.
Полагаться на глаз при оценке распределения энергии нельзя. Глаз обладает избирательной чувствительностью к свету: максимум его чувствительности лежит в желто-зеленой области спектра. Лучше всего воспользоваться свойством черного тела почти полностью поглощать свет всех длин волн. При этом энергия излучения (т.е. света) вызывает нагревание тела. Поэтому достаточно измерить температуру тела и по ней судить о количестве поглощенной в единицу времени энергии.
Спектры излучения
Спектральный состав излучения атомов различных веществ весьма разнообразен. Тем не менее, все спектры можно разделить на три сильно отличающихся друг от друга типа.
Сплошной (непрерывный) спектр
Накаленные твердые и жидкие тела и газы (при большом давлении) испускают свет, разложение которого дает сплошной спектр, в котором спектральные цвета непрерывно переходят один в другой. Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и взаимодействием атомов друг с другом. Сплошные спектры одинаковы для разных веществ, и поэтому их нельзя использовать для определения состава вещества.
Линейчатый (атомный) спектр
Возбужденные атомы разреженных газов или паров испускают свет, разложение которого дает линейчатый спектр,состоящий из отдельных цветных линий. Каждый химический элемент имеет характерный для него линейчатый спектр. Атомы таких веществ не взаимодействуют друг с другом и излучают свет только определенных длин волн. Изолированные атомы данного химического элемента излучают строго определенные длины волн. Это позволяет по спектральным линиям судить о химическом составе источника света.

Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом. При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Молекулярный (полосатый) спектр
Спектр молекулы состоит из большого числа отдельных линий, сливающихся в полосы, четкие с одного края и размытые с другого. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом. Серии очень близких линий группируются на отдельных участках спектра и заполняют целые полосы.
В 1860 г. немецкие ученые Г. Кирхгоф и Р. Бунзен, изучая спектры металлов, установили следующие факты:
1) каждый металл имеет свой спектр;
2) спектр каждого металла строго постоянен;
3) введение в пламя горелки любой соли одного и того же металла всегда приводит к появлению одинакового спектра;
4) при внесении в пламя смеси солей нескольких металлов в спектре одновременно появляются все их линии;
5) яркость спектральных линий зависит от концентрации элемента в данном веществе.
Спектры поглощения
Если белый свет от источника, дающей сплошной спектр, пропускается через пары исследуемого вещества и затем разлагается в спектр, то на фоне сплошного спектра наблюдаются темные линии поглощения в тех же самых местах, где находились бы линии спектра испускания паров исследуемого элемента. Такие спектры получили название атомных спектров поглощения.
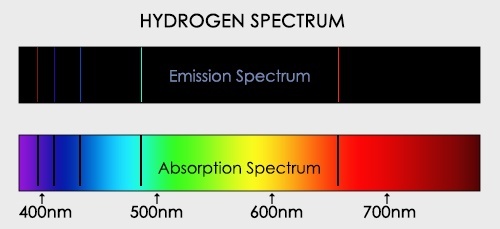
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Атомы поглощают излучение лишь тех длин волн, которые они могут испускать при данной температуре.
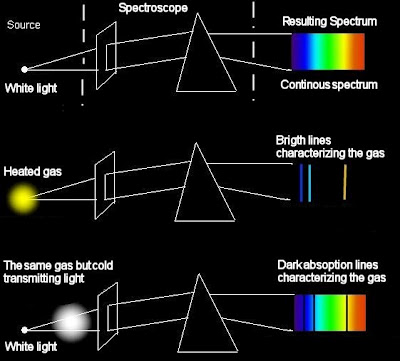
Спектральный анализ
Спектральным анализом называется метод изучения химического состава вещества, основанный на исследовании его спектров. Отдельные линии в спектрах различных элементов могут совпадать, но в целом спектр каждого элемента является его индивидуальной характеристикой.
Спектральный анализ сыграл большую роль в науке. Например, в спектре Солнца (1814) были открыты фраунгоферовы темные линии, происхождение которых объясняется следующим образом. Солнце, являясь раскаленным газовым шаром (Т ~ 6000 °С), испускает сплошной спектр. Солнечные лучи проходят через атмосферу Солнца (солнечную корону, температура которой ~2000— 3000 °С. Корона поглощает из сплошного спектра излучение определенной частоты, а на Земле регистрируется солнечный спектр поглощения, по которому можно определить, какие химические элементы присутствуют в короне Солнца. По спектрам поглощения на Солнце были обнаружены все земные элементы, а также неизвестный ранее элемент, который назвали гелий. Через 26 лет (1894) открыли гелий на Земле. Благодаря спектральному анализу на Земле было открыто еще 25 химических элементов.
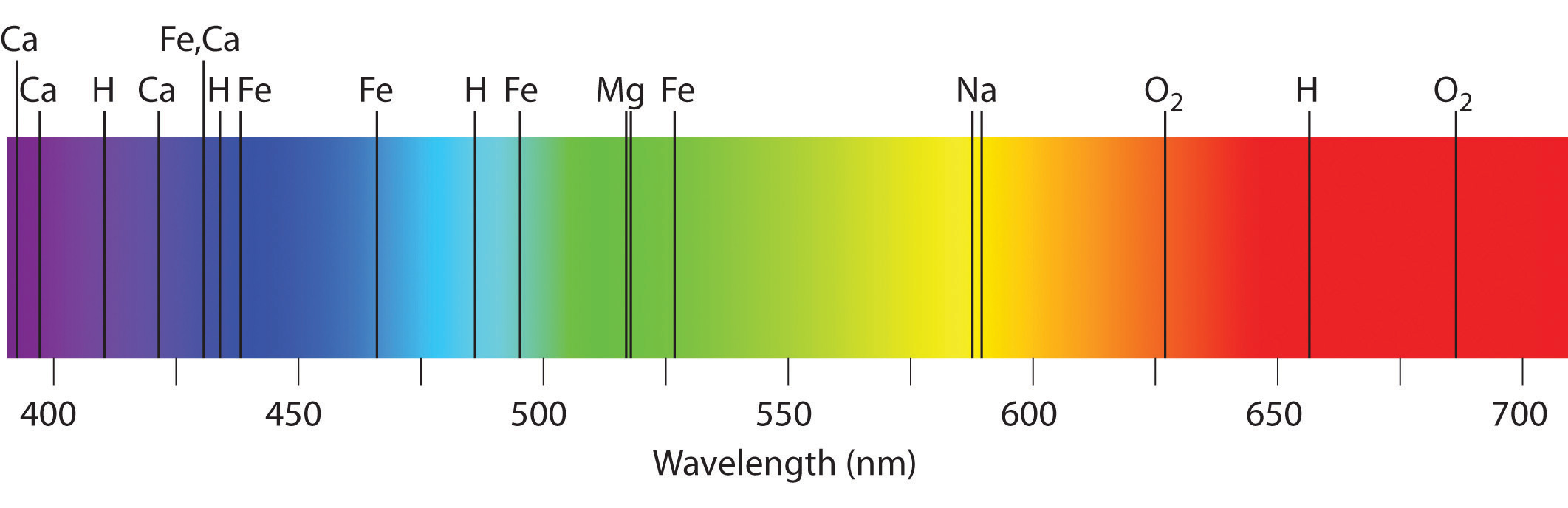
Фраунгоферовы линии дают информацию не только о химическом составе звезды, но и о ее температуре и давлении на поверхности. Более того, спектральный анализ Солнца и звезд показал, что входящие в их состав химические элементы имеются и на Земле, т.е. вещество Вселенной состоит из одного и того же набора элементов.
Спектральные аппараты
Спектроскопом называется прибор, с помощью которого визуально исследуется спектральный состав света, испускаемого некоторым источником. Если регистрация спектра происходит на фотопластинке, то прибор называется спектрографом.
Для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма, уже недостаточны. Необходимы приборы, дающие четкий спектр, т.е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма или дифракционная решетка.
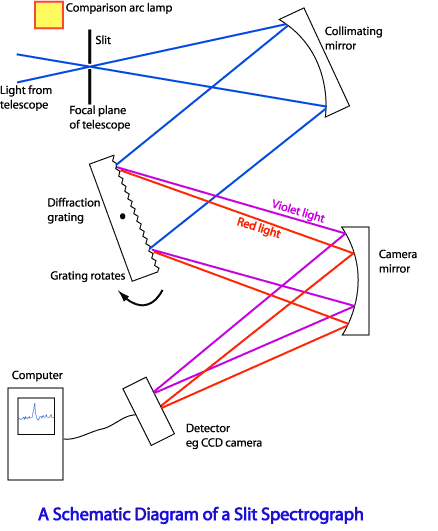
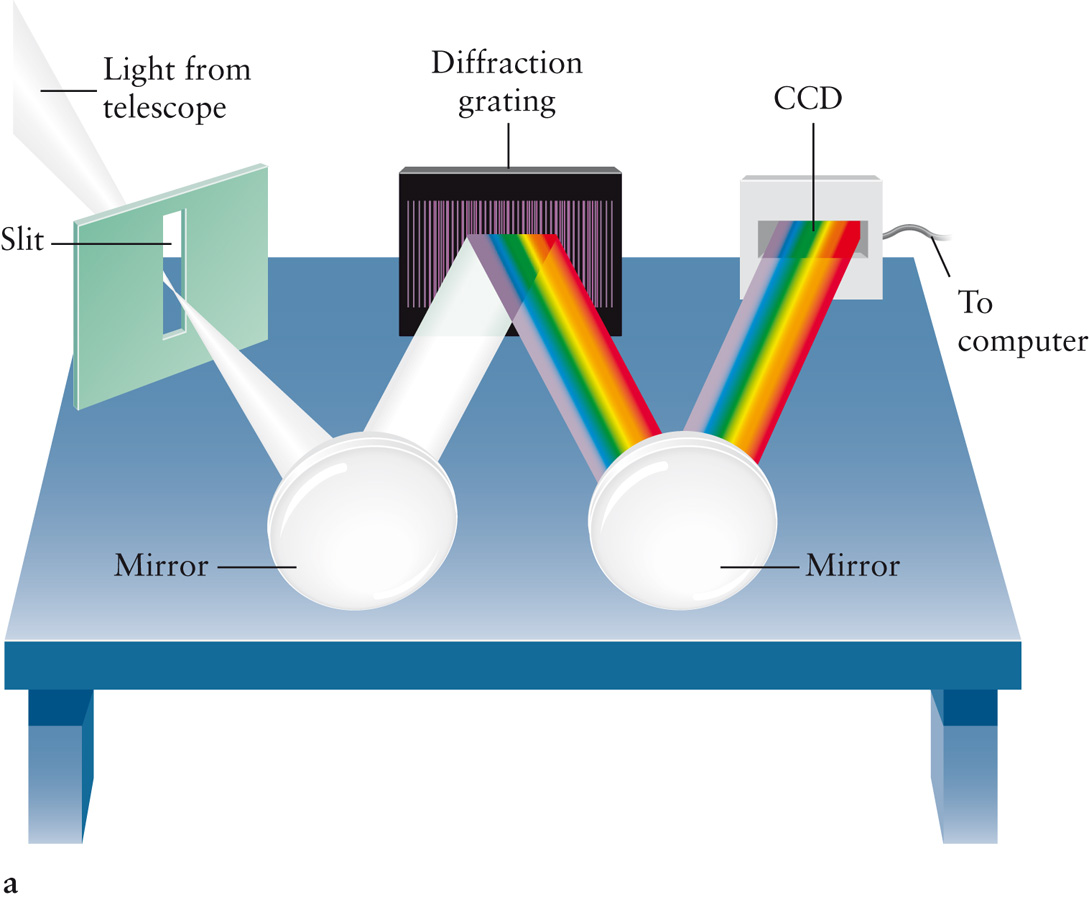
Рассмотрим схему устройства призменного спектрального аппарата. Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором. Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом – собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран – матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр.
Описанный прибор называется спектрографом. Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом.
Применение спектрального анализа
Линейчатые спектры играют особо важную роль, потому что их структура прямо связана со строением атома. Ведь эти спектры создаются атомами, не испытывающими внешних воздействий. Состав сложных, главным образом органических смесей анализируется по их молекулярным спектрам.
С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если даже его масса не превышает 10-10г. Линии, присущие данному элементу, позволяют качественно судить о его наличии. Яркость линий дает возможность (при соблюдении стандартных условий возбуждения) количественно судить о наличии того или иного элемента.
Спектральный анализ можно проводить и по спектрам поглощения. В астрофизике по спектрам можно определить многие физические характеристики объектов: температуру, давление, скорость движения, магнитную индукцию и др. с помощью спектрального анализа определяют химический состав руд и минералов.
Основные направления применения спектрального анализа таковы: физико-химические исследования; машиностроение, металлургия; атомная индустрия; астрономия, астрофизика; криминалистика.
Современные технологии создания новейших строительных материалов (металлопластиковые, пластиковые) непосредственно взаимосвязаны с такими фундаментальными науками как химия, физика. Данные науки используют современные методы исследования веществ. Поэтому спектральный анализ можно применять для определения химического состав состава строительных материалов по их спектрам.
Статья про солнечный спектр