Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
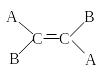
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.

2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан ![]() имеет три структурные формулы изомеров:
имеет три структурные формулы изомеров:

Изомерия положения кратной связи
При общей формуле ![]() пентен имеет два изомера, различающихся расположением двойной связи:
пентен имеет два изомера, различающихся расположением двойной связи:
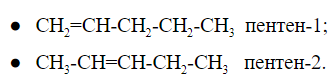
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
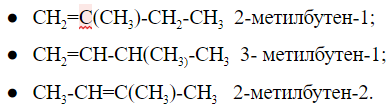
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
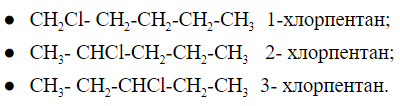
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
![]() бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:

Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу ![]() имеют два вещества:
имеют два вещества:
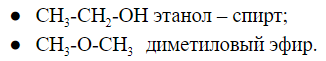
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
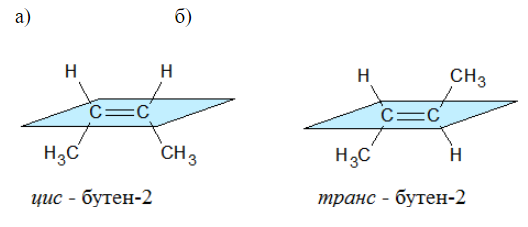
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-![]() :
:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
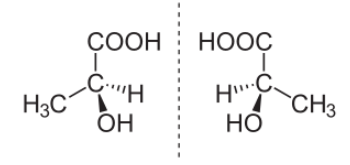
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.

Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Органическая химия — раздел, который вызывает больше всего вопросов. Сложность заключается в первую очередь в огромном количестве веществ: ученым известно более миллиона. Но не нужно пугаться. В органике соединения поделены на классы, свойства внутри которых очень похожи. Выучив общие реакции для каждой группы веществ, вы сможете с легкостью решать задания. Первая тема в рамках подготовки к ЕГЭ — изомерия и номенклатура органических соединений. В статье мы разберем основы этого раздела. Более подробно материал рассматривается на подготовительных курсах. Там изучаются все сложные вопросы органической химии, поэтому выпускники набирают высокие баллы на ЕГЭ.
Изомерия
Первый вопрос, который мы рассмотрим — изомерия органических соединений в химии. Под этим термином понимают явление существования веществ-изомеров. Изомеры — это соединения, имеющие одинаковый качественный и количественный состав (то есть молекулярную формулу), но разное строение и свойства (то есть структурную формулу).
Для начала разберемся в формулах органических соединений. Молекулярная показывает только тип атомов и их количество. Например, C5H10OH. Структурная отражает взаимное расположение атомов в молекуле. Приведенная молекулярная формула может принадлежать сразу нескольким веществам, так как гидроксильная группа может располагаться у разных атомов. Под формулой может скрываться пентанол-1 CH3-CH2-CH2-CH2-CH2-OH, пентанол-2 CH3-CH2-CH2-CH(OH)-CH3 или пентанол-3 CH3-CH2-CH(OH)-CH2-CH3. Эти вещества, имеющие разное взаимное расположение атомов, и называются изомерами.
Различают два вида изомерии — пространственную и структурную. Структурная изомерия подразумевает различный порядок расположения атомов в молекуле. Делится на несколько типов:
- углеродного скелета. Различное расположение радикалов в молекуле: СН3– СН2-СН2-СН2-CH3 (н-пентан) и СН3-СН2-СН(CH3)-CH3 (2-метилбутан);
- положения кратной связи. Двойные и тройные связи могут располагаться у разных атомов. Изомерами являются бутен-1 СН2=СН-СН2-СН3 и бутен-2 СН3-СН=СН2-СН3;
- положения функциональной группы. Пример — уже рассмотренный выше пентанол;
- межклассовая. Иногда под одной формулой скрываются вещества разных классов. Такими изомерами являются алкины и алкадиены, алкены и циклоалканы, спирты и простые эфиры, альдегиды и кетоны, сложные эфиры и карбоновые кислоты. Пример: метилацетат CH3-COO-CH3 и пропановая кислота CH3-CH2-COOH;
- взаимного расположения заместителей. Характерна для циклических соединений (аренов, циклоалканов, циклов с кратными связями). Когда в кольцо вносится второй заместитель, он может располагаться в одном из трех положений: орто (у соседних атомов углерода), мета (через один атом) и пара (напротив друг друга). Это касается ароматических соединений. В циклоалканах заместители обозначают цифрами, например, 1,2-диметилциклобутан;
- метамерия. Связана с разным положением гетероатома в молекуле. Гетероатом — это азот, сера, кислород. Такими изомерами могут быть амины, например, этиламин СН3–СН2–NH2 и диметиламин СН3–NH–СН3;
- таутомерия. Это явление, при котором два изомера легко переходят друг в друга. В таком случае вещество состоит сразу из нескольких молекул, устанавливается равновесие, которое смещается под действием внешних факторов. Пример веществ — пропанон и пропенол-2.
Вторым типом изомерии в органике является пространственная. Она связана с различным взаимным расположением атомов в молекуле. При этом сама структура остается прежней. Оптическая изомерия возникает при вращении атомов вокруг кратной связи. Она характерна для алкенов и алкинов. Аналогичное явление обнаружено у циклов с несколькими заместителями. В цис-изомерах одинаковые группы атомов расположены по одну сторону кратной связи или цикла, в транс — по разные стороны.
Оптическая изомерия характеризуется различным расположением молекул относительно одного атома. Это должен быть ассиметричный углерод — с четырьмя разными заместителями. Он называется хиральным центром. Изомеры являются зеркальным отражением друг друга, как правая и левая рука. Это дает им разные химические свойства.
Номенклатура
Переходим к классификации и номенклатуре органических соединений в химии. В рамках этой темы нужно понимать, какие классы соединений существуют и как их называть. В органике используется систематическая номенклатура ИЮПАК. Основа названия — корень, обозначающий самую длинную углеродную цепь. Первые 10 веществ в гомологическом ряду:
-
С1 — мет-;
-
С2 — эт-;
-
С3 — проп-;
-
С4 — бут-;
-
С5 — пент-;
-
С6 — гекс-;
-
С7 — гепт-;
-
С8 — окт-;
-
С9 — нон-;
-
С10 — дек-.
Далее идет суффикс. Самая простая номенклатура у углеводородов. Алканы имеют суффикс -ан (пропан), алкены — -ен (пропен), алкины — -ин (пропин). Если кратных связей 2 и больше, перед суффиксом добавляется соответствующая цифра — ди, три, тетра, пента и т.д. (бутадиен). У циклических соединений добавляется приставка цикло- (циклопропан). Суффиксами обозначают также наличие заместителей. Для этого используется -ил (этил). Расположение заместителя указывается цифрой, реже используются греческие буквы альфа, бета, гамма. Важный момент: за начало цепочки берется тот конец, у которого ближе кратная связь. Если ее нет, то учитывается близость заместителя. Названия аренов исходят от первого представителя — бензола. К нему добавляются соответствующие заместители, например, 1,2-диметилбензол.
В номенклатуру органических соединений в химии входят и функциональные группы. При нумерации атомов за начало принимается тот конец, ближе к которому располагается группа. Самая старшая указывается в суффиксе, остальные в приставке. Обозначения групп в порядке старшинства:
|
Класс |
Формула |
Название в приставке |
Название в суффиксе |
Пример |
|
Карбоновые кислоты |
-COOH |
карбокси- |
-овая кислота |
CH3COOH этановая кислота карбоксиэтан |
|
Сульфокислоты |
-SO3H |
сульфо- |
-сульфокислота |
CH3-SO3H Сульфометан Метилсульфокислота |
|
Нитрил |
-CN |
циано- |
-нитрил |
CH3-CN цианометан метилнитрил |
|
Альдегиды |
-CHO |
оксо- |
-аль |
CH3-CHO этаналь 1-оксоэтан |
|
Кетоны |
-CO |
оксо- |
-он |
CH3-CO-CH3 пропанон 2-оксопропан |
|
Спирты |
-OH |
гидрокси- |
-ол |
CH3OH метанол гидроксиметан |
|
Амины |
-NH2 |
амино- |
-амин |
CH3-CH2-NH2 этиламин аминоэтан |
|
Простые эфиры |
-OR |
алкокси- |
— |
CH3-O-CH3 алкоксиэтан |
|
Галогениды |
-F, -Cl, -Br, -I |
фтор-, хлор-, бром-, йод- |
-фторид, -хлорид, -бромид, -йодид |
CH3-Cl метилхлорид хлорметан |
|
Нитросоединения |
-NO2 |
нитро- |
— |
CH3-NO2 Нитрометан |
Пример названия
Мы разобрали изомерию и номенклатуру. Попробуем назвать сложное органическое вещество.
-
Определяем главную цепь. В этом случае возьмем за основу бензольное кольцо. У него есть группа -OH, поэтому в названии можем использовать корень -фенол.
-
Нумеруем атомы. Первым будет углерод с группой -OH, потому что мы взяли за основу фенол. Старшим заместителем является карбоксильная группа, но она находится напротив, то есть на равном расстоянии с обеих сторон. Следующий по старшинству заместитель — CH2Cl, он будет вторым. Далее идем по циклу.
-
Называем все заместители. CH2Cl — хлорметил, CH2-CH2-COOH — карбоксипропил, NO2 — нитрогруппа.
-
Записываем название соединения. Все группы указываются в алфавитном порядке. Не забываем указывать, около какого атома они стоят: 4-карбоксипропил-5-нитро-2-хлорметилфенол.
Итак, мы разобрались в классификации, изомерии и номенклатуре органических соединений. Это основы химии, поэтому представленный материал нужно знать наизусть. Обязательно решайте типовые задания из ЕГЭ по химии и тренируйтесь называть сложные вещества. Тема показалась вам трудной? Запишитесь на подготовительные курсы. Там преподаватели ответят на вопросы и разберут все сложные моменты. Желаем вам успехов на итоговой аттестации!
Изомерия органических соединений
Изомерия –
явление существования изомеров,
веществ, имеющих одинаковую молекулярную
формулу, но разное химическое строение
(разные структурные формулы), и по этой
причине различающихся по физическим
или химическим свойствам.
Различают два
основных типа изомерии – структурную
и
пространственную.
Структурная
изомерия:
1. Изомерия
углеродного скелета,
обусловленная различным порядком связи
атомов углерода.
Например, циклобутан
и метилциклопропан:
|
|
|
|
Циклобутан |
Метилциклопропан |
2. Изомерия
положения,
обусловленная различным положением
функциональных групп или кратных связей
при одинаковом углеродном скелета:
|
|
|
|
|
|
бутанол-1 |
бутанол-2 |
бутен-1 |
бутен-2 |
Разновидность
этого вида изомерии – существование
соединений с различным взаимным
расположением функциональных групп
или кратных связей (т.н. изомерия взаимного
расположения), например
|
|
|
|
ά-аминопропионовая кислота |
β-аминопропионовая кислота |
Важную роль играет
изомерия положения у соединений
ароматического ряда, так как положение
заместителей в бензольном ядре определят
и их реакционную способность. Например,
1,2-динитробензол и 1,4-динитробензолы
легко реагируют с аммиаком, тогда как
1,3-динитробензол в реакцию с NH3 не
вступает.

3. Межклассовая.
Во всех приведенных выше примерах
изомеры имеют одинаковую химическую
природу, однако структурные изомеры
могут принадлежать к разным классам
органических соединений, например
дивинилацетилен и бензол (С6H6)
|
|
|
|
Дивинилацетилен |
Бензол |
4. Особым видом
структурной изомерии является таутомерия
(равновесная
динамическая изомерия) – существование
вещества в двух или более изомерных
формах, легко переходящих друг в друга:

Пространственная
изомерия:
1. Геометрическая
изомерия –
наблюдается в соединениях, содержащих
жесткий фрагмент, т.е. двойную связь или
цикл. Атомы или группы атомов могут
располагаться по-разному относительно
этого жесткого фрагмента. Полученное
их расположение называется – конфигурация.
Для соединений с
двойной связью возможность геометрической
изомерии возникает при наличии двух
неодинаковых заместителей у каждого
из атомов, связанных двойной связью.
|
|
|
|
цис-изомеры |
транс-изомеры |
|
|
|
|
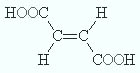
малеиновая
(цис-1,2-этилендикарбоновая |
фумаровая кислота
(транс-1,2-этилендикарбоновая |
Как двойная связь,
так и цикл являются жесткими и препятствуют
вращению атомов или групп атомов вокруг
линии связи. Два заместителя могут
располагаться по разные стороны кольца
или по одну сторону. В первом случае это
– транс-изомеры, во втором – цис-изомеры.
|
|
|
|
цис-1,2-диметилциклопентан |
транс-1,2-диметилциклопентан |
Цис-изомеры –
более полярные, более растворимы в
полярных растворителях, более
высококипящие, но низкоплавкие, менее
устойчивые.
Транс-изомеры –
менее полярные, менее растворимые в
полярных растворителях, более низкокипящие,
но более высокоплавкие, более устойчивые.
Химические
свойства геометрических изомеров схожие
(вступают в одни и те же типы реакций),
но не идентичные (различные по активности,
реакционной способности). Для перевода
одного изомера в другой необходимо
разорвать двойную связь или цикл. Это
происходит или при УФ-облучении или при
нагревании.
Геометрические
изомеры превращаются друг в друга
вращением вокруг связи после разрыва
двойной связи.
Для названия
геометрических изомеров используется
также E,Z
номенклатура.
E,Z-номенклатура носит более универсальный
характер.
|
|
|
|
Z-бутен-2 |
E-бутен-2 |
|
Z (zusammen-вместе) |
E (entgegen-напротив) |
Рассмотрим
правила построения названия:
-
Определяют
относительное старшинство заместителей
у каждого атома, несущего двойную связь.
Старшинство атомов определяется их
положением в периодической системе.
Атом с большим порядковым номером или
массой считается старшим. Если в первом
уровне стоят одинаковые атомы, то
рассматривают второй уровень и так
далее до первого отличия. -
Если старшие
заместители располагаются по одну
сторону от линии двойной связи,
конфигурация двойной связи обозначается
буквой Z (от немецкого “zusammen” – вместе),
если по разные – E (“entgegen” – напротив). -
Буквы Z,E располагают
перед названием с указанием номера
двойной связи.
Примеры:


Аналогом
цис-транс-изомерии относительно связи
С=С является син-анти-изомерия
относительно связей C=N или N=N (анти
соответствует транс, син – цис).
Например, азобензол
обычно существует в анти-конфигурации,
а при УФ-облучении появляется менее
стабильный син-изомер:
|
|
|
|
анти-азобензол |
син-азобензол |
2. Оптическая
изомерия
Оптическая изомерия
была открыта еще задолго до теории
химического строения, т.е. в начале 19
столетия. Было найдено, что при пропускании
поляризованного света через некоторые
вещества, они вращают (отклоняют)
плоскость поляризации плоскополяризованного
света на некоторый угол. Причем находятся
всегда два изомера, которые отклоняют
на одну и ту же величину угла, но в разные
стороны. Такая способность получила
название оптической активности, а
вещества, обладающие такими свойствами,
стали называть оптически активными.
Начнем с того, что
дело имеют с плоскополяризованным
светом. В поляризованном свете поперечное
колебание совершается только в одной
плоскости, перпендикулярной направлению
распространения светового луча. Плоскость
поляризации – плоскость перпендикулярная
к плоскости поперечных колебаний.
Явление оптической
изомерии обнаруживают с помощью прибора
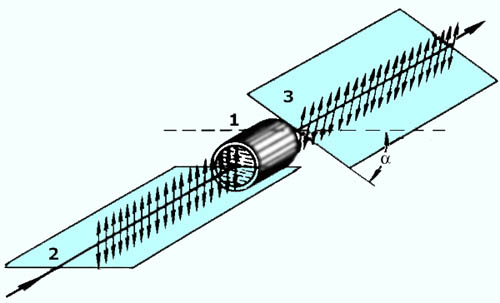
поляриметра (рис.1, 2).
|
|
|
Рисунок 1 – Схематическое изображение |
Соединения, которые
изменяют (вращают) плоскость поляризации,
называют оптически
активными,
и они существуют в виде двух оптических
изомеров. Один из них вращает плоскость
поляризации вправо, а другой – на тот же
угол, но влево (рис.). Для обозначения
этих вращений используют знаки (+) и (-),
которые ставят перед формулой оптического
изомера. Изомеры, которые вращают
плоскость поляризации в разные стороны,
но на один и тот же угол, называют
антиподами
(или энантиомерами
(от греч. enantio – противоположный). Смесь,
состоящая из равных количеств левого
и правого изомеров (антиподов), известна
как рацемическая
смесь, или
рацемат,
и обозначается или буквой r. Рацематы
образуются при синтезе вещества в том
случае, когда вероятность образования
каждого из оптических антиподов
одинакова. Поэтому рацемическое вещество
оптически неактивно в результате
взаимной компенсации активностей
входящих в него оптических изомеров.
|
|
|
Рисунок 2 – Изменение плоскости |
Почему некоторые
органические соединения являются
оптически активными? Ответ на этот
вопрос был дан на основании тетраэдрической
теории Я. Вант-Гоффа и А. Ле-Беля (1874).
Независимо друг от друга эти ученые
отметили, что все оптически активные
вещества содержат в своих молекулах
хотя бы один асимметрический атом
углерода (в формулах этот атом
обозначается звездочкой), т.е. углерод,
который связан с четырьмя различными
атомами или группами атомов (рис. 3).
Такая система лишена практически всех
элементов симметрии. При взаимодействии
с асимметрическим углеродным атомом,
у которого все четыре заместителя
отличаются по своему геометрическому
и электронному строению, электромагнитная
волна света “деформируется”, что
и приводит к повороту плоскости
поляризации.
|
|
|
|
Рисунок 3 – |
Любое органическое
соединение, содержащее асимметрический
углеродный атом, можно представить в
виде двух пространственных форм
(моделей), которые при наложении в
пространстве не могут быть совмещены
друг с другом (рис. 4). Эти две формы
(модели) отличаются друг от друга как
предмет от своего зеркального изображения.
Поэтому такая изомерия получила название
“зеркальной”. Молекулы (или их
модели), которые нельзя совместить в
пространстве (при наложении) и которые
относятся друг к другу как предмет к
своему зеркальному изображению, называют
хиральными
(от греч. хейрос – рука, рукоподобие).
Примером могут служить руки – правая и
левая, которые при наложении не
совмещаются. Таким образом, оптическая
изомерия
– это явление, обусловленное хиральностью.
Если молекула идентична своему зеркальному
изображению, она ахиральна.
|
|
|
Рисунок 4 – |
Существование
хиральности в органических соединениях
не обязательно связано с наличием атома
углерода, имеющего четыре различных
заместителя. Во-первых, помимо соединений
углерода хиральностью обладают другие
органические соединения, имеющие
четырехсвязные атомы, например кремния,
азота и фосфора. Во-вторых, хиральностью
обладают молекулы, формально не содержащие
стереогенного центра. Наличие оптической
изомерии может быть обусловлено также
наличием стереогенной оси (рис.5,
соединения а
и б)
или плоскости (рис.5, соединения в
и г).

Рисунок 5 – Примеры
молекул, содержащих стереогенную ось
(а и б) и плоскость (в и г)
Если молекула
содержит более одного стереогенного
центра, то число оптических изомеров
определяют по формуле 2n,
где n – число стереогенных центров.
Стереоизомеры, не
являющиеся энантиомерами, называются
диастереомерами.
Например, молекула 2,3-дигидроксибутаналя
имеет два стереогенных центра (рис.6,
отмечены звездочками) и следовательно
22=4 оптических изомера. Изомеры а
и б,
как и в
и г
представляют
пары энантиомеров. Изомеры а
и в
или г
являются диастереомерами. Их называют
диастереоизомерами или диастререомерами.
Они различаются не только по отношению
к плоскополяризованному свету, но и по
физическим и химическим свойствам, т.к.
расстояния между функциональными
группами разные.

Рисунок 5 –
Оптические изомеры молекулы
2,3-дигидроксибутаналя
Для изображения
оптических изомеров на плоскости чаще
всего используют проекционные
формулы Фишера.
Например, формула 2-бромбутана в проекции
Фишера изображается следующим образом:

Атомы или группы,
лежащие на горизонтальной линии, должны
рассматриваться как направленные к
наблюдателю, а атомы или группы,
находящиеся на вертикальной линии и
составляющие, как правило, главную цепь
рассматриваются как идущие за плоскость
листа бумаги. Существуют правила
обращения с проекционными формулами
Фишера,
основные из которых:
а) фишеровские
проекции нельзя выводить из плоскости;
б) фишеровские
проекции можно поворачивать в плоскости
только на 180 градусов:
в) в фишеровских
проекциях любое четное число перестановок
заместителей у центрального атома не
изменяет стереохимического смысла
формулы, а нечетное число перестановок
заместителей приводит к формуле
оптического изомера.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #