Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу вещества в растворе зная объем?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора).
Как вычислить концентрацию вещества в растворе?
Определяется по формуле: СМ= ν / V, (моль/л). Величина молярной концентрации показывает, сколько моль вещества содержится в 1 литре раствора.
Как найти массу растворенного вещества формула?
Массу растворённого вещества вычислим по формуле: m ( в − ва ) = w ( в − ва ) ⋅ m ( р − ра ) ; m ( H 2 SO 4 ) = w ( H 2 SO 4 ) ⋅ m ( р − ра ) = 0,64 ⋅ 200 = 128
Как найти массу если есть объем?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Как найти массу сухого вещества в растворе?
Масса растворенного вещества в растворе определяется по формуле: Масса (г) = Объем (л) x Концентрация (моль/л) x Молекулярная масса (а. е. м.)
Как найти массу через концентрацию и объем?
Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как приготовить водный раствор вещества определенной концентрации?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как рассчитать процент вещества в растворе?
% = [(Объем растворенного вещества) / (объем раствора)] x 100%. Обратите внимание, что объемный процент относится к объему раствора, а не к объему растворителя .
Как определить процентное содержание вещества в растворе?
Концентрация вещества или процентное содержание вещества в сплаве — это отношение массы вещества к массе сплава, записанное в виде процентов : K=(mв/M)*100%, где mв — масса вещества, M – масса всего сплава, К – концентрация (процентное содержание) вещества. Пример раствора.
Как можно найти массу вещества?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как найти m растворенного вещества?
m(растворённого вещества)=V×p-m(раствора).
Как найти массу вещества из массовой доли?
Массовая доля растворённого вещества — это величина, равная отношению массы растворённого вещества к массе раствора.
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) .
- w ( в − ва ) = m ( в − ва ) m ( в − ва ) + m ( р − ля ) .
- w ( в − ва ) = m ( в − ва ) m ( р − ра ) ⋅ 100 %.
Как найти массу силу тяжести?
Формула силы тяжести Fт=m*g, где m-масса тела, g-ускорение свободного падения. Для тела массой m=400 г =0.4 кг сила тяжести составит Fт=0.4*10=4 Н. Формула силы тяжести: F=mg, где m- масса тела, g-Н/кг.
Как найти массу и объем газа?
Vm=M/p, где Vm – молярный объем, М – молярная масса, а p – плотность вещества. Рис. 2.
Как найти количество вещества Если дан объем?
Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Как найти массу растворенного вещества
Бывает, что возникает такая задача: как найти массу вещества, содержащегося в том или ином объеме раствора? Ход ее решения зависит от того, какими исходными данными вы располагаете. Оно может быть и очень простым, буквально в одно действие, и более сложным.

Инструкция
Например, вам надо узнать, какое количество поваренной соли содержится в 150 миллилитрах 25%-го раствора. Решение: 25%-й раствор – это значит, что в 100 миллилитрах раствора содержится 25 грамм растворенного вещества (в данном случае поваренной соли). В 150 миллилитрах, соответственно, в полтора раза больше. Произведите умножение: 25* 1,5 = 37,5. Вот и ответ: 37,5 грамм поваренной соли.
Немного видоизмените условия задачи. Предположим, вам даны те же 150 миллилитров раствора поваренной соли. Но вместо массовой концентрации известна молярная – 1 М. Сколько поваренной соли содержится в растворе в этом случае? И здесь нет ничего сложного. Прежде всего, вспомните химическую формулу поваренной соли: NaCl. Заглянув в таблицу Менделеева, уточните атомные массы (округленные) элементов, составляющих это вещество: натрия – 23, хлора – 35,5. Следовательно, молярная масса поваренной соли – 58,5 г/моль.
А что такое молярная концентрация? Это – количество молей растворенного вещества в 1 1 литре 1-молярного раствора поваренной соли содержалось бы 58,5 грамм этого вещества. Сколько же его содержится в 150 миллилитрах? Произведя умножение, получите: 58,5* 0,15 = 8,775 г. Если вам не нужна высокая точность, можно принять результат за 8,78 грамм или за 8,8 грамм.
Предположим, вам известен точный объем раствора и его плотность, но неизвестна концентрация вещества. Как в таком случае определить его количество в растворе? Тут решение займет немного больше времени, но опять-таки не вызовет затруднений. Надо лишь найти любой справочник, где есть таблицы плотностей растворов. Для каждого показателя плотности там приведены соответствующие значения его массовой и молярной концентраций.
Например: даны 200 миллилитров водного раствора вещества Х, с плотностью 1,15 г/мл. По таблице растворимости вы выяснили, что такая плотность соответствует 30%-й концентрации раствора. Сколько вещества Х находится в растворе? Решение: если в 100 миллилитрах раствора содержалось бы 30 грамм вещества Х, то в 200 миллилитрах: 30*2 = 60 грамм.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)

обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
![]()
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
![]()
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
37
|
Vконц |
c разб |
Vразб |
. |
(2.13 в) |
|
|
сконц |
|||||
Пример 2.4. Исследуемый образец уксусной кислоты имеет плотность 1,015 г/см3, которой соответствует концентрация 1,98 моль/дм3. Для титрования предполагается использовать 0,1М раствора NaOH. Очевидно, что концентрация исследуемого образца значительно больше, чем у титранта. Рассчитывают объем исследуемого концентрированного раствора, необходимый для приготовления, к примеру, 200,0 см3 примерно 0,1М СН3СООН (разбавленный раствор)
|
V |
0,1 |
200,0 |
10,0 см3 . |
|
|
конц |
||||
|
1,98 |
||||
Когда объем концентрированного раствора больше или равен 5 см3, его можно измерить с помощью точной пипетки (в данном случае на 10,00 см3); если объем небольшой, то его измеряют мерным цилиндром (или пробиркой с делениями) переносят во взвешенный бюкс, определяют точную массу и количественно переносят навеску в мерную колбу.
При достаточно большой эквивалентной массе исследуемого вещества определение проводят методом отдельных навесок. Массу навески рассчитывают по формуле 2.8 а.
Пример 2.5. Рассчитать массу навески соли Мора (NH4)2Fe(SO4)2 · 6H2O, чтобы на ее титрование было затрачено 20,0 см3 0,05н. раствора KMnO4. Титрование соли железа раствором перманганата калия описывается уравнением реакции:
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O.
Фактор эквивалентности железа равен 1, молярная масса соли Мора равна
392,13 г/моль.
|
0,05 |
392,13 |
20,0 |
||
|
m( соли Мора) |
0,392 г. |
|||
|
1000 |
||||
Формулы расчета массы навески твердого вещества представлены в таблице 2.2.
Таблица 2.2
Формулы расчета массы навески и результатов титриметрического анализа при прямом титровании
|
Способ |
|||
|
титро- |
Способ отдельных навесок |
||
|
вания |
|||
|
Концен- |
|||
|
трация |
масса навески, г (mобщ) |
массовое содержание компонента А в |
|
|
титран- |
образце, г (m) |
||
|
та |
|||
|
Т(В/А) |
mобщ = T(B/A) V(B) |
m = T(B/A) V(B) |
|
38
|
с[(1/z)B] |
mобщ |
с[(1/z)B] M(A) f экв (A) V(B) |
m |
c[(1/z)B] M(A) f экв (A) V(B) |
||||||||||||||||
|
1000 |
||||||||||||||||||||
|
1000 |
||||||||||||||||||||
|
T(B) |
mобщ |
T(B) M(A) fэкв(A)V(B) |
m |
T(B) M(A) f экв (A) V(B) |
||||||||||||||||
|
M(B) fэкв( В) |
M(B) f экв (B) |
|||||||||||||||||||
|
Способ |
||||||||||||||||||||
|
титро- |
Способ пипетирования |
|||||||||||||||||||
|
вания |
||||||||||||||||||||
|
Концен- |
||||||||||||||||||||
|
трация |
масса навески, г (mобщ) |
массовое содержание компонента А в |
||||||||||||||||||
|
титран- |
образце, г (m) |
|||||||||||||||||||
|
та |
||||||||||||||||||||
|
Т(В/А) |
mобщ = T(B/A) Vобщ |
m = T(B/A) V(B) |
Vобщ |
|||||||||||||||||
|
Va |
||||||||||||||||||||
|
с[(1/z)B] |
mобщ |
с[(1/z)B] M(A) f экв (A) Vобщ |
m |
c[(1/z)B] M(A) fэкв (A) V(B) Vобщ |
||||||||||||||||
|
1000 |
1000 |
V |
||||||||||||||||||
|
a |
||||||||||||||||||||
|
T(B) |
mобщ |
T(B) M(A) fэкв (A) Vобщ |
m |
T(B) M(A) fэкв (A) V(B) Vобщ |
||||||||||||||||
|
M(B) fэкв (B) |
Va |
|||||||||||||||||||
|
M(B) fэкв (B) |
В – титрант, А – определяемое вещество, Vобщ – объем мерной колбы, Vа – объем аликвоты, mобщ – масса навески, m – массовое содержание компонента А в образце.
Результаты титриметрического определения представляют в виде массового содержания или массовой доли в процентах вещества в пробе.
Вычисление содержания определяемого вещества проводят по нормальной концентрации титранта или чаще всего через титр соответствия. Этот способ вычисления удобен при массовых определениях одного и того же элемента в большом количестве проб. Вычислив однажды титр стандартного раствора по определяемому веществу Т(В/А), находят затем массу этого вещества простым умножением титра на затраченный объем раствора (формулы 2.6 и 2.8 а).
Так рассчитывают массовое содержание определяемого вещества А по способу отдельных навесок, можно рассчитать и массовую долю (в %) (формулы 2.10. и 2.17).
|
ω(A) |
c[(1/z)B]M(A)f |
экв (A)V(B)100 |
. |
2.17 |
|
1000 |
mобщ |
|||
Пример 2.6. Какова массовая доля (в %) KCl в навеске массой 0,1523 г, если на ее титрование израсходовали 20,10 см3 0,1015 М раствора AgNO3? Определение основано на реакции:
39
KCl + AgNO3 = AgCl↓ + KNO3 .
Молярная масса KCl равна 74,55 г/моль. Фактор эквивалентности равен 1.
|
ω(KCl) |
0,1015 74,55 |
20,10 100 |
99,86 % . |
|
|
1000 |
0,1523 |
|||
В методе пипетирования на титрование аликвоты Va(A) см3 раствора определяемого вещества А израсходовано V(B) cм3 стандартного раствора В с титром по определяемому веществу Т(В/А). Тогда в объеме Va(A) содержится Т(В/А)V(B)г определяемого вещества, а в мерной колбе Vобщ (А)
|
массу m(A) рассчитывают по формулам |
|||||||
|
m( A) |
T (B / A) V (B) Vобщ |
( А) |
, |
(2.18 а) |
|||
|
Va ( A) |
|||||||
|
m(A) |
c[(1/z)B] M(A) f экв (A) V(B) Vобщ (A) |
||||||
|
. |
(2.18 б) |
||||||
|
1000 |
Va (A) |
Массовую долю (в %) вещества в навеске mобщ рассчитывают по фор-
мулам 2.10 или 2.19.
|
ω(А( |
c[(1/z)B] M(A) fэкв (A) V(B) Vобщ (А)100 |
. |
(2.19) |
|
|
1000 |
Va (A) mобщ |
|||
Пример 2.7. В мерную колбу вместимостью 100,0 см3 перенесли 0,6504г образца щавелевой кислоты, растворили и довели объем раствора до метки. Пипеткой взяли 10,00 см3 полученного раствора, поместили в колбу для титрования и титровали 0,1026 М раствором NaOH, расход которого составил 9,85 см3. Определить массовую долю (в %) H2C2O4 · 2H2O в исследуемом образце.
Фактор эквивалентности щавелевой кислоты равен 1/2 , молярная масса составляет 132,066 г/моль, способ титрования – пипетирование. Рассчитывают массовую долю щавелевой кислоты по формуле 2.19.
|
ω |
0,1026 |
66,033 9,85 100,0 100 |
97,97 %. |
|
|
1000 10,00 0,6504 |
||||
В случае титрования по остатку (обратное титрование), когда используется два титрованных раствора с1 и с2, массу определяемого вещества в методе отдельных навесок вычисляют по формуле
|
m(A) |
(c |
1V1 |
c2V2 )M(A)f экв |
(A) |
. |
(2.20) |
|
1000 |
||||||
Соответственно массовую долю (в %) рассчитывают по формуле
|
ω(A) |
(c1V1 c2V2 |
) M(A) f экв |
(А)100 |
(2.21) |
|
|
1000 |
mобщ |
||||
Пример 2.8. К раствору 0,3850 г вещества, содержащему хлориды, прибавили 25,00 см3 0,1100 М раствора AgNO3. На титрование избытка AgNO3

40
затрачено 13,50 см3 0,1020 М раствора NH4NCS. Рассчитать массовую долю (в %) хлора в навеске вещества.
Определение основано на реакциях:
Cl– + Ag+ = AgCl↓,
Ag+ + NCS– = AgNCS↓.
|
Фактор эквивалентности хлорид-иона равен 1. |
|||||
|
( Cl ) |
[c(AgNO |
3 ) V(AgNO3 ) |
c(NH 4 NCS) V(NH 4 NCS)] M(Cl) 100 |
||
|
1000 |
mобщ |
||||
|
(0,1100 |
25,00 |
0,1020 13,50) 35,45 100 |
12,64 % . |
||
|
1000 |
0,3850 |
||||
При определении по методу пипетирования в обратном титровании расчет массовой доли (в %) проводят по формуле
|
ω(А( |
(с1V1 c2V2 ) M(A) fэкв (A) Vобщ (A) 100 |
|||
|
. |
(2.22) |
|||
|
1000 |
Va (A) |
mобщ |
||
|
Пример 2.9. 5,00 см3 раствора KClO3 |
поместили в мерную колбу емко- |
стью 100,0 см3, объем довели до метки. С помощью пипетки отобрали 10,00 см3 приготовленного раствора, перенесли в колбу для титрования, добавили по бюретке 20,00 см3 0,1200 н. раствора FeSO4, избыток оттитровали 10,15 см3 0,1105 н. раствора KMnO4. Рассчитать массовую долю (в %) KClO3 в растворе, если плотность этого раствора равна 1,040 г/см3.
Для определения использовали обратное титрование, основанное на реакциях:
ClO3– + 6Fe2+ + 6H+ = Cl– + 6Fe3+ + 3H2O,
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O.
Фактор эквивалентности KClO3 по уравнению полуреакции
ClO3– + 6H+ + 6ē = Cl– + 3H2O
равен 1/6, молярная масса KClO3 равна 122,550 г/моль, молярная масса эквивалента – 22,425 г/моль.
|
Массовую долю (%) KClO3 |
находят по формуле 2.22, с учетом того, что |
||||||||||
|
массу навески рассчитывают по плотности и объему (Vконц) исследуемого |
|||||||||||
|
раствора (m = Vρ): |
|||||||||||
|
ω(KClO3 ) |
[c(FeSO4 ) V(FeSO4 ) c(1/5KMnO4 ) V(KMnO4 )] |
||||||||||
|
1000 |
|||||||||||
|
M(KClO3 ) f экв Vобщ 100 |
, |
||||||||||
|
Va (KClO3 ) Vконц ρ |
|||||||||||
|
ω(KClO3 ) |
(0,1200 |
20,00 |
0,1105 10,15) 22,425 100,0 100 |
5,52 % . |
|||||||
|
1000 |
10,00 |
5,00 |
1,040 |
||||||||
41
Формулы расчета массового содержания определяемого компонента приведены в табл. 2.2.
2.5.Кривые титрования
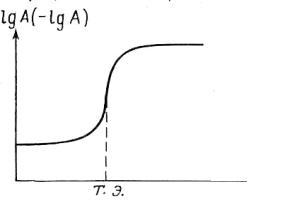
Впроцессе титрования изменяются равновесные концентрации определяемого вещества, титранта и продукта реакции. При этом пропорционально концентрациям веществ изменяются и свойства раствора. Например, при кислотно-основном титровании меняется рН раствора, при окислительновосстановительном титровании – окислительно-восстановительный потенциал системы. График зависимости параметра системы (рН, Е), связанного с концентрацией титруемого вещества, титранта или продукта, от состава раствора в процессе титрования называют кривой титрования.
Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования. При построении кривых по оси ординат можно отложить логарифм концентрации или величину, пропорциональную этому логарифму, по оси абсцисс – объем добавленного титранта или степень оттитрованности титруемого вещества (обычно в процентах). Кривая титрования в общем виде представлена на рис. 2.2.
Рис. 2.2. Кривая титрования
А – концентрация определяемого компонента;
V – объем титранта;
Т.Э. – точка эквивалентности
V
Как видно из рис. (2.2), логарифмическая кривая имеет s-образную форму. На кривой имеются области плавного (до и после точки эквивалентности) и резкого (вблизи Т.Э.) изменения рассчитываемого или измеряемого параметра. Область резкого изменения (вертикальный участок кривой) называют скачком титрования. Если выразить степень оттитрованности в процентах, то скачок титрования начинается, когда оттитровано 99,9 % компонента и заканчивается, когда добавлено 100,1 % титранта. На величину скачка титрования влияет ряд факторов: константа равновесия реакции, концентрация веществ, температура и др.
При визуальном обнаружении точки эквивалентности пользуются индикаторами. Это вещества, окраска которых меняется при определенных значениях параметра. Индикатор выбирают так, чтобы его окраска изменялась в пределах установленного скачка титрования (не обязатель-
42
но в точке эквивалентности). При этом, если индикатор меняет свой цвет до Т.Э., возникает погрешность титрования со знаком минус, если изменяется цвет после Т.Э. – со знаком плюс. Очевидно, что для правильного выбора индикатора и оценки погрешности титрования необходимо построение кривой титрования.
Контрольные вопросы и задачи
1.В чем заключается сущность титриметрического анализа? Какой закон лежит в основе титриметрии?
2.Каким требованиям должны удовлетворять реакции, применяемые в титриметрическом анализе?
3.Что такое точка эквивалентности и как она фиксируется?
4.Что называют эквивалентном, эквивалентным числом, фактором эквивалентности?
5.Является ли молярная масса эквивалента вещества постоянной величиной? От чего зависит ее значение?
6.Определить фактор эквивалентности участников следующих реакций:
Na2CO3 + HCl = NaHCO3 + NaCl; Na2CO3 + 2HCl = NaCl + CO2 + H2O; H3PO4 + 2NaOH = Na2HPO4 + 2H2O;
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 +8H2O; Ca(OH)2 + H2SO4 = CaSO4 + 2H2O.
7.Какой измерительной посудой измеряются точные объемы растворов в титриметрии?
8.С какой точностью взвешивают аналитические навески?
9.Почему бюретки и пипетки необходимо перед употреблением промыть тем раствором, которым их будут наполнять?
10.Что такое «первичный стандартный раствор», «вторичный стандартный раствор»?
11.Какие требования предъявляют к первичным стандартным веществам? 12.Что такое «фиксанал» или «стандарт-титр»?
13.Стандартизацию раствора HCl можно сделать по титрованному раствору NaOH и по х.ч. Na2B4O7 · 10H2O. Какой из этих способов обеспечит более высокую точность и почему?
14.Что такое титр раствора и как он связан с нормальной концентрацией раствора?
15.Что такое титр соответствия или титр по определяемому веществу? 16.В 400 см3 раствора серной кислоты содержится 4,9000 г безводной
H2SO4. Вычислите титр, молярную концентрацию и молярную концентрацию эквивалентов данного раствора. Ответ: 0,01226 г/см3; 0,1250 моль/дм3; 0,2500 моль/дм3.
43
17.В 250,0 см3 раствора гидроксида натрия содержится 10,00 г этого вещества. Чему равен титр этого раствора? Ответ: Т(NaOH) = 0,04000 г/см3.
18.Чему равны титры 0,0900 н. раствора H2SO4 по: а) Ba(OH)2; б) NH3? От-
вет: а) 0,007712 г/см3; б) 0,001593 г/см3.
19.Вычислить нормальную концентрацию раствора хлороводородной кислоты, если T(HCl/NaOH) = 0,005250 г/см3. Ответ: 0,1312 моль/дм3.
20.Сколько граммов КОН содержится в 10 см3 раствора, титр которого ра-
вен 0,004120 г/см3. Ответ: 0,04122 г.
21.Как проводятся титриметрические определения по способу пипетирования и по способу отдельных навесок?
22.Вычислить количество граммов Na2CO3 в растворе, на титрование которого израсходовано 22,00 см3 0,1200 М раствора HCl? Ответ: 0,1399 г.
23.Сколько граммов H2SO4 содержится в 5 дм3 раствора, если на титрование 25,00 см3 этого раствора израсходовано 22,50 см3 0,09500 М раствора КОН? Ответ: 20,97г.
24.Какую массу навески Na2CO3 нужно взять, чтобы на титрование ее требовалось 20 см3 0,1н. раствора H2SO4? Ответ: 0,11г.
25.Какому объему 1 М раствора эквивалентны 23,8 см3 0,2 М раствора HСl?
ГЛАВА 3. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ (ПРОТОЛИТОМЕТРИЯ)
3.1. Сущность метода
Метод кислотно-основного титрования базируется на реакции обмена протонами между протолитами (кислотами и основаниями, по БренстедуЛоури) и в общем виде может быть представлен схемой
кислота1 + основание2 = основание1 + кислота2, НА + В = ВН+ + А–, Н3О+ + ОН– = Н2О.
Кислотно-основное титрование впервые было предложено в 1823 г. Гей-Люссаком.
Реакции кислотно-основного взаимодействия отвечают требованиям, предъявляемым к реакциям в титриметрии, в отношении их стехиометрии и скорости протекания. Связывание Н3О+ и ОН– в растворе происходит за время порядка 10-11с. Применение в качестве титрантов только сильных кислот (HCl, H2SO4) и оснований (КОН, NaOH) позволяет достичь достаточной полноты протекания реакции (Кр ≥ 1 · 108) при титровании не только сильных, но и слабых протолитов, константы диссоциации (Ка, Кв) ко-
44
торых не меньше 1 · 10-8. Фиксирование точки эквивалентности осуществляется вполне доступными методами, в основном, с помощью индикаторов.
В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. Название происходит от латинских слов acidum
– кислота и alkali – щелочь.
Ацидиметрическое титрование (титрант – кислота) применяют для определения протолитов, проявляющих свойства оснований: сильных и слабых оснований, основных солей, солей слабых кислот, а также органических соединений, обладающих основными свойствами.
Алкалиметрическое титрование (титрант – щелочь) используют для определения сильных и слабых кислот, кислых солей, солей слабых оснований и органических соединений, обладающих кислотными свойствами.
При кислотно-основном титровании главным свойством системы, которое меняется пропорционально количеству оттитрованного протолита, является кислотность раствора, характеризующаяся величинами [H3O+] или рН. В зависимости от соотношения силы реагирующих протолитов точка эквивалентности может находится в кислой, нейтральной и щелочной средах. В соответствии с этим рассматривают три случая титрования:
1. Титрование сильной кислоты щелочью (или наоборот):
HCl + NaOH = NaCl + H2O,
H+ + OH– = H2O.
Образующаяся соль NaСl не подвергается гидролизу, и раствор будет иметь нейтральную реакцию. Следовательно, в данном случае точка эквивалентности находится в нейтральной среде (рН=7).
2. Титрование слабой кислоты щелочью:
CH3COOH + NaOH = CH3COONa + H2O.
В точке эквивалентности образуется ацетат натрия – соль слабой кислоты и сильного основания, которая гидролизуется:
CH3COONa + H2O = CH3COOH + NaOH,
CH3COO– + H2O = CH3COOH + OH–.
В растворе появляется избыток ионов ОН–, поэтому среда в точке эквивалентности щелочная (рН > 7).
3. Титрование слабого основания сильной кислотой:
NH4OH + HCl = NH4Cl + H2O.
Образующаяся в точке эквивалентности соль NH4Cl гидролизуется:
NH4Cl + H2O = NH4OH + HCl,
NH4+ + H2O = NH4OH + H+.
В результате накопления ионов H+ среда в точке эквивалентности становится кислой (рН < 7).

45
Таким образом, в двух последних случаях точка эквивалентности не совпадает с точкой нейтральности. (Поэтому не рекомендуется использовать старое название «метод нейтрализации»).
3.2. Индикаторы кислотно-основного титрования
Фиксирование точки эквивалентности при кислотно-основном титровании проводят с помощью индикаторов или инструментальными методами (потенциометрически, кондуктометрически и т.п.).
Индикаторы метода – кислотно-основные индикаторы – представляют собой слабые органические кислоты или основания, протонированные (кислотные) и непротонированные (основные), формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (например, метиловый оранжевый) индикаторы. Кислотно-основные индикаторы относятся к обратимым индикаторам.
В соответствии с ионно-хромофорной теорией изменение окраски индикатора связано с таутомерией органических молекул, содержащих хромофорные группы. Хромофоры, или носители цветности, содержат π- электроны. Наиболее известными хромофорами являются группы:
>С=О, >С=С<, >С=S<, >C=N—, —N=N—, —O—N=N—, —N=0, >C=C— C=C<, = = =. Последняя группа называется хиноидной. Соединения, содержащие хромофорные группы, имеют полосу поглощения в ультрафиолетовой или видимой областях спектра. Если молекулы поглощают свет в видимой части спектра, то вещество имеет определенную окраску.
Соединениям с хромофорными группами, содержащими подвижные π- электроны, в зависимости от распределения электронной плотности можно приписать несколько структур; предельные структуры называются ее таутомерами. На распределение электронной плотности влияет наличие аук-
сохромных групп (NH2–, –OH, –OCH3, –N(CH3)2, –COO и т.п.). Ауксохро-
мы связаны с ненасыщенным скелетом хромофора так, что положение двойных связей изменяется и поглощение света усиливается. Таким образом, ауксохромы сами не сообщают окраску индикатору, но обладают свойством усиливать действие хромофоров повышать интенсивность вызываемой ими окраски.
Рассмотрим индикатор метиловый оранжевый. В щелочной среде индикатор имеет желтую окраску (хромофор –N=N–). В кислой среде азот, содержащий неподеленную пару электронов, протонируется, при этом образуется хиноидная форма и окраска становится красной. В растворе в равновесии находятся обе таутомерные формы.
Метиловый оранжевый относится к классу азоиндикаторов (-N=N-), имеющих в кислой среде красную, а в щелочной среде желтую окраску. Сюда относится также метиловый красный и тропеолин О.
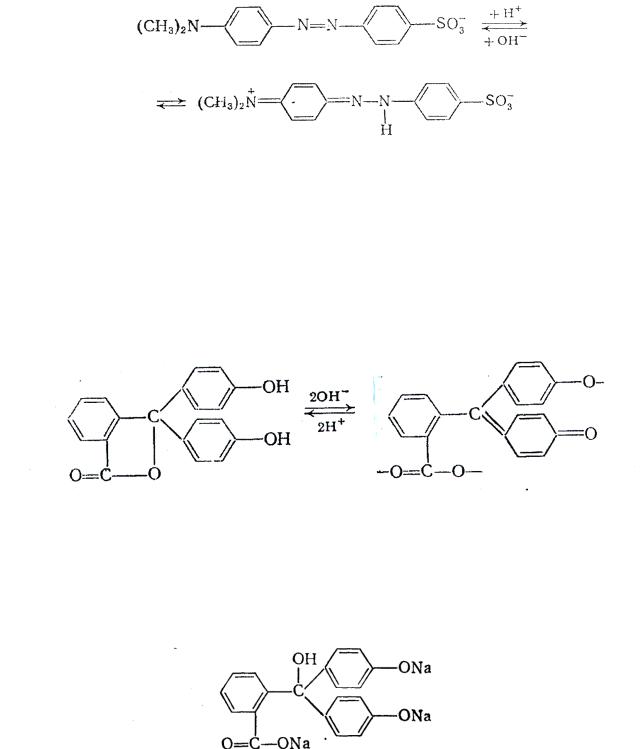
46
желтая форма (нейтральная или щелочная среда))
красная форма (кислая среда)
Существуют индикаторы, не содержащие хромофоров, но под влиянием рН среды их структура изменяется так, что хромофорные группы появляются. Это группа фталеинов. Например, фенолфталеин, тимолфталеин. Так, фенолфталеин в кислой среде бесцветен. В щелочной среде (рН 8-10) в результате перераспределения электронной плотности в его молекуле образуется хиноидная структура (хромофор), находящаяся в равновесии со своей таутомерной формой. Индикатор приобретает малиново-красную окраску:
|
бесцветная форма |
окрашенная форма |
Дальнейшее увеличение рН до 13-14 вызывает новую структурную перегруппировку, в результате чего образуются анионы трехзамещенной соли, лишенные хиноидной группы и потому бесцветные. Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи:
Кислотно-основные индикаторы, меняющие свой цвет в зависимости от концентрации ионов Н+ являются специфическими индикаторами на эти ионы. Известно большое число разных кислотно-основных индикаторов, сведения о некоторых из них приведены в табл. 3.1.

47
|
Таблица 3.1 |
|||||
|
Кислотно-основные индикаторы |
|||||
|
Область пере- |
Изменение окраски |
||||
|
Индикатор |
рКа |
||||
|
кислотная |
основная |
||||
|
хода рН |
|||||
|
форма |
форма |
||||
|
Метиловый фиолетовый |
0-1,8 |
– |
желтая |
фиолетовая |
|
|
Тимоловый синий |
1,2-2,8 |
1,65 |
красная |
желтая |
|
|
Метиловый оранжевый |
3,1-4,4 |
3,36 |
красная |
желтая |
|
|
Бромкрезоловый зеленый |
3,9-5,4 |
4,90 |
желтая |
синяя |
|
|
Метиловый красный |
4,4-6,2 |
5,00 |
красная |
желтая |
|
|
Бромтимоловый синий |
6,0-7,6 |
7,3 |
желтая |
синяя |
|
|
Феноловый красный |
6,4-8,2 |
8,00 |
желтая |
красная |
|
|
Тимоловый синий |
8,0-9,6 |
9,20 |
желтая |
синяя |
|
|
Фенолфталеин |
8,2-9,8 |
9,53 |
бесцветная |
красная |
|
|
Тимолфталеин |
9,3-10,5 |
9,6 |
бесцветная |
синяя |
|
|
Ализариновый желтый |
9,7-10,8 |
– |
желтая |
красная |
|
Равновесие в растворе кислотно-основного индикатора можно представить схематично следующим образом:
HInd + H2O Ind– + H3O+.
Константа равновесия этой реакции, являющаяся константой кислотности, иногда называемой константой индикатора, имеет выражение:
|
KInd |
[Ind |
] [H 3O ] |
. |
|
[HInd] |
|||
Из выражения константы индикатора получаем
|
[H 3O ] K Ind |
[HInd] |
, рН |
рКInd |
lg |
[HInd] |
. |
|
[Ind ] |
||||||
|
[Ind ] |
Так как обе формы индикатора окрашены различно, цвет индикатора при данных условиях рН среды зависит от соотношения [HInd]/[Ind–]. Человеческий глаз воспринимает окраску одной из форм, если ее концентрация превышает концентрацию другой формы примерно в 10 раз. Тогда в
|
интервале рН от pKInd |
lg |
10 |
до pK Ind |
lg |
1 |
, глаз будет видеть смешан- |
|
|
1 |
10 |
||||||
ную окраску обеих форм, а за пределами этого интервала – чистую окраску одной из форм. Этот интервал называют интервалом перехода окраски индикатора:
рН рКInd 1.
48
Очевидно что, если глаз улавливает окраску одной из форм на фоне другой при большем или меньшем соотношении, ∆рН будет другим. Чем меньше интервал, тем ценнее индикатор.
Середина области перехода окраски индикатора называется показателем индикатора рТ (при этом рН = рКInd).
Киндикаторам предъявляют ряд требований:
1.Индикатор должен быть интенсивно окрашен, чтобы окраска даже его небольшого количества была заметна для глаза. Большая концентрация индикатора может привести к расходу на него значительного количества (больше капли) титранта.
2.Переход окраски должен быть контрастным.
3.Область перехода окраски должна быть как можно уже.
Для сужения области перехода окраски и увеличения контрастности применяют смешанные индикаторы, которые составляют из индикатора и красителя или из двух индикаторов. Так, у индикатора метилового красного, переход цвета от красного и желтому (табл. 3.1) происходит в интервале почти двух единиц рН. Если к раствору добавить подходящее количество красителя метиленового синего, то переход от красно-фиолетовой окраски к зеленой наблюдается резко и отчетливо при рН = 5,3. Тот же метиловый красный в смеси с бромкрезоловым зеленым при рН = 5,1 дает отчетливый переход от красного цвета к зеленому.
На область перехода окраски индикатора (положение и интервал) влияют ионная сила, температура, посторонние вещества, растворитель, а также концентрация индикатора. Из посторонних веществ следует отметить влияние углекислого газа и веществ, образующих коллоидные системы. За счет углекислого газа рН водного раствора уменьшается, поэтому все индикаторы с рТ > 4 чувствительны к СО2. Если в растворе имеются коллоидные системы, например, белки, то наблюдается адсорбция индикатора на поверхности коллоидных частиц. Кроме того, происходит взаимодействие кислотных и основных групп белков и индикаторов, что приводит к ошибкам титрования.
3.3. Кривые титрования и выбор индикатора
Для правильного выбора индикатора изучают, как меняется рН раствора в процессе титрования. Значение рН можно рассчитать или измерить с помощью прибора рН-метра. По полученным данным строят кривую титрования, то есть график зависимости рН от объема прибавленного титранта (или от степени оттитрованности). В зависимости от определяемых компонентов различают три вида кривых титрования.
При титровании сильной кислоты щелочью (или наоборот), точка эквивалентности находится на линии нейтральности (рН = 7) и при концентрации вещества и титранта, равным 0,1 моль/дм3, скачок титрования находится в интервале рН от 4 до 10 (рис. 3.1).
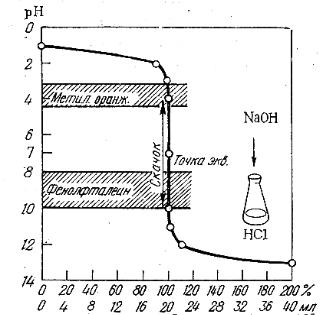
49
В идеале для фиксирования точки эквивалентности подходит индикатор, у которого рТ совпадает с рН в момент эквивалентности, в данном случае можно использовать бромтимоловый синий (табл 3.1). Но можно применять также индикаторы, меняющие окраску в пределах рН от 4 до 10, ошибка титрования при этом будет незначительная. Так, с метиловым оранжевым (рТ = 3,4) раствор будет слегка недотитрован, с фенолфталеином (рТ = 9,5) – перетитрован.
Рис.3.1. Кривая титрования
0,1 М раствора HCl 0,1 М раствором NaOH
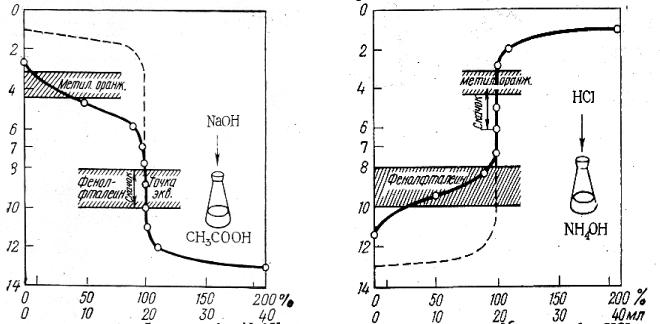
Кривая титрования слабой уксусной кислоты щелочью (0,1 М растворы) представлена на рис. 3.2, здесь скачок титрования охватывает интервал значения рН 7,76 – 10 и точка эквивалентности лежит в щелочной среде при рН 8,88. Для фиксирования точки эквивалентности подходит фенолфталеин.
Кривая титрования слабого основания (раствора аммиака) сильной кислотой (0,1 М растворы) приведена на рис. 3.3. Скачок титрования находится в пределах рН 4-6,24, точка эквивалентности лежит в кислой среде при рН 5,12 и может быть зафиксирована метиловым оранжевым.
Таким образом, кислотно-основное титрование можно проводить с индикатором, интервал перехода окраски которого находится в области скачка рН на кривой титрования.
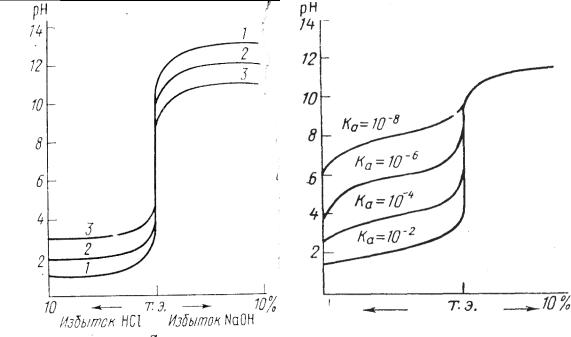
Чем больше скачок титрования, тем отчетливее и с меньшей погрешностью можно зафиксировать момент эквивалентности. Величина скачка титрования зависит от концентрации, а для слабых протолитов и от их констант кислотности и основности (Ка, Кв). Чем сильнее электролит и выше его концентрация, тем больше скачок титрования (рис. 3.4 и 3.5).
50
Слабые протолиты с К ≤ 1,0 · 10-8 вообще не дают скачка на кривой титрования и прямым титрованием в водном растворе не определяются.
При титровании растворов высоких концентраций (с ≥ 1,00 М) возникает погрешность вследствие того, что ошибка титрования в одну каплю составляет уже значительную величину. Оптимальный интервал концентраций растворов при титровании 0,2-0,02 М. Правильное определение конечной точки титрования зависит не только от выбора индикатора, но и от принятого в работе порядка титрования. Необходимо учитывать визуальное восприятие цвета раствора человеческим глазом. Титрование можно проводить «от кислоты к щелочи» и на оборот. При титровании «от кислоты к щелочи» с метиловым оранжевым розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую. Но такое изменение окраски гораздо хуже улавливается глазом, чем переход от желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) титруют «от щелочи к кислоте». С фенолфталеином удобнее титровать «от кислоты к щелочи», так как при этом раствор из бесцветного становится малиновым.
Рис. 3.2. Кривая титрования 0,1 М раствора CH3COOH 0,1 М раствором NaOH
Рис. 3.3. Кривая титрования 0,1 М раствора NH4OH 0,1 М раствором
HCl
Кроме того, правильное фиксирование точки эквивалентности зависит от количества прибавленного индикатора. Чем больше реактива, тем ярче окраска раствора, но тем труднее заметить изменение окраски. Для установления момента эквивалентности имеет значение не столько яркость
51
окраски раствора, сколько четкость ее изменения. Следует помнить, что индикаторы, применяемые в кислотно-основном титровании, сами являются слабыми кислотами или основаниями и при титровании часть стандартного раствора расходуется на титрование индикатора. Опытным путем установлено, что на 10-15 см3 анализируемого раствора достаточно одной капли индикатора, а для 25 см3 – две. Причем при параллельных определениях следует брать одно и то же количество индикатора.
|
10 % |
|
|
Рис. 3.4. Зависимость скачка на |
Рис. 3.5. Зависимость величины |
|
кривой титрования от концен- |
скачка на кривой титрования |
|
трации раствора: |
от силы протолитов |
|
1 – 1,0 М; 2 – 0,1М; 3 – 0,01 М |
На изменение окраски индикатора также влияет присутствие нейтральных электролитов, растворители, температура.
Для учета погрешностей, возникающих при титровании с данным индикатором рекомендуется использовать контрольный раствор (называемый также «холостым» или «свидетелем»). «Холостым» называют титрование раствора, идентичного с анализируемым (по объему, количеству индикатора и т.п.), но не содержащего определяемого вещества. Объем титранта, пошедший на контрольное титрование, можно вычесть из результатов основного титрования, тем самым устранив одну из погрешностей титриметрического определения.
Очень часто в качестве «свидетеля» используют дистиллированную воду, помещаемую в колбу для титрования в количестве равном объему жид-

52
кости в конце титрования, куда добавляют индикатор и 1-2 капли титранта до изменения цвета индикатора. Приготовленный таким образом «свидетель» используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и «свидетеля» была одинакова.
3.4.Титранты метода
Вкачестве титрантов чаще всего используют вторичные стандартные растворы HCl и NaOH. Их готовят, в основном, из концентрированных растворов разбавлением приблизительно до требуемой концентрации с последующей стандартизацией по первичным стандартным веществам.
3.4.1. Приготовление и стандартизация растворов кислот и щелочей
Стандартные растворы кислот и щелочей обычно готовят с молярной концентрацией эквивалентов вещества с[(1/z)B] от 0,05 до 0,1 реже 1 моль/дм3. С помощью ареометра (денсиметра) определяют плотность концентрированной кислоты или щелочи. Ареометр (рис. 3.6) представляет собой герметически закрытый цилиндрический сосуд с нанесенными на нем метками. В нижней части помещен груз (дробь), благодаря чему ареометр, погруженный в жидкость, поддерживается в вертикальном положении. Для определения плотности концентрированную кислоту или щелочь наливают в сухой стеклянный цилиндр объемом 200-250 см3. Правильно подобранный ареометр не должен касаться дна и стенок цилиндра. Отсчет показаний ведут по шкале ареометра. Деление шкалы, совпадающее с уровнем жидкости, показывает плотность раствора ρ (г/см3). По справочным таблицам определяют соответствующую плотности массовую долю (в %) или молярную концентрацию раствора. Если молярная концентрация не указана, ее рассчитывают по формуле (2.12 а), затем переводят в нормальную (если z > 1, например в H2SO4).
Рис. 3.6. Ареометр
53
Требуемый объем исходного концентрированного раствора кислоты или щелочи, необходимый для приготовления раствора заданной концентрации, рассчитывают по формуле 2.13 в.
Рассчитанный объем концентрированной кислоты или щелочи измеряют с помощью мерного цилиндра или градуированной пробирки, переносят в чистую сухую склянку, прибавляют соответствующий объем дистиллированной воды, перемешивают и закрывают пробкой. Таким образом получают раствор приблизительной концентрации.
Точную концентрацию приготовленной кислоты устанавливают с помощью первичных стандартных веществ, имеющих в растворе щелочную реакцию. К ним относятся безводные карбонат или гидрокарбонат натрия Na2CO3, NaHCO3 и тетраборат натрия (бура) Na2B4O7 · 10H2O. Наиболее удобен тетраборат натрия, так как путем перекристаллизации при 600С и высушивании на воздухе эту соль легко получить химически чистой, точно соответствующей формуле Na2B4O7 · 10H2O. Это вещество устойчиво, имеет достаточно большую молярную массу эквивалента (190,7 г/моль), что отвечает требованиям для установочных (ПСВ) веществ.
Водный раствор тетрабората натрия вследствие гидролиза имеет щелочную реакцию и потому может быть оттитрован кислотой.
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3.
В результате реакции накапливается ортоборная кислота. Следовательно, рН раствора в точке эквивалентности слабокислая и для титрования можно использовать индикатор метиловый оранжевый (или метиловый красный).
Стандартизацию кислоты по тетраборату натрия можно проводить как методом пипетирования, так и по отдельным навескам. Большая масса эквивалента позволяет воспользоваться методом отдельных навесок.
Массу навески тетрабората натрия рассчитывают по формуле 2.8 а (см. пример 2.2) исходя из того, что на ее титрование должно расходоваться около 20,00 см3 0,1 М раствора HCl (если готовили раствор кислоты такой концентрации).
Рассчитанную массу навески взвешивают предварительно на технических (или аптечных) весах, затем переносят в бюкс и находят точную массу бюкса с навеской на аналитических весах. Результаты взвешивания записывают в лабораторный журнал. Навеску переносят в коническую колбу для титрования объемом 200-250 см3 . Взвешивают бюкс с оставшимися крупинками и вновь записывают массу в журнал. По разнице двух взвешиваний на аналитических весах находят точную массу тетрабората натрия.
В колбу с навеской добавляют 20-25 см3 горячей дистиллированной воды (бура плохо растворяется в холодной воде), смывая частицы вещества со стенок колбы. Содержимое колбы перемешивают осторожными враща-
54
тельными движениями до растворения вещества. Затем раствор охлаждают до комнатной температуры и добавляют 1-2 капли индикатора метилового оранжевого.
Установленную в штативе чистую бюретку ополаскивают 2 раза приготовленным раствором кислоты, затем наполняют ее почти доверху. Далее, подставив стаканчик под бюретку и приоткрыв зажим, заполняют нижний конец бюретки (носик) так, чтобы в ней не осталось пузырьков воздуха (см. рис.1.11). Нижний мениск раствора кислоты в бюретке должен находиться на нулевом делении (рис. 1.13).
Колбу с раствором тетрабората натрия ставят на белую фарфоровую пластинку или на лист бумаги и осторожно титруют, непрерывно перемешивая раствор в колбе вращательными движениями (рис. 1.14). Необходимо уловить момент, когда от одной капли кислоты раствор в колбе изменит окраску из желтой на оранжевую. Для более точного фиксирования точки эквивалентности рекомендуется титровать по «свидетелю» (см. раздел 3.3).
Титрование первой навески следует проводить очень медленно, чтобы не перетитровать. Вторую и последующие навески можно титровать быстрее. В случае возникновения сомнения в изменении окраски, делают отсчет по бюретке и добавляют еще 1 каплю кислоты. Если при этом раствор порозовеет, значит, титрование было закончено в точке эквивалентности (учитывать объем лишней капли кислоты не следует). Зафиксированный по бюретке объем с точностью до сотых долей см3 (последний знак определяется на глаз), записывают в лабораторный журнал (например, V(HCl)
= 19,85 см3).
Расчет концентрации кислоты проводят до четвертой значащей цифры для каждой навески отдельно. Среднее значение находят по двум-трем сходящимся результатам (отличие может быть только в третьей значащей цифре). Кроме концентрации кислоты с такой же точностью рассчитыва-
ют ее поправочный коэффициент (K = cпракт/стеор). Приготовленный вторичный стандартный раствор кислоты (титрант) помещают в чистую
сухую склянку, закрывают пробкой, наклеивают этикетку с обозначением раствора и его концентрации. Раствора HCl довольно устойчив.
Стандартизацию аналогично приготовленного раствора щелочи проводят по ПСВ: щавелевой кислоте H2C2O4·2H2O, янтарной кислоте H2C4H4O4, бензойной кислоте C6H5COOH и другим органическим кислотам. При взаимодействии слабых органических кислот со щелочью образуется гидролизирующиеся соли, создающие в точке эквивалентности щелочную среду, которую можно зафиксировать индикатором фенолфталеином. Например:
H2C2O4 + 2NaOH = Na2C2O4 + 2H2O,
C6H5COOH + NaOH = C6H5COONa + H2O.
55
Случай стандартизации раствора NaOH по щавелевой кислоте методом пипетирования приведен в примере 2.1. Там же даны расчеты массы навески и концентрации кислоты и щелочи.
Техника работы по методу пипетирования несколько отличается от приема отдельных навесок. Рассчитанную массу навески также вначале взвешивают на аптечных (или технических) весах, помещают в бюкс, взвешивают на аналитических весах, затем навеску аккуратно переносят через сухую воронку в мерную колбу, вновь взвешивают бюкс (уже без навески). По разнице масс первого и второго взвешивания находят массу навески щавелевой кислоты. Остатки щавелевой кислоты с воронки тщательно смывают в ту же колбу дистиллированной водой, колбу наполняют водой до половины ее объема и растворяют навеску. Затем доводят объем колбы водой до метки по нижнему мениску жидкости, добавляя последние капли пипеткой (рис. 1.9). Мерную колбу закрывают пробкой и перемешивают раствор, переворачивая колбу несколько раз.
По точной массе навески щавелевой кислоты и объему колбы рассчитывают фактическую нормальную концентрацию ее раствора.
Мерную пипетку, с помощью которой отбирают аликвотные (равные) объемы раствора, несколько раз промывают приготовленным раствором щавелевой кислоты. Затем набирают пипеткой раствор до метки (см. рис. 1.16) по нижнему мениску жидкости и переносят в чистую коническую колбу для титрования. Добавляют 2-3 капли фенолфталеина и титруют приготовленным раствором щелочи до появления бледно-малиновой окраски, не исчезающей при взбалтывании в течение 30 с.
Проводят не менее трех титрований, объемы щелочи при этом не должны отличаться более чем на 0,1 см3. Из таких сходящихся результатов
__
(промахи отбрасывают) находят среднее значение V . Затем рассчитывают точную концентрацию приготовленного раствора щелочи:
|
c(NaOH) |
c(H |
2C2O4 ) V(H 2C2O4 |
) |
. |
|
__ |
||||
|
V (NaOH) |
Стандартный раствор щелочи хранят в стеклянных сосудах, закрытых резиновой пробкой или в пластмассовых бутылях. Гидроксид натрия поглощает СО2 из атмосферы, поэтому его раствор предохраняют от попадания углекислоты с помощью трубочки, заполненной СаО или натронной известью, вставленной в пробку.
Имея стандартные растворы HCl и NaOH можно, определить с точностью до 0,1 % массу веществ, прямо или косвенно участвующих в протолитических реакциях. Если протолит сильный или слабый, но имеет константу равновесия больше, чем 1 · 10-8, то его количество можно определить прямым титрованием. Если протолит слабый (К < 1 · 10-8), то его

56
определение возможно косвенными методами: обратным титрованием (по остатку) или титрованием заместителя.
3.5. Примеры определений методом кислотно-основного титрования
Метод кислотно-основного титрования находит широкое применение при оценке качества различных групп потребительских товаров и особенно пищевых продуктов. Так, этим методом определяют общую (титруемую) кислотность, обусловленную содержанием свободных кислот и кислых солей в сырье и готовой продукции: муке, дрожжах, крахмале, макаронных и кондитерских изделиях, хлебе, безалкогольных напитках, молоке, квашеной капусте и т.д. Кислотно-основное титрование используют при анализе соды NaHCO3, уксусной, лимонной и других кислот, солей аммония, а также при определении азота в органических соединениях по методу Кьельдаля.
3.5.1. Определение массовой доли (%) NaHCO3 в твердом образце соды
Гидрокарбонат натрия при растворении в воде дает щелочную реакцию и может быть оттитрован раствором хлороводородной кислоты по прямому титрованию:
NaHCO3 + HCl = NaCl + H2CO3.
Слабокислую среду в точке эквивалентности (H2CO3) можно зафиксировать индикатором метиловым оранжевым.
Фактор эквивалентности NaHCO3 равен 1, молярная масса эквивалента составляет 84,0 г/моль. Если концентрация хлороводородной кислоты равна 0,1 моль/дм3, тогда при титровании по способу пипетирования и объеме мерной колбы 100,0 см3 масса навески соли составляет примерно 0,8 г.
|
m(NaHCO 3 ) |
0,1 84,0 100,0 |
0,84г 0,8 г. |
|
|
1000 |
|||
Примерно 0,8 г исследуемой соли отвешивают на аптечных весах, переносят в бюкс и взвешивают на аналитических весах. Содержимое бюкса через сухую воронку переносят в мерную колбу. Бюкс с остатками соли взвешивают на тех же аналитических весах. В лабораторном журнале делают записи, например:
|
масса бюкса с навеской |
21,91350 |
г |
|
масса пустого бюкса |
21,11445 |
г |
|
масса навески |
0,79905 |
г |
По разнице массы бюкса с навеской и без навески рассчитывают точную массу навески соли.
57
Дистиллированной водой смывают остатки соли с воронки в мерную колбу и заполняют ее до половины водой. Содержимое колбы перемешивают плавными круговыми движениями до полного растворения крупинок соли, затем доливают водой до метки по нижнему краю мениска, добавляя последние капли воды с помощью пипетки. Колбу закрывают пробкой и тщательно перемешивают раствор, неоднократно переворачивая колбу.
Мерную пипетку вместимостью 20,00 см3 ополаскивают приготовленным раствором соли. С помощью этой пипетки переносят аликвоту (Va) раствора соли в коническую колбу для титрования, добавляют 1 – 2 капли метилового оранжевого. Бюретку промывают 0,1 М раствором хлороводородной кислоты и заполняют ее до нулевой отметки. Титруют раствор гидрокарбоната натрия до перехода окраски от желтой в оранжевую. Можно приготовить два «свидетеля» – один с желтой окраской (без кислоты), другой с оранжевой (с 1 каплей кислоты). Так легче наблюдать резкий переход окраски при титровании.
Титрование проводят до трех сходящихся результатов. Перед каждым титрованием объем кислоты в бюретке доводят до нуля. Результаты титрования записывают в лабораторный журнал, например:
V1 = 19,50 см3 V2 = 19,00 см3 V3 = 18,90 см3 V4 = 18,95 см3
__
Средний объем V рассчитывают из трех последних значений объемов, считая первый результат «промахом».
|
__ |
19,00 |
18,90 |
18,95 |
18,95 см3 . |
|
V |
||||
|
3 |
||||
Значение среднего объема HCl используют для расчета массовой доли (в %) NaHCO3 в исследуемом образце.
|
__ |
||||||||
|
ω(NaHCO3 |
) |
c(HCl) M(NaHCO3 ) V (HCl) Vобщ (NaHCO3 |
) 100 |
, |
||||
|
1000 |
Va |
m |
||||||
|
ω(NaHCO3 |
) |
0,1 84,0 |
18,95 100,0 100 |
99,61% . |
||||
|
1000 |
20,0 0,79905 |
|||||||
3.5.2. Определение массовой доли (%) уксусной кислоты в растворе
Уксусная кислоты имеет константу кислотности Ка = 1,74 ·10-5 и может быть оттитрована щелочью по прямому титрованию:
CH3COOH + NaOH = CH3COONa + H2O.
В точке эквивалентности образуется гидролизирующаяся соль ацетата натрия, создающая щелочную среду. Следовательно, титрование можно проводить с индикатором фенолфталеином.
58
Однако следует учесть возникновение погрешностей данного определения. Титрование слабых кислот, какой является СН3СООН, происходит в присутствии угольной кислоты, находящейся в их водных растворах и в дистиллированной воде, а также образующейся при нейтрализации карбонатов, содержащихся в растворе NaOH.
Дистиллированная вода, не защищенная от действия диоксида углерода воздуха, имеет кислую реакцию (рН = 5,7). Для нейтрализации угольной кислоты с фенолфталеином затрачивается значительное количество раствора HCl. Для устранения влияния на результаты титрования угольной кислоты следует применять ряд особых мер: использовать свежеперегнанную дистиллированную воду, готовить стандартный раствор NaОН в условиях, исключающих попадание в него CO2, вблизи точки эквивалентности кипятить титруемый раствор для разрушения H2CO3, (с последующим охлаждением перед продолжением титрования).
При подготовке исследуемой пробы уксусной кислоты к анализу первоначально необходимо узнать приблизительную исходную концентрацию кислоты. Для этого с помощью ареометра определяют плотность раствора ρ, допустим, она составляет 1,015 г/см3. По справочным таблицам находят соответствующее плотности значение массовой доли (%) и молярной концентрации. Вышеуказанной плотности соответствует ω = 11,7 % и с(СН3СООН) = 1,98 моль/дм3. Если концентрация титранта NaOH равна 0,1 моль/дм3, то очевидно, что концентрация кислоты значительно выше и необходимо ее разбавить. С этой целью рассчитывают объем концентрированного раствора (Vконц) кислоты, необходимый для приготовления примерно 0,1 М раствора объемом, допустим, 100,0 см3 по формуле 2.13 в.
|
V |
0,1 100,0 |
5,05 см3 . |
|
|
конц |
|||
|
1,98 |
|||
Разводят исходный раствор по объему, для чего 5,00 см3 (Vконц) анализируемого раствора с помощью измерительной пипетки переносят в мер-
ную колбу вместимостью 100,0 см3 (Vобщ), доводят объем водой до метки, закрывают пробкой и хорошо перемешивают. Точную концентрацию раствора кислоты устанавливают титрованием 0,1 М раствором NaOH по способу пипетирования.
Методика определения. В колбу для титрования с помощью измерительной пипетки переносят 10,00 см3 разбавленного раствора уксусной кислоты, добавляют 1-2 капли фенолфталенина и титруют 0,1 М раствором NaOH до появления устойчивой в течение 30 с бледно-малиновой окраски. Титрование проводят до трех сходящихся результатов, например:
__
V1 = 9,90 см3; V2 = 9,80 см3; V3 = 9,85 см3; V = 9,85 см3
Массу навески концентрированного исходного образца уксусной кислоты находят по формуле m = Vконц · ρ. Рассчитывают массовую долю (%) СН3СООН в образце. М(СН3СООН) = 60 г/моль.
|
59 |
|||||||
|
ω(CH |
3COOH) |
0,1 60,0 |
9,85 100,0 100 |
11,64 % . |
|||
|
1000 10,0 |
5,00 |
1,015 |
|||||
3.5.3. Определение солей аммония и азота в органических соединениях по Кьельдалю
Определение иона аммония методом прямого титрования невозможно, так как NH4+ представляет собой очень слабую кислоту [К(NH4+) = 0,6 · 10-9]. Определяют соли аммония обычно методами обратного титрования или титрования по замещению.
В одном из методов обратного титрования к анализируемому раствору добавляют избыток точно измеренного титрованного раствора NaOH и нагревают до полного удаления NH3 из раствора (иначе аммиак титруется вместе со щелочью), после чего оставшееся количество щелочи определяют титриметрически с метиловым оранжевым.
|
t0 |
||||
|
NH4Cl + NaOH NH3 + H2O + NaCl, |
||||
|
NaOH + HCl = NaCl + H2O. |
||||
|
Массу аммиака в соли аммония рассчитывают по формуле |
||||
|
m(NH |
) |
[c(NaOH) V(NaOH) c(HCl) V(HCl)] M(NH3 ) |
. |
|
|
3 |
1000 |
|||
В другом методе обратного титрования к анализируемому раствору соли аммония добавляют избыток щелочи и выделившийся аммиак отгоняют в определенный заведомо избыточный объем титрованного раствора кислоты. Количество кислоты, оставшейся в растворе после взаимодействия с аммиаком, определяют титрованием щелочью по метиловому оранжевому. Применение фенолфталеина недопустимо, так как в реакцию могут вступить ионы аммония, присутствующие в растворе:
NH4Cl + NaOH = NH3 · H2O + NaCl,
NH3 + HCl = NH4Cl,
HCl + NaOH = NaCl + H2O.
Результат анализа рассчитывают по формуле:
|
m(NH |
) |
[c(HCl) V(HCl) c(NaOH) V(NaOH)] M(NH3 ) |
. |
|
|
3 |
1000 |
|||
Отгонка аммиака используется в широко известном методе определения азота в органических соединениях по Кьельдалю. В простейшем варианте этого метода пробу обрабатывают при нагревании концентрированной серной кислотой в присутствии катализатора, в результате чего органические соединения окисляются до СО2 и Н2О, а азот переходит в NH4HSO4. После охлаждения к остатку добавляют раствор щелочи и отгоняют NH3 (рис. 3.7) в отмеренный объем титрованного раствора кислоты, а
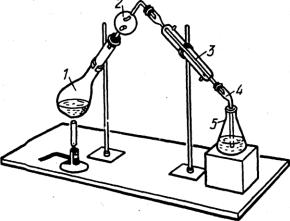
60
затем определяют избыток кислоты, не вошедшей в реакцию с аммиаком, и рассчитывают массу азота в пробе по формуле обратного титрования. Методом Кьельдаля можно определить азот в аминах, аминокислотах, алкалоидах, белках и многих других азотсодержащих соединениях. Этим методом определяют белок во всех белоксодержащих пищевых продуктах.
1. Колба Кьельдаля
2. Ловушка
3. Холодильник
4. Аллонж
5. Приемник
Рис. 3.7. Прибор для отгонки аммиака
Контрольные вопросы:
1.Какие из нижеперечисленных соединений можно определить мето-
дом кислотно-основного титрования: HNO3, NaNO3, NH4NO3, CaCl2, HCl, NH4Cl, Ba(OH)2, Na2CO3, H2SO4, KOH, H3PO4?
2.В каких случаях точка эквиваленнтости лежит при рН = 7 , при рН < 7, при рН > 7?
3.В каких случаях можно достаточно точно оттитровать относительно слабые протолиты?
4.Константа ионизации фенола Ка = 1·10-10. Возможно ли определение этой кислоты методом прямого кислотно-основного титрования?
5.Какие факторы или характеристики влияют на положение точки эквивалентности на кривой титрования, а также на величину и положение скачка титрования?
6.В чем заключается сущность ионно-хромофорной теории индикаторов? Что такое хромофоры и ауксохромы?
7.Что такое интервал перехода окраски индикатора и показатель титрования индикатора? Приведите значение показателя титрования для фенолфталеина и метилового оранжевого.
8.Почему не следует брать много индикатора при титровании?
9.Что такое индикаторная ошибка титрования и за счет чего она возникает?

61
10.Что такое «свидетель» и для чего его применяют при титровании? 11.Какой из индикаторов (метиловый оранжевый, фенолфталеин,
бромтиловый синий) с наименьшей погрешностью позволяет фиксировать точку эквивалентности при титровании: С6Н5СООН + NaOH; Na2CO3 + 2HCl; HNO3 + NaOH; NH3 · H2O + HCl?
12.Как, не прибегая к вычислениям, ориентировочно решить, какой индикатор выбрать для данного кислотно-основного титрования?
13.Какая методика – прямое или обратное титрование – используется при определении содержания следующих веществ: NH3 · H2O, Na2CO3, CH3COOH, NH4Cl, CaCO3? Составить соответствующие уравнения реакций.
14.Почему титр раствора NaOH нельзя найти по точной навеске твердого образца или концентрированного раствора?
15.Какие первичные стандартные вещества (ПСВ) используют для стандартизации: а) щелочи; б) кислоты?
16.По какой формуле рассчитывают массу навески ПСВ: а) по методу отдельных навесок; б) по методу пипетирования?
ГЛАВА 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ (РЕДОКСИМЕРИЯ)
4.1.Общая характеристика редокс-методов
Вредоксиметрии используют реакции окисления-восстановления. В основе метода лежит изменение потенциала окислительно-восстановительной системы при изменении соотношения концентраций окисленной и восстановленной форм в процессе титрования. В реакции участвуют две редокссистемы – титруемого вещества и титранта:
Ох1 + Red2 = Red1 + Ох2
Полнота протекания реакции зависит от разности стандартных потенциалов редокс-пар и константы равновесия реакции К:
Е = Е0(Ох1/Red2) – E0(Ox2/Red2),
|
lg K |
E n |
или |
K 10 |
E n |
, |
|
|
0,059 |
0,059 |
|||||
где n – число перемещаемых электронов, равное наименьшему кратному в полуреакциях.
Константа равновесия реакции тем больше, чем больше разность потенциалов. В этом заключается одна из основных причин того, что при титровании восстановителей предпочитаются титранты с высоким редокспотенциалом, а при титровании окислителей – восстановители с низким значением Е0. Кроме того, насколько более высок стандартный потенциал
62
используемой как окислитель редокс-пары, настолько больше восстановителей, которые можно оттитровать и определить с ее помощью. Так, стандартный потенциал окислителя KMnO4 в кислой среде (Е0(MnO4-, H+/Mn2+ = 1,51 В)) позволяет с достаточной полнотой протекания реакции оттитровать многие восстановители, например, соли железа (II):
E0(Fe3+/Fe2+) = 0,77 В,
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O, ΔE = 1,51 – 0,77 = 0,74 В,
|
lg K |
0,74 |
5 |
64, К 1 1064 . |
|
|
0,059 |
||||
Разность потенциалов влияет и на величину скачка на кривой титрова-
ния, которую строят в координатах Е – V (титранта). Чем больше Е, тем больше скачок титрования и тем точнее титриметрическое определение.
Вотличие от реакций кислотно-основного титрования, окислительновосстановительные реакции протекают значительно сложнее. Во многих реакциях взаимодействуют не только окислители и восстановители, но и другие вещества (кислоты, щелочи). Часто реакции протекают в несколько стадий, причем каждая из них проходит с различной скоростью. Скорость окислительно-восстановительных реакций ниже скорости ионообменных реакций. Учитывая эти особенности протекания окислительно-восстановительных реакций, необходимо создать условия, при которых они могут удовлетворять требованиям титриметрии. Так, необходимую скорость реакций часто увеличивают искусственно: повышением температуры, концентрации реагирующих веществ, изменением рН раствора и применением катализатора.
Взависимости от применяемого титранта-окислителя редокс-методы
делят на перманганатометрию (KMnO4), иодометрию (J2), броматометрию (KBrО3), дихроматометрию (К2Cr2O7) и другие. В качестве титрантоввосстановителей применяют Na2S2O3, FeSO4, H2C2O4, Na3AsO3.
Для фиксирования точки эквивалентности в редоксиметрическом титровании используют: 1) исчезновение или появление окраски титранта или титруемого вещества; 2) окислительно-восстановительные и специфические индикаторы; 3) инструментальные методы.
Так, при титровании раствором KMnO4 с концентрацией не менее 0,02М раствор окрашивается в розовый цвет при введении одной лишней капли титранта.
Специфические индикаторы – это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительновосстановительной системы. Например, при титровании иода используют крахмал, образующий темно-синее соединение с J3– – ионами.
63
Окислительно-восстановительные (редокс) индикаторы – это со-
единения, в основном органические, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску. Например, в качестве редокс-индикаторов используют дифениламин (см. качественную реакцию на нитрат-ион) и его производные. Редокс-индикаторы, как и рН-индикаторы, имеют интервал Е перехода окраски и подбираются для титрования по значению Е в точке эквивалентности или по скачку на кривой титрования.
4.2. Перманганатометрия
Перганатометрический метод анализа основан на реакции перманганата калия с восстановителями преимущественно в кислой среде:
MnO4– + 8H+ + 5ē = Mn2+ + H2O, Е0 = 1,51 В.
В слабокислых, нейтральных и щелочных растворах восстановление происходит до оксида марганца (IV), малорастворимого соединения бурого цвета:
|
MnO4– + 4H+ + 3ē = MnO2 ↓ + 2H2O, |
E0 |
= 1,69 В, |
|
MnO4– + 2H2O + 3ē = MnO2↓ + 4OH–, |
E0 |
= 0,60 В. |
В процессе титрования анализируемого раствора в кислой среде мали- ново-фиолетовая окраска перманганата калия обесцвечивается (ионы Mn2+ бесцветны). Добавление одной избыточной капли KMnO4 после достижения эквивалентности при титровании позволяет зафиксировать этот момент по появлению бледно-малиновой окраски раствора. Таким образом, не требуется дополнительный индикатор. В случае образования бурого осадка MnO2 фиксирование точки эквивалентности затрудняется.
Перманганат калия в кислой среде является сильным окислителем (Е0 =
1,51 В), и его применяют для определения многих восстановителей: ионов металлов (Fe2+, Sn2+, Cu+, Mn2+, Sb3+ и других), неметаллов (S2-, J–, Br–, SO32-,
S2O32-, CN–, NO2–, AsO33-, C2O42-), пероксида водорода. Метод перманганатометрии может быть использован для количественного определения не только восстановителей, но и окислителей. Окислители восстанавливают титрованным раствором щавелевой кислоты или арсенита натрия и избыток восстановителя оттитровывают перманганатом калия.
По заместительному титрованию возможно перманганатометрическое определение ионов, образующих малорастворимые оксалаты (Ca, Mg, Zn, Ba, Pb, Ag и др), которые отделяют от раствора, растворяют в кислоте и затем оттитровывают щавелевую кислоту перманганатом калия
Анализ некоторых органических соединений проводят в сильнощелочной среде:
MnO4– + ē = MnO42-, E0 = 0,56 В.
Органические соединения при этом обычно окисляются до карбонат-иона. По окончании реакции окисления избыток KMnO4 подкисляют и титруют стандартным раствором железа (II) или другого подходящего восстановителя. Таким образом опре-
64
деляют метиловый спирт, муравьиную, винную, лимонную кислоты и другие органические соединения.
Условия титрования в кислой среде. Процесс окисления неорганиче-
ских и органических веществ раствором перманганата калия довольно сложен. На различных стадиях протекания реакции образуются соединения марганца разной степени окисления Mn2+, Mn3+, Mn (IV), Mn (VI), причем, каждая ступень реакции проходит с различной скоростью. Для того чтобы все промежуточные стадии восстановления Mn (VII) в Mn2+ были количественно завершены, необходимо создать соответствующие условия, в частности, титрование необходимо проводить относительно медленно, при определенном значении рН среды и температуры. Повышение концентрации ионов водорода и температуры способствует более быстрому течению этой реакции. Скорость реакции повышается в процессе титрования также за счет каталитического действия образующихся ионов Mn2+ (явление автокатализа).
Кроме того, подкисление титруемого раствора в перманганатометрии необходимо проводить только серной кислотой. Хлороводородную кислоту применять нельзя, так как хлорид-ионы окисляются до Cl2, который частично улетучивается (следовательно, невозможно учесть его эквивалентное окислительное действие на восстановители), что приводит к повышенному расходу KMnO4 при титровании:
10Cl– + 2MnO4– + 16H+ = 5Cl2 + 2Mn2+ + 8H2O.
Особенно этот процесс ускоряется в присутствии ионов Fe2+ за счет протекания сопряженной (индуцированной) реакции.
Азотная кислота, являющаяся окислителем, для подкисления в методах редоксиметрии не применяется.
При титровании раствором KMnO4 следует пользоваться бюреткой со стеклянным краном, так как резина окисляется.
Титрованный раствор KMnO4 по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержится некоторое количество MnO2 и другие продукты разложения. Раствор перманганата калия неустойчив из-за реакции с водой, катализируемой оксидом марганца (IV) на свету:
4MnO4– + 2H2O = 4MnO2↓ + 3O2 + 4OH–.
Поэтому раствор перманганата калия следует готовить используя чистую воду, так как органические примеси в воде могут реагировать с MnO4– и давать MnO2. Перед установлением точной концентрации раствор KMnO4 необходимо выдержать в темной склянке в течение 7-10 дней для окончания протекания всех процессов (для ускорения процесса раствор KMnO4 иногда кипятят). Затем осадок MnO2 следует удалить путем фильтрования через стеклянный фильтр. Приготовленный таким образом рас-

65
твор перманганата калия с нормальной концентрацией не ниже 0,05 моль/дм3 (fэкв = 1/5) не изменяет титр продолжительное время.
Стандартизацию раствора перманганата калия проводят по оксалату натрия, дигидрату щавелевой кислоты H2C2O4 · 2H2O, K4[Fe(CN)6], As2O3, соли Мора (NH4)2Fe(SO4)2 · 6H2O, металлическому железу.
Реакция окисления щавелевой кислоты перманганатом калия протекает по уравнению
5H2C2O4 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8H2O, 2 MnO4– + 8H+ + 5ē = Mn2+ + 4H2O
5 C2O42- – 2ē = 2CO2
5C2O42- + 2MnO4– + 16H+ = 10CO2 + 2Mn2+ + 8H2O.
Однако это уравнение выражает только суммарный результат реакции. Реакция между перманганат- и оксалат-ионами протекает очень медленно, поэтому титрование проводят при нагревании раствора щавелевой кислоты до 70-80 0С. Нагревание раствора выше этой температуры может привести к частичному разложению щавелевой кислоты:
H2C2O4 = H2O + CO2 + CO.
Примеры определений перманганатометрическим методом
Определение Fe (II) в гептагидрате сульфата железа (II) FeSO4 · 7H2O и соли Мора (NH4)2Fe(SO4)2 · 6H2O. При титровании перманганатом калия железо (II) окисляется до железа (III):
|
Fe2+ – ē = Fe3+, |
E0 = 0,77 В, |
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O.
Фактор эквивалентности для железа равен единице. Молярная масса соли Мора составляет 392,14 г/моль, молярная масса эквивалента равна молярной массе. Большая эквивалентная масса соли Мора позволяет проводить опреде-
ление методом отдельных навесок.
Рассчитывают массу навески соли Мора для единичного определения, с учетом, что с(1/5KMnO4) = 0,05 моль/дм3 и на титрование должно пойти примерно 20 см3 титранта.
|
m(солиМора) |
392,14 |
0,05 |
20 |
0,3921 0,4 г . |
|
1000 |
||||
Отвешивают 0,4 г соли Мора на аптечных весах, помещают навеску в бюкс, взвешивают на аналитических весах, переносят соль в коническую колбу для титрования и взвешивают пустой бюкс. По разнице масс бюкса с навеской и без навески находят точную массу соли Мора. В колбу добавляют примерно 20 см3 дистиллированной воды, перемешивают до растворения соли. Затем добавляют 20 см3 2н. раствора H2SO4 и титруют 0,05 н. раствором KMnO4 до появления бледно-малинового окрашивания, устойчивого в течение 30 с. В конце титрования новую каплю титранта прибавляют только по-

66
сле того, как исчезнет окраска от последней капли. Рассчитывают массовую долю (%) Fe в соли. M(Fe) = 55,847 г/моль.
|
(Fe) |
c[(1/ 5)KMnO4 |
] M (Fe) V (KMnO4 ) 100 |
. |
|
|
1000 |
m(соли) |
|||
Проводят 2-3 таких определения и рассчитывают среднее значение массовой доли (в %).
Это же определение можно провести методом пипетирования, тогда соответствующую массу навески соли помещают в мерную колбу, растворяют в воде, добавляют раствор H2SO4 и затем объем доводят водой до метки. Аликвоту уже подкисленного раствора соли железа титруют перманганатом калия.
Определение нитритов. Нитрит-ионы окисляются перманганатом калия до нитрат-ионов.
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O,
5 NO2– + H2O – 2ē = NO3– + 2H+
2 MnO4– + 8H+ + 5ē = Mn2+ + 4H2O
5NO2– + 2MnO4– + 6H+ = 5NO3– + 2Mn2+ + 3H2O.
Особенностью рассматриваемого определения является то обстоятельство, что нитриты легко разлагаются кислотами с образованием оксидов азота:
2NO2– + 2H+ = 2HNO2 = NO↑ + NO2↑+ H2O.
Поэтому, чтобы избежать потерь, приходится применять обратный порядок титрования (реверсивное титрование). Подкисленный раствор перманганата калия титруют нейтральным раствором нитрита. При этом нитрит, попадая в раствор KMnO4, практически мгновенно окисляется до нитрата, и оксида азота не образуется. Титрование проводят до обесцвечивания раствора.
Можно также вводить раствор нитрита в подкисленный титрованный раствор KMnO4, взятый в избытке. Остаток KMnO4 затем определяют иодометрически по обратному титрованию.
Определение пероксида водорода. В реакции с KMnO4 пероксид водоро-
да проявляет свойства восстановителя и окисляется до О2:
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O, 5 H2O2 – 2ē = O2 + 2H+
2 MnO4– + 8H+ + 5ē = Mn2+ + 4H2O.
Торговый препарат пероксида водорода (пергидроль) содержит около 30% H2O2. Первоначально необходимо установить плотность исследуемого раствора, рассчитать массу навески и соответствующий объем, необходимый для приготовления в мерной колбе приблизительно 0,05н. раствора. Рассчитанный объем пергидроля отмеряют пипеткой с резиновой грушей и переносят в предварительно взвешенный бюкс, определяют массу бюкса с навеской, взвешивая его на тех же весах. Содержимое бюкса количественно (смывая водой несколько раз) переносят в мерную колбу, добавляют воды до полови-

67
ны ее объема, перемешивают, добавляют объем водой до метки и вновь перемешивают.
В колбу для титрования переносят 10,00 см3 разбавленного раствора, добавляют 15 см3 2н. раствора H2SO4, 15-20 см3 воды, перемешивают и титруют 0,05н. раствором KMnO4 до появления бледно-малиновой окраски раствора.
Титрование проводят до трех сходящихся результатов и рассчитывают массовую долю (%) H2O2 в образце:
|
__ |
||||||
|
(H |
2O2 ) |
c[(1/ 5)KMnO4 |
] M[(1/ 2)H 2O2 |
] V (KMnO4 ) Vобщ |
100 |
. |
|
1000 |
Va |
m(H 2O2 ) |
||||
Определение содержания кальция в растворе. Перманганатометриче-
ское определение кальция возможно только косвенными методами, так как катион Са2+ не может быть восстановителем, следовательно, не взаимодействует с KMnO4. Определение Са2+ проводят заместительным титрованием.
По заместительному титрованию из анализируемого раствора ионы кальция осаждают действием щавелевой кислоты:
Са2+ + С2O42- = CaC2O4↓.
Осадок оксалата кальция отфильтровывают, промывают и обрабатывают горячим раствором серной кислоты. При этом в раствор переходит эквивалентное кальцию количество щавелевой кислоты:
CaC2O4 + H2SO4 = CaSO4 + H2C2O4.
Образовавшуюся щавелевую кислоту титруют перманганатом калия.
5H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 + K2SO4 + 8H2O.
Фактор эквивалентности для оксалат-иона равен 1/2, следовательно, и для Са2+, взаимодействующего с оксалатом-ионом в соотношении 1:1, соответственно равен 1/2.
Метод перманганатометрии является одним из распространенных методов редоксиметрии. Его широко используют для анализа лекарственных и биологических препаратов, воды и пищевых продуктов. Так, этим методом определяют сахара в хлебобулочных изделиях, примеси KJ в поваренной соли. По количественному содержанию кальция рассчитывают количество молока в напитках (кофе, какао). Перманганатометрию используют для определения общей окисляемости воды и почвы.
4.3. Дихроматометрия
Дихроматометрическое титрование основано на взаимодействии определяемых веществ с дихроматом калия. Основной реакцией метода является реакция окисления восстановителей дихроматом калия в кислой среде.
|
68 |
|
|
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O, |
E0 = 1,33 В. |
Как показывает величина стандартного окислительно-восстановительного потенциала, дихромат калия является менее сильным окислителем, чем
KMnO4, но тем не менее дихроматометрию успешно применяют для определения многих восстановителей: Fe2+, Mn2+, Sb3+, Sn2+, SO32-, AsO33-, J–,
[Fe(CN)6]4-, спиртов, глицерина, аскорбиновой кислоты и др. Например:
Cr2O72- + 6[Fe(CN)6]4- + 14H+ = 2Cr3+ + 6[Fe(CN)6]3- + 7H2O,
Cr2O72- + CH3OH + 8H+ = 2Cr3+ + CO2 + 6H2O, 2Cr2O72- + 3C2H5OH + 16H+ = 4Cr3+ + 3CH3COOH + 11H2O.
Достоинством дихраматометрического метода является то, что титрованный раствор можно приготовить по точной навеске, поскольку K2Cr2O7 удовлетворяет всем требования первичного стандарта. Раствор K2Cr2O7 очень устойчив. Дихромат калия не окисляет (без нагревания) хлоридионы, что позволяет проводить титрование в соляно-кислой среде.
Для фиксирования точки эквивалентности чаще всего используют редокс-индикаторы: дифениламин и его производные (дифениламиносульфоновую, фенилантраниловую кислоты).
Механизм реакций с участием ионов Cr2O72- сложен. В случае медленного протекания реакции прибегают к обратному титрованию, при нагревании избыток K2Cr2O7 оттитровывают раствором соли железа (II). По обратному титрованию определяют и окислители, которые предварительно восстанавливают избытком титранта (Fe2+), остаток которого титруют раствором K2Cr2O7:
3Fe2+ + NO3– + H+ = 3Fe3+ + NO↑ + 2H2O,
6Fe2+ + Cr2O72- + 14H+ = 6Fe3+ + 2Cr2- + 7H2O.
Иногда используют осадительный вариант метода (заместительное титрование) для анализа солей Ag+, Ba2+, Pb2+, образующих нерастворимые осадки хроматов.
4.4.Иодометрия
Воснове иодометрического титрования лежат реакции восстановления свободного иода до иодид-ионов и окисления иодид-ионов в свободный иод (реакция обратима):
|
J2 + 2ē 2J –, |
E0 = 0,62 В. |
Иод плохо растворим в воде, но в присутствии иодид-иона образуется комплексный ион J3–, поэтому при титровании протекает реакция:
|
J3 |
– + 2ē 3J –, E0 = 0,54 В. |
Хорошая обратимость реакции и невысокий стандартный потенциал E0(J3–/3J–) позволяют определять иодометрически восстановители, стан-
69
дартный потенциал, которых меньше 0,54 В, и окислители, потенциал которых больше потенциала пары иода.
При прямом определении восстановителей рабочим стандартным раствором случит раствор иода, который готовят растворением очищенного путем возгонки J2 в растворе KJ. Хранят раствор в темной склянке (с плотно пришлифованной стеклянной пробкой) во избежание окисления иодида (окисление иодид-ионов кислородом воздуха ускоряется на свету) и улетучивания образовавшегося иода. Концентрацию раствора иода можно проверить по ПСВ, например, As2O3.
Метод титрования раствором иода иногда называют иодиметрией. Его используют для определения Sn (II), As (III), Sb (III), S2-, SO32-, S2O32-, орга-
нических соединений, например, аскорбиновой кислоты, сахаров, спиртов, альдегидов. Определение некоторых восстановителей по ряду причин проводят по обратному титрованию. Вторым титрантом служит раствор тиосульфата натрия, который окисляется до тетратионата натрия. Например, определение сульфитов основано на реакциях:
Na2SO32- + J2 + H2O = Na2SO4 + 2HJ,
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6.
Прямая реакция восстановления иода идет быстро, но обратная реакция окисления иодида протекает медленнее. Поэтому использовать раствор иодида для определения окислителей путем прямого титрования невозможно. К тому же раствор KJ неустойчив, поскольку иодид-ион окисляется кислородом воздуха. В этом случае используют заместительное титрование – добавляют к окислителю избыток иодида, а выделившийся в эквивалентном количестве иод оттитровывают стандартным раствором тиосульфата натрия. Этот метод называют иодометрия (следует отметить, что терминология разделения на иодиметрию и иодометрию соблюдается не строго и обе группы методов часто называют иодометрическими). Иодометрическим методом определяют окислители: KMnO4, K2Cr2O7, KClO3, NaNO2, H2O2, Cl2, Br2, соли меди (II), железа (III) и др.
Кислородосодержащие окислители взаимодействуют с избытком иодида калия в кислой среде, например перманганат-ион:
2MnO4– + 10J– + 16H+ = 2Mn2+ + 5J2 + 8H2O, J2 + 2S2O32- = 2J– + S4O62-.
Титровать окислители (кроме J2) непосредственно тиосульфатом натрия нельзя, так как во многих случаях реакция нестехиометрична и невозможно использовать специфический индикатор метода – крахмал.
Раствор тиосульфата натрия является вторичным стандартным раствором, который готовят из пентагидрата тиосульфата натрия Na2S2O3 · 5H2O. Раствор неустойчив. В нем возможно окисление кислородом воздуха S2O32- до SO42- и S, а также образование HSO3– (под влиянием углекислоты). Таким образом, свежеприготовленный раствор Na2S2O3 первое время (7-10

70
дней) медленно меняет свой титр. Добавление Na2CO3 и предохранение от CO2 с помощью хлоркальциевой трубки стабилизирует раствор. Рекомендуется также добавлять немного фенола или хлорамина для уничтожения серных бактерий, способствующих разложению реагента.
Для стандартизации раствора тиосульфата натрия обычно используется дихромат калия:
K2Cr2O7 + 6KJ + 7H2SO4 = Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O, 1 Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O
3 2J– – 2ē = J2.
Выделившийся через несколько минут иод титруют тиосульфатом натрия
2Na2S2O3 + J2 = 2NaJ + Na2S4O6,
1 2S2O3– – 2ē = S4O62-
1 J2 + 2ē = 2J–.
Из ионного уравнения реакции видно, что два тиосульфата-иона S2O32- превращаются в один тетратионат-ион S4O62-, отдавая молекуле иода два электрона. Следовательно, фактор эквивалентности тиосульфата натрия равен (2/2) единице.
Стандартизованный 0,05-0,02М раствор тиосульфата натрия хранят в склянках из темного стекла, при рассеянном свете или в темноте. Титр раствора проверяют еженедельно. Если раствор помутнел, его выливают, так как выпадение серы свидетельствует о существенном разложении тиосульфата натрия.
Фиксирование точки эквивалентности в иодометрии возможно без добавления индикатора по обесцвечиваю желтой окраски иода при его титровании тиосульфатом или по появлению желтой окраски от одной кали иода при прямом титровании восстановителей. Однако этот способ недостаточно чувствителен. При титровании разбавленных или окрашенных растворов в качестве индикатора используют крахмал. Крахмал не растворяется в воде. Но при нагревании его взвеси до кипения получается коллоидный раствор, который и используется в иодометрии. Чувствительность крахмала к иоду значительно повышается в присутствии иодид-ионов (до 10-5М). В коллоидном состоянии крахмал образует с полигалид-ионом [J3]– адсорбционное соединение синего цвета.
При работе с крахмалом в качестве индикатора следует учитывать некоторые особенности. К раствору, содержащему иод, крахмал добавляют в конце титрования, когда раствор приобретет слабую соломенно-желтую окраску. Объясняется это не только тем, что крупные сгустки крахмала медленно отдают адсорбированный иод и плохо обесцвечиваются тиосульфатом. Помимо этого, крахмал обладает свойством частично восстанавливать некоторые окислители. Поэтому вблизи точки конца титрования необходимо добавлять раствор тиосульфата натрия по одной капле, после каждой капли тщательно перемешивать и ждать обесцвечивания раствора
71
в течение 3-5 с. Если не соблюдать эти условия, раствор очень легко перетитровать. При прямом титровании восстановителей, например хлорида олова (II), раствор крахмала приливают с самого начала титрования и титруют до появления синего окрашивания.
В качестве индикатора используют свежеприготовленный 0,2%-0,5% раствор крахмала. Для повышения устойчивости (раствор быстро разлагается микроорганизмами) раствор стерилизуют в течение 2-3 часов на водяной бане или к раствору добавляют антисептики (ZnCl2, HgJ2, салициловую кислоту). Обычно на 50 см3 титруемого раствора добавляют 2-3 см3 индикатора.
Иодометрическое титрование необходимо проводить при определенных условиях. Прямое титрование иодом обычно проводят в нейтральной или кислой среде. При рН > 11 иод окисляется до гипоиодита JO–:
J2 + 2OH– = JO– + J– + H2O.
Гипоиодит-ион является более сильным окислителем, чем J2, дает побочные реакции, например окисляет тиосульфат-ион до сульфата:
S2O32- + 4JO– + 2OH = 4J– + 2SO42- + H2O.
Поэтому титровать в щелочной среде (рН > 8) не рекомендуется.
В большинстве методик окисление органических веществ проводят в щелочной среде, то есть гипоиодитом, но после окончания реакции раствор подкисляют и избыток вновь выделившегося иода оттитровывают тиосульфатом. Титрование в сильнокислой среде может привести к возникновению погрешности, связанной с частичным окислением J– кислородом воздуха. Кроме того, титрование окислителей проводят при избытке иодида калия, который необходим для растворения J2. Так как скорость взаимодействия окислителей с KJ невелика, то дают время (10-15 минут) для завершения реакции. При этом реакционную смесь в закрытой колбе оставляют в темном месте. Титрование проводят при комнатной температуре, так как при нагревании J2 улетучивается и, кроме того, понижается чувствительность иод-крахмальной реакции.
Возможности иодометрического метода распространяются не только на реакции окисления-восстановления, но и на реакции присоединения, замещения и др. Так, реакции присоединения широко применяются в аналитической химии органических соединений для количественного определения двойных связей в ненасыщенных соединениях:
> C = C < + J2 = > CJ ─ CJ < .
Степень ненасыщенности определяется иодным числом, которое служит одной из характеристик, например, жидких жиров.
Иод способен замещать атомы водорода в ароматических соединениях, например, фенолах, ароматических диаминах и др.
Иодометрические определения отличаются большим разнообразием и этим объясняется широкое применение метода в практике различных ла-
72
бораторий. Так, метод иодометрии применяют для определения альдегидов и кетонов в объектах пищевой промышленности, бисульфитсвязывающих соединений, иодного числа, используемого главным образом для определения липидов, жирных кислот и при определении содержания реагирующих с иодом примесей в ароматических углеводородах; редуцирующих веществ в различных пищевых продуктах, сернистой и аскорбиновой кислоты во фруктов-ягодных полуфабрикатах и напитках.
Определение массовой доли (%) аскорбиновой кислоты в растворе
Метод основан на окислении аскорбиновой кислоты (АК) иодом в кислой среде до дегидроаскорбиновой кислоты (ДГАК):
C6H8O6 + J2 = C6H6O6 + 2HJ,
C6H8O6 – 2ē = C6H6O6 + 2H+, J2 + 2ē = 2J– .
Стандартный потенциал ЕДГАК/АК при рН 1 составляет 0,33 В. Фактор эквивалентности аскорбиновой кислоты равен 1/2. М(АК)= 176,0 г/моль.
Обычно используют обратное титрование. Не участвующий в реакции остаток иода оттитровывают тиосульфатом натрия с индикатором – крахмалом:
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6.
Для определения приблизительной концентрации анализируемого раствора определяют его плотность по ареометру. Допустим, плотность раствора ρ = 1,035 г/см3, ей соответствует массовая доля – 8,5 %. Нормальную концентрацию раствора находят по формуле 2.12 б:
|
с(1/ 2) А.К. |
8,5 10 1,035 |
0,999 1 моль / дм3 . |
|
88,0 |
||
Так как при титровании используют 0,05н. раствор иода, необходимо разбавить исследуемый раствор до концентрации титранта. Находят объем концентрированного раствора Vконц, необходимый для приготовления, допустим, 100,0 см3 разбавленного (~ 0,05н.) раствора аскорбиновой кислоты:
|
V |
0,05 100,0 |
5,0 см3 . |
||
|
конц |
||||
|
1 |
||||
Рассчитанный объем с помощью измерительной пипетки на 5,00 см3 переносят в мерную колбу вместимостью 100,0 см3, добавляют объем водой до метки и вновь перемешивают. Далее определение проводят по следующей методике. В коническую колбу для титрования переносят пипеткой 10,00 см3 разбавленного раствора аскорбиновой кислоты, добавляют с помощью цилиндра 4 см3 6 М раствора H2SO4, вводят из бюретки 20,00 см3 0,05н. раствора иода. Колбу закрывают пробкой, оставляют в темном месте на 3-5 минут и затем титруют избыток иода 0,05 М раствором Na2S2O3. Сначала титруют без индикатора. Когда окраска из темно-бурой превра-

73
тится в соломенно-желтую, прибавляют 1-2 см3 0,5 % раствора крахмала и (не доливая объема бюретки) продолжают медленно титровать, хорошо перемешивая раствор, до исчезновения синей окраски.
Титрование повторяют до трех сходящихся результатов. Находят средний объем тиосульфата натрия и рассчитывают массовую долю (в %) аскорбиновой кислоты в исходном образце:
|
ω(A.K.) |
[c(1/2J |
2 ) V(J |
2 ) c(Na 2 S2 O3 |
) V(Na2 S2O3 )] M(1/2A.K.) Vобщ |
100 |
. |
|
1000 |
Va |
ρ Vконц |
||||
Контрольные вопросы
1.Каким требованиям должны отвечать окислительно-восстановительные реакции, лежащие в основе количественных определений?
2.Какая реакция лежит в основе перманганатометрического титрования?
3.Почему перманганатометрическое титрование проводят, в основном, в кислой среде? Какая кислота при этом используется?
4.Каким образом определяют точку эквивалентности в методе перманганатометрии?
5.Как готовится титрованный раствор перманганата калия? Какие ПСВ используются для его стандартизации?
6.Какое вещество является катализатором при перманганатометрических определениях?
7.Уравняйте реакцию и определите фактор эквивалентности для окислителя и восстановителя:
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O.
8.Какая реакция лежит в основе дихроматометрии?
9.В чем заключается сущность иодометрии?
10.Почему в перманганатометрии и дихроматометрии используются лишь окисленные, но не восстановленные формы соответствующих редокспар? Почему в отличие от этого в идометрии используются обе формы пары?
11.Как проводят определение окислителей и восстановителей иодометрическим методом?
12.Какие условия необходимо соблюдать при иодометрических определениях?
13.Каковы особенности приготовления титрованных растворов иода и тиосульфата натрия?
14.Почему при иодометрическом определении окислителей используется большой избыток KJ?
15.В чем заключаются особенности использования крахмала в качестве индикатора?
74
ГЛАВА 5.2. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
5.1. Осадительное титрование
Методы осадительного титрования основаны на реакциях осаждения. Не все реакции осаждения пригодны для титриметрических определений, а только те из них, которые удовлетворяют ряду требований:
1)реакция должна протекать стехиометрично (обычно используют реакции, где ионы взаимодействуют в соотношении 1:1);
2)осадок должен быть практически не растворим;
3)осадок должен выпадать быстро;
4)явления соосаждения не должны заметно искажать результаты титрования;
5)должна иметься возможность фиксировать точку эквивалентности. Удовлетворительны с этой точки зрения реакции осаждения галогени-
дов и тиоцианата нитратом серебра или нитратом ртути (I). Методы аргентометриии применяют для анализа солей галогеноводородных кис- лот-хлоридов, бромидов и иодидов щелочных и щелочноземельных металлов и органических оснований. Соли серебра определяют путем осаждения их тиоцианатом аммония или калия (тиоцианатометрия). Реже применяют меркурометрическое определение галогенидов.
5.1.1. Аргентометрическое титрование
Основными стандартными растворами аргентометрии являются нитрат серебра и тиоцианат аммония. Хранят раствор AgNO3 в склянках из темного стекла, так как на свету соли серебра неустойчивы. Стандартизацию раствора AgNO3 обычно проводят по NaCl. Точную концентрацию NH4NCS (или KNCS) устанавливают по вторичному стандартному раство-
ру AgNO3.
Конечная точка титрования в аргентометрии может быть установлена различными способами, вошедшими в химическую литературу под именами ученых, которые их разработали: методы Гей-Люссака, Мора, Фольгарда, Фаянса.
Так, по методу Гей-Люссака индикатор не используют, титрование проводят до просветления, когда новая порция осадителя не вызывает помутнения раствора. Метод достаточно точный, но требует много времени, и в настоящее время практически не применяется.
Метод Мора. В качестве индикатора в методе Мора используют хромат калия K2CrO4. Хромат-ионы образуют с ионами серебра кирпичнокрасный осадок Ag2CrO4, более растворимый, чем галогениды серебра
75
[P(Ag2CrO4) = 6,5 · 10-5 моль/дм3, P(AgCl) = 1,3 · 10-5 моль/дм3, P(AgBr) =
7,2 · 10-7 моль/дм3].
При титровании хромат серебра не образуется, пока не будет оттитрован галогенид-ион:
Cl– + Ag+ = AgCl↓,
CrO42- + 2Ag+ = Ag2CrO4↓.
Важно правильно выбрать концентрацию хромат-ионов. Если она будет очень мала, потребуется большой избыток серебра для образования заметного визуально осадка. При слишком большой концентрации CrO42- образование осадка начинается раньше, чем оттитруется галогенид-ион. На практике создают концентрацию CrO42-, равную 0,01 – 0,05 моль/дм3.
Титрование с хроматом в качестве индикатора проводится в нейтральной или слабощелочной среде, когда рН раствора больше 6,5; но менее 10,5. В более кислой среде происходит протонирование хромата и чувствительность индикатора падает:
CrO42- + H+ = HСrO4– и 2HCrO4– = Cr2O72- + H2O.
В щелочной среде может выпадать осадок оксида серебра (раньше, чем хромата серебра):
Ag+ + OH– = AgOH↓, 2AgOH = Ag2O↓ + H2O.
В аммиачной среде хлорид и хромат серебра растворяются с образованием комплексного аммиаката серебра.
Метод Мора применим для определения хлоридов и бромидов. Иодиды и тиоционаты не определяются, так как вследствие их адсорбции на поверхности осадка установление точки эквивалентности становится затруднительным. Определению по методу Мора мешают ионы, образующие осадки с хроматом или ионом серебра, а также окрашенные ионы.
Метод Мора широко применяется при анализе пищевых продуктов. Этим методом определяют содержание поваренной соли в отдельных продуктах или рассолах.
Метод Фольгарда. Метод основан на титровании ионов серебра раствором тиоционата аммония в присутствии ионов Fe (III) в качестве индикатора:
Ag+ + NCS– = AgNCS↓,
Fe3+ + NCS– = [Fe(NCS)]2+.
После оттитрования ионов серебра, лишняя капля титранта NH4NCS образует с ионами Fe3+ тиоцианатный комплекс и раствор приобретает оранжевую окраску. В качестве индикатора используют железоаммонийные квасцы (NH4)2Fe(SO4)2 · 12H2O или другие соли Fe (III). Обычно создают концентрацию Fe3+ около 0,01 моль/дм3. Титрование проводят в кислой среде (для подавления гидролиза соли железа).
Для определения анионов этим методом (Cl–, Br–, J–) используют обратное титрование. К раствору титруемого иона добавляют избыток стан-
76
дартного раствора нитрата серебра, после образования осадка оттитровывают избыток AgNO3 стандартным раствором NH4NCS в присутствии соли железа (III). При образовании осадков менее растворимых, чем AgNCS (ПР = 1,1 · 10-12), возможно непосредственное титрование избытка Ag+ над осадком (определение J–, Br–), но при определении Cl– более растворимый AgCl (ПР = 1,78 · 10-10) может частично перейти в AgNCS, поэтому необходимо отделить его (фильтрованием или добавлением тяжелого органического растворителя, например нитробензола, покрывающего осадок и предохраняющего его от контакта с раствором):
Br– + Ag+ = AgBr↓,
Ag+ + NCS– = AgNCS↓,
NCS– + Fe3+ = [Fe(NCS)]2+.
Существенным достоинством метода Фольгарда является возможность определения галогенидов в кислой среде.
Метод Фаянса. В методе Фаянса используют адсорбционные индикаторы, которые при адсорбции на осадке изменяют цвет. Установлено, что в первую очередь на осадке адсорбируются ионы, одноименные с осадком и находящиеся в избытке. Например, при титровании хлорида натрия нитратом серебра на осадке AgCl до точки эквивалентности будут адсорбироваться преимущественно хлорид-ионы (AgCl/Cl–) и для нейтрализации отрицательного заряда к частицам осадка будут притягиваться ионы Na+ (AgCl/Cl– · Na+). После точки эквивалентности адсорбироваться на осадке будут избыточные ионы Ag+ и для нейтрализации уже положительного заряда осадка из раствора будут притягиваться отрицательно заряженные ионы, в том числе ионы индикатора. Анионы некоторых красителей, адсорбируясь, меняют свой цвет. Например, флуоресцеин – слабая органическая кислота желто-зеленого цвета, диссоциирует с образованием аниона (Фл–), который, адсорбируясь на положительно заряженном осадке (AgCl/Ag+ · Фл–), изменяет свой цвет на розовый. Титрование с флуоресцеином происходит при рН 7-10. При титровании в более кислой среде следует использовать красители с более сильными кислотными свойствами, например тетрабромфлуоресцеин (эозин).
Необходимым условием применения адсорбционного индикатора является его способность служить противоионом, но не вытеснять первичноадсорбированный ион осадка. Однозарядные анионы замещают друг друга на поверхности галогенида серебра в порядке, коррелирующим с поляризуемостью анионов. При рН 7 порядок замещения таков: J–, CN– >NCS– > Br– > анион эозина > Cl– > анион флуоресцеина. Таким образом, при рН 7 анион флуоресцеина будет служить индикатором, если он стоит в этом ряду правее титруемого иона.
77
5.1.2. Меркурометрическое титрование
Метод меркурометрии основан на осаждении галогенид-ионов ионами ртути (I):
2Cl– + Hg22+ = Hg2Cl2↓.
Титрантом метода является раствор нитрата ртути (I), который готовят из реагента Hg2(NO3)2 · 2H2O и стандартизуют по NaCl или NaBr.
В качестве индикаторов в меркурометрии применяют тиоционатные комплексы железа (III) и дифенилкарбазон. Приминение первого индикатора основано на обесцвечивании растворов тиоцианатных комплексов железа (III) под действием иона Hg22+, образующего осадок Hg2(NCS)2:
Cl– + Hg22+ = Hg2Cl2↓, 2[Fe(NCS)]2+ + Hg22+ = Hg2(NCS)2↓ + 2Fe3+.
Обесцвечивание происходит вблизи точки эквивалентности. Объем стандартного раствора Hg2(NO3)2, израсходованный на реакцию с индикатором, устанавливают проведением холостого опыта.
Дифенилкарбазон, возможно, являясь адсорбционным индикатором, в точке экивалентности окрашивает осадок Hg2Cl2 в ярко-голубой или синефиолетовый цвет. Титрование с дифенилкарбазоном проводят в сильнокислой среде, что является достоинством метода.
Меркурометрический метод применяют для определения хлоридов и бромидов. Титрование может проводиться в разбавленных (0,01 М) растворах.
Недостатками методов аргентометрии и меркурометрии является высокая стоимость нитрата серебра и токсичность солей ртути.
5.2. Комплексиметрическое титрование
5.2.1. Разновидности комплексиметрии
Комплексиметрическое титрование основано на использовании реакций образования комплексных соединений при титровании ионов металлов раствором комплексообразующего реагента. Среди реакций с участием неорганических лигандов в титриметрии применяют реакции образования галогенидов ртути (II), фторидов алюминия, тория и цианидов некоторых тяжелых металлов (никель, кобальт, цинк). На образовании этих комплек-
сов основаны методы меркуриметрии, фторидометрии и цианидомет-
рии.
Недостатком использования в комплексиметрии монодентатных неорганических и органических лигандов является многоступечатость образования комплексов, в результате чего на кривой титрования часто отсут-

78
ствует скачок. Многие же полидентатные лиганды реагируют с ионами металлов в простом стехиометрическом соотношении 1:1.
Титрование с использованием полидентатных органических реагентов называют комплексонометрией. В качестве таких аналитических органических реагентов используют комплексоны – соединения, являющиеся производными аминополикарбоновых кислот. К ним относятся иминодиуксусная кислота, нитрилтриуксусная кислота (комплексон I), этилендиаминатетрауксусная кислота или ее динатриевая соль и многие другие.
Наиболее часто применяют этилендиаминотетрауксусную кислоту
(комплексон II) – ЭДТУ:
|
HOOCH2C |
CH2COOH |
|
N – CH2 – CH2 – N |
|
|
HOOCH2C |
CH2COOH |
Анион ее обычно обозначают символом Y (с соответствующим зарядом и степенью протонирования). Так как ЭДТУ плохо растворима в воде, на практике используют хорошо растворимую ее соль Na2H2Y·2H2O (комплексон III) – ЭДТА.
5.2.2. Комплексонометрия
Титрованный раствор ЭДТА готовят обычно из продажного препарата, проверку концентрации осуществляют по стандартным растворам цинка (II) или висмута (III), приготовленным растворением соответствующих металлов в соляной кислоте.
Как гексадентатный лиганд, ЭДТА образует с ионами многих металлов (в том числе и щелочноземельных, которые трудно перевести в комплекс) растворимые в воде прочные внутрикомплексные соединения, относящиеся к группе хелатов. Комплексы образуются путем замещения ионов водорода карбоксильных групп в молекуле ЭДТА ионом металла и одновременного взаимодействия с атомами азота аминогрупп (за счет донорноакцепторной связи). Например, ион металла М2+ образует при комплексообразовании три устойчивых цикла:
Ион М3+ замыкает еще одно кольцо с СООН-группой. Такой комплекс еще более прочен:
79
|
O = C – O |
O – C = O |
|||||
|
M2+ |
||||||
|
H2C |
CH2 |
|||||
|
N |
N |
|||||
|
HOOCH2C |
H2C |
CH2 |
CH2COOH |
|||
Схематично взаимодействие комплексона III с ионами металлов можно выразить следующими уравнениями:
M2+ + H2Y2- = MY2- + 2H+,
M3+ + H2Y2- = MY– + 2H+,
M4+ + H2Y2- = MY + 2H+.
Из приведенных уравнений видно, что одна молекула ЭДТА реагирует с одним катионом металла (независимо от степени его окисления), т.е. стехиометрия реакции 1:1. Так как в результате всех реакций выделяется два иона водорода, фактор эквивалентности для ЭДТА и ионов металлов, равен 1/2. Учитывая стехиометрию реакции, чаще для расчетов в комплексонометрии используют молярные концентрации.
Помимо основной реакции комплексообразования, в системе М-ЭДТА- Н2О протекают конкурентные реакции протонирования ЭДТА и образования гидроксокомплексов металлов. Комплексы ионов металлов с ЭДТА характеризуются константами устойчивости, причем, как правило, чем выше заряд иона, тем прочнее комплекс. На прочность комплексов влияет рН среды. Некоторые комплексы, например, кальция и магния, устойчивы только в щелочной среде. Поскольку в результате реакции рН среды меняется (выделяются ионы Н+), для предотвращения смещения равновесия реакции в обратном направлении титрование проводят в присутствии буферной смеси (чаще аммонийной NH4OH + NH4Cl). Ионы, образующие более прочные комплексы (Zn2+, Pb2+), можно титровать в умереннокислой среде (поддерживая постоянство рН кислыми буферами, например ацетатным), а трех-и четырехзарядные ионы – даже в сильно кислой среде.
Для фиксирования точки эквивалентности в комплексонометрии применяют металлоиндикаторы – органические соединения, которые с ионами металлов образуют окрашенные комплексы. Полученные при этом комплексные соединения менее прочны, чем комплексы металлов с комплексоном. Поэтому при титровании, когда все определяемые катионы связаны в прочные комплексы (точка экивалентности), добавление лишней
80
капли титранта приводит к разрушению комплекса индикатора с ионом металла и наблюдается изменение окраски.
Наибольшее распространение приобрели так называемые металлохромные индикаторы, содержащие в своих молекулах хромофорные группы, следовательно, окрашенные и образующие с ионами металлов внутрикомплексные соединения, по цвету отличающиеся от самих индикаторов. К таким индикаторам относятся, например, эрихром черный Т, который с ионами металлов Mg2+, Ca2+, Zn2+ и другими образует комплексы винно-красного цвета; в то время как сам индикатор при рН 8-10 имеет синий цвет, хромоген темно-синий также имеет синий цвет в щелочной среде, а его комплексы с ионами металлов – розового цвета.
Как и в других титриметрических методах, для получения правильных результатов в комплексонометрии необходимо, чтобы рТ индикатора входил в скачок на кривой титрования.
Определение ионов металлов проводят прямым или обратным титрованием.
Прямое титрование проводится при достаточно высокой скорости образования комплексоната металла, отсутствии побочных реакций, доста-
точно контрастном переходе окраски индикатора. Так определяют большинство ионов металлов, например, Zn2+, Mg2+, Ca2+, Ba2+, Cd2+ при рН 8-
10 с индикатором эриохромом черным Т, Fe3+ при рН 1-2 с ксиленоловым оранжевым и др.
Схематично прямое титрование с металлохромным индикатором можно представить следующим образом:
M2+ + Ind = MInd,
M2+ + H2Y2_ = MY2- + 2H+,
MInd + H2Y2- = MY2- + Ind + 2H+.
Обратное титрование, основанное на добавлении избыточного количества ЭДТА и последующем титровании избытка стандартным раствором другого металла, применяют в тех случаях, когда реакции образования комплекса с ЭДТА протекают медленно или нет подходящего металлоиндикатора для фиксирования точки эквивалентности. Например, при определении соли Al3+, хрома (III), ртути (II). Для ускорения реакции иногда реакционную смесь нагревают до кипения (определение Al3+, Cr3+), затем охлаждают и титруют солью магния или цинка:
Al3+ + H2Y2- = AlY– + 2H+,
H2Y2- + Mg2+ = MgY2- + 2H+,
Mg2+ + Ind = MgInd.
Косвенное титрование применяют для определения элементов, не образующих комплексов с ЭДТА. Так при определении анионов их осаждают избытком стандартного раствора какого-либо иона металла, осадок отде-
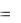
81
ляют и в фильтрате титруют избыток ионов металла, не осадившихся определяемым анионом. Например, при определении SO42- их осаждают избытком BaCl2 (в виде BaSO4), а несвязанные ионы бария оттитровывают комплексоном III. Фосфат-ионы осаждают в виде MgNH4PO4, избыток магния определяют компексонометрически. Оксалат-ионы осаждают в ви-
де CaC2O4.
Комплексонометрическое титрование применяют для определения общей жесткости воды (Ж0). Жесткость воды характеризуется молярной концентрацией эквивалентов кальция и магния (fэкв = 1/2) и выражают в моль/дм3. Содержание этих элементов определяют прямым титрованием пробы воды V(H2O) в аммонийном буфере 0,01 М раствором ЭДТА в присутствии эриохром черного Т, как индикатора, и рассчитывают по формуле
|
Жо |
с(1/ 2Na2 H 2Y ) V (Na2 H 2Y ) 1000 |
. |
|
|
V (H |
2O) |
||
Метод комплексонометрии используется для определения Mg2+ и Ca2+ в различных соках на сахароваренных заводах и предприятиях пищевой промышленности, а также в почве, удобрениях, растительных и животных тканях, молоке, крови и т.д.
Контрольные вопросы
1.Каким условиям должны удовлетворять реакции, используемые в методах осаждения?
2.В каких методах осадительного титрования в качестве индикатора используются реакции образования: а) окрашенных малорастворимых соединений; б) окрашенных комплексных соединений; в) окрашенных адсорбционных соединений?
3.На чем основаны методы Мора, Фольгарда и Фанса?
4.В каких условиях проводят аргентометрическое титрование по Мору?
5.На чем основано меркурометрическое определение хлоридов?
6.На чем основан комплексонометрический метод анализа?
7.Какие соединения называют комплексонами?
8.Какое значение имеет рН при комплексонометрическом титровании?
9.На чем основано действие металлоиндикаторов в комплексонометрии?
10.Какова область применения метода комплексонометрии?
82
Библиографический список
1.Алексеев В.Н. Количественный анализ. – М.: Химия, 1972.
2.Барсукова З.А. Аналитическая химия. – М.: Высшая школа, 1990.
3.Васильев В.П. Аналитическая химия. В 2 ч. Ч.1 Гравиметрический и титриметрический метод анализа. – М.: Высшая школа, 1989.
4.Жванко Ю.Н., Панкратова Г.Р, Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1989.
5.Золотов Ю.А, Дорохова Е.Н., Фадеева В.И. и др. Основы аналитической химии: В 2 кн. Кн. 2. Методы химического анализа. – М.: Высшая школа, 2000.
6.Крешков А.П. Основы аналитической химии: В 3 кн. Кн. 2. Количественный анализ. – М.: Химия, 1976.
7.Лебухов В.И., Окара А.И., Павлюченкова Л.П. Физико-химические свойства и методы контроля качества потребительских товаров. – Хабаровск: РИЦ ХГАЭП, 1999.
8.Павлюченкова Л.П. Аналитическая химия: В 2 ч. Ч. 1. – Качественный анализ. – Хабаровск: РИЦ ХГАЭП, 2000.
9.Петерс Д. Хайес Дж., Хифтье Г. Химическое разделение и измерение. Теория и практика аналитической химии: В 2ч. Ч. 1 Пер. с англ.
– М.: Химия, 1976.
10.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия: В 2 кн.
Кн.1. – М.: Химия, 1990.
11.Полеес М.Э., Душечкина И.Н. Аналитическая химия. – М.: Медици-
на, 1987.
12.Пономарев В.Д. Аналитическая химия: В 2 ч. Ч. 2. Количественный анализ. – М.: Высшая школа, 1982.
13.Попадич И.А., Траубенберг С.Е., Осташенкова Н.В., Лысюк Ф.А. Аналитическая химия. – М .: Химия, 1989.
14.Посыпайко В.И., Козырев Н.А., Логачева Ю.П. Химические методы анализа. – М.: Высшая школа, 1989.
15.Скуг Д., Уэст Д. Основы аналитической химии: В 2 ч. Ч. 2 Пер.с
англ. – М.:Мир, 1979.
16.Толстоусов В.Н., Эфрос С.М. Задачник по количественному анализу.
– Л.: Химия, 1986.
17.Ушакова Н.Н. Курс аналитической химии. – Издательство Московского университета, 1984.
18.Цитович И.К. Курс аналитической химии. – М.: Высшая школа,
1985.
|
83 |
|
|
ОГЛАВЛЕНИЕ |
|
|
Предисловие |
3 |
|
Глава 1. Основные принципы количественного анализа |
4 |
|
1.1. Задачи количественного анализа |
4 |
|
1.2. Принципы и методы количественных определений |
5 |
|
1.3. Правила вычислений в количественном анализе |
6 |
|
1.4. Погрешность количественных определений |
7 |
|
1.5. Аналитические весы и взвешивание |
10 |
|
1.6. Измерительная аналитическая посуда и правило работы с ней |
16 |
|
Глава 2. Титриметрический анализ |
21 |
|
2.1. Сущность титриметрического анализа |
21 |
|
2.2. Классификация методов титриметрического анализа |
22 |
|
2.3. Основные приемы титрования |
23 |
|
2.4. Расчеты в титриметрическом анализе |
25 |
|
2.4.1. Эквивалент |
25 |
|
2.4.2. Способы выражения концентрации веществ в химическом |
|
|
анализе |
28 |
|
2.4.3. Стандартные растворы |
31 |
|
2.4.4. Расчет массы навески исследуемой пробы и вычисление |
|
|
результатов титриметрических определений |
36 |
|
2.5. Кривые титрования |
41 |
|
Глава 3. Кислотно-основное титрование (протолитометрия) |
43 |
|
3.1. Сущность метода |
43 |
|
3.2. Индикаторы кислотно-основного титрования |
45 |
|
3.3. Кривые кислотно-основного титрования и выбор индикатора |
48 |
|
3.4. Титранты метода |
52 |
|
3.4.1. Приготовление и стандартизация растворов кислот и щелочей |
52 |
|
3.5. Примеры определений методом кислотно-основного титрования |
56 |
|
3.5.1. Определение массовой доли (%) NaHCO3 в твердом образце |
56 |
|
3.5.2. Определение массовой доли (%) уксусной кислоты в растворе |
57 |
|
84 |
|
|
3.5.3. Определение солей аммония и азота в органических |
|
|
соединениях по Кьельдалю |
59 |
|
Глава 4. Окислительно-восстановительное титрование |
|
|
(редоксиметрия) |
61 |
|
4.1. Общая характеристика редокс-методов |
61 |
|
4.2. Перманганатометрия |
63 |
|
4.3. Дихроматометрия |
67 |
|
4.4. Иодометрия |
68 |
|
Глава 5. Методы осаждения и комплексообразования |
74 |
|
5.1. Осадительное титрование |
74 |
|
5.1.1. Аргентометрическое титрование |
74 |
|
5.1.2. Муркурометрическое титрование |
77 |
|
5.2. Комплексиметрические титрование |
77 |
|
5.2.1. Разновидности комплексиметрии |
77 |
|
5.2.2. Комплексонометрия |
78 |
|
Библиографический список |
82 |
Концентрация растворов
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ивановский государственный политехнический университет» (ИВГПУ)
Кафедра химии, экологии и микробиологии
Общая химия
Методические указания к выполнению
контрольных заданий
для студентов первого курса всех специальностей
Иваново 2014
Методические указания предназначены для студентов очной формы обучения всех специальностей, изучающих химию. В них рассматриваются основные теоретические положения, необходимые для решения задач по разделам «Концентрация растворов», «Химическая термодинамика», «Растворы неэлектролитов и электролитов», «Электрохимия». Кроме этого приводится большое количество примеров решения разнообразных задач по указанным темам.
Методические указания могут быть использованы в процессе выполнения домашних заданий и при подготовке к экзамену по химии.
Составители: канд. хим. наук, проф. В.
В. Васильев, канд. техн. наук, доц. А.В. Кольчугин, канд. техн. наук, доц. В.Р. Ополовников, канд. техн. наук, проф. Г.М. Прияткин
Научный редактор канд. хим. наук, проф. В.В. Васильев Редактор Е.Л. Аверьянова Корректор А.В. Николаева
Подписано в печать 23.01.2014 Формат1/16 60 х 84. Бумага писчая
Плоская печать. Усл. печ. л. 3,26. Уч.-изд. л. 3,0 Тираж 100 экз. Заказ №
Редакционно-издательский отдел Ивановского государственного политехнического университета
Отдел оперативной полиграфии Текстильного института ИВГПУ 153000 г.Иваново, Шереметевский проспект,21
2
·100%.
1. Концентрация растворов
Раствором называется гомогенная (однородная) система, состоящая из нескольких компонентов. В практической деятельности чаще всего приходится иметь дело с жидкими растворами. Поэтому далее именно жидкие растворы и будут рассматриваться.
Простейший раствор состоит из двух компонентов: растворителя и растворенного вещества. Растворителем считается жидкий компонент.
Чаще всего растворителем бывает вода.
Важнейшей характеристикой любого раствора является его концентрация. Концентрация раствора показывает, в каком соотношении находятся растворенное вещество и растворитель. Это соотношение может быть показано разными способами.
1.1. Способы выражения концентрации растворов
Массовая доля или процентная концентрация (ω)
Этот вид концентрации показывает соотношение масс растворенного вещества и раствора:
ω = m(вещества) . m( раствора)
Так как масса растворенного вещества всегда меньше массы раствора, это соотношение всегда меньше единицы. Поэтому, как правило, его выражают в процентах:
ω = m(вещества) m( раствора)
В этом случае массовую долю растворенного вещества можно назвать процентной концентрацией раствора и использовать обозначение С%:
С% = m(вещества) ·100%. m( раствора)
Можно сказать, что процентная концентрация показывает,
сколько граммов растворенного вещества содержится в 100 граммах раствора.
То есть, если имеется, например, 5%-ный раствор хлорида натрия, то это значит, что в 100 граммах раствора содержится 5 граммов хлорида натрия и соответственно 95 граммов воды.
3
На практике при определении количества жидкого растворителя или раствора измеряют их объем (V). Для определения массы жидкости в этом случае используют ее плотность (ρ), то есть
m(раствора) = V(раствора) · ρ(раствора).
Как правило, плотность растворов измеряется в г/мл или, что одно и то же, в г/см3. Поэтому при использовании этой зависимости объем раствора должен измеряться в миллилитрах.
Молярная концентрация или молярность (СМ)
Этот способ выражения концентрации растворов используется в тех случаях, когда речь идет о каких-либо химических закономерностях, например, о зависимости от концентрации скорости химической реакции, состояния равновесия, электродного потенциала и др.
Молярная концентрация показывает, сколько молей растворенного вещества содержится в одном литре раствора.
То есть, если имеется двухмолярный (2М) раствор серной кислоты, то в одном литре этого раствора содержится два моля серной кислоты.
По определению
С = n(вещества) , М V ( раствора)
где n – число молей растворенного вещества; V- объем раствора, л.
Если принять во внимание, что
n = Mm ,
то можно записать:
|
CM = |
m(вещества) |
, |
|
|
M (вещества) V ( раствора) |
|||
где М – молярная масса вещества, г/моль.
Вэтой формуле объем раствора обязательно должен измеряться
влитрах.
4
Молярная концентрация эквивалента или нормальная концентрация (Сн)
Этот способ выражения концентрации растворов применяется в тех случаях, когда растворенное вещество участвует в какой-либо реакции, и для выполнения расчетов удобно применить закон эквивалентов.
Нормальная концентрация (нормальность) показывает, сколько эквивалентов вещества содержится в одном литре раствора.
Так, если имеем 0,1н раствор гидроксида натрия, то можно сказать, что в одном литре этого раствора содержится 0,1 эквивалент
NaOH.
По определению:
|
СН = |
nЭ |
(вещества) |
, |
|
|
V ( раствора) |
||||
где nэ – число эквивалентов растворенного вещества; V- объем раствора, л,
|
или |
m(вещества) |
||
|
CН = |
, |
||
|
MЭ (вещества) V ( раствора) |
|||
где МЭ – молярная масса эквивалента вещества.
В этой формуле объем раствора также должен измеряться в литрах.
Если в задаче речь идет о реакции, в которой реагирующие вещества находятся в растворах, часто бывает удобно использовать закон эквивалентов для растворов:
СН(1) . V(1) = CH(2) . V(2),
где СН и V – нормальность и объем двух взаимодействующих растворов.
Моляльная концентрация или моляльность (Сm)
Этот способ выражения концентрации растворов встречается довольно редко. Обычно необходимость его использования возникает в тех случаях, когда обсуждается влияние концентрации на изменение температуры замерзания или кипения раствора по сравнению с чистым растворителем.
5
Моляльная концентрация показывает, сколько молей растворенного вещества приходится на 1000 граммов растворителя.
Моляльность может быть рассчитана по формуле:
|
Cm = |
m(вещества) 1000 |
, |
|
|
M (вещества) m( растворителя) |
|||
где m(вещества) – масса растворенного вещества, г; m(растворителя) – масса растворителя, г;
M(вещества) – молярная масса растворенного вещества, г/моль.
1.2. Примеры решения задач по теме «Концентрация растворов»
Задачи по этой теме можно решать или путем логического рассуждения, составляя пропорции на основе определений различных видов концентраций, или используя формулы, приведенные выше. В примерах будут показаны оба способа решения задач.
Пример 1. В 200 мл воды растворено 50 граммов хлорида калия. Вычислите массовую долю вещества в растворе.
|
Дано: |
Решение: |
||||||||
|
V(h3O) = 200 мл |
Плотность воды ρ = 1г/мл, значит, масса воды |
||||||||
|
m(KCl) = 50 г |
m(h3O) = ρ |
. |
V = 1 |
. |
200 = 200 г. |
||||
|
ω = ? |
Общая масса раствора складывается из массы |
||||||||
|
воды и массы растворенного вещества: |
|||||||||
|
m(р-ра) = m(h3O) + m(в-ва) = 200 + 50 = 250 г. |
|||||||||
|
Теперь можно |
рассчитать |
массовую |
долю хлорида калия |
||||||
|
в растворе: |
|||||||||
|
m(KCl ) |
50 |
100% = 20%. |
|||||||
|
ω = |
·100% = |
||||||||
|
( раствора) |
250 |
||||||||
|
m |
Ответ: ω = 20%.
6
Пример 2. Какой объем аммиака (измеренный при нормальных условиях) израсходуется при приготовлении 1 кг 10%-ного раствора? Сколько воды надо взять для приготовления этого раствора?
Какой объем аммиака (измеренный при нормальных условиях) израсходуется при приготовлении 1 кг 10%-ного раствора? Сколько воды надо взять для приготовления этого раствора?
|
Дано: |
Решение: |
||
|
m(р-ра) = 1кг |
Из формулы |
||
|
ω = 10% |
|||
|
m(Nh4 ) |
|||
|
V(Nh4) = ? |
ω = |
·100% |
|
|
m( раствора) |
|||
|
V(h3O) = ? |
|||
можно найти массу растворенного аммиака. При этом масса раствора должна быть выражена в граммах:
При этом масса раствора должна быть выражена в граммах:
m(раствора) = 1кг = 1000 г,
|
m(Nh4) = |
m( раствора) |
= |
10 1000 |
= 100 г. |
|
100% |
100 |
Аммиак в обычных условиях находится в газообразном состоянии. Для определения объема газообразного вещества можно воспользоваться следствием из закона Авогадро, согласно которому один моль любого газа при нормальных условиях занимает объем
22,4 литра.
M(Nh4) = 17 г/моль.
1 моль Nh4 имеет массу 17 граммов и занимает объем 22,4 литра,
|
100 |
граммов ———————— |
Х литров |
||
|
Х = |
100 22,4 |
= 132 литра. |
V(Nh4) = 132 литра. |
|
|
17 |
Зная массу раствора и массу растворенного вещества, можно найти массу воды:
m(h3O) = m(раствора) − m(Nh4) = 1000 – 100 = 900 г.
Для того чтобы найти объем воды, надо использовать ее плотность ρ(h3O) = 1 г/мл:
|
V(h3O) = |
m(H 2O) |
= |
900 |
= 900 мл. |
|
(H 2O) |
1 |
|||
|
Ответ: V(Nh4) = 132 литра; |
V(h3O) = 900 мл. |
7
Пример 3. Вычислите молярность раствора, содержащего 25,4 г FeCl2 в 500 мл раствора.
|
Дано: |
Решение: |
||||
|
m(FeCl2) = 25,4 г |
Используем формулу для расчета молярной |
||||
|
концентрации |
|||||
|
V(р-ра) = 500 мл |
|||||
|
m(FeCl2 ) |
|||||
|
СМ = ? |
CM = |
. |
|||
|
M (FeCl2 ) V |
( раствора) |
||||
Молярная масса FeCl2 равна 127 г/моль.
V(р-ра) = 500 мл = 0,5 л.
25,4
CM = 1270,5 = 0,4М.
Ответ: СМ = 0,4М.
Пример 4. Вычислите нормальность 50%-ного раствора серной кислоты, плотность которого 1,5 г/мл.
|
Дано: |
Решение: |
||||
|
ω(h3SO4) = 50% |
Для расчета нормальной концентрации по |
||||
|
ρ(р-ра) = 1,5 г/мл |
формуле |
||||
|
СН = ? |
CН = |
m(h3SO4 ) |
|||
|
M э |
(h3SO4 ) V ( раствора) |
||||
надо знать массу h3SO4, молярную массу ее эквивалента и объем раствора.
1.Определим объем раствора.
Очевидно, что 50%-ному раствору серной кислоты соответствует какая-то вполне определенная нормальная концентрация, которая не зависит от количества раствора. Поэтому для выполнения расчета можно взять любое количество этого раствора. Для удобства вычислений возьмем 1 литр раствора:
V(р-ра) = 1 л = 1000 мл.
2. Определим массу h3SO4. Масса взятого раствора
m(раствора) = V(раствора) · ρ(раствора) = 1000 . 1,5 = 1500 г.
8
Из формулы для расчета массовой доли можно найти массу растворенного вещества:
|
m(h3SO4 ) |
m( р ра) |
= |
1500 50 |
= 750 г. |
|
100 |
||||
|
100% |
||||
3. Определим молярную массу эквивалента серной кислоты.
Определим молярную массу эквивалента серной кислоты.
Ее можно рассчитать по формуле эквивалента сложного вещества:
|
MЭ (h3SO4 ) |
M |
98 |
49 |
г/моль. |
|
|
n z |
2 1 |
||||
4. Подставим полученные значения в исходную формулу и получим:
750 СН = 491 15,3н .
Ответ: СН = 15,3н.
Пример 5. Определите моляльную концентрацию 10%-ного раствора нитрата натрия.
|
Дано: |
Решение: |
|||||
|
ω(NaNO3) = 10% |
Для расчета моляльной |
концентрации ис- |
||||
|
Сm = ? |
пользуем формулу |
m(NaNO |
||||
|
3 ) 1000 |
||||||
|
Cm |
= |
, |
||||
|
M (NaNO3 ) |
m(h3O) |
|||||
M(NaNO3) = 85 г/моль.
Так же, как в предыдущем примере, для перехода от одного способа выражения концентрации раствора к другому можно взять любое количество этого раствора. В данном случае удобно взять 100 граммов раствора.
Так как ω(NaNO3) = 10%, то по определению процентной концентрации можно сказать, что в 100 граммах раствора содержится 10 граммов NaNO3 и 90 граммов воды, то есть
m(NaNO3) = 10 г, m(h3O) = 90 г.
|
Подставим эти значения в исходную формулу. |
|||
|
Cm = |
m(NaNO3 ) 1000 |
10 1000 |
0,13моль / кг . |
|
M (NaNO3 ) m(h3O) |
85 90 |
||
Ответ: Cm = 0,13 моль/кг.
9
Пример 6. Моляльная концентрация раствора карбоната калия 0,2 моль/кг. Определите массовую долю соли в этом растворе.
Определите массовую долю соли в этом растворе.
|
Дано: |
Решение: |
|||
|
Сm(K2CO3) = 0,2 моль/кг |
Для расчета массовой доли соли ис- |
|||
|
ω(K2CO3) = ? |
пользуем формулу |
|||
|
ω = |
m(K2CO3 ) |
·100%. |
||
|
m( раствора) |
По определению моляльной концентрации можно сказать, что в данном растворе в 1000 граммах воды растворено 0,2 моля K2CO3.
М(K2CO3) = 138 г/моль.
1моль K2CO3 имеет массу 138 граммов,
0,2 моля K2CO3 ———— Х граммов
|
X |
0,2 138 |
27,6 |
г. |
Значит, m(K2CO3) = 27,6 г. |
|
|
1 |
|||||
Масса раствора складывается из массы воды и массы растворенного вещества:
m(р-ра) = m(h3O) + m(K2CO3) = 1000 + 27,6 = 1027,6 г.
Подставим полученные значения в исходную формулу:
|
ω = |
m(K2CO3 ) |
·100% = |
27,6 |
100 = 2,69%. |
||
|
m( раствора) |
1027,6 |
|||||
Ответ: ω = 2,69%.
10
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
16.
 06.2021471.62 Кб0Operacni_navod_Cerklazni_system_RUS_final_2016.02.11.pdf
06.2021471.62 Кб0Operacni_navod_Cerklazni_system_RUS_final_2016.02.11.pdf - #
16.06.20217.94 Mб0Posobie_Dezhuranta-2014_Rekomendatsii_Dlya_Prak.pdf
- #
16.06.20211.36 Mб0АНАЛИЗ ОСНОВНЫХ ЭЛЕМЕНТОВ ФИКСАЦИИ АППАРАТА.pdf
- #
16.06.2021575.31 Кб0Анафилактический шок.pdf
- #
16.06.2021726.49 Кб3Желтухи.pdf
- #
16.06.2021614.58 Кб3Концентрация растворов.pdf
- #
16.06.2021504.93 Кб2Ликвор-q.pdf
- #
16.06.20211.26 Mб30Оценочные и прогностические шкалы в МКС.pdf
- #
16.06.20212.54 Mб9СОВЕРШЕНСТВОВАНИЕ МЕДИЦИНСКОЙ СОРТИРОВКИ РАНЕНЫХ НА ПЕРЕДОВЫХ ЭТАПАХ МЕДИЦИНСКОЙ ЭВАКУАЦИИ.pdf
- #
16.06.
 20216.16 Mб43Судебно-медицинская травматология.pdf
20216.16 Mб43Судебно-медицинская травматология.pdf - #
16.06.20212.02 Mб12Членовредительство.pdf
Как найти массу раствора вещества формула. Вычисление массы растворенного вещества или массы растворителя, которые следует взять для получения раствора определенной концентрации. Расчеты концентрации растворенных веществ в растворах
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
m р-ра
= 40г
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва =
ω ∙
m р-ра /100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н 2 О)
= 40г – 2г = 38 г.
3.
Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
m р-ра1 =80г
m(Н 2 О)
= 30г
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω 1 ·
m р-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H 2 O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω 2
= m в-ва /
m р-ра2
∙ 100%
ω 2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения
раствора с заданной массовой долей (%)
растворенного вещества путем смешивания
двух растворов с известной массовой
долей растворенного вещества пользуются
диагональной схемой («правило креста»).
Сущность этого
метода состоит в том, что по диагонали
из большей величины массовой доли
растворенного вещества вычитают меньшую.
Разности (с-в) и
(а-с) показывают, в каких соотношениях
нужно взять растворы а и в, чтобы получить
раствор с.
Если
для разбавления в качестве исходного
раствора используют чистый растворитель,
например, Н 2 0,
то концентрация его принимается за 0 и
записывается с левой стороны диагональной
схемы.
Задача
Для
обработки рук хирурга, ран, послеоперационного
поля используется йодная настойка с
массовой долей 5%. В каком массовом
соотношении нужно смешать растворы с
массовыми долями йода 2,5% и 30%, чтобы
получить 330 г йодной настойки с массовой
долей йода 5%?
1. Запишите условие
задачи с помощью общепринятых обозначений.
1. Составьте
«диагональную схему». Для этого
запишите массовые доли исходных растворов
друг под другом, по левую сторону креста,
а в центре заданную массовую долю
раствора.
2.
Вычитают из бóльшей массовой доли
меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные
результаты с правой стороны диагональной
схемы: при возможности сокращают
полученные числа. В данном случае 25 в
десять раз больше, чем 2,5, то есть вместо
25 записывают 10, вместо 2,5 пишут 1.
Числа
(в данном случае 25 и 2,5 или 10 и 1)называют
массовыми числами. Массовые числа
показывают, в каком соотношении необходимо
взять исходные растворы, чтобы получить
раствор с массовой долей йода 5%.
3. Определите массу
30% и 2,5% раствора по формуле:
m
р-ра
= число частей · m 3 /
сумму массовых частей
m 1 (30%)
= 1· 330г /1+10 = 30г
m 2 (2,5%)
= 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ:
для приготовления 330 г раствора с массовой
долей йода 5% необходимо смешать 300 г
раствора с массовой долей 2,5% и 30 г с
массовой долей 30%.
Задача 3.1.
Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение.
Из w = m в-ва / m р-ра
находим массу хлорида натрия:
m в-ва = w m р-ра = 0,1 250 г = 25 г NaCl
Поскольку m р-ра = m в-ва + m р-ля
, то получаем:
m(Н 2 0) = m р-ра — m в-ва = 250 г — 25 г = 225 г Н 2 0
.
Задача 3.2.
Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение.
Поскольку w = m в-ва / (V ρ)
, то получаем:
m в-ва = w V ρ = 0,262 400 мл 1,13 г/мл = 118 г
Задача 3.3.
К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение.
Находим массу соли в исходном растворе:
m соли = w m р-ра = 0,14 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
m р-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = m соли / m р-ра = 28 г / 280 г = 0,100.
Задача 3.4.
Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,78
и ρ 1 = 1,70 г/мл
.
Для второго раствора имеем:
V 2 = 500 мл, w 2 = 0,12
и ρ 2 = 1,08 г/мл
.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,12 500 мл 1,08 г/мл = 64,8 г.
m 2 = 64,8 г
. Находим
объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 64,8 г / (0,78 1,70 г/мл) = 48,9 мл.
Задача 3.5.
Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение.
Для первого раствора имеем:
w 1 = 0,0465
и ρ 1 = 1,05 г/мл
.
Для второго раствора имеем:
V 2 = 50 мл
, w 2 = 0,30
и ρ 2 = 1,33 г/мл
.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
Находим массу вещества во втором растворе. Из w 2 = m 2 / (V 2 ρ 2)
имеем:
m 2 = w 2 V 2 ρ 2 = 0,30 50 мл 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m 2 = 19,95 г
.
Находим объем первого раствора. Из w 1 = m 1 / (V 1 ρ 1)
имеем:
V 1 = m 1 / (w 1 ρ 1) = 19,95 г / (0,0465 1,05 г/мл) = 409 мл
.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6.
Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение.
В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
m р-ра = m воды + m соли = 100 г + 8,6 г = 108,6 г
,
а массовая доля соли в растворе равна:
w = m соли / m р-ра = 8,6 г / 108,6 г = 0,0792
.
Задача 3.7.
Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение.
Пусть растворимость соли равна х
г в 100 г воды.
Тогда масса раствора равна:
m р-ра = m воды + m соли = (х + 100) г
,
а массовая доля равна:
w = m соли / m р-ра = х / (100 + х) = 0,256
.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г
на 100 г воды.
Молярная концентрация с
— отношение количества растворенного вещества v (моль)
к объему раствора V (в литрах)
, с = v(моль) / V(л)
, с = m в-ва / (М V(л))
.
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л
) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8.
Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение.
Для растворов с молярной концентрацией имеем:
с = m / (М V)
,
где с
— молярная концентрация,
m
— масса вещества,
М
— молярная масса вещества,
V
— объем раствора в литрах.
Отсюда
m = с М V(л) = 2 моль/л 56 г/моль 4 л = 448 г КОН
.
Задача 3.9.
Сколько мл 98%-ного раствора Н 2 SO 4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w 1 = m 1 / (V 1 (мл) ρ 1)
.
Необходимо найти объем этого раствора V 1 (мл) = m 1 / (w 1 ρ 1)
.
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с 2 = m 2 / (М V 2 (л))
и m 2 = с 2 М V 2 (л)
.
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V 1 (мл) = m / (w 1 ρ 1) = (с 2 М V 2) / (w 1 ρ 1) = (0,25 моль/л 98 г/моль 1,5 л) / (0,98 1,84 г/мл) = 20,4 мл
.
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения. Тем не
Тем не
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m
в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
Количество растворенного вещества :
= c
V
,
где c
– молярная концентрация
растворенного вещества в моль/л, V
– объем
раствора в л.
Масса растворенного вещества m
(р.в.):
m(р. в.) = m
(р-ра) ,
где m
(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c
, V
, m
(р-ра), через с
1 , V
1 ,
m
1 (р-ра), 1 ,
а в разбавленном растворе – через с
2 , V
2 ,
m
2 (р-ра), 2 .
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
Сохранение массы m
(р. в.):
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m
(р.
в.)/M
(р. в.),
где M
(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с 1 V
1 = m
2 (р-ра) 2 /M
(р. в.),
m 1 (р-ра) 1 = с
2 V
2 M
(р.
в.).
Если в задаче известен объем растворенного
газа V
(газа), то его количество вещества связано с объемом
газа (н. у.) отношением:
у.) отношением:
= V
(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с
2 V
2 ,
V(газа)/22,4 = m
2 (р-ра) 2 /M
(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m
(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V
– в л.
Приведем примеры решения «образцовых» задач.
Задача 1.
Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М
H 2 SO 4 ?
Дано:
с 1 = 1 моль/л,
V
2 = 0,5 л,
с
2 = 0,1 моль/л.
Найти:
Решение
V 1 с
1 = V
2 с
2 ,
V 1 1 = 0,5 0,1; V
1 = 0,05 л,
или 50 мл.
Ответ.
V
1 = 50 мл.
Задача 2
(,
№ 4.23). Определите массу раствора с массовой
долей
(СuSО 4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО 4) 2%.
Дано:
1 = 0,1,
m
2 (р-ра) = 500 г,
2 = 0,02.
Найти:
m
1 (р-ра) = ?
m
(H 2 O) = ?
Решение
m 1 (р-ра) 1 = m
2 (р-ра) 2 ,
m 1 (р-ра) 0,1 = 500 0,02.
Отсюда m
1 (р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H 2 O) = m
2 (р-ра) – m
1 (р-ра),
m(H 2 O) = 500 – 100 = 400 г.
Ответ.
m
1 (р-ра) = 100 г, m
(H 2 O)
= 400 г.
Задача 3
(,
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М
раствора
H 2 SO 4
объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с
2 = 0,35 моль/л,
V
2 = 0,04 л,
М
(H 2 SO 4) = 98 г/моль.
Найти:
Решение
m 1 (р-ра) 1 = V
2 с
2 М
(H 2 SO 4),
V 1 1 1
= V
2 с
2 М
(H 2 SO 4).
Подставляем значения известных величин:
V 1 1050 0,093 = 0,04 0,35 98.
Отсюда V
1 = 0,01405 л, или 14,05 мл.
Ответ.
V
1 = 14,05 мл.
Задача 4
. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см 3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М
(HCl) = 36,5 г/моль.
Найти:
V
(HCl) = ?
m
(H 2 O) = ?
Решение
V(HCl)/22,4 = m
(р-ра) /М
(HCl),
V(HCl)/22,4 = V
(р-ра) (р-ра) /М
(HCl),
V(HCl)/22,4 = 1 1050 0,1/36,5.
Отсюда V
(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H 2 O) = m
(р-ра) – m
(HСl),
m(H 2 O) = V
(р-ра) (р-ра) – V
(HCl)/22,4 М
(HCl),
m(H 2 O) = 1 1050 – 64,44/22,4 36,5 = 945 г.
Ответ.
64,44 л HCl и 945 г воды.
Задача 5
(,
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
0,2,
= 1220 г/л,
М
(NaOH) = 40 г/моль.
Найти:
Решение
m(р-ра) = с
V
М
(NaOH),
m(р-ра) = с
m
(р-ра) М
(NaOH)/.
Разделим обе части уравнения на m
(р-ра) и
подставим численные значения величин.
0,2 = c
40/1220.
Отсюда c
= 6,1 моль/л.
Ответ.
c
= 6,1 моль/л.
Задача 6
(,
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na 2 SO 4) = 42,6 г,
m
(H 2 O) = 300 г,
= 1120 г/л,
M
(Na 2 SO 4) = 142 г/моль.
Найти:
Решение
m(Na 2 SO 4) = с
V
М
(Na 2 SO 4).
500 (1 – 4,5/(4,5 + 100)) = m
1 (р-ра) (1 –
4,1/(4,1 + 100)).
Отсюда m
1 (р-ра) = 104,1/104,5 500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ.
m
(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И. Г.
Г.
Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е.
Химия-9. М.:
Просвещение, 1990, с. 166.
Задача 3.
5 г поваренной соли (NаС1) растворили в некотором количестве воды. В результате получили 4%-ный раствор NаС1 в воде. Определить массу использованной воды.
Дано:
масса поваренной соли: mNaСl) = 5 г;
массовая доля NаС1 в полученном растворе: NаС1) = 4%.
Найти:
массу использованной воды.
Решение:
Эту задачу можно решить двумя способами: с использованием формулы и пропорции.
I способ:
Подставляем данные из условия в первую формулу и находим массу раствора.
II способ:
Схематично алгоритм решения можно представить следующим образом:
Массовая доля воды в растворе равна: 100% — 4% = 96%.
Так как в растворе содержится 5 г соли, которые составляют 4%, можно составить пропорцию:
5 г составляют 4%
х г составляют 96%
Ответ:
mводы = 120г.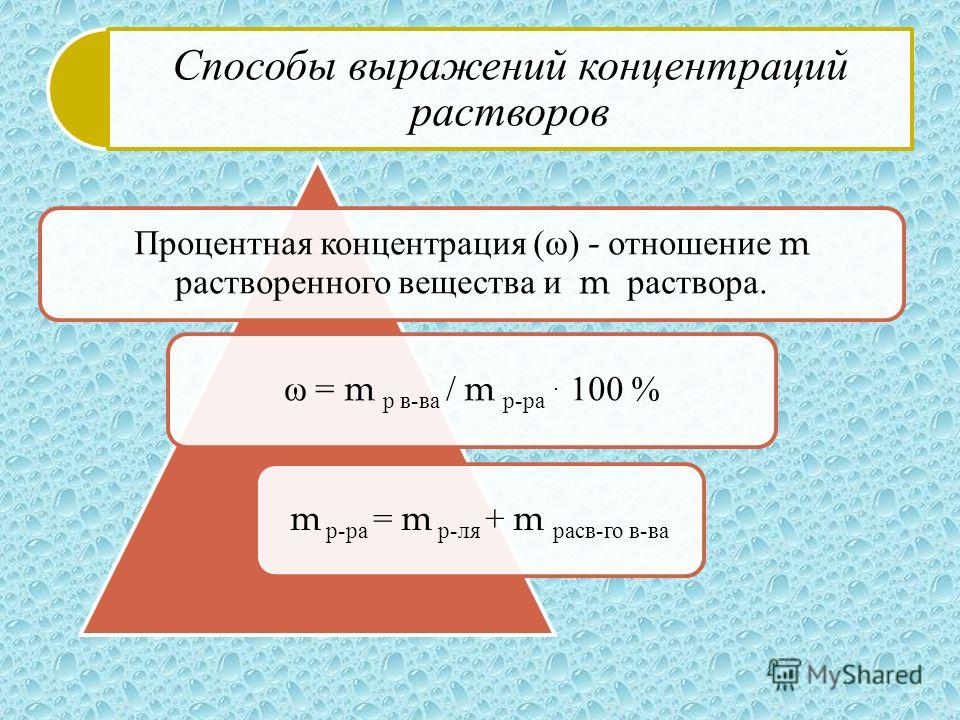
Задача 4.
Некоторое количество чистой серной кислоты растворили в 70 г воды. В результате получили 10%-ный раствор Н 2 SO 4 . Определить массу использованной серной кислоты.
Дано:
масса воды: m(Н 2 О) = 70 г;
массовая доля Н 2 SО 4 в полученном растворе: Н 2 SО 4) = 10%.
Найти:
массу использованной серной кислоты.
Решение:
Здесь также возможно использование и соотношения, и пропорции.
I способ:
Подставим последнее выражение в соотношение для массовой доли:
Подставляем данные из условия в полученную формулу:
Получили одно уравнение с одним неизвестным Решая его, находим массу использованной серной кислоты:
II способ:
Схематично алгоритм решения можно представить следующим образом:
Применим предложенный алгоритм.
m(Н 2 О) = 100% – (Н 2 SО 4) = 100% – 10% = 90%
Составляем пропорцию:
70 г составляют 90%
х г составляют 10%
Ответ:
m(H 2 SO 4) = 7,8 г.
Задача 5.
Некоторое количество сахара растворили в воде. В результате получили 2 л 30%-ного раствора (р = 1,127 г/мл). Определить массу растворенного сахара и объем использованной воды.
Дано:
объем раствора: V р-ра = 2 л;
массовая доля сахара в растворе: (сахара) = 30%;
плотность раствора: р
р-ра =1,127 г/мл
Найти:
массу растворенного сахара; объем использованной воды.
Решение:
Схематично алгоритм решения можно представить следующим образом.
Вычисление массы раствора определенной концентрации по массе растворенного вещества или растворителя.
Вычисление массы растворенного вещества или растворителя по массе раствора и его концентрации.
Вычисление массовой доли (в процентах) растворенного вещества.
Примеры типовых задач по расчету массовой доли (в процентах) растворенного вещества.
Процентная концентрация.
Массовая доля (в процентах) или процентная концентрация (ω)
– показывает число грамм растворенного вещества, содержащееся в 100 граммах раствора.
Процентная концентрация или массовая доля есть отношение массы растворенного вещества к массе раствора.
ω = mраств. в-ва
·100%
(1),
m р-ра
где ω – процентная концентрация (%),
m раств. в-ва – масса растворенного вещества (г),
m р-ра – масса раствора (г).
Массовая доля измеряется в долях единицы и используется в промежуточных расчетах. Если массовую долю умножить на 100 % получится процентная концентрация, которая используется, когда выдается конечный результат.
Масса раствора складывается из массы растворенного вещества и массы растворителя:
m р-ра = m р-ля + m раств. в-ва (2),
где m р-ра – масса раствора (г),
m р-ля – масса растворителя (г),
m раств. в-ва – масса растворенного вещества (г).
Например, если массовая доля растворенного вещества – серной кислоты в воде равна 0,05, то процентная концентрация составляет 5%. Это означает, что в растворе серной кислоты массой 100 г содержится серная кислота массой 5 г, а масса растворителя составляет 95г.
ПРИМЕР 1
. Вычислить процентное содержание кристаллогидрата и безводной соли, если в 450 г воды растворили 50 г CuSO 4 ·5H 2 O.
РЕШЕНИЕ
:
1)Общая масса раствора составляет 450 + 50 = 500 г.
2)Процентное содержание кристаллогидрата находим по формуле (1):
Х = 50 100 / 500 = 10 %
3)Рассчитаем массу безводной соли CuSO 4 , содержащуюся в 50 г кристаллогидрата:
4)Рассчитаем молярную массу CuSO 4 ·5H 2 O и безводной CuSO 4
M CuSO4 · 5h3O = M Cu + M s +4M o + 5M h3O = 64 + 32 + 4·16 + 5·18 = 250 г/моль
М CuSO4 = M Cu + M s + 4M o = 64 + 32 + 4·16 = 160 г/моль
5)В 250 г CuSO 4 ·5H 2 O содержится 160 г CuSO 4
А в 50 г CuSO 4 ·5Н 2 О — Х г СuSO 4
Х = 50·160 / 250 = 32 г.
6)Процентное содержание безводной соли сульфата меди составит:
ω = 32·100 / 500 = 6,4 %
ОТВЕТ
:
ω СuSO4 · 5h3O = 10 %, ω CuSO4 = 6,4 %.
ПРИМЕР 2
.
Сколько грамм соли и воды содержится в 800 г 12 %-ного раствора NaNO 3 ?
РЕШЕНИЕ:
1)Найдем массу растворенного вещества в 800 г 12 %-ного раствора NaNO 3:
800·12 /100 = 96 г
2)Масса растворителя составит: 800 –96 = 704 г.
ОТВЕТ:
Масса HNO 3 = 96 г, масса H 2 O = 704 г.
ПРИМЕР 3
.
Сколько грамм 3 %-ного раствора MgSO 4 можно приготовить из 100 г MgSO 4 7H 2 O?
РЕШЕНИЕ
:
1)Рассчитаем молярную массу MgSO 4 ·7H 2 O иMgSO 4
M MgSO4 · 7h3O = 24 + 32 + 4·16 + 7·18 = 246 г/моль
M MgSO4 = 24 + 32 + 4·16 = 120 г/моль
2)В 246 г MgSO 4 ·7H 2 O содержится 120 г MgSO 4
В 100 г MgSO 4 ·7H 2 O содержится Х г MgSO 4
Х = 100·120 / 246 = 48,78 г
3)По условию задачи масса безводной соли составляет 3 %. Отсюда:
3 % массы раствора составляют 48,78 г
100 % массы раствора составляют Х г
Х = 100·48,78 / 3 = 1626 г
ОТВЕТ
:
масса приготовленного раствора будет составлять 1626 грамм.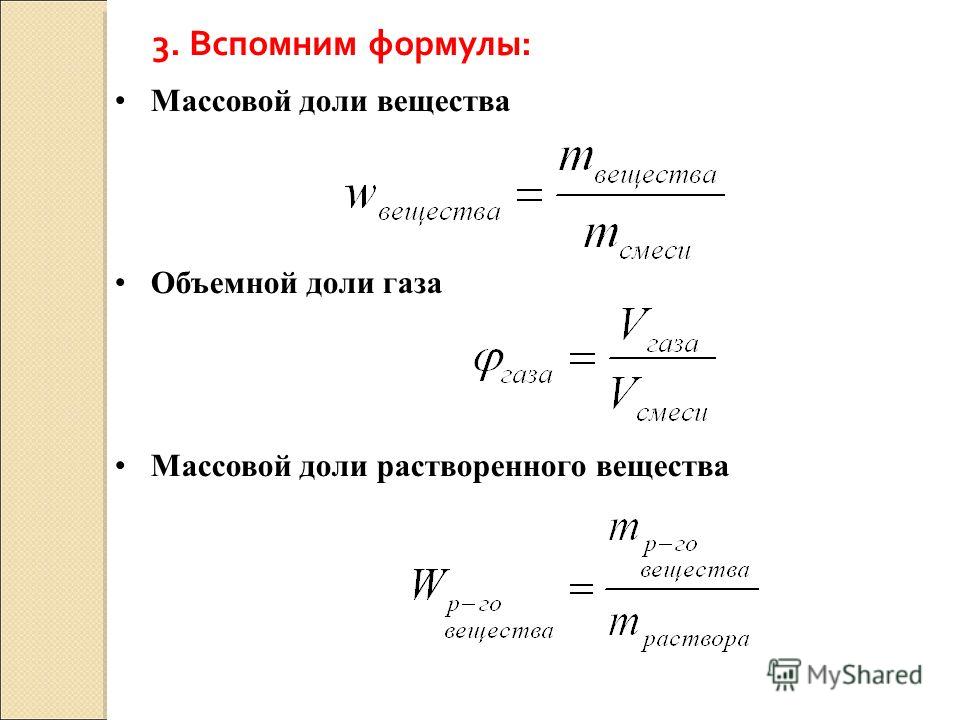
ПРИМЕР 4.
Сколько грамм НС1 следует растворить в 250 г воды для получения 10 %-ного раствора НС1?
РЕШЕНИЕ:
250 г воды составляют 100 – 10 =90 % массы раствора, тогда масса НС1 составляет 250·10 / 90 = 27,7 г НС1.
ОТВЕТ
: Масса HCl составляет 27,7 г.
Приготовление титрованных растворов. Расчеты при приготовлении растворов молярной и нормальной концентрации
Определите, что вам известно и что нет.
В химии разведение означает обычно получение небольшого количества раствора известной концентрации, с последующим его разбавлением нейтральной жидкостью (например водой) и получением, таким образом, менее концентрированного раствора большего объема. Эта операция очень часто применяется в химических лабораториях, поэтому в них реагенты хранятся для удобства в концентрированном виде и разбавляются при необходимости. На практике, как правило, вам известна начальная концентрация, а также концентрация и объем раствора, который вы хотите получить; при этом неизвестен объем концентрированного раствора, который необходимо разбавить.
- В другой ситуации, например при решении школьной задачи по химии, в качестве неизвестной может выступать другая величина: к примеру, вам даны начальный объем и концентрация, и требуется найти конечную концентрацию итогового раствора при его известном объеме. В любом случае полезно выписать известные и неизвестные величины, прежде чем приступать к задаче.
- Рассмотрим пример. Пускай нам необходимо развести раствор концентрацией 5 M, чтобы получить раствор концентрацией 1 мM
. В данном случае нам известна концентрация начального раствора, а также объем и концентрация раствора, который необходимо получить; не
известен объем исходного раствора, который надо развести водой.- Помните: в химии М служит мерой концентрации, называемой также молярностью
, которая соответствует количеству молей вещества на 1 литр раствора.
- Помните: в химии М служит мерой концентрации, называемой также молярностью
Подставьте известные значения в формулу C 1 V 1 = C 2 V 2 .
В этой формуле C 1 — концентрация начального раствора, V 1 — его объем, C 2 — концентрация конечного раствора, и V 2 — его объем. Из полученного уравнения вы без труда определите искомую величину.
Из полученного уравнения вы без труда определите искомую величину.
- Иногда полезно поставить вопросительный знак перед величиной, которую вы собираетесь найти.
- Вернемся к нашему примеру. Подставим в равенство известные нам значения:
- C 1 V 1 = C 2 V 2
- (5 M)V 1 = (1 мM)(1 л). Концентрации имеют разные единицы измерения. Давайте чуть подробнее остановимся на этом.
Учитывайте любое различие в единицах измерения.
Поскольку разбавление приводит к уменьшению концентрации, и нередко значительному, иногда концентрации измерены в разных единицах. Если упустить это, вы можете ошибиться с результатом на несколько порядков. Перед решением уравнения приведите все значения концентрации и объема к одинаковым единицам измерения.
- В нашем случае используются две единицы концентрации, M и мM. Переведем все в М:
- 1 мM × 1 M/1.000 мM
- = 0,001 M
.
Решим уравнение.
Когда вы привели все величины к одинаковым единицам измерения, можете решать уравнение. Для его решения почти всегда достаточно знания простых алгебраических операций.
- Для нашего примера: (5 M)V 1 = (1 мM)(1 л). Приведя все к одинаковым единицам, решим уравнение относительно V 1 .
- (5 M)V 1 = (0,001 M)(1 л)
- V 1 = (0,001 M)(1 л)/(5 M).
- V 1 = 0,0002 л, или 0.2 мл.
Подумайте о применении полученного результата на практике.
Допустим, вы вычислили искомую величину, но все еще затрудняетесь приготовить реальный раствор. Такая ситуация вполне понятна — язык математики и чистой науки иногда далек от реального мира. Если вам уже известны все четыре величины, входящие в уравнение C 1 V 1 = C 2 V 2 , поступите следующим образом:
- Измерьте объем V 1 раствора концентрацией C 1 . Затем долейте разводящую жидкость (воду и т.п.), чтобы объем раствора стал равен V 2 . Этот новый раствор и будет обладать необходимой концентрацией (C 2).

- В нашем примере мы сначала отмеряем 0,2 мл исходного раствора концентрацией 5 M. Затем разводим его водой до объема 1 л: 1 л — 0,0002 л = 0,9998 л, т.е. добавляем к нему 999,8 мл воды. Получившийся раствор будет иметь необходимую нам концентрацию 1 мM.
Для приготовления растворов молярной и нормальной концентрации навеску вещества отвешивают на аналитических весах, а растворы готовятся в мерной колбе. При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
Навеска растворяемого вещества подсчитывается с точностью до четвертого десятичного знака, а молекулярные массы берутся с точностью, с которой они приведены в справочных таблицах. Объем концентрированной.кислоты подсчитывается с точностью до второго десятичного знака.
Пример 1. Сколько граммов хлорида бария необходимо для приготовления 2 л 0,2 М раствора?
Решение.
Молекулярная масса хлорида бария равна 208,27. Следовательно. 1л 0,2 М раствора должен содержать 208,27-0,2= = 41,654 г ВаС1 2 . Для приготовления 2 л потребуется 41,654-2 = 83,308 г ВаС1 2 .
1л 0,2 М раствора должен содержать 208,27-0,2= = 41,654 г ВаС1 2 . Для приготовления 2 л потребуется 41,654-2 = 83,308 г ВаС1 2 .
Пример 2. Сколько граммов безводной соды Na 2 C0 3 потребуется для приготовления 500 мл 0,1 н. раствора?
Решение.
Молекулярная масса соды равна 106,004; эквивалент-пая масса 5 N a 2 C0 3 =М: 2 = 53,002; 0,1 экв. = 5,3002 г.
1000 мл 0,1 н. раствора содержат 5,3002 г Na 2 C0 3
500 »» » » » х
» Na 2 C0 3
5,3002-500
х=——
Гооо—- = 2-6501 г Na 2 C0 3 .
Пример 3. Сколько концентрированной серной кислоты (96%: d=l,84) требуется для приготовления 2 л 0,05 н. раствора серной кислоты?
Решение.
Молекулярная масса серной кислоты равна 98,08. Эквивалентная масса серной кислоты 3h 2 so 4 =М: 2=98,08: 2 = 49,04 г. Масса 0,05 экв. = 49,04-0,05 = 2,452 г.
Найдем, сколько H 2 S0 4 должно содержаться в 2 л 0,05 н. раствора:
1 л-2,452 г H 2 S0 4
2 »- х
» H 2 S0 4
х
= 2,452-2 = 4,904 г H 2 S0 4 .
ЧтобА определить, сколько для этого надо взять 96,% раствора H 2 S0 4 , составим пропорцию:
в 100 г конц. H 2 S0 4 -96 г H 2 S0 4
У
» » H 2 S0 4 -4,904 г H 2 S0 4
4,904-100
У
=——— §6—— = 5,11 г H 2 S0 4 .
Пересчитываем это количество на объем: ,. Р
5,11
К = 7 = ТЖ = 2 ‘ 77 мл —
Таким образом, для приготовления 2 л 0,05 н. раствора надо взять 2,77 мл концентрированной серной кислоты.
Пример 4. Вычислить титр раствора NaOH, если известно что его точная концентрация равна 0,0520 н.
Решение.
Напомним, что титром называется содержание в 1 мл раствора вещества в граммах. Эквивалентная масса NaOH=40 01 г Найдем, сколько граммов NaOH содержится в 1 л данного раствора:
40,01-0,0520 = 2,0805 г.
1итр раствора: -щ=- =0,00208 г/мл. Можно воспользоваться также формулой:
9
N
где Т
— титр, г/мл; Э
— эквивалентная масса; N —
нормальность раствора.
Тогда титр данного раствора:
ф
40,01 0,0520
«NaOH =——— jooo—— 0,00208 г/мл.
„ «Р ие Р 5 — Вычислить нормальную концентрацию раствора HN0 3 , если известно, что титр данного раствора равен 0,0065 Для расчета воспользуемся формулой:
Т ■
1000 63,05
5hno 3 = j- = 63,05.
Нормальная концентрация раствора азотной кислоты равна:
— V = 63,05 = 0,1030 н.
Пример 6. Какова нормальная концентрация раствора, если известно, что в 200 мл этого раствора содержится 2,6501 г Na 2 C0 3
Решение.
Как было вычислено в примере 2, Зма 2 со(=53,002.
Найдем, сколько эквивалентов составляет 2,6501 г Na 2 C0 3: Г
2,6501: 53,002 = 0,05 экв. /
Для того чтобы вычислить нормальную концентрацию раствора, составим пропорцию:
1000 » » х »
1000-0,05
х =
—————— =0,25 экв.
В 1 л данного раствора будет содержаться 0,25 эквивалентов, т. е. раствор будет 0,25 н.
Для такого расчета можно воспользоваться формулой:
Р-
1000
где Р
— количество вещества в граммах; Э
— эквивалентная масса вещества; V
— объем раствора в миллилитрах.
Зыа 2 со 3 =53,002, тогда нормальная концентрация данного раствора
2,6501-10С0
N = 53,002-200
Солевой раствор может понадобится для самых разных целей, например, он входит в состав некоторых средств народной медицины. Так как приготовить 1-процентный раствор, если дома нет специальных мензурок для измерения количества продукта? В целом даже и без них можно сделать 1-процентный раствор соли. Как приготовить его, подробно рассказано далее. Прежде чем приступать к приготовлению такого раствора, следует внимательно изучить рецепт и точно определиться с необходимыми ингредиентами. Все дело в том, что определение «соль» может относиться к разным веществам. Иногда это оказывается обычная пищевая соль, иногда каменная или и вовсе хлорид натрия. Как правило, в подробном рецепте всегда удается отыскать пояснение того, какое именно вещество рекомендуется использовать. В народных рецептах нередко указывается также сульфат магния, которые имеет второе название «английская соль».
Если вещество требуется, например, для полоскания горла или снятия боли с зуба, то чаще всего в таком случае рекомендуется применять именно солевой раствор хлорида натрия. Чтобы полученное средство обладало целебными свойствами и не нанесло вред организму человека, следует подбирать для него исключительно качественные ингредиенты. Например, каменная соль содержит много лишних примесей, поэтому вместо нее лучше использовать обычную мелкую (для полоскания можно и йодированную). Что касается воды, то в домашних условиях следует применять фильтрованную или хотя бы кипяченую. В некоторых рецептах рекомендуется использовать дождевую воду или снег. Но, учитывая современное экологическое состояние, делать этого не стоит. Особенно — жителям крупных мегаполисов. Лучше просто тщательно очистить воду из-под крана.
Если специального фильтра дома не оказалось, то можно использовать для очистки воды известный «дедовский» метод. Он подразумевает замораживание воды из-под крана в морозилке. Как известно, в процессе в лед первым делом превращается именно самая чистая жидкость, а все вредные примеси и грязь опускается на дно емкости. Не дожидаясь замораживания всего стакана, следует снимать верхнюю ледяную часть и затем растапливать ее. Такая вода окажется максимально чистой и безопасной для здоровья. Именно ее можно использовать для приготовления солевого раствора.
Как известно, в процессе в лед первым делом превращается именно самая чистая жидкость, а все вредные примеси и грязь опускается на дно емкости. Не дожидаясь замораживания всего стакана, следует снимать верхнюю ледяную часть и затем растапливать ее. Такая вода окажется максимально чистой и безопасной для здоровья. Именно ее можно использовать для приготовления солевого раствора.
Теперь стоит определиться с единицами измерения жидкости и твердого вещества. Для соли удобнее всего использовать чайную ложку. Как известно, в ней помещается 7 грамм продукта, если ложечка с горкой, то 10. Последний вариант удобнее применять для высчитывания процентного соотношения. Воду отмерить легко обычным граненым стаканом, если в доме нет специальных мензурок. В нем содержится 250 миллилитров воды. Масса 250 миллилитров чистой пресной воды равна 250 граммам. Удобнее всего использовать полстакана жидкости или 100 граммов. Далее самый сложный этап приготовления солевого раствора. Стоит еще раз внимательно изучить рецепт и определиться с пропорциями. Если в нем рекомендуется взять 1% раствор соли, то в каждых 100 граммах жидкости потребуется растворить 1 грамм твердого вещества. Максимально точные расчеты подскажут, что необходимо будет взять 99 граммов воды и 1 грамм соли, но вряд ли потребуется такая точность.
Если в нем рекомендуется взять 1% раствор соли, то в каждых 100 граммах жидкости потребуется растворить 1 грамм твердого вещества. Максимально точные расчеты подскажут, что необходимо будет взять 99 граммов воды и 1 грамм соли, но вряд ли потребуется такая точность.
Вполне возможно допустить некоторую погрешность и, например, в один литр воды добавить одну чайную ложку соли с горкой, чтобы получить 1-процентный солевой раствор. В настоящее время он нередко применяется, например, при лечении простудных заболеваний и особенно боли в горле. В готовый раствор можно добавить также соду или несколько капель йода. Получившаяся смесь для полоскания станет отличным действенным и эффективным средством против боли в горле. Неприятные ощущения уйдут всего после нескольких процедур. Кстати, такой раствор не запрещен для использования самым маленьким членам семьи. Главное, не переусердствовать с дополнительными ингредиентами (особенно с йодом), в противном случае можно повредить слизистую оболочку полости рта и лишь усугубить состояние больного горла.
Также солевой раствор может применяться для облегчения тянущей ноющей зубной боли. Правда, эффективнее использовать более насыщенный, например, 10-процентный. Такая смесь действительно на непродолжительное время способна снять болезненные неприятные ощущения в полости рта. Но она не является лекарственным средством, поэтому откладывать посещение стоматолога после облегчения ни в коем случае нельзя.
Приблизительные растворы.
При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного -55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000-462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5″—требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора
. Пусть с — количество раствора, m%-концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации.
Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы.
Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы.
Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего -0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено. Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01. Это число одновременно является и его грамм-эквивалентом.
Это число одновременно является и его грамм-эквивалентом.
Чтобы приготовить 1 л 1 и. раствора NaOH, нужно взять 40 г химически чистого едкого натра, а для приготовления 1 л0,1н. раствора — в десять раз меньше, т. е. 4 г.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
|
Исходные химические вещества, г |
Молекулярная масса |
Грамм-эквивалент |
Нормальность раствора |
Вещества для установки титров |
||||||
|
Янтарная плп щавелевая кислота |
||||||||||
|
То же |
Чтобы приготовить 1 л 0,1 н. раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (С г Н 2 0 4 -2Н 2 0) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05: 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор. При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025: 10=6,3025 г. Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt,
т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к,
т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С 4 Н 6 0 4) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Чтобы приготовить 1 л децинормального раствора янтарной кислоты, ее нужно взять в количестве 59,02: 10 = =5,902, а для 100 мл раствора -0,59 г.
Установка титра 0,1 н. раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238: 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H 2 S0 4) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H 2 S0 4 . Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H 2 S0 4 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H 2 S0 4 . Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.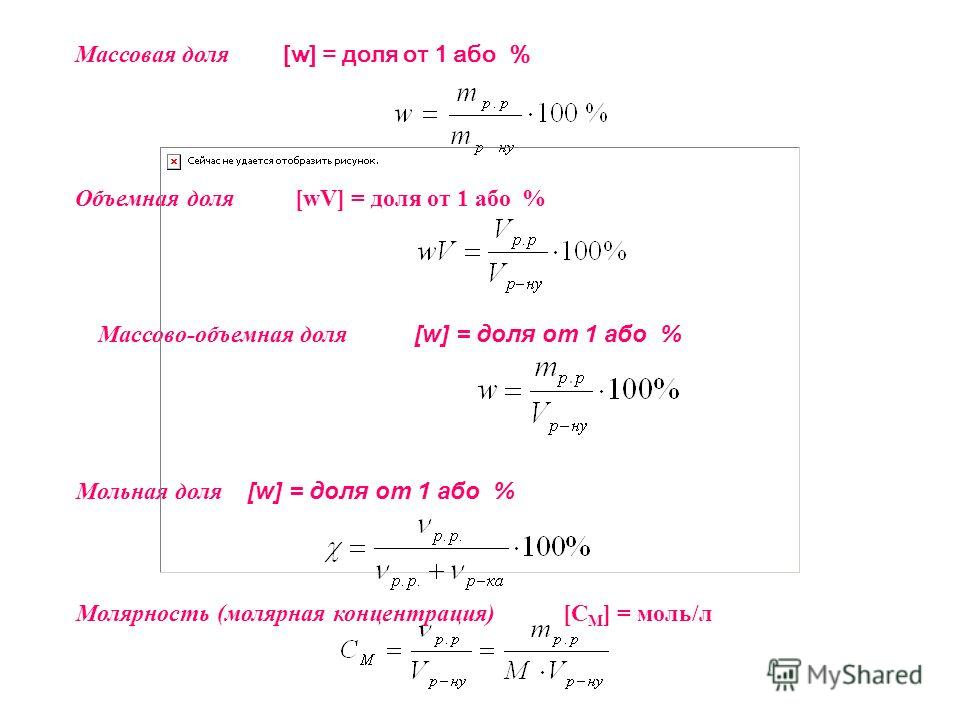
Например, при титровании установлено, что 1 мл 0,1 н. раствора H 2 S0 4 содержит не 0,0049 г H 2 S0 4 , а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V
— объем испытуемого раствора, взятый для титрования;
k t
— поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
У х — объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Таблица 32
|
Исходные химические вещества, мл |
Молекулярная масса |
Нормальность раствора |
|||||||
|
{ |
|||||||||
|
H 2 S0 4 (плотность 1,84) |
|||||||||
|
НС1 (плотность 1,19) |
Для облегчения процесса приготовления титрованных растворов кислот предлагаем таблицу количества исходных веществ для приготовления 1 л растворов разной нормальности (табл. 32).
Необходимо иметь в виду, что при растворении кислот следует прибавлять кислоту к воде, а не наоборот.
7.15: Концентрации: массовые/объемные проценты — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 222385
Цели обучения
- Рассчитайте процент массы/объема раствора.

Как указывалось ранее, химики определили несколько типов концентраций, в каждом из которых используется отдельная химически приемлемая единица или комбинация единиц для обозначения количества растворенного вещества, растворенного в заданном количестве растворителя. В следующих абзацах будет представлено и применено уравнение , которое используется для расчета массовых/объемных процентов, что является последним типом процентной концентрации , которая будет обсуждаться в этой главе.
Уравнение процента массы/объема
массовых/объемных процента раствора определяется как отношение массы растворенного вещества, присутствующего в растворе, к объему раствора в целом. Поскольку этот тип концентрации выражается в процентах, указанную пропорцию должно быть умножено на 100, как показано ниже.
(text{Процент массы/объема}) = ( dfrac{ rm{m_{раствор} ; (rm{g})}}{rm{V_{раствор} ; ( rm{мл})}} ) × ({100})
Как обсуждалось в предыдущих двух разделах этой главы, массовые проценты и объемные проценты можно рассчитать с помощью альтернативного уравнения, в котором массы или объемы растворенного вещества и растворителя, содержащихся в растворе, добавляют соответственно для получения массы или объема, соответственно, этого раствора в целом. В то время как массовые проценты обычно указываются для твердофазных и жидкофазных растворов, а объемные проценты обычно определяются для жидкофазных и газообразных растворов, концентрация массовых/объемных процентов чаще всего рассчитывается для растворов, которые специально готовят путем растворения твердых растворенных веществ. в жидких растворителях. Чтобы создать раствор такого типа, частицы твердого растворенного вещества должны преодолеть силы притяжения, существующие между молекулами жидкого растворителя, чтобы перемещаться и занимать «пустые» пространства, которые временно образуются в процессе сольватации . После того, как частицы растворенного вещества диспергированы в растворителе, молекулы растворителя взаимодействуют с сольватированными частицами растворенного вещества более сильно, чем с другими молекулами растворителя, и, следовательно, находятся в более близком физическом контакте с этими частицами растворенного вещества по сравнению с другими молекулами растворителя. В результате этих взаимодействий растворенного вещества и растворителя сольватированные частицы растворенного вещества занимают меньше места, чем они имели до их сольватации, что приводит к уменьшению объема раствора в целом по сравнению с объединенными объемами отдельного растворенного вещества и растворитель.
В то время как массовые проценты обычно указываются для твердофазных и жидкофазных растворов, а объемные проценты обычно определяются для жидкофазных и газообразных растворов, концентрация массовых/объемных процентов чаще всего рассчитывается для растворов, которые специально готовят путем растворения твердых растворенных веществ. в жидких растворителях. Чтобы создать раствор такого типа, частицы твердого растворенного вещества должны преодолеть силы притяжения, существующие между молекулами жидкого растворителя, чтобы перемещаться и занимать «пустые» пространства, которые временно образуются в процессе сольватации . После того, как частицы растворенного вещества диспергированы в растворителе, молекулы растворителя взаимодействуют с сольватированными частицами растворенного вещества более сильно, чем с другими молекулами растворителя, и, следовательно, находятся в более близком физическом контакте с этими частицами растворенного вещества по сравнению с другими молекулами растворителя. В результате этих взаимодействий растворенного вещества и растворителя сольватированные частицы растворенного вещества занимают меньше места, чем они имели до их сольватации, что приводит к уменьшению объема раствора в целом по сравнению с объединенными объемами отдельного растворенного вещества и растворитель. Поскольку величина этого объемного сжатия варьируется в зависимости от растворенного вещества и растворителя, которые используются для приготовления раствора, расчет процента массы/объема раствора путем сложения объемов его компонентов является непомерно сложным. Следовательно, только приведенное выше уравнение может быть применено для надежного определения массовых/объемных процентов раствора.
Поскольку величина этого объемного сжатия варьируется в зависимости от растворенного вещества и растворителя, которые используются для приготовления раствора, расчет процента массы/объема раствора путем сложения объемов его компонентов является непомерно сложным. Следовательно, только приведенное выше уравнение может быть применено для надежного определения массовых/объемных процентов раствора.
Расчет процента массы/объема
Для включения в приведенное выше уравнение масса растворенного вещества должна быть выражена в граммах, объем раствора должен быть указан в миллилитрах, а химическая формула каждого компонент должен быть записан как вторичная единица в связанной с ним числовой величине. Следовательно, если какое-либо из этих измерений сообщается с использованием альтернативной единицы, его значение необходимо преобразовать в соответствующую единицу, прежде чем включать его в уравнение массовых/объемных процентов.
Во время процессов умножения и деления, которые используются для решения этого уравнения, не происходит сокращения единиц, поскольку единицы, присутствующие в числителе и знаменателе, «г» и «мл» соответственно, не совпадают друг с другом. Таким образом, единицей измерения, полученной в результате деления указанных величин, является «г/мл», которая обычно используется для сообщения плотности вещества. Поскольку плотности и массовые/объемные процентные концентрации имеют уникальные определения и рассчитываются с использованием разных уравнений, эти измерения являются разными величинами и, следовательно, не могут быть выражены с использованием одной и той же единицы. Таким образом, единицы массы и объема исключаются при упрощении уравнения массового/объемного процента, , хотя «г» и «мл» не сокращаются, математически , а расчетная концентрация выражается в процентах. Однако, как указывалось ранее, количество растворенного вещества, которое присутствует в данном растворе, может быть выражено с помощью трех уникальных процентных концентраций. Чтобы отличить процент массы/объема, который рассчитывается путем упрощения отношения массы к объему , от других концентраций, основанных на процентах, единицей, в которой сообщается концентрация процента массы/объема, является «% m/ v», и химическая формула растворенного вещества записывается как вторичная единица этой рассчитанной величины.
Таким образом, единицей измерения, полученной в результате деления указанных величин, является «г/мл», которая обычно используется для сообщения плотности вещества. Поскольку плотности и массовые/объемные процентные концентрации имеют уникальные определения и рассчитываются с использованием разных уравнений, эти измерения являются разными величинами и, следовательно, не могут быть выражены с использованием одной и той же единицы. Таким образом, единицы массы и объема исключаются при упрощении уравнения массового/объемного процента, , хотя «г» и «мл» не сокращаются, математически , а расчетная концентрация выражается в процентах. Однако, как указывалось ранее, количество растворенного вещества, которое присутствует в данном растворе, может быть выражено с помощью трех уникальных процентных концентраций. Чтобы отличить процент массы/объема, который рассчитывается путем упрощения отношения массы к объему , от других концентраций, основанных на процентах, единицей, в которой сообщается концентрация процента массы/объема, является «% m/ v», и химическая формула растворенного вещества записывается как вторичная единица этой рассчитанной величины.
Наконец, поскольку массовые/объемные проценты не определяются как точные величины, их значения следует сообщать с использованием правильного количества значащих цифр. Однако «100» — это точное число, поэтому оно не влияет на значимость окончательной сообщаемой концентрации.
Упражнение (PageIndex{1})
Рассчитайте массовый/объемный процент раствора объемом 762,5 миллилитра, приготовленного путем растворения 289,15 граммов азида кальция, Ca(N 3 ) 2 , в воде.
- Ответить
- Чтобы рассчитать массовый/объемный процент раствора, каждое вещество, на которое ссылаются в задаче, должно быть сначала классифицировано как растворенное вещество или растворитель. Поскольку в данном утверждении присутствует индикаторное слово «в», химическое вещество, которое упоминается после , растворитель 9, 0 9045, вода, H в этом растворе, а оставшееся вещество, азид кальция, Ca(N 3 ) 2 , растворенное вещество «по умолчанию».

Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, масса растворенного вещества должна быть выражена в граммах, а объем раствора должен быть указан в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в уравнение массовых/объемных процентов, как показано ниже. Единицы массы и объема исключаются при упрощении этого уравнения, , хотя «г» и «мл» не сокращаются, математически , чтобы избежать получения единицы плотности в результате деления заданных величин. Чтобы отличить массовый/объемный процент, который рассчитывается путем упрощения отношения массы к объему , от других концентраций, основанных на процентах, единицей, в которой сообщается результирующая концентрация, является «% m/v Ca( N 3 ) 2 ». Химическая формула растворенного вещества записывается как вторичная единица расчетного количества, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.

(text{Процент массы/объема}) = ( dfrac{289,15 ; rm{g} ; rm{Ca(N_3)_2}}{762,5 ; rm{мл} ; rm{решение}}) × ({100})
(text{Процент массы/объема}) = ({37,92131… % rm{m/v} ; rm{Ca(N_3)_2}} ≈ {37,92 % rm{m/v} ;rm{Ca(N_3)_2}})
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
-
- Теги
-
-
На этой странице нет тегов.
Концентраторы | Безграничная химия |
Молярность
Молярность определяется как количество молей растворенного вещества на объем всего раствора.
Цели обучения
Расчет концентрации раствора с использованием молярности.
Ключевые выводы
Ключевые моменты
- Молярность (М) указывает количество молей растворенного вещества на литр раствора (моль/литр) и является одной из наиболее распространенных единиц, используемых для измерения концентрации раствора.
- Молярность можно использовать для расчета объема растворителя или количества растворенного вещества.
- Связь между двумя растворами с одинаковым количеством молей растворенного вещества может быть представлена формулой c 1 V 1 = c 2 V 2 , где c — концентрация, а V — объем.
Ключевые термины
- разбавление : Процесс, при котором раствор делается менее концентрированным путем добавления большего количества растворителя.
- Единица СИ : Современная форма метрической системы, широко используемой в науке (сокращенно SI от французского: Système International d’Unités).

- молярность : Концентрация вещества в растворе, выраженная в количестве молей растворенного вещества на литр раствора.
- концентрация : Относительное количество растворенного вещества в растворе.
В химии концентрацию раствора часто измеряют в молярности (М), которая представляет собой количество молей растворенного вещества на литр раствора. Эта молярная концентрация (c i ) рассчитывается путем деления количества молей растворенного вещества (n i ) на общий объем (V) из:
ci=niVtext{c}_text{i}=frac{text{n}_text{i}}{text{V} }ci=Vni
Единицей СИ для молярной концентрации является моль/м 3 . Однако моль/л является более распространенной единицей молярности. Раствор, который содержит 1 моль растворенного вещества на 1 литр раствора (1 моль/л), называется «однимолярным» или 1 М. Единица моль/л может быть преобразована в моль/м 3 с помощью следующего уравнения:
1 моль/л = 1 моль/дм 3 = 1 моль дм −3 = 1 M = 1000 моль/м 3
Расчет молярности
Чтобы рассчитать молярность раствора, количество молей растворенного вещества необходимо разделить на общее количество литров полученного раствора.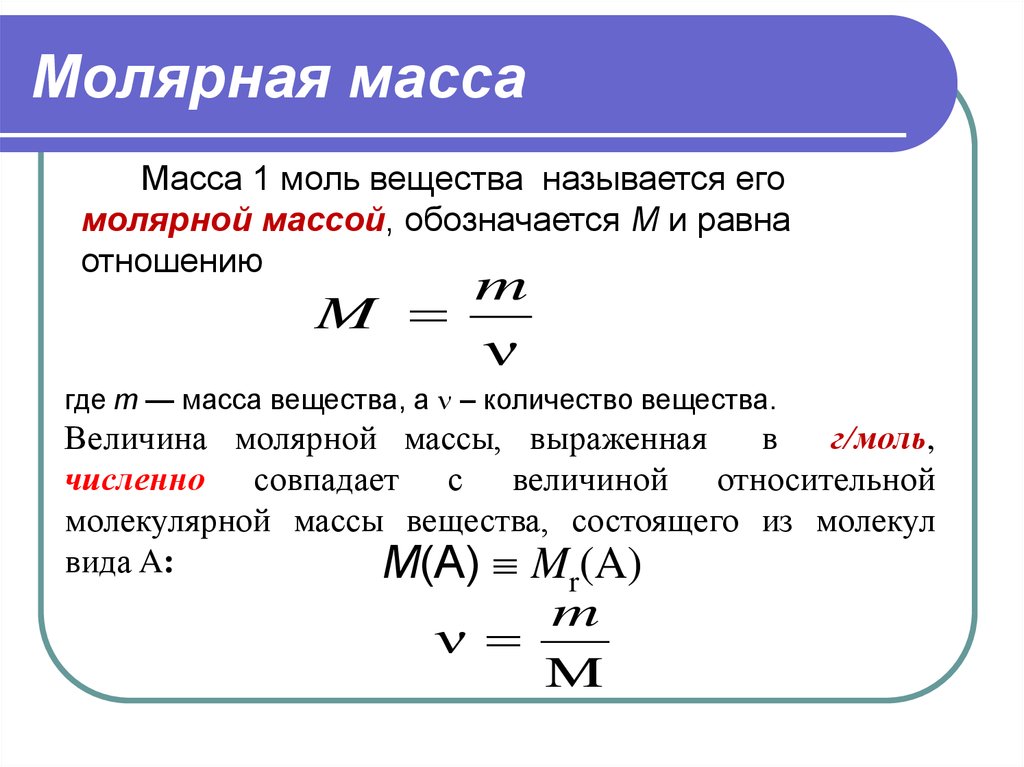 Если количество растворенного вещества указано в граммах, мы должны сначала рассчитать количество молей растворенного вещества, используя молярную массу растворенного вещества, а затем рассчитать молярность, используя количество молей и общий объем.
Если количество растворенного вещества указано в граммах, мы должны сначала рассчитать количество молей растворенного вещества, используя молярную массу растворенного вещества, а затем рассчитать молярность, используя количество молей и общий объем.
Расчет молярности по молям и объему
Если в воде (растворителе) растворить 10,0 г NaCl (растворенное вещество) и получить 2,0 л раствора, какова молярность этого раствора?
Сначала мы должны преобразовать массу NaCl в граммах в моли. Мы делаем это путем деления на молекулярную массу NaCl (58,4 г/моль).
10,0 грамм NaCl×1 моль58,4 г/моль=0,17 моль NaCl10,0 text{ грамм NaCl} times frac{text{1 моль}}{58,4 text {г/моль}} = 0,17 text { моль NaCl} 10,0 грамм NaCl×58,4 г/моль1 моль=0,17 моль NaCl
Затем мы делим количество молей на общий объем раствора, чтобы получить концентрацию.
ci=niVtext{c}_text{i}=frac{text{n}_text{i}}{text{V}}ci=Vni
ci=0,17 моль NaCl2 л растворtext{c}_text{i}=frac{0,17 text{ моль NaCl}}{2 text{ л раствор}}ci=2 л раствор 0,17 моль NaCl
ci=0,1 Mtext{c}_text{i} = 0,1 text{ M}ci=0,1 M
Раствор NaCl представляет собой 0,1M раствор.
Расчет молей с учетом молярности
Чтобы рассчитать количество молей в растворе с учетом молярности, мы умножаем молярность на общий объем раствора в литрах.
Сколько молей хлорида калия (KCl) содержится в 4,0 л 0,65 М раствора?
ci=niVtext{c}_{text{i}}=frac{text{n}_{text{i}}}{text{V}}ci=Vni
0,65 M=ni4,0 L0,65 text{M} = frac{text{n}_text{i}}{4,0 text{L}}0,65 M=4,0 Lni
ni= (0,65 М)(4,0 л)=2,6 моль KCltext{n}_text{i} = (0,65 text{ M})(4,0 text{ L}) = 2,6 text{ моль KCl}ni =(0,65 М)(4,0 л)=2,6 моль KCl
2,6 моль KCl содержится в 0,65 М растворе, который занимает 4,0 л.
Расчет объема с учетом молярности и молей
Мы также можем рассчитать объем, необходимый для удовлетворения определенной массы в граммах, учитывая молярность раствора. Это полезно для определенных растворенных веществ, которые не могут быть легко взвешены с помощью весов. Например, диборан (B 2 H 6 ) является полезным реагентом в органическом синтезе, но также является высокотоксичным и легковоспламеняющимся. Диборан безопаснее в использовании и транспортировке, если он растворен в тетрагидрофуране (ТГФ).
Например, диборан (B 2 H 6 ) является полезным реагентом в органическом синтезе, но также является высокотоксичным и легковоспламеняющимся. Диборан безопаснее в использовании и транспортировке, если он растворен в тетрагидрофуране (ТГФ).
Сколько миллилитров 3,0 М раствора Bh4-ТГФ необходимо для получения 4,0 г Bh4?
Сначала мы должны перевести граммы BH 3 в моли, разделив массу на молекулярную массу.
4,0 г Bh413,84 г/моль Bh4=0,29 моль Bh4frac{4,0 text{ г }text{BH}_3 }{13,84 text{г/моль}text{BH}_3} = 0,29text{ моль }text{BH}_313,84 г/моль Bh44,0 г Bh4=0,29 моль Bh4
Зная, что нам нужно получить 0,29 моль BH 3, , мы можем использовать это и заданной молярности (3,0 М) для расчета объема, необходимого для достижения 4,0 г.
ci=niVtext{c}_{text{i}}=frac{text{n}_{text{i}}}{text{V}}ci=Vni
3,0 M=0,29 моль Bh4V3.0 text{ M} = frac{0,29 text{моль BH}_3} {text{V}}3,0 M=V0,29 моль Bh4
V=0,1L text{V} = 0,1 text{L}V=0,1 л
Теперь, когда мы знаем, что существует 4,0 г BH 3 присутствует в 0,1 л, мы знаем, что нам нужно 100 мл раствора для получения 4,0 г BH 3 .
Разбавление
Разбавление — это процесс уменьшения концентрации растворенного вещества в растворе, обычно путем добавления большего количества растворителя. Эта зависимость представлена уравнением c 1 V 1 = c 2 V 2 , где c 1 и c 2 — начальная и конечная концентрации, а V 1
Пример 1
У ученого есть 5,0 М раствор соляной кислоты (HCl), и для его нового эксперимента требуется 150,0 мл 2,0 М HCl. Сколько воды и сколько 5,0 М HCl должен использовать ученый, чтобы получить 150,0 мл 2,0 М HCl?
c 1 V 1 = c 2 V 2
c 1 и V 1 – концентрация и объем исходного раствора HCl 5. c 2 и V 2 представляют собой концентрацию и объем желаемого раствора или 150,0 мл 2,0 М раствора HCl. Объем пока не нужно преобразовывать в литры, потому что обе части уравнения используют мл. Следовательно:
Объем пока не нужно преобразовывать в литры, потому что обе части уравнения используют мл. Следовательно:
(5,0 М HCl)(V1)=(2,0 М HCl)(150,0 мл)(5,0 text{М HCl})(text{V}_1) = (2,0 text{М HCl})(150,0 text{мл})(5,0 М HCl)(V1)=(2,0 М HCl)(150,0 мл)
V 1 = 60,0 мл 5,0 М HCl
Если для приготовления используется 60,0 мл 5,0 М HCl нужного раствора, можно рассчитать количество воды, необходимое для правильного разбавления раствора до нужной молярности и объема:
150,0 мл — 60,0 мл = 90,0 мл
Чтобы ученый получил 150,0 мл 2,0 М HCl, ему потребуется 60,0 мл 5,0 М HCl и 90,0 мл воды.
Пример 2
К 25 мл исходного раствора 5,0 М HBr добавляли воду до тех пор, пока общий объем раствора не составлял 2,5 л. Какова молярность нового раствора?
Нам дано следующее: c 1 = 5,0 M, V 1 = 0,025 л, V 2 = 2,50 л. разбавленный раствор.
(5,0 М)(0,025 л) = c 2 (2,50 л)
c2=(5,0 М)(0,025 л)2,50 л=0,05 Мtext{c}_2 = frac{(5,0 text {M})(0,025 text{L}) }{2,50 text{L}} =0,05 text{M}c2=2,50L(5,0M)(0,025L)=0,05M
Обратите внимание, что все единицы измерения объема были преобразованы в литры. Мы подсчитали, что у нас будет 0,05 М раствор, что соответствует нашим ожиданиям, учитывая, что мы разбавили 25 мл концентрированного раствора до 2500 мл.
Мы подсчитали, что у нас будет 0,05 М раствор, что соответствует нашим ожиданиям, учитывая, что мы разбавили 25 мл концентрированного раствора до 2500 мл.
Моляльность
Моляльность – это свойство раствора, которое указывает количество молей растворенного вещества на килограмм растворителя.
Цели обучения
Рассчитайте моляльность раствора и объясните, как это свойство является коллигативным
Ключевые выводы
Ключевые моменты
- Моляльность — это свойство раствора, которое определяется как количество молей растворенного вещества на килограмм растворителя.
- Единицей моляльности в системе СИ является моль/кг. Раствор с моляльностью 3 моль/кг часто описывают как «3 моляль» или «3 моляль». Однако, следуя системе единиц СИ, теперь предпочтительнее использовать моль/кг или родственную единицу СИ.
- Поскольку объем раствора зависит от температуры и давления окружающей среды, масса может иметь большее значение для измерения растворов.
 В этих случаях подходящей мерой является моляльность (не молярность).
В этих случаях подходящей мерой является моляльность (не молярность).
Ключевые термины
- моляльность : Концентрация вещества в растворе, выраженная как количество молей растворенного вещества на килограмм растворителя.
- коллигативное свойство : Свойство растворов, которое зависит от отношения числа частиц растворенного вещества к числу молекул растворителя в растворе, а не от типа присутствующих химических соединений.
- интенсивное свойство : Свойство материи, не зависящее от количества материи.
Измерения массы (моляльности) в зависимости от объема (молярности)
Моляльность — это интенсивное свойство растворов, которое рассчитывается как количество молей растворенного вещества, деленное на килограммы растворителя. В отличие от молярности, которая зависит от объема раствора, моляльность зависит только от массы растворителя. Поскольку объем зависит от температуры и давления, молярность также зависит от температуры и давления. В некоторых случаях использование веса является преимуществом, поскольку масса не зависит от условий окружающей среды. Например, моляльность используется при работе с диапазоном температур.
Поскольку объем зависит от температуры и давления, молярность также зависит от температуры и давления. В некоторых случаях использование веса является преимуществом, поскольку масса не зависит от условий окружающей среды. Например, моляльность используется при работе с диапазоном температур.
Определение моляльности
Моляльность b (или m) раствора определяется как количество растворенного вещества в молях, n растворенного вещества , деленное на массу растворителя в кг, m растворителя :
bMsolute=nsolutemsolvent text{bM}_{text{solute}}=frac{text{n}_{text{solute}}}{text{m}_{text{растворитель}}}bMsolute=msolvent nsolute
Моляльность основана на массе, поэтому ее можно легко преобразовать в отношение масс, обозначаемое w:
bMsolute=nsolutemsolvent=wsolutewsolventtext{bM}_{text{solute}}=frac{ text{n}_{text{растворенное}}}{text{m}_{text{растворитель}}} = frac{text{w}_{text{растворенное}}}{text {w}_{text{растворитель}}}bMsolute=msolventnsolute=wsolventwsolute
По сравнению с молярной концентрацией или массовой концентрацией приготовление раствора заданной молярности проще, поскольку для этого требуется только хороший масштаб; и растворитель, и растворенное вещество взвешиваются, а не измеряются по объему. Во многих слабых водных растворах молярность и моляльность одинаковы, потому что один килограмм воды (растворитель) занимает один литр объема при комнатной температуре, а небольшое количество растворенного вещества мало влияет на объем растворителя.
Во многих слабых водных растворах молярность и моляльность одинаковы, потому что один килограмм воды (растворитель) занимает один литр объема при комнатной температуре, а небольшое количество растворенного вещества мало влияет на объем растворителя.
Раствор соленой воды : Поваренная соль легко растворяется в воде с образованием раствора. Если известны массы соли и воды, можно определить моляльность.
шт.
Единицей моляльности в СИ является моль/кг или моль растворенного вещества на кг растворителя. Раствор с молярностью 1 моль/кг часто называют «1 моляль» или «1 моль». Однако, следуя системе единиц СИ, Национальный институт стандартов и технологий, который является авторитетом США в области измерений, считает термин «моляль» и символ единицы измерения «м» устаревшими и предлагает использовать моль / кг. или другая родственная единица СИ вместо этого.
Расчет моляльности
Легко вычислить моляльность, если мы знаем массу растворенного вещества и растворителя в растворе. Моляльность является интенсивным свойством и, следовательно, не зависит от измеряемого количества. Это верно для всех концентраций однородных растворов, независимо от того, исследуем ли мы образец одного и того же раствора объемом 1,0 л или 10,0 л. Концентрация, или моляльность, остается постоянной.
Моляльность является интенсивным свойством и, следовательно, не зависит от измеряемого количества. Это верно для всех концентраций однородных растворов, независимо от того, исследуем ли мы образец одного и того же раствора объемом 1,0 л или 10,0 л. Концентрация, или моляльность, остается постоянной.
Расчет моляльности по заданной массе
Если мы взвесим 5,36 г KCl и растворим это твердое вещество в 56 мл воды, какова будет моляльность раствора? Помните, что моляльность равна моль растворенного вещества/кг на растворитель. KCl — это наше растворенное вещество, а вода — наш растворитель. Сначала нам нужно рассчитать количество молей, присутствующих в 5,36 г KCl:
моль KCl=5,36 г × (1 моль74,5 г)=0,0719 моль KCltext{моль KCl} = 5,36 text{г} times (frac{1 text{ моль}}{74,5 text{г}}) = 0,0719 text{ моль KCl} моль KCl=5,36 г × (74,5 г1 моль)=0,0719 моль KCl
Нам также необходимо преобразовать 56,0 мл воды в эквивалентную массу в граммах, используя известную плотность воды (1,0 г/мл):
56,0 мл × (1,0 г/л) = 56,0 г56,0 text{мл} times (frac{1,0 text{g}}{text{мл}}) = 56,0 text{g}56,0 мл×(мл1,0г)=56,0 г
56,0 г воды эквивалентно 0,056 кг воды. Имея эту информацию, мы можем разделить количество молей растворенного вещества на кг растворителя, чтобы найти моляльность раствора:
Имея эту информацию, мы можем разделить количество молей растворенного вещества на кг растворителя, чтобы найти моляльность раствора:
моляльность=(молькг растворителя)=(0,0719 моль KCl0,056 кг воды)=1,3 мtext{ моляльность} = (frac {text{моль}}{text{кг растворителя}}) = (frac {0,0719text{моль KCl}}{0,056text{кг воды}})= 1,3\text{м } моляльность = (кг моль растворителя) = (0,056 кг воды 0,0719моль KCl)=1,3 м
Моляльность нашего раствора KCl и воды составляет 1,3 м. Поскольку раствор очень разбавлен, моляльность почти идентична молярности раствора, которая составляет 1,3 М.
Расчет массы с учетом моляльности
Мы также можем использовать моляльность, чтобы найти количество вещества в растворе. Например, сколько уксусной кислоты в мл необходимо для приготовления 3,0 м раствора, содержащего 25,0 г KCN?
Во-первых, мы должны преобразовать образец KCN из граммов в моли:
моль KCN = 25,0 г × (1 моль 65,1 г) = 0,38 мольtext{ моль KCN} = 25,0 text{г} times (frac {1 text{ моль}}{65,1 text{г} }) = 0,38 text{ моль} моль KCN=25,0 г × (65,1 г1 моль)=0,38 моль
Затем можно использовать моли KCN, чтобы найти кг уксусной кислоты. Мы умножаем количество молей на обратную величину заданной моляльности (3,0 моль/кг), чтобы наши единицы измерения соответствующим образом сокращались. Результатом является желаемая масса уксусной кислоты, необходимая для приготовления нашего 3-метрового раствора:
Мы умножаем количество молей на обратную величину заданной моляльности (3,0 моль/кг), чтобы наши единицы измерения соответствующим образом сокращались. Результатом является желаемая масса уксусной кислоты, необходимая для приготовления нашего 3-метрового раствора:
0,38 моль KCl×(кг уксусной кислоты3,0 моль KCl)=0,12 кг уксусной кислоты0,38 text{ моль KCl} times ( frac {text{кг уксусной кислоты}}{3,0 text{моль KCl}}) = 0,12text{кг уксусной кислоты}0,38 моль KCl×(3,0 моль KCl кг уксусной кислоты)=0,12 кг уксусной кислоты
Получив массу уксусной кислоты в кг, переведем из кг в граммы: 0,12 кг равно 120 г. Затем мы используем плотность уксусной кислоты (1,05 г/мл при 20 90 203 o 90 204 C) для преобразования в требуемый объем в мл. Чтобы получить это, мы должны умножить на величину, обратную плотности:
120,0 г уксусной кислоты × (мл1,05 г) = 114,0 мл уксусной кислоты120,0 text{ г уксусной кислоты} times (frac {text{мл} }{1,05 text{г}}) = 114,0 text{мл уксусной кислоты}120,0 г уксусной кислоты×(1,05 гмл)=114,0 мл уксусной кислоты
Таким образом, нам потребуется 114 мл уксусной кислоты для приготовления 3,0 м раствора, содержащего 25,0 г KCN.
Молярность и моляльность : В этом уроке вы узнаете, чем отличаются молярность и моляльность.
Молярная доля и молярный процент
Молярная доля – это количество молекул данного компонента в смеси, деленное на общее количество молей в смеси.
Цели обучения
Рассчитайте мольную долю и мольный процент для данной концентрации смеси
Ключевые выводы
Ключевые моменты
- Мольная доля описывает количество молекул (или молей) одного компонента, деленное на общее количество молекул (или молей) в смеси.
- Молярная доля используется, когда два реакционноспособных компонента смешиваются вместе, поскольку соотношение двух компонентов известно, если известна мольная доля каждого из них.
- Умножение мольной доли на 100 дает мольные проценты, которые описывают то же самое, что и мольная доля, только в другой форме.
 Молярные доли могут быть получены из различных концентраций, включая моляльность, молярность и композиции в процентах по массе.
Молярные доли могут быть получены из различных концентраций, включая моляльность, молярность и композиции в процентах по массе.
Ключевые термины
- моль : Основная единица СИ для количества вещества; количество вещества, которое содержит столько элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12.
- молярная доля : Отношение количества молей одного компонента в смеси к общему количеству молей.
Мольная доля
В химии молярная доля x i определяется как количество молей компонента, n i , деленное на общее количество молей всех компонентов смеси, n tot :
xi=nintottext{x}_{text{i}}=frac{ text{n}_{text{i}}}{text{n}_{text{tot}}}xi=ntotni
Молярные доли безразмерны, а сумма всех молярных доля в данной смеси всегда равна 1.
Свойства молярной доли
Мольная доля очень часто используется при построении фазовых диаграмм. Имеет ряд преимуществ:
Имеет ряд преимуществ:
- Не зависит от температуры, в отличие от молярной концентрации, и не требует знания плотностей фаз(ы).
- Смесь с известными молярными долями может быть приготовлена путем взвешивания соответствующих масс компонентов.
- Мера симметрична; в молярных долях х=0,1 и х=0,9 роли «растворителя» и «растворенного вещества» обратимы.
- В смеси идеальных газов мольная доля может быть выражена как отношение парциального давления к общему давлению смеси.
Молярная доля в растворе хлорида натрия : Молярная доля увеличивается пропорционально массовой доле в растворе хлорида натрия.
Мольные проценты
Умножение мольной доли на 100 дает мольный процент, также называемый количеством/количественным процентом (сокращенно n/n%). Для общей химии все мольные проценты смеси в сумме составляют 100 мольных процентов. Мы можем легко преобразовать мольные проценты обратно в мольные доли, разделив на 100. Таким образом, молярная доля 0,60 равна молярному проценту 60,0%.
Таким образом, молярная доля 0,60 равна молярному проценту 60,0%.
Расчеты с молярной долей и молярным процентом
Молярная доля в смесях
Смесь газов образовалась путем соединения 6,3 молей O 2 и 5,6 молей N 2 . Какова молярная доля азота в смеси?
Сначала мы должны найти общее количество родинок с n всего = n N2 + n O2 .
ntotal=6,3 моль+5,6 моль=11,9 мольtext{n}_{text{всего}}=6,3 text{моли}+5,6 \ text{моли} = 11,9 text{moles}ntotal=6,3 моля+5,6 моля=11,9 моля
.
Затем мы должны разделить количество молей N 2 на общее количество молей:
x (молярная доля) = (моли N2 моли N2+ моли O2) = (5,6 моль11,9 моль) = 0,47x (text {мольная доля}) = (frac {text{моли} text{N}_2}{text{моли} text{N}_2 + text{моли} O_2})= (frac {5,6 text { моль}}{11,9 text{ моль}})= 0,47x(молярная доля)=(моль N2+ моль O2 моль N2)=(11,9 моль5,6 моль)=0,47
Молярная доля азота в смеси равна 0,47.
Мольная доля в растворах
Молярная доля также может применяться в случае растворов. Например, 0,100 моль NaCl растворяют в 100,0 мл воды. Какова молярная доля NaCl?
Нам дано количество молей NaCl, но объем воды. Сначала мы конвертируем этот объем в массу, используя плотность воды (1,00 г/мл), а затем переводим эту массу в моли воды:
100 мл h3O×(1,0 г1мл)=100,0 г h3O×(1 моль18,0 г) = 5,55 моль ч3O100 text{мл} H_2O times (frac {1,0text{г}}{1text{мл}})= 100,0 text{г} text{ H}_2text{O} times (frac {1 text{ моль}}{18,0 г}) = 5,55 text{ моль } text{H}_2text{O}100 мл ч3O× (1мл1,0г)=100,0г·ч3О×(18,0г1 моль) = 5,55 моль·ч3О
С помощью этой информации мы можем найти общее количество имеющихся родинок: 5,55 + 0,100 = 5,65 молей. Если разделить моли NaCl на общее количество молей, то найдем мольную долю этого компонента:
x=(0,100моль5,65моль)=0,0176text{x} = (frac {0,100 text{моль }}{5,65 text {моль}}) = 0,0176x=(5,65моль0,100моль)=0,0176
Мы находим, что молярная доля NaCl равна 0,0176.
Мольная доля многокомпонентных смесей
Мольные доли также можно найти для смесей, которые образованы из нескольких компонентов. С ними обращаются так же, как и раньше; опять же, общая мольная доля смеси должна быть равна 1,9.0028
Например, раствор образуется при смешивании 10,0 г пентана (C 5 H 12 ), 10,0 г гексана (C 6 H 14 ) и 10,0 г бензола (C 6
4 Н 6 ). Какова молярная доля гексана в этой смеси?
Сначала мы должны найти количество молей, присутствующих в 10,0 г каждого компонента, учитывая их химические формулы и молекулярные массы. Количество молей для каждого находится путем деления его массы на соответствующий молекулярный вес. Находим, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Мы можем найти общее количество молей, взяв сумму всех молей: 0,138+0,116+0,128 = 0,382 общих молей. Если мы разделим количество молей гексана на общее количество молей, мы вычислим мольную долю:
x=(0,116 моль0,382 моль)=0,303text{x} = (frac {0,116 text{моль}}{0,382 text{моль}}) = 0,303x=(0,382 моль0,116 моль)=0,303
Мольная доля гексана равна 0,303.
Молярная доля от моляльности
Молярная доля также может быть рассчитана по моляльности. Если у нас есть 1,62 м раствора столового сахара (C 6 H 12 O 6 ) в воде, какова молярная доля столового сахара?
Поскольку нам дана моляльность, мы можем преобразовать ее в эквивалентную молярную долю, которая уже является массовым отношением; помните, что моляльность = моли растворенного вещества/кг растворителя. Учитывая определение моляльности, мы знаем, что у нас есть раствор с 1,62 моль сахара и 1,00 кг (1000 г) воды. Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя ее молекулярную массу:
1000 г h3O×(1 моль18,0 г)=55,5 молей h3O1000 text{g} text{H}_2text{O} times (frac {1 text{mol}}{ 18,0 text{г}}) = 55,5 text{ моль }text{H}_2text{O}1000 г·ч3O×(18,0 г1 моль)=55,5 моль·ч3O
Общее число молей представляет собой сумму молей воды и сахара, или всего 57,1 молей раствора. Теперь мы можем найти молярную долю сахара:
Теперь мы можем найти молярную долю сахара:
x=(1,62 моль сахара57,1 моль раствор)=0,0284text{x} = (frac {1,62 text{ моль сахара}}{57,1 text{ моль раствор}}) = 0,0284 x = (57,1 моль раствора 1,62 моль сахара) = 0,0284
При мольной доле 0,0284 мы видим, что имеем 2,84% раствор сахара в воде.
Молярная доля от массы в процентах
Молярная доля также может быть рассчитана из массовых процентов. Какова молярная доля коричной кислоты, которая имеет массовый процент мочевины 50,00% в коричной кислоте? Молекулярная масса мочевины составляет 60,16 г/моль, а молекулярная масса коричной кислоты – 148,16 г/моль.
Во-первых, мы принимаем общую массу 100,0 г, хотя можно принять любую массу. Это означает, что мы имеем 50,0 г мочевины и 50,0 г коричной кислоты. Затем мы можем рассчитать присутствующие моли, разделив каждый на его молекулярную массу. У нас есть 0,833 моля мочевины и 0,388 моля коричной кислоты, так что всего у нас 1,22 моля.
Чтобы найти молярную долю, мы делим количество молей коричной кислоты на общее количество молей:
x=(0,388 моль коричной кислоты1,22 моль раствора)=0,318text{x} = (frac {0,388 text{ моль коричной кислоты}}{1,22 text{ моль раствора}})= 0,318x=(1,22 моль раствора.388 моль коричной кислоты)=0,318
Молярная доля коричной кислоты равна 0,318.
Лицензии и авторство
Контент под лицензией CC, совместно используемый ранее
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензионный контент CC, конкретное указание авторства
Концентрация в процентах по массе/объему Учебное пособие по химии
Ключевые понятия
⚛ Концентрация в процентах по массе/объему – это измерение концентрации раствора.
· Массовая/объемная процентная концентрация также известна как массовая/объемная процентная концентрация.
⚛ массовая/объемная концентрация в процентах обычно обозначается аббревиатурой w/v (%) или w/v% или (w/v)% или %(w/v) или %w/v
· Массовая/объемная концентрация в процентах обычно обозначается аббревиатурой m/v (%) или m/v% или (m/v)% или %(m/v) или %m/v
⚛ вес. /об.% (масс./об.%) — полезная мера концентрации при дозировании реагентов.
/об.% (масс./об.%) — полезная мера концентрации при дозировании реагентов.
⚛ Для расчета концентрации вес/объем % (массовая/объемная концентрация):
| мас./об. (%) = % (масс./об.) = 908:30 | масса растворенного вещества (г) объем раствора (мл) |
× 100 |
⚛ Общепринятыми единицами измерения (1) для % массы/объема являются г/100 мл (граммы растворенного вещества на 100 мл раствора)
· пример: 5% (масса/объем) = 5 г/100 мл
· пример: 12%(масс./об.) = 12 г/100 мл
⚛ Измените уравнение для концентрации w/v% (m/v%), чтобы найти:
(i) масса растворенного вещества
масса (растворенное вещество) = [объем (раствор) × (вес/объем)%]/100
(ii) объем раствора
объем (раствор) = [масса (растворенное вещество)/(вес/объем)%] × 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Расчет концентрации в процентах по массе/объему
Концентрация в процентах по массе/объему (w/v%) или концентрация в процентах по массе/объему (m/v%) является мерой концентрации раствора.
мас./об.% или масс./об.% рассчитывают путем деления массы растворенного вещества в граммах на объем раствора в миллилитрах с последующим умножением на 100, как показано ниже.
| мас./об. (%) = | масса растворенного вещества (г) объем раствора (мл) |
× 100 |
Процентная концентрация говорит нам, сколько частей растворенного вещества присутствует на 100 частей раствора.
В терминах веса на объем (масса на объем) это означает, что процентная концентрация говорит нам о частях растворенного вещества по массе на 100 частей по объему раствора.
В единицах СИ концентрация w/v% (m/v%) должна быть указана в кг/100 л, но эти единицы слишком велики, чтобы быть полезными для химиков в лаборатории, граммы и миллилитры являются более удобными единицами измерения для нас. .
Напомним, что 1 кг = 1 000 г
Напомним, что 1 л = 1 000 мл
т.о. кг/100 л = 1000 г/100 000 мл = г/100 мл
, поэтому единицы измерения концентрации в весовом/объемном % чаще всего указываются как г/100 мл
Таким образом, единицами концентрации w/v% (m/v%) являются граммы растворенного вещества на 100 мл раствора (г/100 мл).
Это означает, что концентрация в процентах масса/объем (концентрация в процентах масса/объем) может быть указана разными, но эквивалентными способами. Некоторые примеры приведены в таблице ниже:
| мас./об.% (масс./об.%) |
= | г/100 мл |
|---|---|---|
| 0,5 % (вес/объем) | = | 0,5 г/100 мл |
| 1,0 %(масс./об.) 908:30 | = | 1,0 г/100 мл |
| 5,25 % (вес/объем) | = | 5,25 г/100 мл |
| 12,78 %(масс./об.) | = | 12,78 г/100 мл |
| 22,75 % (вес/объем) | = | 22,75 г/100 мл |
Чтобы приготовить раствор с определенной концентрацией, вы взвесите твердое вещество, а затем растворите его в достаточном количестве растворителя, чтобы получился известный объем раствора.
Следовательно, вы будете знать значение двух величин:
- масса растворенного вещества
- объем раствора
, который можно использовать для расчета процентной концентрации веса/объема (концентрация в процентах масса/объем).
Для расчета процентной концентрации масса/объем (массовая/объемная концентрация в процентах):
- Шаг 1: Напишите уравнение: либо масса/объем % = масса/объем × 100, либо масса/объем % = масса/объем × 100
- Шаг 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
- Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
- Шаг 4: Проверить соответствие единиц измерения и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
- Шаг 5: Подставьте эти значения в уравнение и решите.
- Шаг 6: Напишите ответ
Примеры обработки: масс./об.% (масс./об.%) Расчеты
Вопрос 1. Какова массовая/объемная концентрация 250 мл водного раствора хлорида натрия, содержащего 5 г NaCl?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
вес/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Шаг 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaCl) = 5 г
объем раствора = 250 мл
Шаг 4: Проверить единицы измерения на соответствие и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества (NaCl) = 5 г (преобразование единиц не требуется)
объем раствора = 250 мл (пересчет единиц измерения не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = (5 г ÷ 250 мл) × 100 = 2 г/100 мл
(Примечание: допустима только 1 значащая цифра)
Шаг 6: Напишите ответ
вес./об. % = 2 г/100 мл = 2 % (вес./об.) = 2 % (масс./об.)
Вопрос 2. 10,00 г BaCl 2 растворяют в 90,00 г воды.
Плотность раствора 1,090 г/мл (1,090 г/мл -1 ).
Рассчитайте массовую/объемную процентную концентрацию раствора.
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
масса/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид бария = BaCl 2
растворитель = вода = H 2 O (l) (это водный раствор)
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г
масса растворителя = масса (H 2 O) = 90,00 г
плотность раствора = 1,090 г/мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г (преобразование единиц не требуется)
объем раствора неизвестен и должен быть рассчитан с использованием плотности раствора и масс растворенного вещества и растворителя:
плотность = масса(раствор) ÷ объем(раствор)
масса(раствор) = масса(раствор) + масса(растворитель)
масса(раствор) = 10,00 г BaCl 2 + 90,00 г воды = 100,0 г
объем(раствор) = масса(раствор) ÷ плотность(раствор)
объем (раствор) = 100,0 г ÷ 1,090 г /мл = 91,74 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
m/v (%) = (масса растворенного вещества ÷ объем раствора) × 100
м/об (%) = (10,00 г ÷ 91,74 мл) × 100
м/об (%) = 10,90 г/100 мл
(Примечание: оправданы только 4 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 10,90 г/100 мл = 10,90 % (масс./об.) = 10,90 % (масс./об.)
↪ Наверх
Преобразование других единиц измерения в вес./об. % или масс./об. %
Наиболее распространенными единицами измерения % масс./об. (масс./об.%) являются г/100 мл (граммы растворенного вещества на 100 мл раствора).
Если масса растворенного вещества не указана в граммах, вам необходимо перевести единицы измерения в граммы.
Если объем раствора не указан в миллилитрах, вам необходимо перевести единицы измерения в миллилитры.
Рабочие примеры: w/v% (m/v%) Расчеты, требующие преобразования единиц измерения
Вопрос 1. 2,00 л водного раствора хлорида калия содержат 45,0 г KCl.
Какова процентная концентрация массы/объема этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид калия = KCl
9Растворитель 0027 – вода, H 2 O, так как это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса KCl = 45,0 г
объем раствора = 2,00 л
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса KCl = 45,0 г (масса в г, преобразование единиц измерения не требуется)
объем раствора = 2,00 л (необходимо перевести в мл)
В (раствор) = 2,00 л × 10 3 мл/ л = 2000 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = [45,0 г ÷ 2000 мл] × 100 = 2,25 г/100 мл
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 2,25 г/100 мл = 2,25 % (масс./об.) = 2,25 % (масс./об.)
Вопрос 2. 15 мл водного раствора сахарозы содержат 750 мг сахарозы.
Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = сахароза
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (сахароза) = 750 мг
объем раствора = 15 мл
Шаг 4: Проверить соответствие единиц измерения и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
Масса растворенного вещества
(сахароза) = 750 мг (необходимо перевести в граммы)
масса растворенного вещества = 750 мг ÷ 1000 мг /г = 0,750 г
объем раствора = 15 мл (преобразование не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = (0,750 г ÷ 15 мл) × 100 = 5,0 г/100 мл
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 5,0 г/100 мл = 5,0 % (масс./об.) = 5,0 % (масс./об.)
Вопрос 3. 186,4 л водного раствора гидроксида натрия содержит 1,15 кг NaOH.
Какова процентная концентрация массы/объема этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = гидроксид натрия = NaOH
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaOH) = 1,15 кг
объем раствора = 186,4 л
Шаг 4: Проверьте единицы измерения на соответствие и при необходимости переведите (масса в граммах, объем в миллилитрах) (2)
масса растворенного вещества (NaOH) = 1,15 кг (перевести единицы в г)
масса растворенного вещества (NaOH) = 1,15 кг = 1,15 кг × 1000 г/ кг = 1 150 г
объем раствора = 186,4 л (перевести единицы в мл)
объем раствора = 186,4 л = 186,4 л × 1000 мл/ л = 186 400 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
мас./об. (%) = (1 150 г ÷ 186 400 мл) × 100
мас./об. (%) = 0,617 г/100 мл
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 0,617 г/100 мл = 0,617 % (масс./об.) = 0,617 % (масс./об.)
↪ Наверх
Расчет объема и массы реагента
В предыдущих разделах мы рассчитали концентрацию растворов в процентах по весу и объему, используя известные массу растворенного вещества и объем раствора.
Когда мы начинаем использовать этот раствор в лаборатории, мы, скорее всего, будем использовать пипетку или бюретку для подачи объема раствора.
Если мы знаем объем используемого раствора, мы можем рассчитать массу присутствующего растворенного вещества.
| масса растворенного вещества (г) = | объем раствора (мл) × масса/объем (%) 100 |
Если мы знаем массу растворенного вещества, которое хотим использовать, мы можем рассчитать объем раствора, который нам потребуется.
| объем раствора (мл) = 908:30 | масса растворенного вещества (г) масса/объем (%) |
× 100 |
Вопрос 1. Учащийся должен добавить в реакционный сосуд 1,22 г хлорида натрия.
Студенту предоставляется 11,78 г/100 мл водного раствора хлорида натрия (11,78 % масс./об.).
Какой объем этого раствора нужно добавить в реакционный сосуд?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Преобразуйте уравнение, чтобы найти объем раствора:
мас./об.% = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Умножить обе части уравнения на объем
мас./об.% × объем (мл) = (масса растворенного вещества (г) ÷ объем раствора (мл) ) × объем (мл) × 100
мас./об.% × объем (мл) = масса растворенного вещества (г) × 100
Разделите обе части уравнения на мас. /об.%
/об.%
[ мас./об.% × объем (мл)]/ мас./об.% = (масса растворенного вещества (г) × 100)/вес./об.%
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) |
× 100 |
Этап 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г
концентрация NaCl (водн.) при условии = масса/объем (%) = 11,78 г/100 мл
Требуется
объемов раствора = ? мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г (преобразование единиц не требуется)
концентрация NaCl (водн. ) при условии = масса/объем (%) = 11,78 г/100 мл (пересчет единиц не требуется)
) при условии = масса/объем (%) = 11,78 г/100 мл (пересчет единиц не требуется)
Требуется
объемов раствора = ? мл
Шаг 5: Подставьте эти значения в уравнение и решите.
| объем раствора (мл) | = | масса растворенного вещества (г) масса/объем (%) |
× 100 |
| = | 1,22 г 11,78 г/100 мл |
× 100 | |
| = | 10,36 мл | ||
| = | 10,4 мл |
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
объем раствора = 10,4 мл
Вопрос 2. Какова масса йодида калия в граммах в 14,86 мл 32,44 г/100 мл водного раствора йодида калия (32,44 % вес/объем)?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти массу растворенного вещества:
вес/объем (%) = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Разделите обе части уравнения на 100
вес/объем (%) ÷ 100 = масса растворенного вещества (г) ÷ объем раствора (мл)
Умножить обе части уравнения на объем раствора (мл)
масса растворенного вещества (г) = (вес/объем (%) ÷ 100) × объем раствора (мл)
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = йодид калия = KCl
Растворитель
– вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (KI) = ? г
объем (KI (водн.) ) = 14,86 мл
концентрация раствора = мас./об.% (KI (водн.) ) = 32,44 г/100 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
объем (KI (водн.) ) = 14,86 мл (преобразование единиц не требуется)
мас./об.% (KI (водн.) ) = 32,44 г/100 мл (преобразование единиц не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
масса растворенного вещества (г) = (масс./об.% ÷ 100) × объем раствора (мл)
масса (KI) = (32,44 ÷ 100) × 14,86 = 4,821 г
(Примечание: оправданы 4 значащие цифры)
Шаг 6: Напишите ответ
масса растворенного вещества (KI) = 4,821 г
↪ Наверх
Пример вопроса: расчеты масс.
 /об.% (масс./об.%)
/об.% (масс./об.%)
Определите массу в граммах нитрата калия (KNO 3 ) в 22,65 мл 2,15% (масс./об.) водного раствора нитрата калия.
м (КНО 3 (водн.) ) = г
↪ Наверх
Сноски:
(1) Общепринятыми единицами измерения % масс./об. (масс./об.%) являются г/100 мл, но возможны и другие единицы, например, кг/100 л, мг/100 мкл.
Мы ограничим последующее обсуждение г/100 мл, но вы можете применить ту же логику и уравнения, используя другие подходящие единицы измерения.
Обратите внимание, что растворимость чаще всего указывается в виде весового отношения процентной концентрации.
(2) Вам не нужно преобразовывать эти единицы, потому что и масса, и объем даны в единицах СИ, то есть
мас./об.% = (1,15 кг/186,4 л) × 100 = 0,617 кг/100 л = 617 г/100 000 мл = 0,617 г/100 мл
, но, вероятно, лучше попрактиковаться в преобразовании единиц измерения, по крайней мере, до тех пор, пока вы полностью не поймете, что означает концентрация w/v%.




