An alternate way to define salt is to describe it as a salt form of carbonic acid and an antacid with phosphate-binding action. Pure aluminium carbonate is extremely uncommon in nature; it is more commonly found as the sodium aluminium carbonate mineral dawsonite and the hydrated basic aluminium carbonate minerals scarbroite and hydroscarbroite.
What is Aluminium Carbonate?
Aluminium carbonate is a carbonate of an aluminium salt, which does not occur in nature. It is possible to produce it at high carbon dioxide pressure and at temperatures near to 0°C.
Aluminium carbonate storage would necessitate the development of a highly complicated mechanism that would safeguard the chemical from any external forces. Aluminium carbonate is a carbonate of aluminium. Furthermore, it is a water-insoluble Aluminium source that may readily be converted into other Aluminium compounds.
The chemical formula of Aluminium Carbonate is Al2(CO3)3.
Properties of Aluminium Carbonate
Physical Properties
The physical attributes of a chemical include its density, melting point, boiling temperature, and physical appearance. Some of the compound’s physical characteristics are also affected by the aluminium carbonate formula.
The following is a list of physical properties:
- Aluminium carbonate has a density of 1.5 g/cm3
- The compound’s molar mass is 96.09 g/mol.
- They are water-soluble.
- The melting point of aluminium carbonate is 58 °C.
- At the boiling point, it decomposes.
- The physical appearance of aluminium carbonate might be described as powdery and white. They seem like whitish powder.
Chemical Properties
The chemical properties of a compound provide information on the chemical formula of aluminium carbonate, molecular weight, reaction type, bond types involved, and other aspects of a compound.
The following are some of the compound’s chemical properties:
- Dialuminum Tricarbonate is the IUPAC term for aluminium carbonate.
- Aluminium carbonate has a molecular weight of 233.99.
- The compound’s hydrogen bond acceptor number is 9.
- The amount of hydrogen bond donors is zero. There are no bonds that can be rotated.
- The chemical compound has a complexity of 18.8.
- The characteristics of salt are basic in nature.
Structure of Aluminium Carbonate
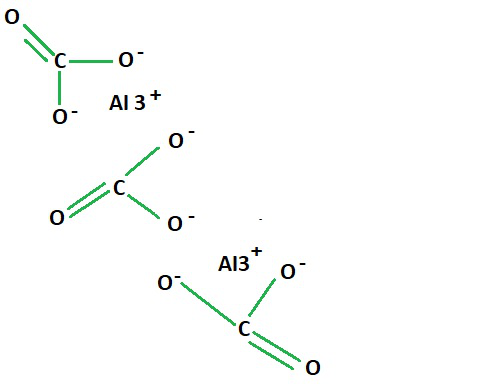
Aluminium Carbonate
Preparation of Aluminium Carbonate
There is no indication that the production of aluminium carbonate may occur in double displacement processes. Furthermore, soluble carbonates can precipitate aluminium hydroxide, resulting in the production of carbon dioxide. This is due to the fact that soluble carbonate is considered alkaline. Above all, the reaction of aluminium sulphate with sodium bicarbonate produces carbon dioxide and aluminium hydroxide. Furthermore, aluminium hydroxide inhibits foam production. This reaction was also the inspiration for the development of an early fire extinguisher.
Uses of Aluminium Carbonate
- Aluminium carbonate, like aluminium oxide and aluminium hydroxide, is a phosphate-binding medication. This medication is occasionally given to dogs and cats by veterinarians in order to bind intestinal phosphate.
- This medicine inhibits the absorption of dietary phosphate and reduces the absorption of pancreatic phosphorus. Furthermore, it is rarely used in humans. This is because of worries about its toxicity. Dogs and cats do not have a harmful reaction to their presence.
- Aluminium carbonate is useful to prevent the formation of urinary stones in humans. It is also useful as a medicinal treatment in situations of excess stomach acid. Inflammations and ulcerations may occur in some of these situations. Aluminium carbonate merely treats the symptoms of the disease; it has no impact on the disease itself.
- Furthermore, this medication can be taken as a tablet or as a liquid. Above all, caution should be exercised when taking aluminium carbonate, and it should be discussed with a medical professional before to use. Those suffering from renal problems should absolutely avoid it. Furthermore, aluminium carbonate allows for the regulation of phosphate levels in the body.
Sample Questions
Question 1: Is aluminium carbonate water soluble?
Answer:
Basic Aluminum Carbonate is a water-insoluble Aluminum source that can be easily transformed to other Aluminum compounds like the oxide by heating (calcination).
Question 2: What is the formula and valency of aluminium oxide?
Answer:
The valency of aluminum is +3 and that of oxide is -2. Therefore, the chemical formula of aluminum oxide is Al2O3.
Question 3: What is the ion content of aluminium carbonate?
Answer:
As seen in the structural formula for aluminium carbonate, two aluminium ions are present in the bonding between the three carboxylic groups that constitute the aluminium and carbonate formula.
Question 4: What is the purpose of using aluminium in water treatment?
Answer:
Aluminum is used in water treatment to eliminate disease-causing germs and other contaminants from drinking water that might harm your health. When treated appropriately, the quantity of residual aluminium remaining in the water should be comparable to or lower than that of untreated water.
Question 5: Is aluminium toxic in water?
Answer:
The EPA initially issued aluminium guidelines in 1988 in order to safeguard aquatic life from the adverse effects of aluminium toxicity in freshwaters.
Aluminum can impair an aquatic organism’s capacity to control salt concentrations and clog fish gills, potentially leading to death or impairing development and reproduction.
Last Updated :
31 Mar, 2022
Like Article
Save Article
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Что такое карбонат алюминия?
Анонимный вопрос
18 января 2019 · 6,2 K
Физические свойства – белая соль. При нормальных условиях вещество существовать не может. Данная соль образована слабым основанием гидроксидом алюминия и слабой кислотой. Карбонат алюминия распадается в присутствии воды или водяного пара с образованием гидроксида алюминия и двуокиси углерода. Эта закономерность была использована для продуцирования пены в огнетушителях (1904г.)
5,0 K
Комментировать ответ…Комментировать…
Карбонат алюминия – алюминиевая соль угольной кислоты Al2(CO3)3. При нормальных условиях карбонат алюминия не существует, для его синтеза требуется высокое давление углекислого газа. Практического значения не имеет.
2,7 K
Комментировать ответ…Комментировать…
Содержание
- Карбонат алюминия: строение, свойства, применение
- Содержание:
- Структура карбоната алюминия
- Карбонат гидроксида аммония алюминия
- Свойства
- Молярная масса
- Нестабильность
- Сухой
- Мокрый
- Физический
- Приложения
- Ссылки
- Acetyl
Карбонат алюминия: строение, свойства, применение
Содержание:
В карбонат алюминия представляет собой неорганическую соль, химическая формула которой Al2(CO3)3. Это карбонат металла практически не существует из-за его высокой нестабильности при нормальных условиях.
Среди причин его нестабильности можно назвать слабые электростатические взаимодействия между ионами Al. 3+ и CO3 2- , которые теоретически должны быть очень сильными из-за величины их зарядов.
Соль не испытывает никаких неудобств на бумаге, когда записываются химические уравнения ее реакций; но на практике это работает против него.
Несмотря на сказанное, карбонат алюминия может встречаться вместе с другими ионами, такими как минерал даусонит. Точно так же есть производное, в котором он взаимодействует с водным раствором аммиака. В остальном это считается смесью Al (OH)3 и H2CO3; который представляет собой шипучий раствор с белым осадком.
Эта смесь имеет лечебное применение. Однако чистая, выделяемая и поддающаяся обработке соль Al2(CO3)3, не известно возможных приложений; по крайней мере, не в условиях огромного давления или экстремальных условий.
Структура карбоната алюминия
Кристаллическая структура этой соли неизвестна, поскольку она настолько нестабильна, что не может быть охарактеризована. Из его формулы Al2(CO3)3Однако известно, что доля ионов Al 3+ и CO3 2- 2: 3; то есть для каждых двух катионов Al 2+ должно быть три аниона CO3 2- электростатически взаимодействуя с ними.
Проблема в том, что оба иона очень неравны по размеру; Аль 3+ очень мало, а CO3 2- это громоздко. Это различие само по себе уже влияет на стабильность кристаллической решетки, ионы которой «неудобно» взаимодействовали бы, если бы эту соль можно было изолировать в твердом состоянии.
В дополнение к этому аспекту Al 3+ представляет собой сильно поляризующий катион, свойство, которое деформирует электронное облако CO3 2- . Это как если бы вы хотели заставить его связываться ковалентно, хотя анион не может.
Следовательно, ионные взаимодействия между Al 3+ и CO3 2- они склонны к ковалентности; еще один фактор, усиливающий нестабильность Al2(CO3)3.
Карбонат гидроксида аммония алюминия
Хаотические отношения между Аль 3+ и CO3 2- смягчается на вид, когда в стекле присутствуют другие ионы; такие как NH4 + и ОН – , из раствора аммиака. Этот квартет ионов Al 3+ , CO3 2- , NH4 + и ОН – Им действительно удается определить стабильные кристаллы, даже способные принимать различные морфологии.
Другой подобный пример наблюдается в минерале даусоните и его ромбических кристаллах NaAlCO.3(ОЙ)2, где Na + заменяет NH4 + . В этих солях их ионные связи настолько сильны, что вода не способствует высвобождению CO.2; или, по крайней мере, не резко.
Хотя NH4Al (ОН)2CO3 (AACC, аббревиатура на английском языке), ни NaAlCO3(ОЙ)2 представляют собой карбонат алюминия, их можно рассматривать как его основные производные.
Свойства
Молярная масса
Нестабильность
В предыдущем разделе с молекулярной точки зрения было объяснено, почему Al2(CO3)3 это нестабильно. Но какую трансформацию он претерпевает? Следует учитывать две ситуации: сухую и «мокрую».
Сухой
В сухой ситуации анион CO3 2- возвращается в СО2 используя следующую декомпозицию:
Что имеет смысл, если он синтезируется под высоким давлением CO.2; то есть обратная реакция:
Следовательно, чтобы предотвратить Al2(CO3)3 соль следует подвергнуть воздействию высокого давления (используя N2, например). Таким образом, образование CO2 это не было бы термодинамически благоприятным.
Мокрый
В условиях повышенной влажности CO3 2- подвергается гидролизу, в результате чего образуется небольшое количество ОН – ; но достаточно, чтобы осадить гидроксид алюминия, Al (OH)3:
А с другой стороны, Аль 3+ также гидролизует:
Хотя Al на самом деле сначала гидратировал 3+ с образованием комплекса Al (H2ИЛИ)6 3+ , который гидролизуется с образованием [Al (H2ИЛИ)5ОЙ] 2+ и H3ИЛИ + . Тогда H3O (или H + ) протон к CO3 2- к H2CO3, который разлагается на CO2 и H2ИЛИ:
Обратите внимание, что в итоге Al 3+ ведет себя как кислота (выделяет H + ) и база (выпускает OH – с балансом растворимости Al (OH)3); то есть проявляет амфотеризм.
Физический
Если его можно выделить, эта соль, вероятно, будет белого цвета, как и многие другие соли алюминия. Также из-за разницы ионных радиусов Al 3+ и CO3 2- , он, несомненно, будет иметь очень низкие температуры плавления или кипения по сравнению с другими ионными соединениями.
Что касается его растворимости, он бесконечно растворим в воде. Кроме того, это будет гигроскопичное и расплывающееся твердое вещество. Однако это лишь догадки. Другие свойства должны быть оценены с помощью компьютерных моделей, подвергнутых воздействию высоких давлений.
Приложения
Известные применения карбоната алюминия — медицина. Его использовали как мягкое вяжущее средство и как лекарство для лечения язвы желудка и воспалений. Он также использовался для предотвращения образования мочевых камней у людей.
Он использовался для контроля увеличения содержания фосфатов в организме, а также для лечения симптомов изжоги, кислотного расстройства желудка и язвы желудка.
Ссылки
- XueHui L., Zhe T., YongMing C., RuiYu Z. и Chenguang L. (2012). Гидротермальный синтез гидроксида алюминия карбоната аммония (AACH), нанопластинки и морфологии нановолокон, контролируемые pH. Атлантис Пресс.
- Робин Лаффикер, Матье Динь, Фабьен Сальватори, Малика Буаллег, Дидье Колсон, Франсуа Пюэль (2017) Гидроксид карбоната алюминия аммония NH4Al (OH) 2CO3 в качестве альтернативного способа получения глинозема: сравнение с классическим предшественником бемита. Порошковая технология, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Национальный центр биотехнологической информации. (2019). Карбонат алюминия. База данных PubChem., CID = 10353966. Получено с: pubchem.ncbi.nlm.nih.gov
- Википедия. (2019). Карбонат алюминия. Получено с: en.wikipedia.org
- Сульфат алюминия. (2019). Карбонат алюминия. Получено с: aluminumsulfate.net
Антидепрессанты и алкоголь: эффекты и последствия их сочетания
Первоначальное вложение в компанию: структура и пример
Источник
Acetyl

Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2
Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник Adblock |
Составьте формулы веществ по их названию : карбонат алюминия, оксид марганца (VI), азотная кислота, оксид алюминия, гидроксид бария, сульфид лития.
Вы находитесь на странице вопроса Составьте формулы веществ по их названию : карбонат алюминия, оксид марганца (VI), азотная кислота, оксид алюминия, гидроксид бария, сульфид лития? из категории Химия.
Уровень сложности вопроса рассчитан на учащихся 5 – 9 классов. На странице
можно узнать правильный ответ, сверить его со своим вариантом и обсудить
возможные версии с другими пользователями сайта посредством обратной связи.
Если ответ вызывает сомнения или покажется вам неполным, для проверки
найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте
новый вопрос, используя ключевые слова: введите вопрос в поисковую строку,
нажав кнопку в верхней части страницы.

