Решение задач по хими на расчёт объем раствора щелочи, необходимиго для нейтрализации раствора кислоты
Задача 2
Сколько миллилитров раствора NH4OH с массовой долей w% = 10,4 (%) и плотностью p =0,956 (г/мл) потребуется для нейтрализации раствора H2SO4, содержащего массу m =1,47 г растворенного вещества?
Решение:
Уравнение реакции нейтрализации:
х г 1,47 г
2NH4OH + H2SO4 = (NH4)2SO4 + 2Н2О
34 г 98 г
Рассчитаем массу NH4OH, которая необходима для нейтрализации 1,47 г H2SO4 из пропорции:
х г 1,47 г
34 г 98 г; х = 34 * 1,47/98 = 0,51г.
Рассчитаем массу 1 л раствора NH4OH:
m(р-ра NH4OH) = 1000 мл • 0,956 г/мл = 956 г.
Тогда масса растворенного NH4OH в 1л раствора будет составлять:
m(р-ра NH4OH) • w%
m(NH4OH) = —————————— = 95,6г
100
Находим объем раствора NH4OH, взятого для нейтрализации раствора H2SO4:
96,5 г ————- 1000 мл
0,51 7 ———— х мл; х = 0,51 • 1000/96,5 = 5,28 мл или 5,3 мл.
Ответ: V = 5,3 мл.
Массовая доля кислоты (серная кислота)
Какой объем серной кислоты (H2SO4) с массовой долей кислоты 10% (плотность раствора равна 1,07 г/см3) потребуется для нейтрализации раствора, содержащего 16 грамм гидроксида натрия (NaOH).
Решение задачи
Запишем реакцию нейтрализации раствора гидроксида натрия (NaOH) с раствором серной кислоты (H2SO4) с массовой долей кислоты 10%:
![]()
Учитывая, что молярные массы гидроксида натрия (NaOH) и серной кислоты (H2SO4) соответственно равны 40 г/моль и 98 г/моль, по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 16 г гидроксида натрия (NaOH):
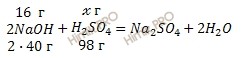
на нейтрализацию 80 г NaOH нужно 98 г H2SO4
на нейтрализацию 16 г NaOH нужно ![]() г H2SO4
г H2SO4
Откуда:
![]()
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора:
![]()
Получаем:
m (раствора H2SO4) = 19,6 / 0,1 = 196 (г).
Если раствор 10-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,1.
Рассчитаем объем раствора серной кислоты (H2SO4) с массовой долей кислоты 10% по формуле, устанавливающей связь между объемом и массой:
![]()
Получаем:
V (раствора H2SO4) = 196 / 1,07 = 183,18 (см3).
Ответ:
объем серной кислоты равен 183,18 см3.
Отношение количества
или массы вещества, содержащегося в
системе, к объему или массе этой системы
называется концентрацией.
Рассмотрим несколько
способов выражения концентрации.
Процентная
концентрация
(массовая доля растворенного вещества)
(ω) показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
![]() ,
,
где ω – массовая
доля (%) растворенного вещества; m1
– масса растворенного вещества, г; m
– масса раствора, г.
Масса раствора
равна произведению объема раствора V
(мл) на его плотность r
(г/см3):
![]() ,
,
тогда
![]() .
.
Молярная
концентрация (молярность)
раствора – показывает, сколько молей
растворенного вещества содержится в
1л раствора.
Молярную концентрацию
(моль на литр) выражают формулой
![]() ,
,
где m1
– масса растворенного вещества, г; М –
молярная масса растворенного вещества,
г/моль; V
– объем раствора, л.
Количество вещества
в молях определяется по формуле:
n
= m1
/М, тогда
![]()
Нормальная
концентрация (нормальность раствора)
показывает, сколько грамм-эквивалентов
растворенного вещества содержится в 1
л раствора (моль на литр):
![]() ,
,
где m1
– масса растворенного вещества, г; V
– объем раствора, л.
Э – эквивалентная
масса растворенного вещества (г/моль),
которую рассчитывают по формуле:
Э=![]() (г/моль),
(г/моль),
где М – мольная
масса вещества, n
– количество катионов (анионов), В
– валентность. Валентность – это
способность атомов элемента присоединять
определенное число атомов другого
элемента. Эквивалент кислоты можно
определить по формуле: Э = М (кислоты)
/ основность (число атомов водорода).
Например: Э
Н2SO4=![]() =49г/моль;
=49г/моль;
эквивалент основания по формуле: Э = М
(основания) / кислотность (число ОН–
групп), так Э
Fe(OH)3=![]() =35,6г/моль;
=35,6г/моль;
эквивалент соли по формуле: Э = М(соли)
/ число атомов металла * валентность
металла,
Э Al2(SO4)3=![]() =114г/моль.
=114г/моль.
Моляльность
раствора Сm
показывает
количество растворенного вещества,
находящееся в 1 кг растворителя:
![]() ,
,
где m2
– масса растворителя, кг; n
– количество растворенного вещества,
моль.
Пример
1.
Вычислить молярность и нормальность
40 %-го раствора фосфорной кислоты,
плотность которого 1,25 г/см3.
Объем раствора 1л.
Решение.
Для расчета молярности и нормальности
раствора найдем массу фосфорной кислоты
в 1 л (1000 мл) 40 %-го раствора:
w
= m1
· 100/V
∙ r;
![]() .Молярная
.Молярная
масса Н3РO4
равна 98 г/моль, следовательно,
![]() =
=
500/98 = 5,1 моль/л.
Молярная
масса эквивалента Н3РO4
равна 98/3 = 32,7 г/моль.
Тогда
СН
= 500/32,7 =
1,53 моль/л.
Пример
2.
Вычислить
массовую долю КОН в 2н. растворе, плотность
которого 1,08 г/см3.
Решение.
Поскольку
нормальность рассчитывается на 1 л
раствора, найдем массу растворенного
вещества в 1 л:
СН=
m1/Э∙V;
ЭKOH
= 56 г/моль;
mКОН=2∙56∙1=112
г.
Теперь
вычислим массовую доли КОН в растворе,
содержащем 112
г
гидроксида калия:
w=
m1∙100/V∙r=112∙100/1000∙1,08=10,4
%.
Пример 3.
На нейтрализацию 50 см3
раствора кислоты израсходовано 25 см3
0,5 н. раствора щелочи. Чему равна молярная
концентрация эквивалентов кислоты?
Решение.
Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной молярной концентрации
эквивалентов реагируют в равных объемах.
При разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям, т.е.
V1:
V2
= С2
: С1
или V1∙
С1
= V2
∙
С2
50С1
= 25 • 0,5; откуда С1
= 25 • 0,5 / 50 = 0,25н.
Задание:
решить следующие задачи, принимая объем
раствора равным
1 л:
|
Вариант |
Вещество |
Концентрация |
Плотность |
Вычислить |
|
121 |
Na2CO3 |
0,30 |
1,030 |
Процентную |
|
122 |
HNO3 |
9,0 |
1,275 |
Процентную |
|
123 |
NH4Cl |
10 |
1,028 |
Молярную |
|
124 |
Al2(SO4)3 |
0,55 |
1,176 |
Процентную |
|
125 |
HNO3 |
2 |
– |
Нормальную |
|
126 |
HCl |
15,0 |
1,073 |
Нормальную |
|
127 |
H2SO4 |
13,0 |
1,680 |
Процентную |
|
128 |
H3PO4 |
44,0 |
1,285 |
Нормальную |
|
129 |
HClO4 |
9,0 |
1,150 |
Процентную |
|
130 |
H2SO4 |
2 |
– |
Нормальную |
|
131 |
CH3COOH |
34,0 |
1,043 |
Молярную |
|
132 |
BaCl2 |
2,30 |
1,203 |
Процентную |
|
133 |
K2CO3 |
4 |
– |
Нормальную |
|
134 |
CuSO4 |
14,0 |
1,155 |
Нормальную |
|
135 |
FeCl3 |
1,90 |
– |
Нормальную |
|
136 |
K2CO3 |
6,0 |
1,567 |
Процентную |
|
137 |
NaCl |
3 |
– |
Молярную |
|
138 |
NaCl |
20 |
1,148 |
Молярную |
|
139 |
HClO4 |
4,0 |
1,230 |
Процентную |
|
140 |
K2CO3 |
3 |
– |
Нормальную |
Задание: решить
следующие задачи
|
№ задачи |
|
|
141 |
На |
|
142 |
Смешали |
|
143 |
Определить |
|
144 |
Смешали |
|
145 |
Для |
|
146 |
Смешали |
|
147 |
На |
|
148 |
Смешали |
|
149 |
На |
|
150 |
Вычислить |
|
151 |
Определить |
|
152 |
Вычислить |
|
153 |
Определить |
|
154 |
Определить |
|
155 |
Вычислить |
|
156 |
Вычислить |
|
157 |
Определить |
|
158 |
Смешали |
|
159 |
Определить |
|
160 |
Вычислить |
Соседние файлы в папке му по химии
- #
- #
- #
- #
- #
- #
- #
В уроке 17 «Реакция нейтрализации» из курса «Химия для чайников» рассмотрим процесс нейтрализации, а также понятия химический эквивалент вещества и грамм-эквивалент; кроме того научимся вычислять нормальную концентрацию раствора. С реакцией нейтрализации тесно связаны понятия «кислота» и «основание», поэтому настоятельно рекомендую подробно изучить урок 16 «Кислоты и основания»

Нейтрализация
Важным свойством кислот и оснований является их способность образовывать в растворе ионы H+ и OH-, которые могут атаковать другие имеющиеся там молекулы и вызывать химические превращения, с трудом или медленно протекающие в их отсутствии. Когда кислоты и основания реагируют друг с другом, ионы H+ и OH— соединяются, образуя молекулы воды. Этот процесс называется нейтрализацией:
- H+ + OH— → H2O
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Химический эквивалент кислоты — количество кислоты, которое при нейтрализации основания высвобождает 1 моль ионов H+.
Химический эквивалент основания — количество основания, которое при нейтрализации основания высвобождает 1 моль ионов OH—.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H+ (или OH—)
Для кислот, способных высвобождать 1 ион H+ на молекулу, как, например, HCl или HNO3, химический эквивалент представляет собой то же самое количество вещества, что и моль, а 1 грамм-эквивалент — то же самое, что и молекулярная масса. Однако поскольку H2SO4 способна высвобождать два иона H+ на молекулу, 1 молю H2SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты H3PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и NH3, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:

Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Решение:
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO3 и Ba(OH)2:
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
- 100,0 г / 85,67 г/экв = 1,167 экв Ba(OH)2
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
- 1,167 экв × 63,01 г/экв = 73,53 г HNO3
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции:
- 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
Число моль Ba(OH)2, вступающего в реакцию, равно:
- 100,0 г / 171,3 г/моль = 0,5838 моля Ba(OH)2
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
- 0,5838 моля × 2 = 1,167 моля HNO3
А в граммах это составит:
- 1,167 моля × 63,01 г/моль = 73,53 г HNO3
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.

Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
Решение:
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
- 4,00 г / 40,0 г/моль = 0,100 моля NaOH
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
- 0,100 моля NaOH / 0,500 л раствора = 0,200 моль/л, или 0,2 М NaOH
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH— ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Решение:
- 10,0 г / 98,1 г/моль = 0,102 моля серной кислоты
- 0,102 моля / 0,750 л = 0,136 М раствор серной кислоты
Поскольку каждый моль серной кислоты высвобождает 2 эквивалента ионов H+, полученный раствор серной кислоты имеет нормальность, равную 2·0,136=0,272 н., т.е. представляет собой 0,272 н. раствора H2SO4.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Chemiday.com74
Дипломированный специалист в прикладной математике и физике. Профессиональный химик -… · 6 окт 2020 · chemiday.com
Уравнение реакции:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
0.05*0.01 = 0.005 (моль) – количество Ba(OH)2.
Понадобится в 2 раза больше, т.е. 0,01 моль HCl. Это количество содержится в 0,01/0,5 = 0,02 л = 20 мл 0,5 М раствора.
2,9 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
