Таблица и формулы оснований.
Таблица и формулы оснований (1 часть):
| Формула основания | Название основания |
| Al(OH)3 | Гидроксид алюминия |
| NH3·H2O | Гидроксид аммония (Гидрат аммиака) |
| Ba(OH)2 | Гидроксид бария |
| Be(OH)2 | Гидроксид бериллия |
| Bi(NO3)3 | Гидроксид висмута (III) |
| Ga(OH)3 | Гидроксид галлия (III) |
| Ge(OH)4 | Гидроксид германия (IV) |
| Fe(OH)2 | Гидроксид железа (II) |
| Fe(OH)3 | Гидроксид железа (III) |
| In(OH)3 | Гидроксид индия (III) |
| KOH | Гидроксид калия |
| Ca(OH)2 | Гидроксид кальция |
| LiOH | Гидроксид лития |
| Mg(OH)2 | Гидроксид магния |
| Mn(OH)2 | Гидроксид марганца (II) |
| Mn(OH)4 | Гидроксид марганца (IV) |
| Mo(OH)3 | Гидроксид молибдена (III) |
| MoO(OH)3 | Гидроксид молибдена (V) |
| NaOH | Гидроксид натрия |
| Ni(OH)2 | Гидроксид никеля |
Таблица и формулы оснований (2 часть):
| Sn(OH)2 | Гидроксид олова (II) |
| RbOH | Гидроксид рубидия |
| Pb(OH)2 | Гидроксид свинца |
| Sc(OH)3 | Гидроксид скандия (III) |
| Sr(OH)2 | Гидроксид стронция |
| TlOH | Гидроксид таллия (I) |
| Ti(OH)2 | Гидроксид титана (II) |
| Ti(OH)3 | Гидроксид титана с |
| CsOH | Гидроксид цезия |
| Ce(OH)3 | Гидроксид церия (III) |
| Ce(OH)4 | Гидроксид церия (IV) |
| Zn(OH)2 | Гидроксид цинка |
| Сr(OH)2 | Гидроксид хрома (II) |
| Сr(OH)3 | Гидроксид хрома (III) |
| TiO(OH)2 | Дигидроксид-оксид титана |
| AlO(OH) | Метагидроксид алюминия |
| GaO(OH) | Метагидроксид галлия |
| FeO(OH) | Метагидроксид железа |
| ScO(OH) | Метагидроксид скандия |
| CrO(OH) | Метагидроксид хрома |
| MoO(OH)3 | Тригидроксид-оксид молибдена |
Коэффициент востребованности
11 592
Основания


4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.

Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
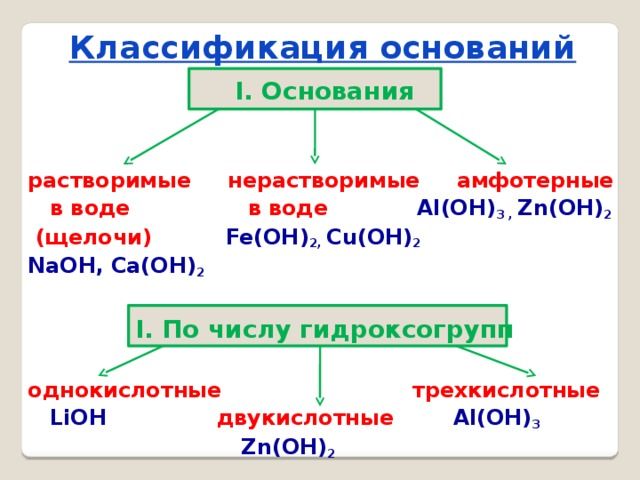
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
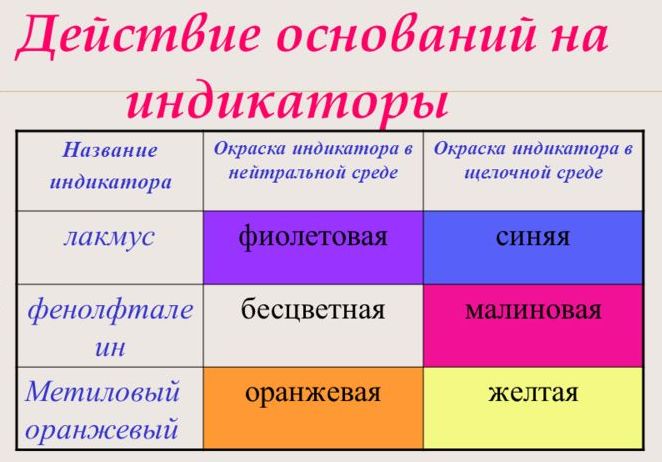
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.

Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Никита Ковалёв
9/10
-

Еркежан Рысова
10/10
-

Александр Котков
10/10
-

Мишлен Громов
10/10
-

Вика Мартынова
10/10
-

Ольга Хромцова
10/10
-

Лилия Швец
10/10
-

Наталья Чернова
10/10
-

Максим Макеев
10/10
-

Сергей Ефремов
8/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 2537.
А какая ваша оценка?
У этого термина существуют и другие значения, см. Основание.
Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда![]() ) либо с вакантной орбиталью другого химического соединения (основание Льюиса
) либо с вакантной орбиталью другого химического соединения (основание Льюиса![]() )[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
Частным случаем оснований являются щёлочи — гидроксиды щелочных, щелочноземельных металлов, а также некоторых других элементов, например, таллия. Реакции оснований с кислотами называют реакциями нейтрализации.
История[править | править код]
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме[3].
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−[4]. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам[5].
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя[4].
Современное определение[править | править код]
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури[править | править код]
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты[6]. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием[4]:
Основание в теории Льюиса[править | править код]
![]()
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса[7]. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями[8]. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях[4].
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания[8][4].
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью[9][10]. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью[10]. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами[11].
| Жёсткие основания | Промежуточные основания | Мягкие основания |
|---|---|---|
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. Например, мягкость оснований убывает в следующих рядах[8]:
Основание в общей теории Усановича[править | править код]
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители[5]. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции[13].
Сила оснований[править | править код]
Количественное описание силы оснований[править | править код]
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон[8]. Часто константу основности выражают в виде показателя константы основности pKb. Например, для аммиака как основания Брёнстеда можно записать[4][14]:
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов[14] и константе автопротолиза растворителя в общем случае[8].
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−[8].
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах[4]
| Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) | Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) |
|---|---|---|---|---|---|---|---|
| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Влияние растворителя[править | править код]
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH−, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14[15][16].
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных оснований для них разный[17].
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большинство известных оснований по силе со своим сопряжённым основанием — ацетат-ионом CH3COO−. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований[18].
Влияние строения основания[править | править код]
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак[19]. Напротив, введение акцепторных заместителей в молекулу понижает силу основания[8].
| Аммиак NH3 |
Метиламин CH3NH2 |
Этиламин C2H5NH2 |
Диметиламин (CH3)2NH |
Диэтиламин (C2H5)2NH |
Триметиламин (CH3)3N |
Триэтиламин (C2H5)3N |
|---|---|---|---|---|---|---|
| 4,75 | 3,36 | 3,33 | 3,23 | 3,07 | 4,20[К 1] | 3,12[К 1] |
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания соответственно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Данный эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы[20].
- Эффект сопряжения проявляется также в том случае, если электронная пара основания находится в системе сопряжения, например, с ароматической системой или двойной связью. В таком случае основания имеют более низкую силу. Например, амиды и анилины являются гораздо более слабыми основаниями, чем амины[19].
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона[20].
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2– и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной[19].
Супероснования[править | править код]
Основания в органической химии[править | править код]
См. также[править | править код]
- Кислота
Комментарии[править | править код]
- ↑ 1 2 С одной стороны, наличие третьей алкильной группы в триметиламине и триэтиламине должно увеличивать их основность. С другой стороны, с добавлением третьего заместителя резко уменьшается способность сопряжённых кислот (CH3)3NH+ и (C2H5)3NH+ к гидратации, что уменьшает их устойчивость и суммарно понижает основность аминов.
Примечания[править | править код]
- ↑ IUPAC Gold Book — base (недоступная ссылка — история). Дата обращения: 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. Органическая химия. 9 класс. — 13-е изд. — М.: Просвещение, 2009. — С. 10. — ISBN 978-5-09-021-625-8.
- ↑ William B. Jensen, The Origin of the Term Base, Journal of Chemical Éducation • 1130 Vol. 83 No. 8 août 2006
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М.: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395. — ISBN 5-85270-039-8.
- ↑ 1 2 Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1999. — С. 118. — ISBN 5-06-003558-1.
- ↑ IUPAC Gold Book — Brønsted base. Дата обращения: 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ IUPAC Gold Book — Lewis base. Дата обращения: 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 3 4 5 6 7 8 Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- ↑ IUPAC Gold Book — hard base. Дата обращения: 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 Химическая энциклопедия, 1992, т. 2, с. 145.
- ↑ IUPAC Gold Book — hard acid. Дата обращения: 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Золотов и др., 1999, с. 152.
- ↑ Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 40—44.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978. — С. 232—236.
- ↑ Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд. — М.: Бином. Лаборатория знаний, 2010. — Т. 1. — С. 40. — ISBN 978-5-94774-614-9.
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М.: Академия, 2004. — Т. 1. — С. 89—94. — ISBN 5-7695-1446-9.
- ↑ Золотов и др., 1999, с. 123—125.
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ: Издательство ВСГТУ, 2005. — С. 8—14. — ISBN 5-89230-037-4.
- ↑ 1 2 3 4 Сайкс П. Механизмы реакций в органической химии = A Guidebook to Mechanism in Organic Chemistry / Под ред. Я. М. Варшавского. — 3-е изд.. — М.: Химия, 1977. — С. 82—91.
- ↑ 1 2 Марч Дж. Органическая химия. Реакции, механизмы и структура. Т. 1 / Пер. с англ. З. Е. Самойловой, под ред. И. П. Белецкой. — М.: Мир, 1987. — С. 340—346.
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH– – гидроксид-ион является сложным ионом.
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При
составлении формулы конкретного основания, необходимо в таблице
растворимости найти ион металла, для которого составляем формулу, и в
соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла “+”, то с ионом металла связанна только одна гидроксогруппа OH–, например гидроксид натрия Na+OH;
-
Если “2+”, то две Ca2+(OH)2.
![]() Вопрос:
Вопрос:
Заряд иона алюминия “3+” (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
![]() Запомни:
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО – основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH– |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
|
|
|
|
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
Оксиды из оснований: CuOH , Cu(OH)2
* * *
.
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.

Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.

Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.

Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.

Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.

Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.

Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции – соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.

Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.


Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.

Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.

В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.

Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.

Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.

Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы – ОН.

Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.

Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.

Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.

Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.

Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.

Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.

Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.

Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.

Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.

Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.

Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.

Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.

Источник
Теперь необходимо справиться с задачей дать название этому типу солей.

Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.

Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.

В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.

Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.







![K_{b}={frac {[{mathsf {NH_{4}^{+}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {NH_{3}}}]}}=1{,}79cdot 10^{{-5}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a84df26045c54cf2f49c317887b42b68713f776)

![{mathsf {PO_{4}^{{3-}}+H_{2}O}}rightleftharpoons {mathsf {HPO_{4}^{{2-}}+OH^{-}}};K_{{mathrm {b1}}}={frac {[{mathsf {HPO_{4}^{{2-}}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {PO_{4}^{{3-}}}}]}}=2{,}10cdot 10^{{-2}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/07098ccbbeb4b3ec557cd12b11ecc95247ac46fa)
![{mathsf {HPO_{4}^{{2-}}+H_{2}O}}rightleftharpoons {mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{{mathrm {b2}}}={frac {[{mathsf {H_{2}PO_{4}^{-}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {HPO_{4}^{{2-}}}}]}}=1{,}58cdot 10^{{-7}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/98f41277386fdfb0493fa73864e09fc0d5efa8e7)
![{mathsf {H_{2}PO_{4}^{-}+H_{2}O}}rightleftharpoons {mathsf {H_{3}PO_{4}+OH^{-}}};K_{{mathrm {b3}}}={frac {[{mathsf {H_{3}PO_{4}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32cdot 10^{{-12}}.](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8edd80220578041bf77ca61fac3b8d75cd680c5)
![K_{a}{mathrm {(NH_{4}^{+})}}={frac {[{mathsf {NH_{3}}}]cdot [{mathsf {H^{+}}}]}{[{mathsf {NH_{4}^{+}}}]}}=5{,}62cdot 10^{{-10}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/73e68780390be761544486c2075e5adb99a96674)








