Изучая строение молекул органических веществ, вы узнали, что все молекулы имеют определённое пространственное строение. Это является следствием направленности ковалентных связей. Ковалентные связи располагаются в пространстве в направлении максимального перекрывания электронных облаков. Угол между связями — валентный угол — зависит от числа атомных орбиталей данного атома, принимающих участие в образовании σ-связей.
Для объяснения и предсказания пространственного строения молекул как органических, так и неорганических веществ, а также сложных ионов (например, ,
) используют представление о гибридизации атомных орбиталей.
Термин гибрид вам известен из биологии и означает организм, полученный вследствие скрещивания. По аналогии с этим в теории химической связи вводят понятие гибридная орбиталь. Она рассматривается как результат своеобразного «скрещивания» разных по форме, но близких по энергии атомных орбиталей.
Теоретические представления о гибридизации атомных орбиталей построены на следующих положениях.
1. При образовании ковалентных σ-связей исходные валентные s– и p-орбитали приобретают одинаковую форму и энергию, превращаясь в гибридные орбитали.
Гибридизацией называют перераспределение электронной плотности орбиталей свободного атома при образовании молекулы с формированием гибридных орбиталей.
2. Гибридные орбитали похожи друг на друга и отличаются от исходных s– и p-орбиталей своей энергией и формой электронного облака. В результате гибридизации энергия гибридных атомных орбиталей выравнивается. Гибридные орбитали более вытянуты в пространстве в сторону соседних атомов. Это обеспечивает их более полное перекрывание с атомными орбиталями соседних атомов и, соответственно, более прочные связи с ними.
3. В гибридизации участвуют разные по форме, но близкие по энергии атомные орбитали. Это означает, что в гибридизации могут принимать участие, например, 2s-орбиталь с 2p-орбиталью, но не 1s-орбиталь с 2p-орбиталью.
4. Число образующихся гибридных орбиталей равно суммарному числу исходных орбиталей, принимающих участие в гибридизации.
5. Гибридные орбитали участвуют в образовании только σ-связей.
6. π-Связи образуются за счёт бокового перекрывания негибридных орбиталей.
7. Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга.
8. В гибридизации принимают участие не только орбитали, которые образуют σ-связи, но и s– и р-орбитали с неподелённой парой электронов того же энергетического уровня. Гибридные орбитали с неподелённой парой электронов занимают больший объём, чем связывающая пара электронов между двумя атомами. По этой причине неподелённые пары обладают максимальной отталкивающей силой, что приводит к уменьшению валентного угла между орбиталями со связывающими электронами.
Различают несколько типов гибридизации. Каждому из них соответствует определённая ориентация гибридных орбиталей в пространстве (табл. 12.1).
Так, если атом образует две σ-связи за счёт его одной s– и одной p-орбиталей, то образуется две sp-гибридные орбитали, которые ориентированы друг к другу под углом 180°. Такой тип гибридизации называют sp-гибридизацией.
Если атом образует три σ-связи за счёт его одной s– и двух p-орбиталей, то угол между образующимися тремя sp2-гибридными орбиталями составляет 120°. Такой тип гибридизации называют sp2-гибридизацией.
Если атом образует четыре σ-связи за счёт его одной s– и трёх p-орбиталей, то угол между образующимися четырьмя sp3-гибридными орбиталями составляет 109,5°. Такой тип гибридизации называют sp3-гибридизацией.
У элементов 3-го и последующих периодов в образовании гибридных атомных орбиталей могут принимать участие и d-орбитали.
Таким образом, расположение в пространстве гибридных орбиталей определяет углы между σ-связями, то есть пространственное строение молекул и сложных ионов.
Характеристики различных типов гибридизации и примеры молекул и сложных ионов, пространственное строение которых отвечает этим типам гибридизации, приведены в таблице 12.1.
Таблица 12.1. Характеристики sp–, sp2– и sp3-гибридизации валентных орбиталей центрального атома
| Исходные атомные орбитали | Число гибридных орбиталей | Тип гибридизации | Валентный угол* | Геометрическая фигура, отвечающая типу гибридизации центрального атома, и форма структурных единиц | Примеры |
|---|---|---|---|---|---|
| s + p | Две | sp | 180° | ||
| s + p + p | Три | sp2 | 120° |  |
|
| s + p + p + p | Четыре | sp3 | 109,5° |
* Указан идеальный валентный угол. В реальных структурах вследствие отталкивания неподелённых электронных пар валентный угол может отклоняться от идеального.
Рассмотрим, как можно использовать представление о гибридизации атомных орбиталей для предсказания и объяснения формы молекул неорганических веществ.
Пример 1. Валентный угол в молекуле аммиака составляет 107, а ионе аммония — 109,5°. Используя представление о гибридизации атомных орбиталей атома азота, объясните наблюдаемые различия в значениях валентных углов в NH3 и .
Решение
В молекуле аммиака азот является центральным атомом и образует три ковалентные связи с атомами водорода по обменному механизму. Если бы в образовании ковалентных связей участвовали исходные гантелеобразные р-орбитали азота, то угол между связями должен был составлять 90°. Объяснить действительный валентный угол в аммиаке можно, если использовать представление о гибридизации атомных орбиталей.
У атома азота на валентном слое имеется три неспаренных электрона на р-орбиталях и пара электронов на s-орбитали. При образовании химических связей все эти орбитали (s + 3p) подвергаются гибридизации с образованием четырёх sp3-гибридных орбиталей, которые в идеальном случае должны были бы располагаться по вершинам тетраэдра под углом друг к другу в 109,5°.
Однако, из-за того что на одной из гибридных орбиталей имеется неподелённая пара электронов, которая отталкивает орбитали со связывающими электронами, валентный угол уменьшается до 107.
В связи с тем что орбиталь с неподелённой парой электронов не входит в описание взаимного расположения атомов, принято говорить, что молекула аммиака имеет форму треугольной пирамиды с основанием в виде правильного треугольника из атомов Н—Н—Н и вершиной — атомом N.
При присоединении к молекуле аммиака катиона водорода искажение валентных углов устраняется.
Пример 2. В соответствии с экспериментальными данными валентный угол Н—O—Н в молекуле воды составляет 104,5°, то есть молекула воды имеет угловое строение. Используя представление о гибридных орбиталях, объясните пространственное строение молекулы воды.
Решение
В молекуле воды центральный атом кислорода образует две σ-связи с атомами водорода. Остальные электроны кислорода, расположенные на валентном электронном слое, образуют две неподелённые пары. В этом случае можно говорить об образовании четырёх гибридных орбиталей (s + 3p) и, соответственно, о sp3-гибридизации орбиталей атома кислорода.
Как и в случае молекулы аммиака, гибридные орбитали ориентированы по углам тетраэдра, однако орбитали с двумя неподелёнными парами электронов отталкивают пары электронов, образующих химические связи О—Н. Это уменьшает валентный угол Н—O—Н. Он становится равным 104,5°, то есть меньше тетраэдрического (109,5°):
Неподелённые пары электронов не во всех соединениях обладают сильным отталкивающим действием на электроны химической связи. Например, в спиртах валентный угол Н—O—C составляет 107–109° и мало отличается от тетраэдрического. В молекуле серной кислоты угол Н—O—S тоже составляет 108,5° и также мало отличается от тетраэдрического. В простых эфирах, например H3C—O—CH3, угол C—O—C составляет 109–112° и также близок к тетраэдрическому.
При определении пространственного строения молекул всегда надо помнить, что, как всякое модельное представление, понятие о гибридизации имеет ограниченную область применения. Если при определении формы молекул, образуемых элементами 2-го периода, гибридизация даёт хороший прогноз, то для элементов периодов с большими номерами её предсказательные возможности не всегда совпадают с экспериментальными данными. Например, в молекулах воды и сероводорода атомы кислорода и серы, с точки зрения возможного типа гибридизации, должны находиться в состоянии sp3-гибридизации. Однако в молекуле воды валентный угол близок к тетраэдрическому, а в молекуле сероводорода он составляет 92°. Тем не менее валентный угол в молекуле H3C—S—H составляет уже 99,5°, в молекуле Cl—S—Cl — 103°, а у циклической молекулы S8 угол S—S—S равен 108°, что весьма близко к 109,5°.
Валентный угол — угол, образованный направлениями химических (ковалентных) связей, исходящими из одного атома.
Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путём анализа их вращательных спектров (см. Инфракрасная спектроскопия, Молекулярные спектры, Микроволновая спектроскопия). Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
|
|
Это статья-заготовка по физической химии. Помогите Википедии, дополнив эту статью, как и любую другую. |
|
|
В статье не хватает ссылок на источники (см. рекомендации по поиску). Информация должна быть проверяема, иначе она может быть удалена. Вы можете отредактировать статью, добавив ссылки на авторитетные источники в виде сносок. (8 июня 2019) |
Параметры ковалентной связи
Совокупность
атомов, образующих химическую частицу,
существенно отличается от совокупности
свободных атомов. Образование химической
связи приводит, в частности, к изменению
радиусов атомов и их энергии. Происходит
также перераспределение электронной
плотности: повышается вероятность
нахождения электронов в пространстве
между связываемыми атомами.
Длина химической связи
При
образовании химической связи всегда
происходит сближение атомов – расстояние
между ними меньше, чем сумма радиусов
изолированных атомов:
r(A−B)
< r(A)
+ r(B)
Радиус
атома водорода составляет 53 пм, атома
фтора − 71 пм, а расстояние между ядрами
атомов в молекуле HF равно 92 пм:

Межъядерное
расстояние между химически связанными
атомами называется длиной химической
связи.
Во
многих случаях длину связи между атомами
в молекуле вещества можно предсказать,
зная расстояния между этими атомами в
других химических веществах. Длина
связи между атомами углерода в алмазе
равна 154 пм, между атомами галогена в
молекуле хлора – 199 пм. Полусумма расстояний
между атомами углерода и хлора,
рассчитанная из этих данных, составляет
177 пм, что совпадает с экспериментально
измеренной длиной связи в молекуле
CCl4.
В то же время это выполняется не всегда.
Например, расстояние между атомами
водорода и брома в двухатомных молекулах
составляет 74 и 228 пм, соответственно.
Среднее арифметическое этих чисел
составляет 151 пм, однако реальное
расстояние между атомами в молекуле
бромоводорода равно 141 пм, то есть заметно
меньше.
Расстояние
между атомами существенно уменьшается
при образовании кратных связей. Чем
выше кратность связи, тем короче
межатомное расстояние.
Длины
некоторых простых и кратных связей
|
Связь |
Длина |
Связь |
Длина |
|
С−С |
154 |
С−О |
143 |
|
С=С |
133 |
С=О |
123 |
|
С≡С |
131 |
С≡O |
113 |
Валентные углы
Направление
ковалентных связей характеризуется
валентными углами – углами между линиями,
соединяющими связываемые атомы.
Графическая формула химической частицы
не несет информации о валентных углах.
Например, в сульфат-ионе SO42−
валентные углы между связями сера−кислород
равны 109,5o,
а в тетрахлоропалладат-ионе [PdCl4]2−
− 90o.
Совокупность длин связей и валентных
углов в химической частице определяет
ее пространственное строение. Для
определения валентных углов используют
экспериментальные методы изучения
структуры химических соединений. Оценить
значения валентных углов можно
теоретически, исходя из электронного
строения химической частицы.
Энергия ковалентной связи
Химическое
соединение образуется из отдельных
атомов только в том случае, если это
энергетически выгодно. Если силы
притяжения преобладают над силами
отталкивания, потенциальная энергия
взаимодействующих атомов понижается,
в противном случае − повышается. На
некотором расстоянии (равном длине
связи r0)
эта энергия минимальна.
Таким
образом, при образовании химической
связи энергия выделяется, при ее разрыве
− поглощается. Энергия E0,
необходимая для того, чтобы разъединить
атомы и удалить их друг от друга на
расстояние, на котором они не
взаимодействуют, называется энергией
связи. Для
двухатомных молекул энергия связи
определяется как энергия диссоциации
молекулы на атомы. Она может быть измерена
экспериментально.
В
молекуле водорода энергия связи численно
равна энергии, которая выделяется при
образовании молекулы Н2
из атомов Н:
Н
+ Н = Н2
+ 432 кДж
Эту
же энергию нужно затратить, чтобы
разорвать связь Н-Н:
H2
= H + H − 432 кДж
Типы
гибридизации атомных орбиталей
Пространственное
строение молекул. Представления о
природе ковалентных связей с учетом
типа орбиталей, участвующих в образовании
химической связи, позволяют делать
некоторые суждения о форме молекул.
Если
химическая связь образуется с помощью
электронов s-орбиталей, как, например,
в молекуле Н2, то в силу сферической
формы s-орбиталей не существует никакого
преимущественного направления в
пространстве для наиболее выгодного
образования связей. Электронная
плотность в случае р-орбиталей распределена
в пространстве неравномерно, поэтому
появляется некоторое выделенное
направление, вдоль которого наиболее
вероятно образование ковалентной связи.
Рассмотрим
примеры, которые позволяют понять общие
закономерности в направленности
химических связей. Обсудим образование
связей в молекуле воды H2O. Молекула
H2O образуется из атома кислорода
и двух атомов водорода. Атом кислорода
имеет два неспаренных электрона, которые
занимают две орбитали, расположенные
под углом 90° друг к другу. Атомы водорода
имеют неспаренные 1s-электроны. Ясно,
что углы между двумя связями О—Н,
образованными р-электронами атома
кислорода с s-электронами атомов водорода,
должны быть прямыми или близкими к нему
(см. рис.).
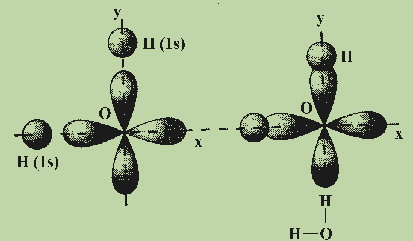
Аналогично,
прямыми должны быть углы между связями
в молекулах Н2О, H2S, F2О.
Cl2O, РН3, РСl3 и т. д.
Действительные значения углов между
связями заметно отличаются от
теоретических.
Увеличение
валентных углов (> 90°) вполне объяснимо
взаимным отталкиванием не связанных
друг с другом атомов, которое мы не
учитывали при предсказании углов между
связями. Так, взаимное отталкивание
атомов водорода в молекуле H2S
слабее, чем в молекуле Н2О (так как
радиус атома серы больше радиуса атома
кислорода), поэтому и валентные углы
Н—S—Н ближе к 90°, чем углы Н—О—Н.
Таким
образом, двухвалентный атом неметалла
с двумя валентными р-орбиталями образует
изогнутую (угловую, с углом, близким к
90°) молекулу, а трехвалентный атом с
тремя валентными р-орбиталями образует
молекулу, имеющую форму пирамиды.
Гибридизация
орбиталей. Рассмотрим образование
молекулы метана СН4. Атом углерода
в возбужденном состоянии обладает
четырьмя неспаренными электронами:
одним s-электроном и тремя р-электронами
— ls22sl2p3.
Рассуждая
как в случае H2O, можно было бы
предполагать, что атом углерода будет
образовывать три связи С—Н, направленные
под прямым углом друг к другу (р-электроны),
и одну связь, образованную s-электроном,
направление которой было бы произвольным,
поскольку s-орбиталь имеет сферическую
симметрию.
Следовательно,
можно было ожидать, что три связи С—Н
в СН4 являются направленными
p-связями и совершенно одинаковы, а
четвертая связь есть ненаправленная
s—s-связь и отличается от первых трех.
Однако
экспериментальные данные показали, что
все четыре связи С—Н в молекуле метана
СН4 одинаковы и направлены к
вершинам тетраэдра (угол между ними
составляет 109,5°).
Ввиду
относительной близости значений энергии
2s- и 2p-электронов эти электроны могут
взаимодействовать между собой в ходе
образования химической связи с электронами
другого атома, давая четыре новых
равноценных гибридных электронных
облака.
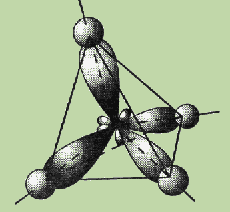
Четыре
sp3-гибридные орбитали атома
углерода расположены под углом 109,5°
друг к другу, они направлены к вершинам
тетраэдра, в центре которого находится
атом углерода. Гибридная орбиталь сильно
вытянута в одну сторону от ядра (см.
рис.).
Это
обусловливает более сильное
перекрывание таких орбиталей с
орбиталями электронов других атомов
по сравнению с перекрыванием s- и
р-орбиталей и приводит к образованию
более прочных связей.
Таким
образом, при образовании молекулы метана
различные орбитали валентных электронов
атома углерода — одна s-орбиталь и три
р-орбитали — превращаются в четыре
одинаковые “гибридные” sр3-орбитали
(sp3-гибридизация). Этим и объясняется
равноценность четырех связей атома
углерода в молекуле.
Гибридизация
оказывается характерной не только для
соединений атома углерода. Гибридизация
орбиталей может происходить в том
случае, когда в образовании связей
одновременно участвуют электроны,
которые принадлежат к различным типам
орбиталей.
Р ассмотрим
ассмотрим
примеры различных видов гибридизации
s– и р-орбиталей. Гибридизация одной
s- и одной р-орбиталей (sp-гибридизация)
происходит при образовании галогенидов
бериллия, например BeF2, цинка,
ртути, молекулы ацетилена и др. Атомы
этих элементов в основном состоянии
имеют на внешнем слое два спаренных
s-электрона. В результате возбуждения
один из электронов s-орбитали переходит
на близкую по энергии р-орбиталь, т. е.
появляются два неспаренных электрона,
один из которых s-электрон, а другой
р-электрон. При возникновении химической
связи эти две различные орбитали
превращаются в две одинаковые гибридные
орбитали (тип гибридизации — sp),
направленные под углом 180° друг к другу,
т. е. эти две связи имеют противоположное
направление (см. рис.).
Экспериментальное
определение структуры молекул BeX2,
ZnX2, HgX2, C2H2 и т.
д. (X — галоген) показало, что эти молекулы
действительно являются линейными.
Остановимся
подробнее на структуре молекулы ацетилена
С2Н2. В молекуле ацетилена
каждый атом углерода образует две
гибридизированные связи, направленные
под углом 180° друг к другу (см. рис.).
Как
при образовании связей С—С, так
и при образовании связей С—Н возникает
общее двухэлектронное облако, образуя
s -связи. В общем случае s -связью можно
назвать связь, возникающую при
обобществлении электронных облаков
двух атомов, если облака перекрываются
по линии, соединяющей атомы.

Но
в молекуле ацетилена атомы углерода
находятся в sp-гибридных состояниях, т.
е. в каждом из атомов углерода содержится
еще по два р-электрона, которые не
принимали участие в образовании s
-связей. Молекула ацетилена имеет плоский
линейный скелет, поэтому оба р-электронных
облака в каждом из атомов углерода
выступают из плоскости молекулы в
перпендикулярном к ней направлении. В
этом случае происходит также некоторое
взаимодействие электронных облаков,
но менее сильное, чем при образовании
s -связей. Таким образом, в молекуле
ацетилена образуются еще две ковалентные
углерод-углеродные связи, называемые
p -связями (см. рис.).
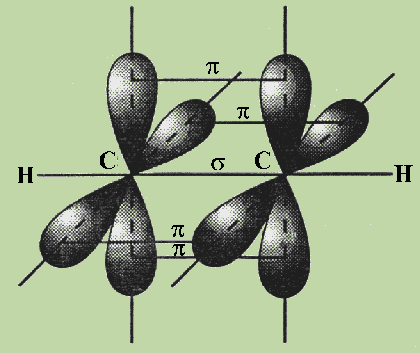
Случай
образования кратных связей
между атомами углерода для молекулы
ацетилена — случай образования тройной
связи, которая состоит из одной s – и двух
p -связей. s -Связи являются более
прочными, чем p -связи.
Еще
один вид гибридизации s- и p-орбиталей
осуществляется, например, в соединениях
бора, алюминия или углерода (этилен
бензол). Возбужденный атом бора имеет
один s- и два p-электрона. В этом случае
при образовании соединений бора
происходит гибридизация одной s- и двух
p-орбиталей (ps2-гибридизация), при
этом образуется три одинаковые
sp2–гибридные орбитали, расположенные
в одной плоскости под углом 120° друг к
другу (см. рис.).
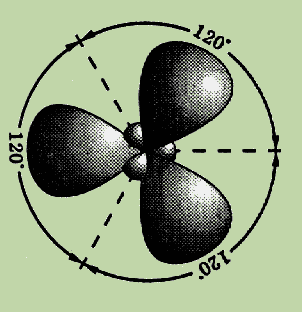
Эксперименты
показали, что такие соединения как BF3,
AlCl3, а также этилен и бензол имеют
плоское строение и все три связи Bѕ F(в
молекуле BF3) расположены под углом
120° друг к другу.
Посредством
образования sp2-гибридных орбиталей
объясняются и структуры непредельных
углеводородов.
Вопросы
13-17.
13. Дайте определение
параметров ковалентной связи: длина,
угол связи, энергия связи. Почему углы
между связями в молекулах CH4
и SiH4
одинаковы,
а у молекул H2O
и H2S
– различны (у молекул NH3
и AsH3
– различны)?
14. По методу
валентных связей покажите образование
молекул NH3
и H2Se
(угол 91 о)
[CH4
и BF3;
HCl
и COCl2;
C2H2
и H2Te].
Раскройте физический смысл свойств
ковалентной связи: насыщаемость и
направленность.
15. Определите тип
гибридизации атомных орбиталей
центрального атома в молекулах BeCl2,
BCl3,
CCl4.
Покажите форму перекрывающихся атомных
орбиталей и величину валентных углов.
16. Раскройте
физический смысл свойства ковалентной
связи «насыщаемость». Определите тип
гибридизации атомных орбиталей азота
в молекуле
NH3
(BF3)
и ионе NH4+
(BF4–
). Определите
величину валентных углов.
17. Покажите
образование молекулы О2
(NO,
В2,
N2,
CN,
F2)
по методу
валентных связей.
Ковалентная
связь. Механизм ее образования: обменные
и донорно-акцепторный. Метод валентных
связей. Гибридизация атомных орбиталей;
виды гибридизации. Геометрическая
конфигурация молекул. Свойства ковалентной
связи: направленность, насыщаемость,
полярность. Электрический (дипольный)
момент связи и молекулы.
Ковалентная
связь – это связь, возникающая между
атомами за счет образования общих
электронных пар. В основе ее
также лежит представление о приобретении
атомами энергетически выгодной и
устойчивой электронной конфигурации
из 8 электронов (для атома водорода из
2). Такую конфигурацию атомы получают
не путем отдачи или присоединения
электронов как в ионной связи, а
посредством образования общих электронных
пар. Механизм образования такой
связи может быть обменный или
донорно-акцепторный.
К обменному
механизму относят случаи, когда в
образовании электронной пары от каждого
атома участвует по одному электрону.
Например водород: Н2 Н. +Н. →Н:Н
или Н-Н. Связь возникает благодаря
образованию общей электронной пары за
счет объединения неспаренных электронов.
У каждого атома есть по одному s –электрону.
Атомы Н равноценны и пары одинаково
принадлежат обоим атомам. По этому же
принципу происходит образование общих
электронных пар (перекрывание р-электронных
облаков) при образовании молекулы Сl2.
При образовании молекулы N2 Образуются
3 общие электронные пары. Перекрываются
р-орбитали. Связь называется
неполярная.
При образовании
молекулы хлороводорода перекрывается
орбиталь s-электрона водорода и орбиталь
р-электрона хлора Н-Сl. Связывающая
электронная пара смещена к атому хлора,
в результате чего образуется диполь,
который измеряется дипольным моментом.
Связь называется полярная.
По донорно-акцепторному механизму
происходит образование иона аммония.
Донор (азот) имеет электронную пару,
акцептор – (Н+) свободную орбиталь,
которую пара электронная азота может
занять. В ионе аммония три связи
азота с водородом образованы по обменному
механизму, а одна по донорно-акцепторному.
Все 4 связи равноценны.
Ковалентные
связи классифицируют не только по
механизму образования общих электронных
пар, соединяющих атомы, но и по способу
перекрывания электронных орбиталей ,
по числу общих пар, а также по смещению
их. По способу перекрывания – σ
(сигма s- s, s-р, р-р) π (р-р гантели
перекрываются двумя местами). В молекуле
азота между атомами существуют одна
σ-связь и две π-связи, которые находятся
в двух взаимно перпендикулярных
плоскостях.
По числу общих
электронных пар различают: одинарные
Н2, НСl; двойные С2Н4, СО2; тройные N2.
По
степени смещенности: полярные и
неполярные. Связь между атомами с
одинаковой электроотрицательностью –
неполярная, с разной – полярная.
Исследования
ученых позволили сделать вывод, что
химическая связь в молекуле водорода
осуществляется путем образования пары
электронов с противоположно направленными
спинами. Каждый электрон занимает место
в квантовых ячейках обоих атомов, т.е.
движется в силовом поле, образованном
двумя силовыми центрами – ядрами атомов
водорода. Это представление о механизме
образования химической связи было
развито учеными Гейтлером и Лондоном
на примере водорода.это было распространено
и на более сложные молекулы. Разработанная
на этой основе теория образования
химической связи получила название
метода валентных связей. Метод
ВС дал теоретическое объяснение важнейших
свойств ковалентной связи, позволил
понять строение большого числа молекул.
Хотя этот метод не оказался универсальным
и в ряде случаев не в состоянии правильно
описать структуру и свойства молекул
– все же он сыграл большую роль в
разработке квантово-механической теории
химической связи и не потерял своего
значение до настоящего времени. В основе
метода ВС лежат следующие положения:
–
ковалентная связь образуется двумя
электронами с противоположно направленными
спинами, причем эта электронная пара
принадлежит двум атомам.
-ковалентная
связь тем прочнее, чем в большей степени
перекрываются взаимодействующие
электронные облака.
Геометрическая
форма s –орбитали сферическая, от центра
к краям размазанная (более плотная у
ядра, и менее- на краях). Орбитали
р-электронов представляют собой гантели,
направленные вдоль осей координат.
Облака d –электронов имеют более сложную
форму. Метод гибридизации орбиталей
исходит из предположения, что при
образовании молекул вместо исходных
s-, р-, d-,f- орбиталей (облаков) образуются
такие равноценные «смешанные» или
гибридные электронные облака, которые
вытянуты по направлению к соседним
атомам, благодаря чему достигается
более полное их перекрывание с электронными
облаками других атомов. На гибридизацию
затрачивается энергия, за то она окупается
более полным перекрыванием. Получается
более прочная молекула. Затраченная на
гибридизацию энергия окупается энергией,
выделяющейся при образовании связи.
Пример –молекула метана.В результате
перекрывания четырех гибридных sр3
орбиталей атома углерода и 4 s орбиталей
4-х атомов водорода, образуется
тетраэдрическая модель молекулы метана
с четырьмя σ связями, под углом 1090.
Если в молекуле гибридизуется 3-р
орбитали, то sр2 гибридизация – молекула
этилена, если 2 орбитали sр – гибридизция
(ацетилен). У элементов 3 и последующих
периодов в образовании гибридных облаков
участвуют и d-электроны. В этом случае
образуются 6 равноценных гибридных
облака, вытянутых к вершинам октаэдра
sр3 d2-гибридизация. Такую гибридизацию
имеет центральный атом комплексного
иона. Этим объясняется их октаэдрическая
структура.
Ковалентная связь
обладает направленностью. Область
перекрывания располагается в определенном
направлении по отношению к взаимодействующим
атомам.
Характер распределения
электронов по молекулярным орбиталям
позволяет объяснить магнитные
свойства частиц. Молекулы, суммарный
спин которых равен нулю, проявляют
диамагнитные свойства, т.е. во внешнем
магнитном поле их собственные магнитные
моменты ориентируются против направления
поля. Молекулы, суммарный спин которых
отличен от нуля, проявляют парамагнитные
свойства, т.е. во внешнем магнитном поле
их собственные магнитные моменты
ориентируются в направлении поля. Таким
образом молекула Н2 диамагнитна.
Геометрическая
форма молекул зависит от направленности
химической связи. Ядра атомов молекул
имеющих sр-гибридизацию атомных орбиталей
расположены в одной плоскости, sр2
–направлены к вершинам треугольника,
sр3 – к верщинам тетраэдра.
Свойства
ковалентной связи:
насыщаемость,
направленность и поляризуемость.
Насыщаемость
ковалентной связи обусловлена
ограниченными валентными возможностями
атомов, т.е. их способностью к образованию
строго определенного числа связей,
которое обычно лежит в пределах от 1 до
6. Общее число валентных орбиталей
в атоме, т.е. тех, которые могут быть
использованы для образования химических
связей, определяет максимально возможную
валентность
элемента. Число уже использованных для
этого орбиталей
определяет валентность элемента в
данном соединении.
|
|
Направленность
ковалентной
связи является результатом стремления
атомов к образованию наиболее прочной
связи за счет возможно большей электронной
плотности между ядрами. Это достигается
при такой пространственной направленности
перекрывания электронных облаков,
которая совпадает с их собственной.
Исключение составляют s-электронные
облака, поскольку их сферическая
форма делает все направления равноценными.
Для p-
и d-электронных облаков перекрывание
осуществляется вдоль оси, по которой
они вытянуты, а образующаяся при этом
связь называется s-связью.
-Связь
имеет осевую симметрию, и оба атома
могут вращаться вдоль линии связи, т.е.
той воображаемой линии, которая проходит
через ядра химически связанных атомов.
После
образования между двумя атомами -связи
для остальных электронных облаков той
же формы и с тем же главным
квантовым числом *
остается только возможность бокового
перекрывания по обе стороны от линии
связи. В результате образуется p-связь.
Она менее прочна, чем -связь:
перекрывание происходит диффузными
боковыми частями орбиталей. Каждая
кратная связь (например, двойная или
тройная) всегда содержит только одну
-связь.
Число
-связей,
которые образует центральный атом в
сложных молекулах или ионах, определяет
для него значение координационного
числа. Термин “координационное число”
используется также в других областях
химии. В случае комплексных соединений
он означает количество лигандов,
окружающих центральный ион. В кристаллохимии
координационное число показывает
количество атомов кристаллической
решетки, соседних с данным атомом..
Например, в молекуле NH3
и ионе NH4+
для атома азота
оно равно трем и четырем. Образование
-связей
фиксирует пространственное положение
атомов относительно друг друга, поэтому
число -связей
и углы между линиями связи, которые
называются валентными
углами, определяют пространственную
геометрическую конфигурацию молекул.
При
оценке степени перекрывания электронных
облаков следует учитывать знаки
волновых
функций электронов. При перекрывании
облаков с одинаковыми знаками волновых
функций электронная плотность в
пространстве между ядрами возрастает.
В этом случае происходит положительное
перекрывание, приводящее к взаимному
притяжению ядер. Если знаки волновых
функций противоположны, то плотность
электронного облака уменьшается
(отрицательное перекрывание), что
приводит к взаимному отталкиванию ядер.
Поляризуемость
рассматривают на основе представлений
о том, что ковалентная связь может быть
неполярной
(чисто ковалентной) или полярной .
Важными
характеристиками химической связи
являются также ее длина
и кратность. Длина
связи
определяется расстоянием между ядрами
связанных атомов в молекуле. Как правило,
длина химической связи меньше, чем сумма
радиусов
атомов, за счет перекрывания электронных
облаков. Кратность
связи
определяется количеством электронных
пар, связывающих два атома, например:
этан
H3C–CH3
одинарная связь (-связь)
этилен
H2C=CH2
двойная связь (одна -связь
и одна -связь)
ацетилен
HCCH
тройная связь (одна -связь
и две -связи).
С
увеличением кратности возрастает
энергия
связи, однако это возрастание не
пропорционально кратности, т.к. -связи
менее прочны, чем -связь.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Шорсткий И.А.
1
1 ФГБОУ ВО «Кубанский государственный технологический университет»
В данной работе представлен комплексный метод определения конфигурации молекул, в частности значения валентного угла для одиночной молекулы жидкой воды с описанием геометрической модели валентного угла. С помощью разработанной методики проведена расшифровка инфракрасного спектра молекулы жидкой воды на предмет определения валентного угла. Определено, что диапазон частот между метками ультрафиолетового и инфракрасного излучения показывает, как меняется частота молекулы водорода после того, как она вступила в связь с молекулой кислорода для образования молекулы воды. Полученное выражение для определения значения валентного угла базируется на основе геометрической модели молекулы жидкой воды, состоящей из двух колебательных систем, как диапазон частот индуцированного суммарного наведенного орбитального магнитного момента. На основе математической модели валентного угла определена точка баланса между колебательной частотой и длиной валентной связи. Спектр молекулы водорода Н2 в нормальном электронном состоянии с колебательной частотой 4340,5 см-1 является необходимым условием при определении валентного угла трехатомных водородосодержащих молекул, находящихся в устойчивом состоянии. Полученные результаты валентного угла жидкой воды 105,2 ° хорошо согласуются с известными данными. Предложенный метод определения валентного угла может быть распространен на другие одиночные водородосодержащие молекулы типа AX2E1 и AX2E2 при расшифровке инфракрасных спектров.
конфигурация молекулы
валентный угол
вода
спектр
колебательная частота
геометрическая модель
гипотетическая модель
1. Астапенко В.А. Взаимодействие излучения с атомами и наночастицами. М.: Интеллект, 2010. 496 с.
Astapenko V.A. Interaction of radiation with atoms and nanoparticles. M.: Intelligence, 2010. 496 p. (in Russian).
2. Герцберг Г. Спектры и строение двухатомных молекул. М.: Издательство иностранной литературы, 1949. 413 с.
Gertsberg G. Ranges and structure of diatomic molecules. M.: Publishing house of foreign literature, 1949. 413 p. (in Russian).
3. Герцберг Г. Колебательные и вращательные спектры многоатомных молекул. М.: Рипол Классик, 2013. 652 с.
Gertsberg G. Oscillatory and rotary ranges of polyatomic molecules. M.: Ripol Klassik, 2013. 652 p. (in Russian).
4. Linstrom P.J., Mallard W.G., Eds., NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology. URL: http://webbook.nist.gov (дата обращения: 04.08.2018).
5. Шорсткий И.А. Комплексный метод определения валентного угла в конфигурации трехатомной симметричной нелинейной молекулы воды // Спектроскопия координационных соединений: тезисы докладов XIV международной конференции. Краснодар: КГУ, 2017. С. 327–328.
Shorstky I.A. A complex method of definition of a valent corner in a configuration of a triatomic symmetric nonlinear molecule of water // Spectroscopy of coordination connections: theses of reports of the XIV international conference. Krasnodar: KGU, 2017. P. 327–328 (in Russian).
Большинство молекулярных структур рассмотрено методом валентных связей, описывающим конфигурацию молекул с точки зрения направленности атомных орбиталей [1]. В последнее время значительное внимание уделено методу молекулярных орбиталей, согласно которому электроны в молекуле занимают орбитали, охватывающие всю молекулу.
Целью работы является разработка комплексного метода определения валентного угла трехатомных водородосодержащих молекул, находящихся в устойчивом состоянии на основе данных инфракрасных спектров.
Молекула воды является симметричной и относится к точечной группе C2ν с двумя зеркальными плоскостями симметрии и двукратной осью вращения. Для определения валентного угла в молекуле H2O необходимо построить ее геометрическую модель. Для этого построим в пространстве плоскость E1 и проведем нормаль n, которая в свою очередь будет принадлежать плоскости Е2. В точке пересечения нормали и плоскости Е1 разместим центр массы (ЦМ) атома кислорода. Зафиксируем данную точку как точку О. Проведем в плоскости E1 вектор R и совместим его начало с точкой О. Проведем через данный вектор ось абсцисс.
Путем вращения вектора R вокруг нормали n получаем окружность с радиусом R. На данной окружности произвольно выбираем две точки 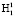 и
и 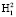 , как показано на рис. 1. Точка О является центром масс атома кислорода и совмещена с началом координат. Точки H1 и H2 являются однотипными точками (атомы водорода), при этом H1 – вершина вектора R, а положение точки H2 выбирается на окружности произвольно. Предлагаемая идея расчета валентного угла заключается в построении двух геометрических фигур: прямоугольника PH1K2H2, задача которого управлять величиной валентного угла ∠H1OH2 с помощью диагонали PK2, и прямоугольника PH1OK1, задача которого управлять координатами точек H1 и H2 относительно точки О с помощью диагонали прямоугольника РO. Таким образом, валентный угол a молекулы H2O представляет собой угол H1OH2. Для определения величины валентного угла из точки H2 проведем линию параллельно линии ОH1 и опустим на нее перпендикуляр из точки H1. Точку пересечения этих двух линий обозначим буквой Р, координаты которой потребуются для формирования математической модели при вычислении валентного угла. Если валентный угол выбрать как угол, равный 90 °, то установится подобие двух фигур, а именно PH1OK1 и PH1K2H2 с одной общей диагональю РО. Отношение диагонали РК2 прямоугольника PH1K2H2 к диагонали РО квадрата PH1OK1 обозначим через коэффициент симметрии эквивалентных координат:
, как показано на рис. 1. Точка О является центром масс атома кислорода и совмещена с началом координат. Точки H1 и H2 являются однотипными точками (атомы водорода), при этом H1 – вершина вектора R, а положение точки H2 выбирается на окружности произвольно. Предлагаемая идея расчета валентного угла заключается в построении двух геометрических фигур: прямоугольника PH1K2H2, задача которого управлять величиной валентного угла ∠H1OH2 с помощью диагонали PK2, и прямоугольника PH1OK1, задача которого управлять координатами точек H1 и H2 относительно точки О с помощью диагонали прямоугольника РO. Таким образом, валентный угол a молекулы H2O представляет собой угол H1OH2. Для определения величины валентного угла из точки H2 проведем линию параллельно линии ОH1 и опустим на нее перпендикуляр из точки H1. Точку пересечения этих двух линий обозначим буквой Р, координаты которой потребуются для формирования математической модели при вычислении валентного угла. Если валентный угол выбрать как угол, равный 90 °, то установится подобие двух фигур, а именно PH1OK1 и PH1K2H2 с одной общей диагональю РО. Отношение диагонали РК2 прямоугольника PH1K2H2 к диагонали РО квадрата PH1OK1 обозначим через коэффициент симметрии эквивалентных координат:
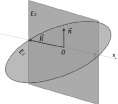
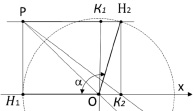
Рис. 1. Образование геометрической модели молекулы H2O (слева) и геометрическая модель валентного угла молекулы H2O (справа)
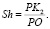 (1)
(1)
При значении угла a, равном 90 градусов, коэффициент Sh = 1. При этом условии координаты точек H1 и H2 переходят друг в друга при операциях симметрии. Коэффициент Sh также можно определить из отношения валентного угла a к углу 90 °
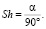 (2)
(2)
По условию задачи валентный угол a неизвестен. С помощью вращения вектора R вокруг нормали получим множество точек, равноудаленных от центра О. Воспользовавшись формулой (2), построим табл. 1 значений коэффициента Sh для различных валентных углов.
Таблица 1
Коэффициент симметрии при различных валентных углах
|
Валентный угол α |
Коэффициент Sh |
Валентный угол α |
Коэффициент Sh |
|
90 |
1,0 |
104 |
1,155 |
|
100 |
1,111 |
105 |
1,166 |
|
102 |
1,133 |
106 |
1,177 |
Согласно уравнению (1) коэффициента симметрии определяется через отношение двух отрезков (диапазонов). Изменение значений колебательных частот водорода в составе жидкой молекулы воды и электронных колебаний молекулы водорода H2 представим разностью этих частот, как диапазон. Прецессия суммарного наведённого орбитального магнитного момента молекулы воды в инфракрасном спектре отражает колебательные частоты как целой молекулы вокруг вектора магнитной индукции внешнего поля и является результирующей двух прецессий. Прецессии от общего наведённого орбитального магнитного момента первого атома и второго атома водорода молекулы воды. Прецессия суммарного наведённого орбитального магнитного момента молекулы воды в инфракрасном спектре отражает колебательные частоты молекулы, состоящей из разных атомов и меняется с изменением расстояния между центрами масс ядер около их равновесного положения. Частота вращательного движения молекулы воды определяется как вращение целой молекулы вокруг оси симметрии. Таким образом, и колебательные, и вращательные частоты связаны с амплитудой общего наведённого орбитального магнитного момента молекулы воды и индуцированного дипольного момента, в инфракрасном спектре излучения.
Результаты исследования и их обсуждение
Инфракрасный спектр жидкой воды по линии водорода выражен колебательными частотами 3657 и 3756 см-1 [2, 3], о чем свидетельствует широкий спектр в данном диапазоне (рис. 2), излучаемый атомами водорода молекулы жидкой воды.
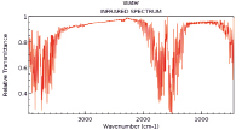
Рис. 2. Инфракрасный спектр жидкой воды [4]
Для построения гипотетической модели валентного угла одиночной молекулы Н2О как нелинейной и симметричной воспользуемся данными колебательных и вращательных констант для нормальных электронных состояний трехатомных молекул [2, 3] (табл. 2).
Таблица 2
Колебательные и вращательные константы для нормальных электронных состояний жидкой молекулы воды в инфракрасном спектре излучения
|
Молекула |
Длина валентной связи, пм |
Колебательная частота, ω (см-1) |
|
H2O |
О- |
3756 |
|
О- |
3657 |
|
|
O2 |
1595 |
Для удобства отобразим данные колебательных частот в виде вертикальных полос, аналогично полосатым спектрам излучения для двухатомных и трехатомных молекул (рис. 3).
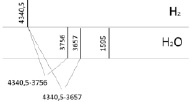
Рис. 3. Определение диапазона спектра прецессии вектора общего наведённого орбитального магнитного момента в инфракрасном спектре в молекуле жидкой воды и электронной частоты двухатомной молекулы водорода в ультрафиолетовом спектре
Молекула водорода как самостоятельная молекула идентифицируется по ультрафиолетовому спектру электронного излучения с колебательной частотой, равной 4340,5см-1 для состояния 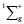 . Состояние
. Состояние 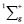 имеет потенциальную кривую с глубоким минимумом потенциальной энергии и является устойчивым состоянием. Данное значение отобразим вертикальной полосой в верхнем ряду электронных колебательных частот атома водорода. Значения колебательных частот молекулы жидкой воды, полученных в инфракрасном спектре излучения, отобразим в нижнем ряду. Изменение значения колебательных частот водорода в составе жидкой молекулы воды и электронных колебаний молекулы водорода H2 представим разностью этих частот, как диапазон. Диапазон частот между метками в инфракрасном и ультрафиолетовом излучении определим как разность. Метками в инфракрасном спектре являются колебательные частоты одиночной молекулы воды 3756 см-1 и 3657 см-1, метками в ультрафиолетовом излучении является электронная частота молекулы водорода 4340,5 см-1. Таким образом, диапазон частот между метками ультрафиолетового и инфракрасного излучения показывает, как меняется частота молекулы водорода после того, как она вступила в связь с атомом кислорода для образования молекулы воды. Согласно выражению полной энергии, в каждом устойчивом электронном состоянии молекула может иметь и колебательную энергию относительно положения равновесия, и вращательную энергию. Е = Еэ + Екол + Евр. Испускаемую или поглощаемую частоту молекулы можно рассмотреть как сумму составных частей V = Vэ + Vкол + Vвр. Таким образом разность между электронной частотой и колебательной при Vвр = 0 определяет длину диапазона спектра прецессии вектора общего наведённого орбитального магнитного момента молекулы воды как целого. Молекула воды содержит два атома водорода, следовательно, прецессия общего наведённого орбитального магнитного момента О-
имеет потенциальную кривую с глубоким минимумом потенциальной энергии и является устойчивым состоянием. Данное значение отобразим вертикальной полосой в верхнем ряду электронных колебательных частот атома водорода. Значения колебательных частот молекулы жидкой воды, полученных в инфракрасном спектре излучения, отобразим в нижнем ряду. Изменение значения колебательных частот водорода в составе жидкой молекулы воды и электронных колебаний молекулы водорода H2 представим разностью этих частот, как диапазон. Диапазон частот между метками в инфракрасном и ультрафиолетовом излучении определим как разность. Метками в инфракрасном спектре являются колебательные частоты одиночной молекулы воды 3756 см-1 и 3657 см-1, метками в ультрафиолетовом излучении является электронная частота молекулы водорода 4340,5 см-1. Таким образом, диапазон частот между метками ультрафиолетового и инфракрасного излучения показывает, как меняется частота молекулы водорода после того, как она вступила в связь с атомом кислорода для образования молекулы воды. Согласно выражению полной энергии, в каждом устойчивом электронном состоянии молекула может иметь и колебательную энергию относительно положения равновесия, и вращательную энергию. Е = Еэ + Екол + Евр. Испускаемую или поглощаемую частоту молекулы можно рассмотреть как сумму составных частей V = Vэ + Vкол + Vвр. Таким образом разность между электронной частотой и колебательной при Vвр = 0 определяет длину диапазона спектра прецессии вектора общего наведённого орбитального магнитного момента молекулы воды как целого. Молекула воды содержит два атома водорода, следовательно, прецессия общего наведённого орбитального магнитного момента О-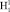 и О-
и О-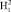 для такой молекулы воды как целого состоит из двух частей. Для молекулы водорода, которая состоит из двух одинаковых атомов, диполь отсутствует, поэтому излучение в инфракрасном спектре тоже отсутствует.
для такой молекулы воды как целого состоит из двух частей. Для молекулы водорода, которая состоит из двух одинаковых атомов, диполь отсутствует, поэтому излучение в инфракрасном спектре тоже отсутствует.
Для вычисления валентного угла по данным спектра излучения колебательных частот в инфракрасном диапазоне представим значения электронной частоты молекулы водорода, и атомов водорода, входящих в состав воды и атома кислорода в одном ряду (рис. 4).
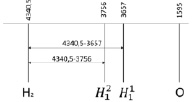
Рис. 4. Определение диапазона спектра прецессии вектора общего наведённого орбитального магнитного момента в инфракрасном спектре в молекуле жидкой воды и электронной частоты двухатомной молекулы водорода в ультрафиолетовом спектре
Согласно уравнению (1) определение коэффициента симметрии осуществляется через отношения двух отрезков (диапазонов). В качестве числителя используется диапазон между частотой индуцированного общего наведённого орбитального магнитного момента О-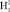 и колебательной частотой нормального электронного состояния молекулы водорода. В качестве знаменателя используется диапазон между частотой индуцированного общего наведённого орбитального магнитного момента О-
и колебательной частотой нормального электронного состояния молекулы водорода. В качестве знаменателя используется диапазон между частотой индуцированного общего наведённого орбитального магнитного момента О-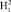 и колебательной частотой нормального электронного состояния молекулы водорода. Уравнение коэффициента симметрии эквивалентных координат представлено в виде
и колебательной частотой нормального электронного состояния молекулы водорода. Уравнение коэффициента симметрии эквивалентных координат представлено в виде
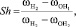 (3)
(3)
где в ультрафиолетовом спектре 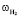 – колебательная частота нормального электронного состояния атома водорода Н2, см-1; в инфракрасном спектре
– колебательная частота нормального электронного состояния атома водорода Н2, см-1; в инфракрасном спектре 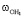 – колебательная частота первого атома водорода молекулы воды, см-1;
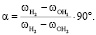
– колебательная частота первого атома водорода молекулы воды, см-1; 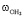 – колебательная частота второго атома водорода молекулы воды, см-1. Согласно уравнению (2) связь коэффициента Sh и валентного угла определяется углом 90 °:
– колебательная частота второго атома водорода молекулы воды, см-1. Согласно уравнению (2) связь коэффициента Sh и валентного угла определяется углом 90 °:
 (4)
(4)
Подставив значения колебательных частот, получим
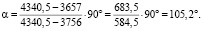
Диапазон прецессии между метками для диполя О- составляет 683,5 см-1, а для диполя
составляет 683,5 см-1, а для диполя  составляет 584,5 см-1. Полученное значение валентного угла соответствует значению коэффициента эквивалентных координат Sh = 1,169. Коэффициент полученный в результате этого отношения, определяет валентный угол жидкой воды по спектру излучения колебательных частот в инфракрасном диапазоне согласно выражению (3).
составляет 584,5 см-1. Полученное значение валентного угла соответствует значению коэффициента эквивалентных координат Sh = 1,169. Коэффициент полученный в результате этого отношения, определяет валентный угол жидкой воды по спектру излучения колебательных частот в инфракрасном диапазоне согласно выражению (3).
Данные валентного угла водородосодержащих молекул, полученные с помощью выражения (4), представлены в табл. 3 и хорошо согласуются с известными результатами расчета валентного угла [5].
Таблица 3
Колебательные частоты водородосодержащих молекул
|
Молекула |
Колебательная частота, ω (см-1) |
Валентный угол, α* |
|
SH2 |
2611 и 2684 |
93,96 ° |
|
SeH2 |
2260 и 2350 |
94,07 ° |
|
HOD |
3707,5 и 2723,7 |
92,4 ° |
Примечание. *при условии взаимности фундаментальных колебаний WHO/WDO = 1,355.
Физический смысл показателя коэффициента симметрии эквивалентных координат Sh заключается в том, что он определяет, на сколько диапазон прецессии индуцированного общего наведённого орбитального магнитного момента первого атома водорода молекулы воды отличается от диапазона прецессии индуцированного общего наведённого орбитального магнитного момента второго атома водорода согласно меткам в ультрафиолетовом и инфракрасном спектре излучения. А также, как далеко друг от друга расположены центры масс атомов водорода в трехатомных водородосодержащих молекулах и тем самым выражает амплитуду деформационного колебания, как результат изменения межъядерного расстояния между центром масс атома кислорода и центром масс атома водорода.
Математическая модель валентного угла одиночной молекулы жидкой воды
Для определения точки P геометрической модели построим математическую модель молекулы жидкой воды в системе координат колебательной частоты ω и длины ковалентной связи R. Межъядерное расстояние 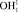 составляет 110,26 пм. Центр масс атома кислорода совмещен с началом координат согласно рис. 5. В нашей математической модели центр масс молекулы водорода в цепочке
составляет 110,26 пм. Центр масс атома кислорода совмещен с началом координат согласно рис. 5. В нашей математической модели центр масс молекулы водорода в цепочке 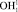 находится в точке Х2. Водород цепочки
находится в точке Х2. Водород цепочки 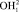 поместим в точку Х1 на расстоянии 95,8 пм от начала координат. Перенесем геометрическую модель (рис. 1) в данную систему координат ω-R. Из рис. 5 видно, что точка Х1 принадлежит прямоугольнику РК1Х1ХР , а Х2 прямоугольнику PK2X2Xp. Обозначим значения спектров водородов на оси ординат и соединим их с точками X1 и X2. Точку пересечения полученных линий обозначим через P, координаты которой определяют значение валентного угла.
поместим в точку Х1 на расстоянии 95,8 пм от начала координат. Перенесем геометрическую модель (рис. 1) в данную систему координат ω-R. Из рис. 5 видно, что точка Х1 принадлежит прямоугольнику РК1Х1ХР , а Х2 прямоугольнику PK2X2Xp. Обозначим значения спектров водородов на оси ординат и соединим их с точками X1 и X2. Точку пересечения полученных линий обозначим через P, координаты которой определяют значение валентного угла.
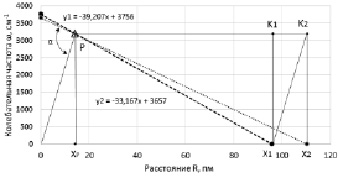
Рис. 5. Молекула водорода Н2 и ОН в системе координат ω-R, с точкой пересечения P(Δ)
Валентный угол в соответствии с выражением (1) составляет 105,2 °, и определяется через коэффициент симметрии эквивалентных координат. На рис. 5 представлены две диагонали РХ1 и РХ2 двух прямоугольников, которые определяют угол между прямой ОХ1К2. Система линейных уравнений, составленной из у1 и у2, при совместном решении определяет точку пересечения, обозначенной буквой Р. Точка Р симметричная относительно оси ординат и является балансной между колебательной частотой и длиной валентной связи.
Заключение
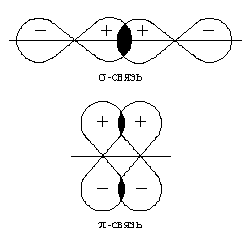
На основании предложенной идеи расчета валентного угла получена геометрическая модель молекулы жидкой воды с двумя колебательными системами, характеризующимися диагоналями PK2 и РО (рис. 3). С помощью разработанной методики проведена расшифровка инфракрасного спектра жидкой воды на предмет определения валентного угла. Полученное выражение для определения значения валентного угла базируется на основе представленной геометрической модели молекулы жидкой воды, состоящей из двух колебательных систем, и выраженной как диапазон между частотой индуцированного общего наведённого орбитального магнитного момента молекулы воды и электронной частотой атома водорода. Полученные значения валентных углов для жидкой воды и водородосодержащих молекул хорошо согласуются с известными результатами. Спектр молекулы водорода Н2 в нормальном электронном состоянии имеет электронную частоту 4340,5 см-1. Состояние 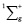 имеет потенциальную кривую с глубоким минимумом потенциальной энергии, что является необходимым условием при выборе электронной частоты и при определении валентного угла трехатомных водородосодержащих молекул, находящихся в устойчивом состоянии. Таким образом, диапазон частот между метками ультрафиолетового и инфракрасного излучения показывает, как меняется частота молекулы водорода после того, как она вступила в связь с молекулой кислорода для образования молекулы воды.
имеет потенциальную кривую с глубоким минимумом потенциальной энергии, что является необходимым условием при выборе электронной частоты и при определении валентного угла трехатомных водородосодержащих молекул, находящихся в устойчивом состоянии. Таким образом, диапазон частот между метками ультрафиолетового и инфракрасного излучения показывает, как меняется частота молекулы водорода после того, как она вступила в связь с молекулой кислорода для образования молекулы воды.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-38-00448.
Библиографическая ссылка
Шорсткий И.А. МЕТОД ОПРЕДЕЛЕНИЯ ВАЛЕНТНОГО УГЛА ОДИНОЧНОЙ МОЛЕКУЛЫ ЖИДКОЙ ВОДЫ ЧЕРЕЗ ИНФРАКРАСНЫЙ СПЕКТР ИЗЛУЧЕНИЯ // Успехи современного естествознания. – 2018. – № 10.
– С. 28-33;
URL: https://natural-sciences.ru/ru/article/view?id=36877 (дата обращения: 19.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
В образовании ковалентных
связей принимают участие как эс-, так и пэ-электроны,
орбитали которых имеют различную форму и направленность в пространстве.
Связи, которые
образуются между ними,
являются равноценными и расположены симметрично.
Это явление
объясняется на основе концепции гибридизации атомных валентных орбиталей.
Согласно концепции, в образовании химической связи принимают участие гибридные
орбитали, то есть это орбитали, усреднённые по форме и размерам, а,
следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.
Гибридные орбитали
более вытянуты в пространстве, а это обеспечивает их более полное перекрывание
с орбиталями соседних атомов.
Из-за своей
симметрии гибридные орбитали не участвуют в образовании пи-связи,
так как не могут обеспечить перекрывание между собой в двух областях
пространства.
Основными
условиями устойчивой гибридизации являются:
Первое, в
гибридизации могут участвовать орбитали с близкими значениями энергий, то
есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего
или предвнешнего уровня;
второе, гибридная
атомная орбиталь должна более плотно перекрываться с орбиталями другого атома
при образовании связи;
третье, в гибридизации
участвуют орбитали с достаточно высокой электронной плотностью, которыми в
большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные
орбитали должны быть ориентированы в пространстве таким образом, чтобы
обеспечить максимальное взаимное удаление друг от друга.
Ориентация
гибридных орбиталей определяет геометрическую структуру молекулы. При
комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные
орбитали, расположенные симметрично под углом сто восемьдесят градусов.
Связи, образованные
с участием электронов этих орбиталей, также располагаются под углом сто
восемьдесят градусов.
Например, у атома
бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия,
которая вследствие этого имеет линейную форму.
Комбинация трёх
орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два
гибридных орбиталей, расположенных под углом сто двадцать градусов, как в
молекуле фторида бора.
Комбинация четырёх
орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при
которой четыре гибридные орбитали симметрично ориентированы в пространстве к
четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать
восемь минут, как в атоме углерода в молекуле метана.
Таким образом, если
исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали,
возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто
восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные
орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали,
тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов,
а форма молекулы треугольная.
Если в
гибридизации участвуют одна эс и три пэ-орбитали
то образуется
четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при
этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
Основные
характеристики разных типов гибридизации
Пространственное
строение молекул или ионов зависит от типа гибридизации и
взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах
углы между связями отличаются от углов, соответствующих типу гибридизации.
Почему же так происходит?
Во-первых, геометрическая
конфигурация молекул определяется в основном пространственной направленностью сигма-связей.
Устойчивому состоянию молекулы соответствует такое пространственное
расположение электронных облаков валентного слоя, при котором их взаимное
отталкивание минимально. Поэтому такие электронные пары стремятся
максимально оттолкнуться друг от друга, располагаясь в пространстве под
возможно большим углом.
Основными
причинами отклонений углов связей от углов, соответствующих типу гибридизации
являются:
во-первых, не все гибридные
орбитали участвуют в образовании связей, часть из них – несвязывающие.
Электронные пары, находящиеся на этих орбиталях, называются несвязывающими,
или неподелёнными. Так, в молекуле аммиака у атома азота одна
пара электронов – не связывающая, в молекуле воды у атома кислорода две пары
электронов являются несвязывающими.
Связывающая
электронная пара локализована между атомами и поэтому занимает меньше
пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее
действие несвязывающей пары проявляется в большей мере, чем связывающей. В
молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип
гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота
и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа
гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до
ста семи градусов у аммиака и ста четырёх с половиной у воды.
Второй причиной
отклонений углов
связей является наличие пи-связей, которые влияют на величину валентного угла,
но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что
электронные пары кратной связи занимают ту же область пространства, что и
электронная пара простой связи. Суммарное электронное облако кратной связи
занимает больший объём пространства, чем одинарной и поэтому обладает
большим отталкивающим действием.
Так, в молекуле
углекислого газа две ковалентные связи одинарные, так как являются сигма-связями,
а две другие связи – это пи-связи. Пи-связи не влияют на геометрию
молекул, поэтому в пространстве молекула углекислого газа имеет линейное
строение, и здесь эс-пэ-тип гибридизации.
Виды
геометрических конфигураций
Молекулы с эс-пэ-гибридизацией
имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К
таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида
азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией
валентный угол сто двадцать градусов, форма молекулы может быть треугольной,
как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы
четыре.
В молекулах с эс-пэ-три-гибридизацией
валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь
тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное
строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида
кислорода и воды.
Иногда строение
многих молекул нельзя изобразить такой одной графической формулой, потому что
истинные свойства молекулы оказываются промежуточными между теми, которые
отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты
можно изобразить двумя равнозначными графическими формулами. Так как в этой
молекуле два атома кислорода равноценны, строение молекулы лучше отражает
графическая формула с дэлокализованной пи-связью. Пунктирные линии означают,
что одна из общих электронных пар в равной степени распределена между одной и
другой связями. Эта электронная пара принадлежит не двум, а трём атомам,
поэтому образованная таким образом связь является трёхцентровой.
Многоцентровые
связи
Таким образом,
гибридные орбитали должны быть ориентированы в пространстве таким образом,
чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные
орбитали участвуют в образовании только сигма-связи.
Геометрия любой
молекулы определяется пространственной направленностью сигма-связью. На
пространственное строение молекулы оказывают влияние несвязывающие пары
электронов, которые уменьшают углы связей между сигма-связями.
 95,8
95,8 95,8
95,8