Для измерения масс
атомов и молекул в физике и химии принята
единая система измерения. Эти величины
измеряются в относительных единицах.
Атомная
единица массы (а.е.м.) равна 1/12 массы m
атома углерода 12С
(m
одного атома 12С
равна 1,99310-26кг).
![]()
Относительная
атомная масса элемента (Ar)
– это безразмерная величина, равная
отношению средней массы атома элемента
к 1/12 массы атома 12С.
При расчете относительной атомной массы
учитывается изотопный состав элемента.
Величины Ar
определяют по таблице
Д.И. Менделеева
Абсолютная
масса атома (m)
равна относительной атомной массе,
умноженной на 1 а.е.м. Например, для атома
водорода абсолютная масса определяется
следующим образом:
m
(H) = 1,0081,66110-27
кг = 1,67410-27
кг
Относительная
молекулярная масса соединения (M
r)
– это безразмерная величина, равная
отношению массы m
молекулы вещества к 1/12 массы атома 12С:
![]()
Относительная
молекулярная масса равна сумме
относительных масс атомов, входящих в
состав молекулы. Например:
М
r
(C2H6)
= 2
A
r
(C) + 6A
r
(H) = 212
+ 6 = 30.
Абсолютная масса
молекулы равна относительной молекулярной
массе, умноженной на 1 а.е.м.
2.2. Моль, молярная масса
В
химических процессах участвуют мельчайшие
частицы – молекулы, атомы, ионы, электроны.
Число таких частиц даже в малой порции
вещества очень велико. Поэтому, чтобы
избежать математических операций с
большими числами, для характеристики
количества вещества, участвующего в
химической реакции, используется
специальная единица – моль.
Моль
это такое количество вещества, в котором
содержится определенное число частиц
(молекул, атомов, ионов), равное постоянной
Авогадро (NA=
6,021023
моль–1).
Постоянная
Авогадро NA
определяется как число атомов, содержащееся
в 12 г изотопа 12С:
![]()
Таким
образом, 1 моль вещества содержит 6,02
1023
частиц этого вещества.
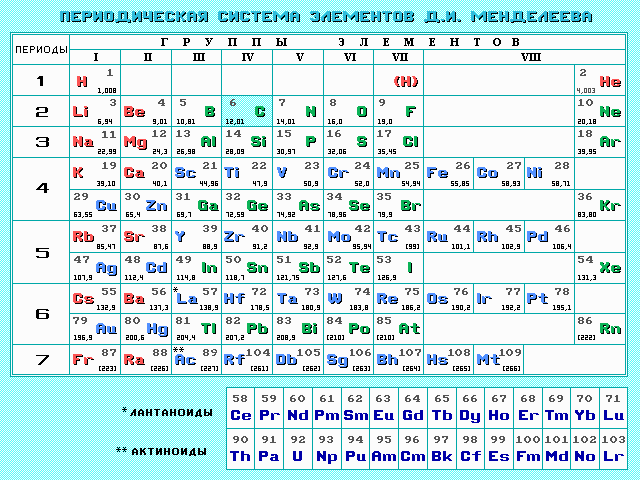
Исходя
из этого, любое количество вещества
можно выразить определенным числом
молей
(ню). Например, в образце вещества
содержится 12,04
1023
молекул. Следовательно, количество
вещества в этом образце составляет:
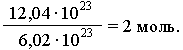
В общем
виде:
![]()
где N
– число частиц данного вещества;
NA
– число частиц в одном моле вещества
(постоянная Авогадро).
Молярная
масса вещества (M)
– масса одного моля этого вещества.
По
величине она равна относительной
молекулярной массе Mr
(для веществ атомного строения –
относительной атомной массе Ar).
Молярная масса имеет размерность г/моль.
Например, молярная масса метана CH4
определяется следующим образом:
Мr(CH4)
= Ar(C)
+ 4 Ar(H)
= 12+4 =16
M(CH4)=16
г/моль, т.е. 16 г CH4
содержат 6,021023
молекул.
Молярную массу вещества
можно вычислить, если известны его масса
m
и количество (число молей) ,
по формуле:
![]()
Соответственно,
зная массу и молярную массу вещества,
можно рассчитать число его молей:
![]()
или найти массу
вещества по числу молей и молярной
массе:
m =
M .
Необходимо
отметить, что значение молярной массы
вещества определяется его качественным
и количественным составом, т.е. зависит
от Mr
и Ar.
Поэтому разные вещества при одинаковом
количестве молей имеют различные массы
m.
Пример:
Вычислить
массы метана CH4
и этана С2H6,
взятых в количестве
= 2 моль каждого.
Решение:
Молярная
масса метана равна 16 г/моль, а этана С2Н6
– 30 г/моль. Отсюда:
m(CH4)
= 2 моль
16 г/моль = 32
г;
m(С2Н6)
= 2 моль
30 г/моль = 60
г.
Таким образом,
моль – это порция вещества, содержащая
одно и то же число частиц, но имеющая
разную массу для разных веществ, т.к.
частицы вещества (атомы и молекулы) не
одинаковы по массе.
(CH4)
= (С2Н6),
но m(CH4)
< m(С2Н6)
Вычисление
используется практически в каждой
расчетной задаче.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Очень часто дети, особенно в последнее время, забывают элементарные вещи.
Поэтому в работе использую памятки или планы (алгоритмы) для учащихся. Например.
1. При определении относительной молекулярной массы веществ
1).Надо найти в таблице химических элементов Д. И. Менделеева нужные химические элементы и выписать их относительные атомные массы Аr, округленные до целых чисел, кроме хлора (у хлора -35.5).
2).Нужно умножить эти значения Аr на количество атомов каждого элемента в молекуле вещества.
3). Нужно сложить получившиеся произведения для всех химических элементов в молекуле данного вещества. Получится относительная молекулярная масса вещества Мr.
Пример: Определить относительную молекулярную массу оксида углерода (IV) СО2.
Решение:
1 шаг.
Молекула вещества состоит из 1 атома углерода и 2 атомов кислорода. Находим эти элементы в таблице Д. И. Менделеева. Выписываем их относительную атомную массу: А (С) =12; А (О) =16.
2 шаг.
Умножаем относительную атомную массу на количество атомов этих элементов, получим два произведения. 12х1=12; 16х2=32
3 шаг.
Складываем произведения. Получаем Мr= 12+32=44(безразмерная величина)
Ответ: Мr(СО2)=44
Молекулярная масса (устаревшее название — молекулярный вес) — масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы) и относительную молекулярную массу — безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12C (обозначается Mr, от англ. relative).
Молекулярная масса, выраженная в а. е. м., численно равна относительной молекулярной массе и молярной массе, выраженной в г/моль. Однако следует чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и различаются по размерности.
Относительные молекулярные массы сложных молекул можно определить, просто складывая относительные атомные массы входящих в них элементов. Например, относительная молекулярная масса воды (H2O) есть
где
— относительная молекулярная масса,
— относительная атомная масса.
См. также[править | править код]
- Атомная единица массы
- Молярная масса
Ссылки[править | править код]
- МОЛЕКУЛЯРНАЯ МАССА на chemport.ru.
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов
|
Вычисление количества вещества эквивалента, молярной массы эквивалента, абсолютной атомной и молекулярной массы
Задание 18.
Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
Решение:
Моль – это количество вещества, в котором содержится число частиц любого определённого сорта равное постоянной Авогадро (6,02 . 1023). Молярная масса вещества – это масса одного моля, выраженная в граммах, (г/моль) и численно равная его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м. ). Так как атомная масса углерода и молекулярная масса воды соответственно равны 12 и 18 а. е.м., то их молярные массы равны: М(С) = 12 г/моль; М(Н2О) = 18 г/моль. Исходя из того, что 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов или молекул). Рассчитаем массу атома углерода и массу молекулы воды, получим:
- m = M/NA; m = 12/6,02 . 1023 = 2 . 10-23 г; m = 18/6,02 . 1023 = 3 . 10-23 г.
Ответ: 2,0 . 10-23 г; 3,0 . 10-23 г.
Задание 19.
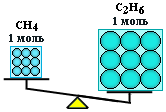
На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции.
Решение:
М(H3PO4) = 98 г/моль; М(NaOH) = 40 г/моль; МЭ(NaOH) = 40 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
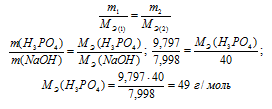
Количество вещества эквивалента равно:
Э = МЭ(H3PO4)/ М(H3PO4) = 49/98 = 0,5 моль.
Основность кислоты определяем делением молекулярной массы на молярную массу эквивалента , получим: М(H3PO4)/ МЭ(H3PO4) = 98/49 = 2. Исходя из того, что основность кислоты равна 2, то количество вещества эквивалента кислоты равно 0,5 моль (1/2 = 0,5).
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: 0,5 моль; 49 г/моль; основность кислоты 2.

