Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 января 2021 года; проверки требуют 9 правок.
| Бромид алюминия | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Бромид алюминия | |
| Хим. формула | AlBr3, Al2Br6 | |
| Рац. формула | AlBr3 | |
| Физические свойства | ||
| Состояние | твёрдое | |
| Молярная масса | 266,69 г/моль | |
| Плотность | 3,205[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | 97,5[1] | |
| • кипения | 255[2] °C | |
| Энтальпия | ||
| • образования |
− 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ)[3] кДж/моль |
|
| Структура | ||
| Кристаллическая структура | моноклинная | |
| Классификация | ||
| Рег. номер CAS | 7727-15-3 | |
| PubChem | 24409 | |
| Рег. номер EINECS | 231-779-7 | |
| SMILES |
[Al](Br)(Br)Br |
|
| InChI |
InChI=1S/Al.3BrH/h;3*1H/q+3;;;/p-3 PQLAYKMGZDUDLQ-UHFFFAOYSA-K |
|
| RTECS | BD0350000 | |
| Номер ООН | 1725 | |
| ChemSpider | 22818 | |
| Безопасность | ||
| Пиктограммы ECB |
|
|
| NFPA 704 |
1 3 1 COR |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула 
Физические свойства[править | править код]
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
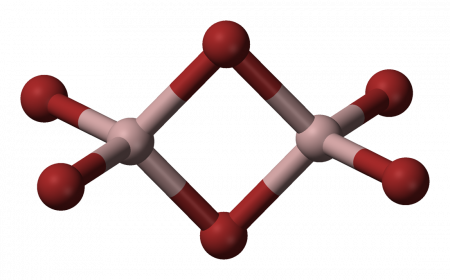
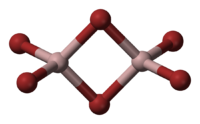
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
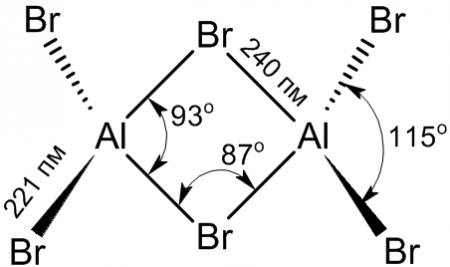
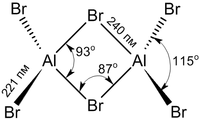
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома[4].
Координационное число алюминия в молекуле бромида равно 4[5].
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль[6].
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O[7]. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне[8]; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор). Разлагается в горячей воде[9].
Химические свойства[править | править код]
- Безводный бромид алюминия очень энергично реагирует с водой, выделяя при растворении много тепла и частично гидролизуясь:
- При нагревании водного раствора гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения[10]:
- При высокой температуре разлагается:
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия[2]:
- С гидридом лития образует алюмогидрид:
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе)[7]:
Получение[править | править код]
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2)[11]:

Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:

Применение[править | править код]
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий[12].
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.

Соединение может выступать катализатором в реакции изомеризации бромалканов, например[13]:

Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом[14]:

Опасность для здоровья[править | править код]
При контакте с кожей бромид алюминия может вызывать ожоги.
Примечания[править | править код]
- ↑ 1 2 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 74. — ISBN 5-7107-8085-5.
- ↑ 1 2 Турова Н.Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 67.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5.
- ↑ Chambers C., Holliday A.K. Modern inorganic chemistry. — Chichester: Butterworth & Co (Publishers) Ltd, 1975. — P. 153.
- ↑ Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 86. — ISBN 5-7695-1436-1.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 6. Энергия связи для многоатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 384. — ISBN 5-7107-8085-5.
- ↑ 1 2 Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М.: «Высшая школа», 2001. — С. 498. — ISBN 5-06-003363-5.
- ↑
Алюминий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 207. - ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5.
- ↑ Гофман У., Рюдорф В., Хаас А. и др. Руководство по неорганическому синтезу. — Пер. с нем., под ред. Г.Брауэра. — М.: «Мир», 1985. — Т. 3. — С. 899.
- ↑ Взаимодействие брома с алюминием Архивная копия от 4 марта 2016 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Спиридонов Б.А., Федянин В.И. Исследование процесса электроосаждения алюминия из пара-ксилольных электролитов. Российское общество гальванотехников и специалистов в области обработки поверхности. Дата обращения: 26 октября 2009. Архивировано 18 мая 2008 года.
- ↑ Douwes H.S.A. The kinetics of the aluminium bromide catalyzed isomerization of 1-propyl bromide (англ.) // Journal of Molecular Catalysis A: Chemical. — 2005. — Vol. 240, no. 1-2. — P. 82-90.
- ↑ Unated States Patent 2553518. Production of Organic Bromides (англ.) (pdf). FreePatentsOnline (May, 1951). Дата обращения: 26 октября 2009. Архивировано 9 апреля 2012 года.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А.. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X.
| Бромид алюминия | ||
|---|---|---|
|
||
| Систематическое наименование |
Бромид алюминия | |
| Хим. формула | AlBr3, Al2Br6 | |
| Рац. формула | AlBr3 | |
| Состояние | твёрдое | |
| Молярная масса | 266,69 г/моль | |
| Плотность | 3,205 | |
| Температура | ||
| • плавления | 97,5 | |
| • кипения | 255 °C | |
| Энтальпия | ||
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
|
| Кристаллическая структура | моноклинная | |
| Рег. номер CAS | 7727-15-3 | |
| PubChem | 24409 | |
| Рег. номер EINECS | 231-779-7 | |
| SMILES |
[Al](Br)(Br)Br |
|
| InChI |
1S/Al.3BrH/h;3*1H/q+3;;;/p-3 PQLAYKMGZDUDLQ-UHFFFAOYSA-K |
|
| RTECS | BD0350000 | |
| Номер ООН | 1725 | |
| ChemSpider | 22818 | |
| Пиктограммы ECB |  |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al+3Br3−1. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.

Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- AlBr3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3Br−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- При нагревании водного раствора гидролиз можно провести полностью:
- AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
- Вступает в реакцию со щелочами:
- AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr
- AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
- AlBr3 + H2S = AlBr3 ⋅ H2S
- При высокой температуре разлагается:
- 2 AlBr3 = 2 Al + 3 Br2
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия:
- AlBr3 + 2 Al ⇆ 3 AlBr
- С гидридом лития образует алюмогидрид:
- AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе):
- AlBr3 + C2H5Br → [C2H5]+[AlBr4]−
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
2 Al + 3 Br2 = Al2Br6
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
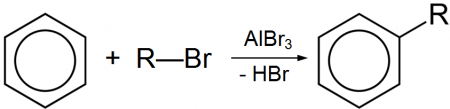
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
CH3−CH2−CH2Br →AlBr3 CH3−CHBr−CH3
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
CHCl3 + HBr →90oC; AlBr3 CHBrCl2 + HCl
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Aluminium bromide |
|
| Other names
Aluminic bromide Aluminium(III) bromide Aluminium tribromide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.891 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1725 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AlBr3 Al2Br6 AlBr3·6H2O (hexahydrate) |
| Molar mass | 266.694 g/mol (anhydrous) 374.785 g/mol (hexahydrate)[1] |
| Appearance | white to pale yellow powder[1] |
| Odor | pungent |
| Density | 3.2 g/cm3 (anhydrous) 2.54 g/cm3 (hexahydrate)[1] |
| Melting point | 97.5 °C (anhydrous) 93 °C (hexahydrate)[1] |
| Boiling point | 255 (anhydrous)[1] |
|
Solubility in water |
very soluble, partially hydrolyses indicated by a fuming solution and an optional appearance of white precipitate |
| Solubility | slightly soluble in methanol, diethyl ether, acetone |
| Structure[2] | |
|
Crystal structure |
Monoclinic, mP16 (anhydrous) |
|
Space group |
P21/c, No. 14 |
|
Lattice constant |
a = 0.7512 nm, b = 0.7091 nm, c = 1.0289 nm α = 90°, β = 96.44°, γ = 90° |
|
Formula units (Z) |
4 |
| Thermochemistry[1] | |
|
Heat capacity (C) |
100.6 J/(mol·K) |
|
Std molar |
180.2 J/(mol·K) |
|
Std enthalpy of |
-572.5 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314 |
|
Precautionary statements |
P260, P264, P270, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P330, P363, P405, P501 |
| NFPA 704 (fire diamond) |
3 1 1 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1598 mg/kg (oral, rat) |
| Related compounds | |
|
Other anions |
aluminium trichloride aluminium triiodide |
|
Other cations |
boron tribromide |
|
Related compounds |
iron(III) bromide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium bromide is any chemical compound with the empirical formula AlBrx. Aluminium tribromide is the most common form of aluminium bromide.[3] It is a colorless, sublimable hygroscopic solid; hence old samples tend to be hydrated, mostly as aluminium tribromide hexahydrate (AlBr3·6H2O).
Structure[edit]
The dimeric form of aluminium tribromide (Al2Br6) predominates in the solid state, in solutions in noncoordinating solvents (e.g. CS2), in the melt, and in the gas phase. Only at high temperatures do these dimers break up into monomers:
- Al2Br6 → 2 AlBr3 ΔH°diss = 59 kJ/mol
The species aluminium monobromide forms from the reaction of HBr with Al metal at high temperature. It disproportionates near room temperature:
- 6/n “[AlBr]n” → Al2Br6 + 4 Al
This reaction is reversed at temperatures higher than 1000 °C. Aluminium monobromide has been crystallographically characterized in the form the tetrameric adduct Al4Br4(NEt3)4 (Et = C2H5). This species is electronically related to cyclobutane. Theory suggest that the diatomic aluminium monobromide condenses to a dimer and then a tetrahedral cluster Al4Br4, akin to the analogous boron compound.[4]
Al2Br6 consists of two AlBr4 tetrahedra that share a common edge. The molecular symmetry is D2h.
The monomer AlBr3, observed only in the vapor, can be described as trigonal planar, D3h point group. The atomic hybridization of aluminium is often described as sp2. The Br-Al-Br bond angles are 120 °.
Synthesis[edit]
Experiment showing synthesis of aluminium bromide from the elements.
By far the most common form of aluminium bromide is Al2Br6. This species exists as hygroscopic colorless solid at standard conditions. Typical impure samples are yellowish or even red-brown due to the presence of iron-containing impurities. It is prepared by the reaction of HBr with Al:
- 2 Al + 6 HBr → Al2Br6 + 3 H2
Alternatively, the direct bromination occurs also:
- 2 Al + 3 Br2 → Al2Br6
Reactions[edit]
A demonstration of the reaction of the exothermic reaction of the strong Lewis acid (Al2Br6) and strong Lewis base (H2O).
Al2Br6 dissociates readily to give the strong Lewis acid, AlBr3. Regarding the tendency of Al2Br6 to dimerize, it is common for heavier main group halides to exist as aggregates larger than implied by their empirical formulae. Lighter main group halides such as boron tribromide do not show this tendency, in part due to the smaller size of the central atom.
Consistent with its Lewis acidic character, Al2Br6 is hydrolyzed by water with evolution of HBr and formation of Al-OH-Br species. Similarly, it also reacts quickly with alcohols and carboxylic acids, although less vigorously than with water. With simple Lewis bases (L), Al2Br6 forms adducts, such as AlBr3L.
Aluminium tribromide reacts with carbon tetrachloride at 100 °C to form carbon tetrabromide:
- 4 AlBr3 + 3 CCl4 → 4 AlCl3 + 3 CBr4
and with phosgene yields carbonyl bromide and aluminium chlorobromide:[citation needed]
- AlBr3 + COCl2 → COBr2 + AlCl2Br
Al2Br6 is used as a catalyst for the Friedel-Crafts alkylation reaction.[3] Related Lewis acid-promoted reactions include as epoxide ring openings and decomplexation of dienes from iron carbonyls. It is a stronger Lewis acid than the more common Al2Cl6.
Safety[edit]
Aluminium tribromide is a highly reactive material.[5]
References[edit]
- ^ a b c d e f Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.45. ISBN 1-4398-5511-0.
- ^ Troyanov, Sergey I.; Krahl, Thoralf; Kemnitz, Erhard (2004). “Crystal structures of GaX3(X= Cl, Br, I) and AlI3“. Zeitschrift für Kristallographie. 219 (2–2004): 88–92. doi:10.1524/zkri.219.2.88.26320. S2CID 101603507.
- ^ a b Paquette, Leo A. (2001). Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X. hdl:10261/236866. ISBN 0471936235.
- ^ Dohmeier, Carsten; Loos, Dagmar; Schnöckel, Hansgeorg (1996). “Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions”. Angewandte Chemie International Edition in English. 35 (2): 129. doi:10.1002/anie.199601291.
- ^ Renfew, Malcom M. (1991). “Hazardous laboratory chemicals: Disposal guide (Armour, M.A.)”. Journal of Chemical Education. 68 (9): A232. Bibcode:1991JChEd..68Q.232R. doi:10.1021/ed068pA232.2.
Содержание
- Бромид алюминия
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
- Опасность для здоровья
- Бромид алюминия
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
- Опасность для здоровья
- Бромид алюминия, химические свойства, получение
- Взаимодействие алюминия с простыми веществами
- с кислородом
- с галогенами
- с серой
- с углеродом
- Видео
- Получение
- Опасность для здоровья
- Бромид алюминия
- Содержание
- Структура [ править ]
- Синтез [ править ]
- Реакции [ править ]
- Безопасность [ править ]
Бромид алюминия
| Бромид алюминия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Бромид алюминия |
| Химическая формула | AlBr3, Al2Br6 |
| Эмпирическая формула | AlBr3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205 [1] г/см³ |
| Термические свойства | |
| Температура плавления | 97,5 [1] °C |
| Температура кипения | 255 [2] °C |
| Энтальпия образования (ст. усл.) | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) [3] кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| Рег. номер EINECS | 231-779-7 |
Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула  . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
Содержание
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома [4] .
Координационное число алюминия в молекуле бромида равно 4 [5] .
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль [6] .
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O [7] . Хорошо растворимо в воде, спирте, сероуглероде, ацетоне [8] ; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор) [9] .
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:

 При нагревании водного раствора гидролиз можно провести полностью:
При нагревании водного раствора гидролиз можно провести полностью: 
- Вступает в реакцию со щелочами:


- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения [10] :

- При высокой температуре разлагается:
 При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия [2] :
При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия [2] : 
- С гидридом лития образует алюмогидрид:

- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы доноры (на этом, в частности, основано его применение в органическом синтезе) [7] :

Получение
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании:

Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:

Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий [11] .
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
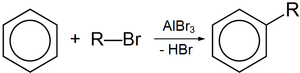
Соединение может выступать катализатором в реакции изомеризации бромалканов, например [12] :

Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом [13] :

Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно) [14] .
Источник
Бромид алюминия

| Бромид алюминия | ||
|---|---|---|
|
||
| Систематическое наименование |
Бромид алюминия | |
| Хим. формула | AlBr3, Al2Br6 | |
| Рац. формула | AlBr3 | |
| Состояние | твёрдое | |
| Молярная масса | 266,69 г/моль | |
| Плотность | 3,205 | |
| Температура | ||
| • плавления | 97,5 | |
| • кипения | 255 °C | |
| Энтальпия | ||
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
|
| Кристаллическая структура | моноклинная | |
| Рег. номер CAS | 7727-15-3 | |
| PubChem | 24409 | |
| Рег. номер EINECS | 231-779-7 | |
| SMILES | ||
| RTECS | BD0350000 | |
| Номер ООН | 1725 | |
| ChemSpider | 22818 | |
| Пиктограммы ECB |    |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al +3 Br 3 −1 . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
Содержание

Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
AlBr3 + 4 H2O ⇆ [Al(H2O)4] 3+ + 3Br − [Al(H2O)4] 3+ + H2O ⇆ [Al(H2O)3(OH)] 2+ + H3O + При нагревании водного раствора гидролиз можно провести полностью: AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
- Вступает в реакцию со щелочами:
AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
AlBr3 + H2S = AlBr3 ⋅ H2S
- При высокой температуре разлагается:
2 AlBr3 = 2 Al + 3 Br2 При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия: AlBr3 + 2 Al ⇆ 3 AlBr
- С гидридом лития образует алюмогидрид:
AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе):
AlBr3 + C2H5Br → [C2H5] + [AlBr4] −
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
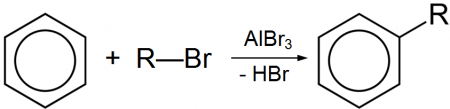
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
Источник
Бромид алюминия, химические свойства, получение
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
 — сульфид алюминия
— сульфид алюминия
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.

Видео
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
Источник
Бромид алюминия
Бромид алюминия (III)
- 7727-15-3
 Y
Y - 7784-11-4 гексагидрат
 Y
Y
- 22818
 Y
Y - 9040513 геми ( ацетилбромид )
 Y
Y - 9499890 этантиол
 Y
Y
- 24409
- 11062022 тертикис (тетрахлорметан)
- 10865226 геми ( ацетилбромид )
- 11324936 этантиол
- 6093832 трис (пиридин)
- IY20HBK5LK
 Y
Y
AlBr 3
Al 2 Br 6
AlBr 3 · 6H 2 O (гексагидрат) Молярная масса 266,694 г / моль (безводный)
374,785 г / моль (гексагидрат) [1] Внешность порошок от белого до бледно-желтого [1] Запах острый Плотность 3,2 г / см 3 (безводный)
2,54 г / см 3 (гексагидрат) [1] Температура плавления 97,5 ° C (безводный)
93 ° C (гексагидрат) [1] Точка кипения 255 (безводный) [1] очень растворим, частично гидролизуется, на что указывает дымящийся раствор и, возможно, появление белого осадка Растворимость мало растворим в метаноле , диэтиловом эфире , ацетоне Структура [2] -572,5 кДж / моль Опасности Пиктограммы GHS 
 Сигнальное слово GHS Опасность
Сигнальное слово GHS Опасность

Смертельная доза или концентрация (LD, LC): 1598 мг / кг (перорально, крыса) Родственные соединения  Y проверить ( что есть ?)
Y проверить ( что есть ?)  Y
Y  N Ссылки на инфобоксы
N Ссылки на инфобоксы
Бромид алюминия — это любое химическое соединение с эмпирической формулой AlBr x . Трибромид алюминия — наиболее распространенная форма бромида алюминия. [3] Это бесцветное, сублимируемое гигроскопичное твердое вещество; следовательно, старые образцы имеют тенденцию к гидратации, в основном в виде гексагидрата трибромида алюминия (AlBr 3 · 6H 2 O).
Содержание
Структура [ править ]
Димерная форма трибромида алюминия (Al 2 Br 6 ) преобладает в твердом состоянии, в растворах в некоординирующих растворителях (например, CS 2 ), в расплаве и в газовой фазе. Только при высоких температурах эти димеры распадаются на мономеры:
Al 2 Br 6 → 2 AlBr 3 ΔH ° dis = 59 кДж / моль
Видовой монобромид алюминия образуется в результате реакции HBr с металлическим Al при высокой температуре. Он диспропорционирует вблизи комнатной температуры:
Эта реакция обратная при температуре выше 1000 ° C. Монобромид алюминия кристаллографически охарактеризован в виде тетрамерного аддукта Al 4 Br 4 (NEt 3 ) 4 (Et = C 2 H 5 ). Этот вид электронно связан с циклобутаном. Теория предполагает, что двухатомный монобромид алюминия конденсируется с образованием димера, а затем тетраэдрического кластера Al 4 Br 4 , родственного аналогичному соединению бора. [4]
Al 2 Br 6 состоит из двух тетраэдров AlBr 4 , имеющих общее ребро. Молекулярная симметрия является D 2h .
Мономер AlBr 3 , наблюдаемый только в паре, можно описать как тригонально-планарную точечную группу D 3h . Атомная гибридизация алюминия часто описывается как sp 2 . В Br — Al — Br валентные углы составляют 120 °.
Синтез [ править ]
Безусловно, наиболее распространенной формой бромида алюминия является Al 2 Br 6 . Этот вид существует в виде гигроскопичного бесцветного твердого вещества при стандартных условиях. Типичные нечистые образцы имеют желтоватый или даже красно-коричневый цвет из-за присутствия железосодержащих примесей. Его получают реакцией HBr с Al:
В качестве альтернативы также происходит прямое бромирование:
Реакции [ править ]
Al 2 Br 6 легко диссоциирует с образованием сильной кислоты Льюиса , AlBr 3 . Что касается тенденции Al 2 Br 6 к димеризации , более тяжелые галогениды основной группы обычно существуют в виде агрегатов большего размера, чем подразумевается их эмпирическими формулами. Галогениды более легкой основной группы, такие как трибромид бора , не демонстрируют этой тенденции, отчасти из-за меньшего размера центрального атома.
В соответствии со своим кислотным характером по Льюису, вода гидролизует Al 2 Br 6 с выделением HBr и образованием частиц Al-OH-Br. Точно так же он также быстро реагирует со спиртами и карбоновыми кислотами, хотя и менее активно, чем с водой. С простыми основаниями Льюиса (L) Al 2 Br 6 образует аддукты , такие как AlBr 3 L.
Трибромид алюминия реагирует с четыреххлористым углеродом при 100 ° C с образованием тетрабромида углерода :
Al 2 Br 6 используют в качестве катализатора для реакции алкилирования Фриделя-Крафтса . [3] Родственные реакции, инициируемые кислотой Льюиса, включают раскрытие эпоксидного цикла и разложение диенов из карбонилов железа. Это более сильная кислота Льюиса, чем более распространенный Al 2 Cl 6 .
Безопасность [ править ]
Трибромид алюминия является высокореактивным материалом. [5]
Источник
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.


![{displaystyle {mathsf {AlBr_{3}+4H_{2}Oleftrightarrows [Al(H_{2}O)_{4}]^{3+}+3Br^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56ece160e189b81c316065f55ef35c5d66935831)
![{mathsf {[Al(H_{2}O)_{4}]^{{3+}}+H_{2}Oleftrightarrows [Al(H_{2}O)_{3}(OH)]^{{2+}}+H_{3}O^{+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b99b79a01eb414967bc983c36ed9faf716e34a2)


![{displaystyle {mathsf {AlBr_{3}+4NaOH=Na[Al(OH)_{4}]+3NaBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc4b8f80759f0185464f1043db59af5a38218f83)



![{displaystyle {mathsf {AlBr_{3}+4LiH=Li[AlH_{4}]+3LiBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fd7d067c28e0b04f084643bd7a1ebb6373a3cb5)
![{displaystyle {mathsf {AlBr_{3}+C_{2}H_{5}Br}}rightarrow {mathsf {[C_{2}H_{5}]^{+}[AlBr_{4}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59849b7904fdaa3af64746a63e33fea92d389176)