Дефе́кт ма́ссы (англ. mass defect) ΔM — разность между суммой масс отдельных составляющих какой-либо связанной физической системы взаимодействующих объектов (тел, частиц), находящихся в свободном состоянии, и массой само́й этой системы. В таком определении знак дефекта масс положителен; иногда дефект масс определяют как разность между массой системы и суммой масс компонент, в этом случае знак отрицателен[1]. С точностью до коэффициента c2 дефект массы равен энергии связи Eсв системы:
Так, дефект масс атомного ядра — связанной системы из Z протонов и N нейтронов — равен
где mp и mn — массы свободных протона и нейтрона, соответственно,
- M(Z, N) — масса ядра.
Например, масса Md дейтрона (ядра атома дейтерия, тяжёлого изотопа водорода 2H), состоящего из одного протона и одного нейтрона, равна 2,013 553 а.е.м.[2] (1875,613 МэВ/c2 в энергетическом эквиваленте)[3]. Масса свободного протона равна 1,007 276 а.е.м.[4] (938,272 МэВ/c2)[5], нейтрона — 1,008 665 а.е.м.[6] (939,565 МэВ/c2)[7]. Дефект масс будет равен
- ΔMd = mp + mn − Md = 0,002 388 а.е.м. = 2,224 МэВ/c2.
В результате слияния одного моля протонов (масса 1,007 276 г) и одного моля нейтронов (масса 1,008 665 г) образуется 1 моль дейтронов массой 2,013 553 г, что на 0,002 388 г меньше, чем сумма масс исходных компонентов. Указанный дефект массы выделится как энергия, равная энергии связи одного дейтрона (Eсв(d) = 2,224 МэВ), умноженной на число Авогадро (количество дейтронов в одном моле): 2,224 МэВ · NA = 214,6 ГДж (эквивалентно теплоте сгорания 5 тонн бензина).
Удельная энергия связи в зависимости от массового числа для бета-стабильных нуклидов
Для атомных ядер понятие дефекта массы тесно связано с понятием упаковочного коэффициента (упаковочного множителя) f или удельной энергии связи εсв, т.е. дефекта массы или энергии связи, приходящихся на один нуклон:
- f = ΔM / A,
- εсв = Eсв / A,
где A = Z + N — массовое число, общее количество нуклонов (протонов и нейтронов) в ядре. Удельная энергия связи и упаковочный коэффициент характеризуют устойчивость ядра.
Можно определить также относительный дефект массы системы — безразмерную величину, представляющую собой отношение дефекта массы ΔM к сумме масс Mi компонентов системы: Δμ = ΔM/ΣMi. Типичные значения относительного дефекта массы для атомных ядер средней массы составляют 0,008—0,009, для атомов (без учёта дефекта массы ядра) ~10−8…10−6. Астрономические объекты могут иметь существенный гравитационный дефект масс. Так, для звезды, близкой по массе к Солнцу, относительный гравитационный дефект массы составляет ~10−6, для белого карлика ~10−3…10−4, для нейтронной звезды ~10−1. Наибольший относительный дефект масс среди гравитационно связанных объектов характерен для чёрных дыр; он может достигать десятков процентов[1]. Так, при слиянии двух чёрных дыр суммарной массой 65 M⊙, которое вызвало гравитационно-волновой всплеск GW150914, зафиксированный 14 сентября 2015 года, образовалась чёрная дыра массой 62 M⊙; дефект массы в 3 M⊙ был излучён в форме гравитационных волн[8].
Дефект массы всегда возникает в результате превращения энергии связи в энергию излучения (электромагнитного, нейтринного, гравитационного), покидающего образовавшуюся связанную систему[1].
См. также[править | править код]
- Эквивалентность массы и энергии
Примечания[править | править код]
- ↑ 1 2 3 Хлопов М. Ю. Дефект массы // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1: Ааронова — Бома эффект — Длинные линии. — С. 591. — 707 с. — 100 000 экз.
- ↑ Deuteron mass in u // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018. (Tiesinga E. et al. CODATA recommended values of the fundamental physical constants: 2018 (англ.) // Reviews of Modern Physics. — 2021. — Vol. 93, no. 2. — P. 025010-1—025010-63. — doi:10.1103/RevModPhys.93.025010. [исправить])
- ↑ Deuteron mass energy equivalent in MeV // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018.
- ↑ Proton mass in u // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018.
- ↑ Proton mass energy equivalent in MeV // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018.
- ↑ Neutron mass in u // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018.
- ↑ Proton mass energy equivalent in MeV // The NIST Reference on Constants, Units, and Uncertainty. CODATA Internationally recommended 2018 values of the Fundamental Physical Constants. — National Institute of Standarts and Technologies, 2018.
- ↑ B. P. Abbott et al. (LIGO Scientific Collaboration and Virgo Collaboration). Observation of Gravitational Waves from a Binary Black Hole Merger (англ.) // Physical Review Letters. — 2016. — Vol. 116, no. 6. — P. 061102. — doi:10.1103/PhysRevLett.116.061102.
Ссылки[править | править код]
- Астронет. Масса и энергия связи ядра
- Сивухин Д. В. Общий курс физики, т.5, ч. 2
Опытным путём было доказано, что масса ядра оказывается меньше, чем масса протонов и нейтронов, из которых состоит ядро. Разница между этими массами называется дефектом массы ядра.
Дефект массы ядра (
Δm
) — это разница между суммарной массой свободных нуклонов, из которых состоит ядро, и массой ядра.
Почему же масса нуклонов, связанных ядерными силами в ядро, оказывается меньше массы этих же нуклонов в свободном состоянии? Оказывается, что масса и энергия взаимосвязаны.
Всякое тело массой m обладает энергией, которая называется энергией покоя (
E0
):
, где c — скорость света в вакууме.
Впервые соотношение между энергией и массой вывел Альберт Эйнштейн, поэтому это выражение и получило название «уравнение Эйнштейна».
Уменьшение энергии покоя нуклонов в ядре вызвано наличием ядерных сил, которые удерживают протоны и нейтроны в ядре. Работа, которую необходимо совершить для разрыва ядерных сил и разъединения нуклонов, равна энергии, которая связывает нуклоны вместе. Эта энергия называется энергией связи (
Eсв
) ядра.
Энергия связи и дефект массы ядра связаны между собой уравнением Эйнштейна:
Удельной энергией связи ядра называют энергию связи, приходящуюся на (1) нуклон:
Удельная энергия равна средней энергии, необходимой для отрыва (1) нуклона от ядра.
Вычисления показали, что наибольшей удельной энергией связи обладают элементы, находящиеся в центре Периодической системы химических элементов. С увеличением порядкового номера начинает уменьшаться удельная энергия связи. Именно поэтому ядра элементов с порядковым номером больше (83) являются радиоактивными. Благодаря небольшой удельной энергии связи они способны самопроизвольно распадаться.
Единицы измерения энергии
В ядерной физике принято измерять энергию в мегаэлектронвольтах ((1) МэВ):
(1) МэВ (=)
106
эВ
≈1,6⋅10−13
Дж.
Для вычисления энергии связи удобно пользоваться переводным коэффициентом для массы и энергии.
Дефекту массы в (1) а. е. м. соответствует энергия, равная
кг
⋅(3⋅108
м/с
)2≈1,49⋅10−10
Дж
=931,5
МэВ.
Обрати внимание!
Для выражения изменения энергии системы в мегаэлектронвольтах нужно
изменение массы системы в атомных единицах массы умножить на переводной коэффициент (931,5) МэВ/а. е. м.
(1) а. е. м. (=) (931,5) МэВ.
Дефект массы

4.4
Средняя оценка: 4.4
Всего получено оценок: 120.
4.4
Средняя оценка: 4.4
Всего получено оценок: 120.
Энергия, излучаемая звездами, выделяется в ходе термоядерных реакций, идущих в их центрах. Ключевую роль в образовании энергии при этом играет дефект масс. Рассмотрим это понятие более подробно.
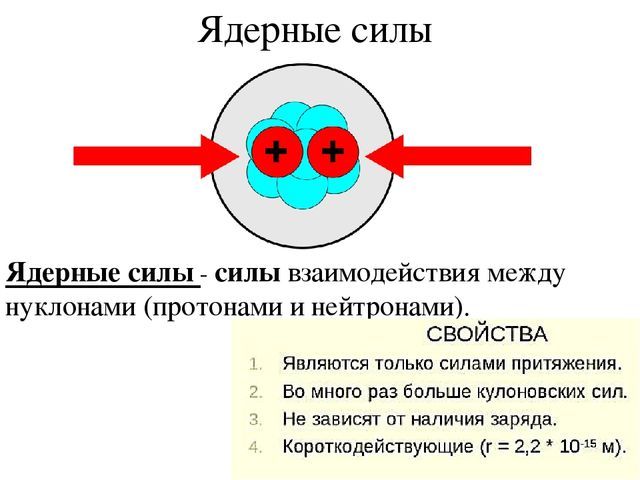
Ядерные силы
Заряд атомного ядра равен номеру элемента в таблице Менделеева и складывается из зарядов протонов, входящих в его состав. Каждый протон имеет одинаковый положительный заряд, равный по модулю заряду электрона. Одноименные заряды отталкиваются, протоны должны разлетаться в разные стороны, все вещество (кроме водорода, ядро которого состоит из одного протона) должно очень быстро распадаться. Однако, многие атомы являются стабильными, несмотря на то, что в них больше одного протона.
Следовательно, внутри ядра существуют некоторые силы, более мощные, чем кулоновские силы отталкивания. Эти силы называют ядерными силами. Их природа отличается как от природы электрических сил, так и от природы гравитационных. Взаимодействие, которым они обеспечиваются, называется Сильным, поскольку это самые мощные силы в Природе.
Особенность Сильного взаимодействия в том, что оно короткодействующее. Ядерные силы действуют лишь на коротких расстояниях, не превышающих размеров атомных ядер. Происходит это потому, что, в отличие от кулоновских сил, передаваемых безмассовыми фотонами, переносчики Сильного взаимодействия имеют массу. Они действуют на протоны и нейтроны (общее название – нуклоны), удерживая их на близком расстоянии в ядрах атомов.
Энергия связи. Дефект масс.
Для расщепления ядра на отдельные нуклоны требуется затратить энергию, которая называется энергией связи ядра. Количественная теория ядерных сил в настоящее время не разработана, однако, энергию связи можно оценить, исходя из формулы связи массы и энергии:
$$Е=mc^2$$
Прямые измерения показывают, что для легких элементов масса покоя ядра всегда меньше, чем массы покоя входящих в него частиц:
$$М_я < Zm_p + (A-Z)m_n,$$
где:
- $М_я$ – масса покоя ядра;
- $m_p$ – масса покоя протона;
- $m_n$ – масса покоя нейтрона;
- $Z$ – число протонов в ядре (порядковый номер элемента);
- $А$ – общее число нуклонов в ядре (массовое число)
Разница между массой ядра и входящих в него нуклонов называется дефектом массы ядра. Формулу дефекта массы можно записать следующим образом:
$$ΔМ = Zm_p+(A-Z)m_n -М_я$$
Для легких элементов дефект масс положителен, ядро оказывается легче, чем входящие в него частицы. Для тяжелых элементов это не так, ядерных сил едва хватает, чтобы удерживать вместе большое число протонов, и поэтому ядра с большими порядковыми номерами самопроизвольно распадаются с выделением энергии. Для «цементирования» атомного ядра можно было бы добавить в ядро нейтроны, которые не обладают зарядом, однако, нейтроны также нестабильны, и распадаются на протон и электрон.
Дефект масс при образовании ядра выделяется в виде γ-квантов с энергией:
$$Е_{св}=ΔМc^2 = (Zm_p+(A-Z)m_n -М_я)c^2$$
Именно благодаря дефекту масс ядерное оружие обладает такой огромной разрушительной силой. При взрыве термоядерной бомбы протекает реакция образования гелия из дейтерия и трития. При образовании каждого грамма гелия выделяется энергия порядка $4.5×10^{11}$ Дж. Этой энергии хватит, чтобы нагреть от нуля до кипения более 1000 тонн воды !
Что мы узнали?
Протоны и нейтроны в ядрах удерживаются силами ядерного взаимодействия. Это самые мощные силы в Природе. Масса легкого ядра, как правило, меньше суммы масс отдельных входящих в него частиц. Разница в массе называется дефектом массы ядра. При образовании ядра дефект массы выделяется в виде энергии. Именно эта энергия поддерживает «горение» звезд, именно эта энергия выделяется при ядерных взрывах.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Павел Федин
6/10
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 120.
А какая ваша оценка?
7
Лекция 18. Элементы
физики атомного ядра
[1] гл. 32
План лекции
-
Атомное ядро.
Дефект массы, энергия связи ядра. -
Радиоактивное
излучение и его виды. Закон радиоактивного
распада. -
Законы сохранения
при радиоактивных распадах и ядерных
реакциях.
Состав атомного
ядра
Ядерная физика
– наука о строении, свойствах и превращениях
атомных ядер. В 1911 году Э. Резерфорд
установил в опытах по рассеянию -частиц
при их прохождении через вещество, что
нейтральный атом состоит из компактного
положительно заряженного ядра и
отрицательного электронного облака.
В. Гейзенберг и Д.Д. Иваненко (независимо)
высказали гипотезу о том, что ядро
состоит из протонов и нейтронов.
Атомное ядро
– центральная массивная часть атома,
состоящая из протонов и нейтронов,
которые получили общее название нуклонов.
В ядре сосредоточена почти вся масса
атома (более 99,95%). Размеры ядер порядка
10-13
– 10-12
см и зависят от числа нуклонов в ядре.
Плотность ядерного вещества как для
легких, так и для тяжелых ядер почти
одинакова и составляет около 1017
кг/м3,
т.е. 1 см3
ядерного вещества весил бы 100 млн. т.
Ядра имеют положительный электрический
заряд, равный абсолютной величине
суммарного заряда электронов в атоме.
Протон
(символ p) –
элементарная частица, ядро атома
водорода. Протон обладает положительным
зарядом, равным по величине заряду
электрона. Масса протона mp
= 1,6726 10-27
кг = 1836 me
, где me
– масса электрона.
В ядерной физике
принято выражать массы в атомных единицах
массы:
1 а.е.м. = 1,65976 10-27
кг.
Следовательно,
масса протона, выраженная в а.е.м., равна
mp
= 1,0075957 а.е.м.
Число протонов в
ядре называется зарядовым
числом
Z. Оно равно
атомному номеру данного элемента и,
следовательно, определяет место элемента
в периодической системе элементов
Менделеева.
Нейтрон
(символ n) –
элементарная частица, не обладающая
электрическим зарядом, масса которой
незначительно больше массы протона.
Масса нейтрона mn
= 1,675 10-27
кг = 1,008982 а.е.м. Число нейтронов в ядре
обозначается N.
Суммарное число
протонов и нейтронов в ядре (число
нуклонов) называется массовым
числом и
обозначается буквой А,
А = Z + N.
Для обозначения
ядер применяется символ
,
где Х – химический символ элемента.
Изотопы
– разновидности атомов одного и того же
химического элемента, атомные ядра
которых имеют одинаковое число протонов
(Z) и разное число нейтронов (N). Изотопами
называют также ядра таких атомов. Изотопы
занимают одно и то же место в периодической
системе элементов. В качестве примера
приведем изотопы водорода:
.
Понятие о ядерных
силах.
Ядра атомов –
чрезвычайно прочные образования,
несмотря на то, что одноименно заряженные
протоны, находясь на очень малых
расстояниях в атомном ядре, должны с
огромной силой отталкиваться друг от
друга. Следовательно, внутри ядра
действуют чрезвычайно большие силы
притяжения между нуклонами, во много
раз превышающие электрические силы
отталкивания между протонами. Ядерные
силы представляют собой особый вид сил,
это самые сильные из всех известных
взаимодействий в природе.
Исследования
показали, что ядерные силы обладают
следующими свойствами:
-
ядерные силы
притяжения действуют между любыми
нуклонами, независимо от их зарядового
состояния; -
ядерные силы
притяжения являются короткодействующими:
они действуют между любыми двумя
нуклонами на расстоянии между центрами
частиц около 2·10-15
м и резко спадают при увеличении
расстояния (при расстояниях более
3·10-15
м они уже практически равны нулю); -
для ядерных сил
характерна насыщенность, т.е. каждый
нуклон может взаимодействовать только
с ближайшими к нему нуклонами ядра; -
ядерные силы не
являются центральными, т.е. они не
действуют вдоль линии, соединяющей
центры взаимодействующих нуклонов.
В настоящее время
природа ядерных сил изучена не до конца.
Установлено, что они являются так
называемыми обменными силами. Обменные
силы носят квантовый характер и не имеют
аналога в классической физике. Нуклоны
связываются между собой третьей частицей,
которой они постоянно обмениваются. В
1935 г. японский физик Х. Юкава показал,
что нуклоны обмениваются частицами,
масса которых примерно в 250 раз больше
массы электрона. Предсказанные частицы
были обнаружены в 1947 г. английским ученым
С. Пауэллом при изучении космических
лучей и впоследствии названы -мезонами
или пионами.
Взаимные превращения
нейтрона и протона подтверждаются
различными экспериментами.
Дефект масс
атомных ядер. Энергия связи атомного
ядра.
Нуклоны в атомном
ядре связаны между собой ядерными
силами, поэтому, чтобы разделить ядро
на составляющие его отдельные протоны
и нейтроны, необходимо затратить большую
энергию.
Минимальная
энергия, необходимая для разделения
ядра на составляющие его нуклоны,
называется энергией
связи ядра.
Такая же по величине энергия освобождается,
если свободные нейтроны и протоны
соединяются и образуют ядро.
Точные
масс-спектроскопические измерения масс
ядер показали, что масса покоя атомного
ядра меньше суммы масс покоя свободных
нейтронов и протонов, из которых
образовалось ядро. Разность между суммой
масс покоя свободных нуклонов, из которых
образовано ядро, и массой ядра называется
дефектом
массы:
Этой разности масс
m
соответствует энергия связи ядра Есв,
определяемая соотношением Эйнштейна:
или, подставив
выражение для m,
получим:
Энергию связи
обычно выражают в мегаэлектронвольтах
(МэВ). Определим энергию связи,
соответствующую одной атомной единице
массы (,
скорость света в вакууме
):
.
Переведем полученную
величину в электронвольты:
В связи с этим на
практике удобнее пользоваться следующим
выражением для энергии связи:
,
где множитель m
выражен в атомных единицах массы.
Важной характеристикой
ядра служит удельная энергия связи
ядра, т.е. энергия связи, приходящаяся
на нуклон:
.
Чем больше
,
тем сильнее связаны между собой нуклоны.
Рис.1
Зависимость
величины
от массового числа ядра показана на
рисунке 1. Как видно из графика, сильнее
всего связаны нуклоны в ядрах с массовыми
числами порядка 50-60 (Cr-Zn).
Энергия связи для этих ядер достигает
Соседние файлы в папке лекции
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.