Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 октября 2021 года; проверки требуют 2 правки.
Электрохимический эквивалент (устар. электролитический эквивалент) — масса вещества, которая должна выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества заряда. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Законы Фарадея[править | править код]
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
,
где 


Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
,
где 

,
где 

.
Таблица значений электрохимических эквивалентов[править | править код]
| Элемент | молярная масса  (г/моль) (г/моль)
|
изменение валентности z |
 (мкмоль/кулон) |
электрохимический эквивалент (мг/кулон) |
электрохимический эквивалент (г/Ампер-час) |
пример применения |
|---|---|---|---|---|---|---|
| Водород | 1,0079 | 1 ↔ 0 | 10,364 | 0,0104 | 0,0376 | электролиз воды |
| Кислород | 15,999 | 2 ↔ 0 | 5,1821 | 0,0829 | 0,298 | |
| Фтор | 18,998 | 1 ↔ 0 | 10,364 | 0,197 | 0,709 | производство фтора |
| Натрий | 22,990 | 1 ↔ 0 | 10,364 | 0,238 | 0,858 | производство натрия |
| Алюминий | 26,981 | 3 ↔ 0 | 3,4548 | 0,0932 | 0,336 | производство алюминия |
| Хлор | 35,451 | 1 ↔ 0 | 10,364 | 0,367 | 1,32 | электролиз хлорида натрия[en] |
| Хром | 51,996 | 6 ↔ 3 или 3 ↔ 0 | 3,4548 | 0,180 | 0,647 | |
| Хром | 51,996 | 6 ↔ 0 | 1,7274 | 0,0898 | 0,323 | |
| Марганец | 54,938 | 4 ↔ 3 или 3 ↔ 2 | 10,364 | – | – | щелочной элемент |
| Марганец | 54,938 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,285 | 1,02 | |
| Марганец | 54,938 | 7 ↔ 4 или 3 ↔ 0 | 3,4548 | 0,190 | 0,683 | |
| Марганец | 54,938 | 7 ↔ 0 | 1,4806 | 0,0813 | 0,293 | |
| Железо | 55,845 | 3 ↔ 2 | 10,364 | – | – | |
| Железо | 55,845 | 2 ↔ 0 | 5,1821 | 0,289 | 1,04 | |
| Железо | 55,845 | 3 ↔ 0 | 3,4548 | 0,193 | 0,695 | |
| Никель | 58,693 | 2 ↔ 0 | 5,1821 | 0,304 | 1,09 | |
| Кобальт | 58,933 | 2 ↔ 0 | 5,1821 | 0,305 | 1,10 | |
| Медь | 63,546 | 2 ↔ 1 или 1 ↔ 0 | 10,364 | 0,659 | 2,37 | |
| Медь | 63,546 | 2 ↔ 0 | 5,1821 | 0,329 | 1,19 | рафинирование меди[de] |
| Цинк | 65,409 | 2 ↔ 0 | 5,1821 | 0,339 | 1,22 | |
| Родий | 102,91 | 3 ↔ 0 | 3,4548 | 0,356 | 1,28 | |
| Палладий | 106,42 | 2 ↔ 0 | 5,1821 | 0,552 | 1,99 | |
| Серебро | 107,87 | 1 ↔ 0 | 10,364 | 1,12 | 4,02 | |
| Кадмий | 112,41 | 2 ↔ 0 | 5,1821 | 0,583 | 2,10 | |
| Олово | 118,71 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,615 | 2,21 | |
| Олово | 118,71 | 4 ↔ 0 | 2,5911 | 0,308 | 1,11 | |
| Платина | 195,08 | 2 ↔ 0 | 5,1821 | 1,01 | 3,64 | |
| Золото | 196,97 | 1 ↔ 0 | 10,364 | 2,04 | 7,35 | Au(I) |
| Золото | 196,97 | 3 ↔ 0 | 3,4548 | 0,680 | 2,45 | |
| Свинец | 207,2 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 1,07 | 3,87 | свинцово-кислотный аккумулятор |
| Свинец | 207,2 | 4 ↔ 0 | 2,5911 | 0,537 | 1,93 |
Примечания[править | править код]
- ↑ Кистяковский В. А. Электрохимический эквивалент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Петрий, О. А. Эквивалент электрохимический // Краткая химическая энциклопедия / гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия. — Т. 5: Т−Я. — С. 979.
Тип 24 № 2200 

i
Найдите электрохимические эквиваленты одновалентной и двухвалентной меди.
Спрятать решение
Решение.
Электрохимический эквивалент находим по формуле
Для одновалентной меди:
Для двухвалентной меди:
Ответ: 6,6 · 10-7 кг/Кл; 3,3 · 10-7 кг/Кл.
Источник: Гельфгат И. М. Сборник задач по физике для 10 класса, Х.: «Гимназия», 2001 (№ 14.27)
Перейти к контенту
Условие задачи:
Электрохимический эквивалент меди 3,3·10-7 кг/Кл. Сколько меди выделится на электроде при непрерывной работе электролитической ванны в течение 1 ч 40 мин с постоянным током 100 А?
Задача №7.3.26 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(k= 3,3 cdot 10^{-7}) кг/Кл, (t=1 ;ч ; 40 ; мин), (I=400) А, (m-?)
Решение задачи:
Чтобы найти массу выделившейся меди, воспользуемся первым законом Фарадея для электролиза:
[m = kIt]
Эта задача решается в одну формулу, поэтому нам осталось только правильно перевести все данные в условии величины в систему СИ, подставить в формулу и посчитать ответ:
[m = 3,3 cdot {10^{ – 7}} cdot 100 cdot 6000 = 0,198;кг = 198;г]
Ответ: 198 г.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
7.3.25 Определить массу меди, выделившейся из раствора медного купороса за 100 с, если сила тока
7.3.27 К источнику с ЭДС 200 В и внутренним сопротивлением 2 Ом подсоединены последовательно
7.4.1 По проводнику сопротивлением 20 Ом за 5 мин прошло количество электричества 300 Кл
( 4 оценки, среднее 4 из 5 )
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея ![]()
Решение:![]()
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка ![]()
Решение:![]()
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея![]()
отсюда![]()
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.![]()
Следовательно, элементарный заряд![]()
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент ![]() . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
. Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем![]()
отсюда электрохимический эквивалент золота![]()
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра ![]()
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ![]()
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля ![]() , его плотность
, его плотность ![]()
Решение:![]()
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди ![]() .
.
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку![]()
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра ![]() .
.
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения![]()
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность ![]() .
.
Решение:
Толщина слоя![]()
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда ![]() . Молярные массы железа и хлора
. Молярные массы железа и хлора ![]() .
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне![]()
во второй ванне![]()
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора![]()
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:![]()
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля ![]() . При каком напряжении производится электролиз?
. При каком напряжении производится электролиз?
Решение:![]()
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди ![]() .
.
Решение:
К.п.д. установки![]()
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда![]()
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди ![]() .
.
Решение: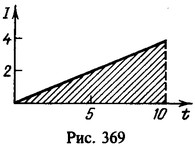 Средний ток
Средний ток![]()
Заряд, протекший через раствор,![]()
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,![]()
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди ![]() .
.
Решение:![]()
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода ![]() .
.
Решение:![]()
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение:![]()
Т![]() еория.
еория.
Рабочая формула
![]()
Оборудование:
весы с
разновесом, амперметр, часы, электроплитка,
выпрямитель, реостат, рубильник (ключ),
медные электроды (2 шт.) со вставкой,
соединительные провода, электролитическая
ванна с раствором медного купороса.
Схема цепи:
Таблица:
|
Масса катода |
Масса катода |
Масса отложившейся |
Время пропускания |
Величина силы |
Электрохимический |
Электрохимический |
Относительная
|
|
0.33*10-6 |
Расчеты:
m
= m2
– m1
k
=
![]()
![]() =
=
Контрольные
вопросы.
-
Нужно ли опыт
проделать снова, если электролитическая
ванна была включена так, что взвешенная
пластинка оказалась не катодом, а
анодом? Как следует поступить в этом
случае? -
Изменяется ли при
электролизе концентрация раствора
медного купороса, если анодом служит
графит? Если анодом служит медь? -
Изменяется
ли при электролизе величина силы тока? -
Трамвайная линия
питается постоянным током, причем
воздушный провод присоединен к
положительному полюсу генератора, а
рельсы к отрицательному. Почему не
наоборот?
12. Определение ускорения свободного падения с
ПОМОЩЬЮ
МАТЕМАТИЧЕСКОГО МАЯТНИКА.
Теория.
Рабочая
формула
![]()
Оборудование:
штатив с держателем, шарик, подвешенный
на нити длиной около 1м, пробка,
измерительная лента или метровая
линейка, штангенциркуль, секундомер.
Таблица:
|
№ опыта |
Длина маятника, |
Число полных |
Время полных |
Период полного |
Ускорение |
Относительная |
|
1. |
||||||
|
2. |
||||||
|
3. |
Вычисления:
по формуле
![]()
Т=
g1
=
g
2=
g
3=
![]()
= ![]()
=
Контрольные
вопросы
-
Показать на чертеже
силы, заставляющие маятник возвращаться
к прежнему положению. Одинаковы ли эти
силы по величине и направлению при
симметричных положениях маятника? -
Каким будет по
характеру движение маятника? Куда
направлено и каково по величине ускорение
маятника: а) в крайних его положениях;
б) при переходе через среднее положение? -
Наблюдая за
движением маятника, ответить на вопрос:
можно ли считать его движение
равноускоренным? -
Как будет меняться
период колебания ведерка с водой,
подвешенного на длинном шнуре, если из
отверстия в его дне постепенно будет
вытекать вода?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
