Химические знаки позволяют изобразить состав сложного вещества в виде формул.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Химические формулы составляют на основании валентности атомов.
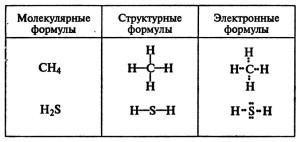
Формулы различают молекулярные, структурные, электронные и другие.
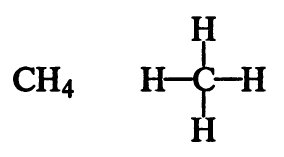
Молекулярные формулы (H3PO4, Fe2O3, Al(OH)3, Na2SO4, O2 и т.д.) показывают качественный (т.е. из каких элементов состоит вещество) и количественный (т.е. сколько атомов каждого элемента имеются в веществе) состав.
Структурные формулы показывают порядок соединения атомов в молекуле, соединяя атомы черточками (одна черточка — одна химическая связь между двумя атомами в молекуле).
Рассмотрим составление структурных формул кислот.
1) Составление структурных формул бескислородных кислот.
При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот атомы водорода связаны с атомами неметалла:
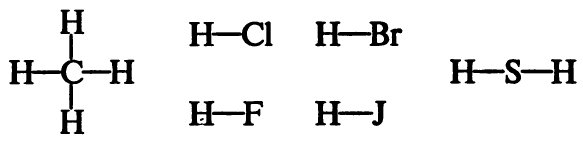
2) Составление структурных формул кислородсодержащих кислот.
При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород связан с центральным атомом посредством атомов кислорода:

Следует помнить, что в кислородсодержащих кислотах центральным атомом всегда будет неметалл (S, P, N и т.д.).
Если, например, требуется составить структурные формулы серной и ортофосфорной кислот, то поступают так:
а) пишут один под другим атомы водорода данной кислоты:

б) затем через атомы кислорода черточками связывают их с центральным атомом:

в) к центральному атому (с учетом валентности) присоединяют остальные атомы кислорода:

Электронные формулы так же, как и структурные, показывают порядок соединения атомов в молекуле (связь показана посредством электронной пары, в которой один электрон принадлежит одному атому, а другой электрон — другому атому):

Итак:
По химической формуле можно:
1) определить, к какому классу соединений относится данное вещество;
2) прогнозировать строение и свойства вещества;
3) вычислять молекулярную массу вещества и молярную массу его; массу его молекулы в а.е.м.; массовые доли (%) элементов вещества.
Химические формулы веществ дают возможность записать результат любой химической реакции в виде уравнения:
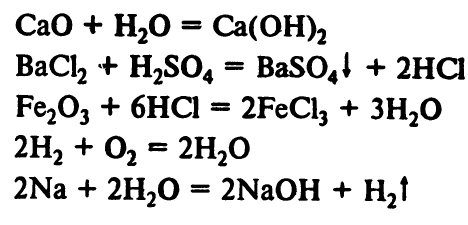
[Справочник школьника. Решение задач по химии. Н.И. Берман]
Электронная формула уксусной кислоты:

Карбоксильную группу СООН можно рассматривать, как комбинацию карбонильной C=O и гидроксильной ОН групп. Атом углерода в карбоксильной группе находится в состоянии sр2-гибридизации. С одним из атомов кислорода также, как в альдегидах, образуется двойная связь за счет орбиталей атома углерода и 2р-орбиталей атома кислорода.

Одна из этих связей образована одной из гибридизованных 8р -орбиталей атома углерода и одной из двух р-орбиталей атома кислорода, это σ-связь. Вторая связь, π-связь, образована негибридизованной р-орбиталью атома углерода и второй р-орбиталью атома кислорода.
С другим атомом кислорода образуется одна σ-связь за счет другой 8р2-орбитали атома углерода и одной р-орбитали атома кислорода. Другая р-орбиталь атома кислорода участвует в образовании σ-связи с атомом водорода (так же, как в гидроксильной группе спиртов).
Электроотрицательность кислорода больше, чем углерода и кислорода. Поэтому в карбоксильной группе электроны, участвующие в, смещены к атомам кислорода.
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Как составлять графические формулы
В графических (структурных) формулах электронная пара, образующая связь между атомами, обозначается черточкой. Графические формулы дают наглядное представление о порядке связей между атомами вещества и особенно широко используются в органической химии. Углеводороды при одинаковом наборе атомов могут сильно отличаться по строению молекул. Эти различия хорошо отражают структурные формулы.
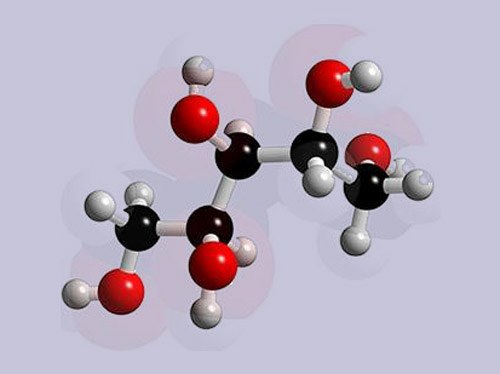
Инструкция
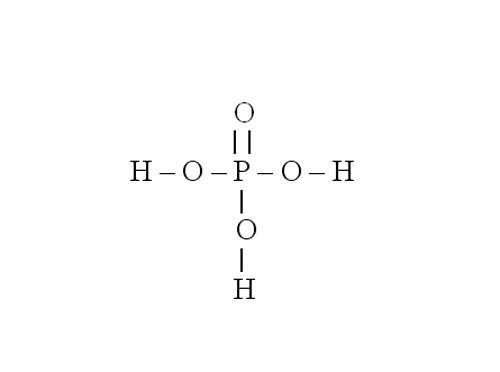
Рассмотрите порядок составления графической формулы на примере фосфата магния. Его химическая формула – Mg3(PO4)2. Сначала нарисуйте структурную формулу для ортофосфорной кислоты, которая образовала эту соль. Для этого определите валентность фосфора в H3PO4. Водород является донором электронов, он одновалентен. Кислород – акцептор электронов, у него валентность равна 2. Значит, четыре молекулы кислорода присоединяют восемь электронов. Три из них дает водород, остальные пять – фосфор. Следовательно, фосфор пятивалентен.
Напишите символ фосфора. От него нужно нарисовать пять черточек, обозначающих электронные связи. Три из них забирают группы –OH. Остаются еще две черточки и один атом кислорода, с которым фосфор и соединяется двойной связью.
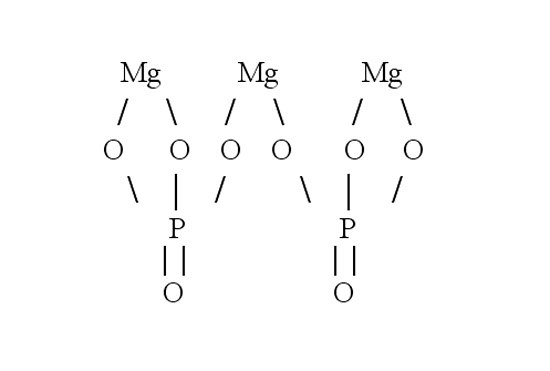
Затем составьте графическую формулу фосфата магния. В молекуле соли три атома металла связаны с двумя кислотными остатками. Запишите в строку три символа, обозначающих магний. Магний двухвалентен – от каждого символа должны отходить по две черточки-связи. В молекуле соли магний вытесняет из кислоты водород и встает на его место. Каждый кислотный остаток забирает по три связи. Чтобы проверить себя, сосчитайте количество атомов в получившейся структурной формуле. Оно должно совпасть с числом атомов в химической формуле.
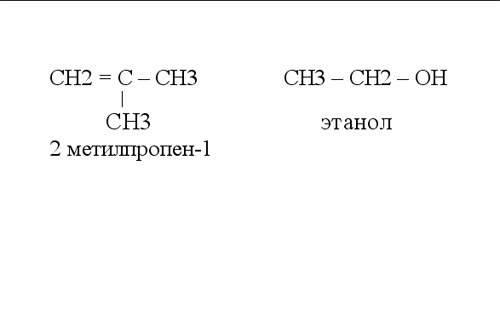
В органической химии при написании графических формул принято не обозначать связь с атомами водорода. На рисунке показаны примеры таких структурных формул органических соединений.
Видео по теме
Источники:
- графические формулы атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Электронные формулы молекул
Для изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа – октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т.е. 2 валентных электрона.
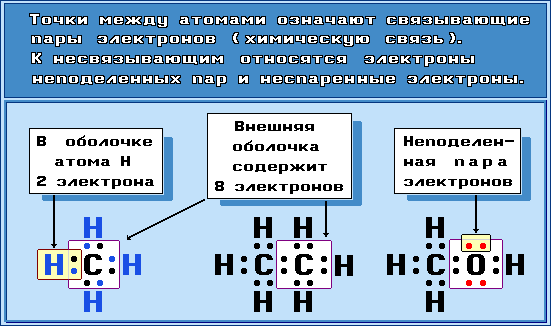
Примеры электронных формул

- Элементы 3-го и последующих периодов, имеющие на внешнем валентном уровне относительно низкие по энергии 3d-орбитали, могут за счет участия этих орбиталей образовывать более 4-х ковалентных связей. В этом случае правило октета теряет свою силу, например, в соединениях фосфора и серы: (C2H5)3P=O,
CH3-SO3H.
Связывающие электронные пары, соответствующие ковалентным связям между атомами, чаще изображают валентной чертой. Несвязывающие электроны (электроны неподеленных пар, неспаренные электроны в свободных радикалах) обозначают точками, формальные заряды в ионах – знаками “+” или “–”:
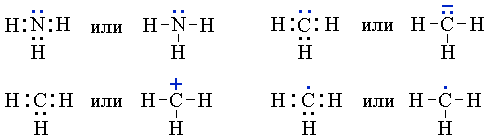
Электронные формулы молекул (а также ионов и свободных радикалов) нашли широкое применение в органической химии. Однако они не отражают пространственного строения молекул. Поэтому в тех случаях, когда необходимо иметь представление не только о распределении электронов, но и о пространственном строении органических соединений, используются атомно-орбитальные модели, которые служат основой для построения стереохимических (пространственных) формул молекул.
