Si (кремний) – элемент с прядковым номером 14 в периодической системе.
Находится в III периоде. Температура плавления: 1410 ℃. Плотность: 2.33 г/см3.
Электронная формула атома кремния:
1s2 2s2 2p6 3s2 3p2
Сокращенная электронная конфигурация Si:
[Ne] 3s2 3p2
Ниже приведена электронно-графическая схема атома кремния

Распределение электронов по энергетическим уровням в атоме Si
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 4

Валентные электроны кремния
Количество валентных электронов в атоме кремния – 4.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
Степени окисления, которые может проявлять кремний: -4, -3, -2, -1, +1, +2, +3, +4
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,912 -
разное
16,901
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Электронное строение атома кремния
Электронное строение нейтрального атома кремния в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме кремния.
Si
+14
2
8
4
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме кремния.
| 3 | ↑↓ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома кремния выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома кремния.
14Si 1s2 2s2 2p6 3s2 3p2
Сокращённая электронная конфигурация атома кремния.
14Si [Ne] 3s2 3p2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома кремния.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| 1 | +½ |
Строение атома кремния


4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
Кремний (Si) – второй по распространённости в земной коре неметалл после кислорода. В природе находится в составе соединений, в чистом виде встречается редко. Строение атома кремния определяет свойства элемента.
Строение
Кремний – 14 элемент периодической таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента. Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт вакантной 3d-орбитали, проявляя степень окисления +4.
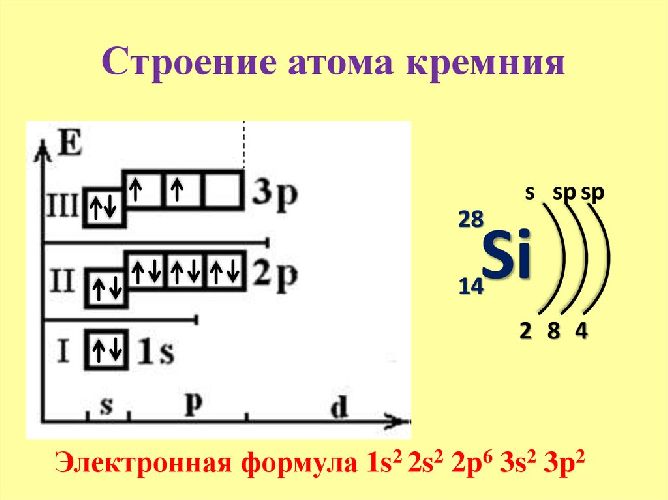
Схема строения атома кремния – 1s22s22p63s23p2 или +14 Si)2)8)4.
Физические свойства
Кремний – твёрдый тёмно-серый элемент с металлическим блеском. Является полупроводником. Имеет одну модификацию, схожую по структуре с аллотропной модификацией углерода – алмазом. Однако связи между атомами кремния не такие прочные, как между атомами углерода.

Кремний встречается в природе в составе песка, глины, кварца, силикатов. Диоксид кремния (SiO2) – песок. Получают кремний путём прокаливания песка с углеродом (углём) или металлами:
- 2C + SiO2 t˚→ Si + 2CO;
- 3SiO2 + 4Al → 3Si + 2Al2O3;
- 2Mg + SiO2 t˚→ Si + 2MgO.
Кремний используют для производства радиоэлементов, фотоэлементов, при производстве жароупорных материалов.
Химические свойства
Благодаря электронному строению кремний способен реагировать с другими элементами, принимая или отдавая электроны. В реакциях с металлами выступает в роли восстановителя, с неметаллами – окислителя. При оптимальных условиях кремний реагирует только с фтором:
Si + 2F2 → SiF4.
При нагревании реагирует:
- с кислородом (600°C) – Si + O2 → SiO2;
- с хлором (400°C) – Si + 2Cl2 → SiCl4;
- с углеродом (2000°C) – Si + C → SiC;
- с азотом (1000°C) – 3Si + 2N2 → Si3N4.
Является окислителем в реакциях с металлами:
Si + 2Mg → Mg2Si.
Может реагировать с концентрированными щелочами с выделением водорода:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Кремний не реагирует непосредственно с водородом и кислотами, кроме плавиковой кислоты HF: Si + 6HF → H2[SiF6] + 2H2 или Si + 4HF → SiF4 + 2H2. Соединение с водородом – силан (SiH4) – получают разложением соли кислотой – Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.

Что мы узнали?
Кремний – неметалл четвёртой группы периодической системы. На внешнем энергетическом уровне атома располагается четыре электрона. Имеет степень окисления +2. В природе находится в соединениях в виде глины, песка, кварца и других веществ. Существует только одна модификация кремния, схожая с алмазом. Получают кремний путём нагревания песка с углём или металлами. Реагирует элемент с неметаллами, металлами и щелочами. С водородом и кислотами (исключение – HF) не реагирует.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Полина Шалаева
4/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
А какая ваша оценка?
Кремний в таблице менделеева занимает 14 место, в 3 периоде.
| Символ | Si |
| Номер | 14 |
| Атомный вес | 28.0840000 |
| Латинское название | Silicium |
| Русское название | Кремний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кремния
Si: 1s2 2s2 2p6 3s2 3p2
Короткая запись:
Si: [Ne]3s2 3p2
Одинаковую электронную конфигурацию имеют
атом кремния и
P+1, S+2, Cl+3
Порядок заполнения оболочек атома кремния (Si) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Кремний имеет 14 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
2 электрона на 3p-подуровне
Степень окисления кремния
Атомы кремния в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кремния
Валентность Si
Атомы кремния в соединениях проявляют валентность IV, III, II, I.
Валентность кремния характеризует способность атома Si к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Si
Квантовые числа определяются последним электроном в конфигурации,
для атома Si эти числа имеют значение N = 3, L = 1, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Si:
Eo = 787 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Si в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
