Загрузить PDF
Загрузить PDF
Если вам задали домашнее задание, в котором требуется найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow придет вам на помощь! Сначала прочтите базовые знания, которые необходимы вам для нахождения эмпирической формулы, а затем просмотрите пример во второй части статьи.
-

1
Узнайте, что такое эмпирическая формула. В химии ЭФ – это самый простой способ описания соединения – по сути это список элементов, образующих соединение с учетом их процентного содержания. Нужно обратить внимание, что эта простейшая формула не описывает порядок атомов в соединении, она просто указывает, из каких элементов оно состоит.[1]
For example:- Соединение, состоящее из 40,92% углерода; 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3H4O3 (пример того, как найти ЭФ этого соединения будет рассмотрен во второй части).
-

2
Усвойте термин ‘процентный состав’. ‘Процентным составом’ называется процентное содержание каждого отдельного атома во всем рассматриваемом соединении. Чтобы найти эмпирическую формулу соединения, необходимо знать процентный состав соединения. Если вы находите эмпирическую формулу в качестве домашнего задания, то проценты, скорее всего, будут даны.
- Чтобы найти процентный состав химического соединения в лаборатории, его подвергают некоторым физическим экспериментам, а затем – количественному анализу. Если вы не находитесь в лаборатории, вам не нужно делать эти эксперименты.
-

3
Имейте в виду, что вам придется иметь дело с грамм-атомами. Грамм-атом – это определенное количество вещества, масса которого равна его атомной массе. Чтобы найти грамм-атом, нужно воспользоваться следующим уравнением: Процентное содержание элемента в соединении делится на атомную массу элемента.[2]
- Допустим, к примеру, что у нас есть соединение, содержащее 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет иметь 40,92 / 12 = 3,41.
-

4
Знайте, как находить атомное соотношение. Работая с соединением, у вас будет получаться больше одного грамм-атома. После нахождения всех грамм-атомов вашего соединения, посмотрите на них. Для того, чтобы найти атомное соотношение, вам нужно будет выбрать наименьшее значение грамм-атома, которые вы вычислили. Затем нужно будет разделить все грамм-атомы на наименьший грамм-атом. Например:
- Допустим вы работаете с соединением, содержащим три грамм-атома: 1,5; 2 и 2,5. Наименьшее из этих чисел – 1,5. Поэтому, чтобы найти соотношение атомов, вы должны разделить все числа на 1,5 и поставить между ними знак отношения :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Следовательно, соотношение атомов равно 1 : 1,33 : 1,66.
-

5
Разберитесь, как переводить значения отношений атомов в целые числа. Записывая эмпирическую формулу, вы должны использовать целые числа. Это значит, что вы не можете использовать числа вроде 1,33. После того, как вы найдете отношение атомов, вам нужно перевести дробные числа (вроде 1,33) в целые (например, 3). Для этого вам нужно найти целое число, умножив на которое каждое число атомного соотношения, вы получите целые числа. Например:
- Попробуйте 2. Умножьте числа атомного соотношения (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не подходит.
- Попробуйте 3. Если вы умножите 1, 1,33 и 1,66 на 3, у вас получится 3, 4 и 5 соответственно. Следовательно, атомное соотношение целых чисел имеет вид 3 : 4 : 5.
-

6
Разберитесь, что значат эти целые числа для эмпирической формулы. Соотношение целых чисел, которое мы только что нашли, подходит для эмпирической формулы. Эти три числа являются маленькими числами, которые записываются под каждой буквой, представляющей отдельный элемент химического соединения. Например, наша рассчитанная эмпирическая формула будет иметь вид:
- X3Y4Z5
Реклама
-

1
Определите процентный состав соединения. Если вы пытаетесь найти эмпирическую формулу для домашней работы, то вам, вероятнее всего, будет дан процентный состав, вам просто нужно знать, как он выглядит. Например:
- Допустим, в задании просят рассмотреть образец витамина C. В него входят 40,92% углерода, 4,58% водорода 54,5% кислорода — это и есть процентный состав.
- 40,92% витамина C состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.
-

2
Найдите значения грамм-атомов в соединении. Как было сказано в части 1, уравнение для нахождения количества грамм-атомов имеет вид: Процентное содержание элемента в соединении (%) деленное на атомную массу элемента. В нашем примере есть углерод, атомная масса которого 12, водород, с атомной массой 1, и кислород, с атомной массой 16.
- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41
-

3
Выясните атомное соотношение. Найдите наименьший грамм-атом из всех вычисленных. В нашем примере – это 3,41 (углерод или кислород – у них одинаковое значение). Затем вы должны разделить все значения грамм-атомов на это число. Соотношение будет выглядеть следующим образом: значение для углерода : значение для водорода : значение для кислорода.
- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение – 1 : 1.34 : 1.
-

4
Переведите соотношение в целые числа. Если ваше атомное соотношение состоит из целых чисел, то вы можете пропустить этот шаг. В нашем примере, однако, нам нужно превратить 1,34 в целое число. Наименьшее число, которое можно умножить числа в атомном соотношении – это 3.
- 1 x 3 = 3 (подходит, так как 3 – целое число).
- 1,34 x 3 = 4 (4 – также целое число).
- 1 x 3 = 3 (и снова, 3 – это целое число).
- Следовательно, полученное соотношение целых чисел имеет вид углерод (C) : водород (H) : кислород (O) = 3 : 4 : 3
-

5
Запишите эмпирическую формулу. Для этого, все что вам нужно – это записать букву каждого компонента, в нашем случае – C для углерода, H для водорода и O для кислорода, с сопутствующими им числами в виде нижних индексов. В нашем примере эмпирическая формула имеет вид:
- C3H4O3
Реклама
Советы
- Молекулярная формула отражает общее количество присутствующих атомов, тогда как эмпирическая отражает наименьшее соотношение между отдельными атомами.
- Если вам нужно найти процентное соотношение в лаборатории, то вы должны будете провести над образцом соединения спектрометрические эксперименты.
Реклама
Об этой статье
Эту страницу просматривали 22 027 раз.
Была ли эта статья полезной?
Download Article
Download Article
If you have been assigned homework where you have to find the empirical formula of a compound, but you have no idea how to get started, never fear! wikiHow is here to help! First, take a look at the basic knowledge you need to have to find the empirical formula, and then walk through an example in Part 2.
-

1
Know what the empirical formula is. In chemistry, the EF is the simplest way to describe a compound—it is basically a list of the elements that make up a compound, organized by percentage. It’s important to note that this simple formula does not describe the arrangement of the atoms within the compound, it simply states which elements compound is made of. For example:[1]
- A compound that is made up of 40.92% Carbon, 4.58% hydrogen, and 54.5% Oxygen would have an empirical formula of C3H4O3 (we will go through an example of how to find the EF of this compound in Part Two).
-

2
Understand the term ‘percent composition’. ‘Percentage composition’ refers to the percent of each individual atom in the whole compound that we are looking at. To find the empirical formula of a compound, we must know the percentage composition of the compound. If you are finding the empirical formula for homework, you will most likely be given the percentages.[2]
- In a chemistry lab, to find the percentage composition, the compound would be examined through some physical experiments and then quantitative analysis. Unless you are in a lab, you will not need to actually do these experiments.
Advertisement
-

3
Be aware that you will be dealing with gram atoms. A gram atom is the specific amount of an element that’s weight in grams equals its atomic mass. To find a gram atom, the equation is: The percent of the element in the compound (%) divided by the element’s atomic mass.[3]
- For example, let’s say that we have a compound that is made up of 40.92% carbon. The atomic mass of carbon is 12 so our equation would be 40.92 / 12 = 3.41.
-

4
Know how to find the atomic ratio.[4]
When you are working with a compound, you will have more than one gram atom to calculate. After you have found all of the gram atoms in your compound, look at all of them. To find the atomic ratio, you will have to pick out the gram atom that is the smallest out of all of the gram atoms that you calculated. You will then divide all of your gram atoms by the smallest gram atom. For example:- Let’s say that we are working with a compound that has three gram atoms: 1.5, 2 and 2.5. The smallest gram atom out of those three numbers is 1.5. So to find the atomic ratio, you must divide all of the numbers by 1.5 and then separate them with the symbol for ratio :.
- 1.5 / 1.5 = 1. 2 / 1.5 = 1.33. 2.5 / 1.5 = 1.66. So your atomic ratio is 1 : 1.33 : 1.66.
-

5
Understand how to convert numbers of atomic ratio into whole numbers. When writing an empirical formula, you need whole numbers. This means you can’t use a number like 1.33. After you have found your atomic ratio, you need to convert any partial numbers (again, like 1.33) into whole numbers (like 3). To do this, you have to find a whole number that can be multiplied by each individual number in your atomic ratio to get a whole number.[5]
For example:- Try 2. Multiply the numbers in your atomic ratio (1, 1.33, and 1.66) by 2. You get 2, 2.66, and 3.32. These are not whole numbers so 2 doesn’t work.
- Try 3. You get 3, 4, and 5 when you multiply 1, 1.33, and 1.66 by 3. Therefore, your atomic ratio of whole numbers is 3 : 4 : 5.
-

6
Understand what those whole numbers mean for the empirical formula. The whole number ratio that we just solved actually fits in to the empirical formula. Those three whole numbers are the little numbers that hang at the foot of each letter that represents a separate element of the compound. For example, our made up empirical formula would look like:[6]
- X3Y4Z5
Advertisement
-

1
Determine the percentage composition of your compound. If you are trying to find the empirical formula for a homework assignment, you will most likely be given the percentage composition—you just need to know where to look. For example:[7]
- Let’s say that the assignment asks you to look at a sample of vitamin C. It lists 40.92% Carbon, 4.58% hydrogen 54.5% Oxygen—this is the percent composition.
- 40.92% of the vitamin C is made up of carbon, while the rest is made up of 4.58% hydrogen and 54.5% oxygen.
-

2
Find the number of gram atoms in the compound. As discussed in Part 1, the equation for finding the number of gram atoms is: The percent of the element in the compound (%) divided by the element’s atomic mass. For our example, the atomic mass of carbon is 12, hydrogen is 1 and oxygen is 16.
- Number of gram atoms of carbon = 40.92 / 12 = 3.41
- Number of gram atoms of hydrogen = 04.58 / 01 = 4.58
- Number of gram atoms of oxygen = 54.50 / 16 = 3.41
-

3
Figure out the atomic ratio. Look for the gram atom that is the smallest of all of the gram atoms that we just calculated. For our example, this is 3.41 (carbon or oxygen—they both have the same value). You must then divide all of the gram atom values by this number.[8]
You write the ratio like this: value Carbon : value Hydrogen : value Oxygen.- Carbon: 3.41 / 3.41 = 1
- Hydrogen: 4.58 / 3.41 = 1.34
- Oxygen: 3.41 / 3.41 = 1
- The atomic ratio is 1 : 1.34 : 1.
-

4
Convert the ratio to whole numbers. If your atomic ratio has whole numbers you can skip this step. For our example, however, we have to convert 1.34 to a whole number. Our smallest whole number that can be multiplied with the numbers in our atomic ratio to create whole numbers is 3.[9]
- 1 x 3 = 3 (this works because 3 is a whole number).
- 1.34 x 3 = 4 (4 is also a whole number).
- 1 x 3 = 3 (again, 3 is a whole number).
- Our whole number ratio is therefore Carbon(C) : Hydrogen(H) : Oxygen(O) = 3 : 4 : 3
-

5
Write down the empirical formula. To do this, all you have to do is write the letters of each component, in this case C for carbon, H for hydrogen, and O for oxygen, with their whole number counter parts as subscripts.[10]
The empirical formula for our example is:- C3H4O3
Advertisement
Add New Question
-
Question
How do I calculate empirical formula?

It is the simplest ratio of elements in the compound. I.e. C2H6 (Ethane) has a ratio of 2 to 6. If you simplify you get 1 to 3, the the empirical formula of Ethane is CH3.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
The molecular formula represents the total number of elements present whereas the empirical formula represents the smallest ratio between the individual atoms.[11]
-
If you were to find the percent compositions in a lab, you would use spectrometric experiments on the sample compound.[12]
Thanks for submitting a tip for review!
Advertisement
References
About This Article
Article SummaryX
To find the empirical formula of a compound, start by multiplying the percentage composition of each element by its atomic mass. For example, if a compound is 40.92 percent carbon, multiply 40.92 by 12, its atomic mass, to get 3.4. Next, divide each element’s gram atoms by the smallest weight to find the atomic ratio, then convert it to whole numbers. For example, if the atomic weights were 3.41, 4.58, and 3.41, the atomic ratio would be 1:1.34:1. Finally, write the letters of each component with their ratio amounts as subscripts. To learn how to find the percent composition of a compound if it’s not given to you, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 65,008 times.
Did this article help you?
Как найти эмпирическую формулу из процентного состава
На чтение 2 мин. Просмотров 29 Опубликовано 30.05.2021
Эмпирическая формула химического соединения дает соотношение элементов с использованием нижних индексов для обозначения номера каждого атома. Его также называют простейшей формулой. Вот как найти эмпирическую формулу на примере:
Содержание
- Шаги по поиску эмпирической формулы
- Задача эмпирической формулы
- Решение для поиска эмпирической формулы
Шаги по поиску эмпирической формулы
Вы можете найти эмпирическая формула соединения с использованием данных процентного состава. Если вам известна общая молярная масса соединения, обычно можно определить и его молекулярную формулу. Самый простой способ найти формулу:
- Предположим, у вас есть 100 г вещества (упрощает вычисления, потому что все прямое процентов).
- Считайте, что вам даны количества в граммах.
- Преобразуйте граммы в моль для каждого элемента.
- Найдите наименьшее целочисленное отношение молей для каждого элемента.
Задача эмпирической формулы
Найдите эмпирическая формула для соединения, состоящего из 63% Mn и 37% O
Решение для поиска эмпирической формулы
Принятие 100 г Соединения будет 63 г Mn и 37 г O
Найдите количество граммов на моль для каждого элемента с помощью Периодической таблицы. В каждом моль марганца содержится 54,94 грамма, а в моль кислорода – 16,00 граммов.
63 г Mn × (1 моль Mn)/(54,94 г Mn) = 1,1 моль Mn
37 г O × (1 моль O)/(16,00 г O) = 2,3 моль O
Найдите наименьшее целочисленное отношение, разделив количество молей каждого элемента на количество молей элемента, присутствующего в наименьшем молярном количестве. В этом случае Mn меньше, чем O, поэтому разделите на количество молей Mn:
1,1 моль Mn/1,1 = 1 моль Mn
2,3 моль O/1,1 = 2,1 моль O
Лучшее соотношение Mn: O 1: 2 и формула MnO 2
Эмпирическая формула: MnO 2
Как найти эмпирическую формулу
2 методика:Разберитесь в основахНахождение эмпирической формулы
Если вам задали домашнее задание, в котором требуется найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow придет вам на помощь! Сначала прочтите базовые знания, которые необходимы вам для нахождения эмпирической формулы, а затем просмотрите пример во второй части статьи.
Шаги
Метод 1 из 2: Разберитесь в основах
-

1
Узнайте, что такое эмпирическая формула. В химии ЭФ – это самый простой способ описания соединения – по сути это список элементов, образующих соединение с учетом их процентного содержания. Нужно обратить внимание, что эта простейшая формула не описывает порядок атомов в соединении, она просто указывает, из каких элементов оно состоит.[1] For example:- Соединение, состоящее из 40,92% углерода; 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3H4O3 (пример того, как найти ЭФ этого соединения будет рассмотрен во второй части).
-

2
Усвойте термин ‘процентный состав’. ‘Процентным составом’ называется процентное содержание каждого отдельного атома во всем рассматриваемом соединении. Чтобы найти эмпирическую формулу соединения, необходимо знать процентный состав соединения. Если вы находите эмпирическую формулу в качестве домашнего задания, то проценты, скорее всего, будут даны.- Чтобы найти процентный состав химического соединения в лаборатории, его подвергают некоторым физическим экспериментам, а затем – количественному анализу. Если вы не находитесь в лаборатории, вам не нужно делать эти эксперименты.
-

3
Имейте в виду, что вам придется иметь дело с грамм-атомами. Грамм-атом – это определенное количество вещества, масса которого равна его атомной массе. Чтобы найти грамм-атом, нужно воспользоваться следующим уравнением: Процентное содержание элемента в соединении делится на атомную массу элемента.[2]- Допустим, к примеру, что у нас есть соединение, содержащее 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет иметь 40,92 / 12 = 3,41.
-

4
Знайте, как находить атомное соотношение. Работая с соединением, у вас будет получаться больше одного грамм-атома. После нахождения всех грамм-атомов вашего соединения, посмотрите на них. Для того, чтобы найти атомное соотношение, вам нужно будет выбрать наименьшее значение грамм-атома, которые вы вычислили. Затем нужно будет разделить все грамм-атомы на наименьший грамм-атом. Например:- Допустим вы работаете с соединением, содержащим три грамм-атома: 1,5; 2 и 2,5. Наименьшее из этих чисел – 1,5. Поэтому, чтобы найти соотношение атомов, вы должны разделить все числа на 1,5 и поставить между ними знак отношения :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Следовательно, соотношение атомов равно 1 : 1,33 : 1,66.
-

5
Разберитесь, как переводить значения отношений атомов в целые числа. Записывая эмпирическую формулу, вы должны использовать целые числа. Это значит, что вы не можете использовать числа вроде 1,33. После того, как вы найдете отношение атомов, вам нужно перевести дробные числа (вроде 1,33) в целые (например, 3). Для этого вам нужно найти целое число, умножив на которое каждое число атомного соотношения, вы получите целые числа. Например:- Попробуйте 2. Умножьте числа атомного соотношения (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не подходит.
- Попробуйте 3. Если вы умножите 1, 1,33 и 1,66 на 3, у вас получится 3, 4 и 5 соответственно. Следовательно, атомное соотношение целых чисел имеет вид 3 : 4 : 5.
-

6
Разберитесь, что значат эти целые числа для эмпирической формулы. Соотношение целых чисел, которое мы только что нашли, подходит для эмпирической формулы. Эти три числа являются маленькими числами, которые записываются под каждой буквой, представляющей отдельный элемент химического соединения. Например, наша рассчитанная эмпирическая формула будет иметь вид:- X3Y4Z5
Метод 2 из 2: Нахождение эмпирической формулы
-

1
Определите процентный состав соединения. Если вы пытаетесь найти эмпирическую формулу для домашней работы, то вам, вероятнее всего, будет дан процентный состав, вам просто нужно знать, как он выглядит. Например:- Допустим, в задании просят рассмотреть образец витамина C. В него входят 40,92% углерода, 4,58% водорода 54,5% кислорода — это и есть процентный состав.
- 40,92% витамина C состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.
-

2
Найдите значения грамм-атомов в соединении. Как было сказано в части 1, уравнение для нахождения количества грамм-атомов имеет вид: Процентное содержание элемента в соединении (%) деленное на атомную массу элемента. В нашем примере есть углерод, атомная масса которого 12, водород, с атомной массой 1, и кислород, с атомной массой 16.- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41
-

3
Выясните атомное соотношение. Найдите наименьший грамм-атом из всех вычисленных. В нашем примере – это 3,41 (углерод или кислород – у них одинаковое значение). Затем вы должны разделить все значения грамм-атомов на это число. Соотношение будет выглядеть следующим образом: значение для углерода : значение для водорода : значение для кислорода.- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение – 1 : 1.34 : 1.
-

4
Переведите соотношение в целые числа. Если ваше атомное соотношение состоит из целых чисел, то вы можете пропустить этот шаг. В нашем примере, однако, нам нужно превратить 1,34 в целое число. Наименьшее число, которое можно умножить числа в атомном соотношении – это 3.- 1 x 3 = 3 (подходит, так как 3 – целое число).
- 1,34 x 3 = 4 (4 – также целое число).
- 1 x 3 = 3 (и снова, 3 – это целое число).
- Следовательно, полученное соотношение целых чисел имеет вид углерод (C) : водород (H) : кислород (O) = 3 : 4 : 3
-

5
Запишите эмпирическую формулу. Для этого, все что вам нужно – это записать букву каждого компонента, в нашем случае – C для углерода, H для водорода и O для кислорода, с сопутствующими им числами в виде нижних индексов. В нашем примере эмпирическая формула имеет вид:- C3H4O3
Советы
- Молекулярная формула отражает общее количество присутствующих атомов, тогда как эмпирическая отражает наименьшее соотношение между отдельными атомами.
- Если вам нужно найти процентное соотношение в лаборатории, то вы должны будете провести над образцом соединения спектрометрические эксперименты.
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.

Содержание
- Анализ химического состава вещества
- Эмпирическая формула вещества
- Определение формулы вещества
Анализ химического состава вещества
Анализ химического состава вещества или элементный анализ выполняют так: сначала разлагают исходное химическое соединение на отдельные элементы, а затем измеряют их относительные количества, выраженных в граммах на 100 грамм исходного вещества, либо в весовых (массовых) процентах. На практике это можно проделать, например, с углеводородом — соединением, содержащим лишь атомы углерода C и водорода H. Если известное количество углеводорода сжечь в кислороде, то образуется CO2 (диоксид углерода) и H2O, количество которых нужно затем измерить.
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Решение:
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
- (12,011/44,010)×100 = 27,29% углерода
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
- 27,29%×68,58 г = 18,72 г углерода
Аналогичный расчет содержания H в воде дает
- (2×1,008/18,015)×100 = 11,19% водорода
- 11,19%×56,15 г = 6,283 г водорода
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Решение:
- (100 г / 25,0 г)×18,72 г углерода = 74,88 г углерода на 100 г образца
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Решение:
- (18,72 г углерода / 25,00 г образца)×100% = 74,88% углерода
- (6,28 г водорода / 25,00 г образца)×100% = 25,12% водорода
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Решение:
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
- 74,88 г углерода / 12,011 г/моль = 6,234 моля углерода
- 25,12 г водорода / 1,008 г/моль = 24,92 моля водорода
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Решение:
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
- 11,19 г водорода / 1,008 г/моль = 11,10 моля водорода
- 88,81 г кислорода / 15,999 г/моля = 5,551 моля кислорода
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
Одним лишь элементным анализом невозможно определить правильную молекулярную формулу соединения. Например, с результатами вычислений в примере 4 согласуется формула метана -CH4, но те же аналитические результаты могли бы согласоваться с молекулярными формулами C2H8, C3H12 или C4H16, если бы подобные молекулы существовали. Вещество в примере 5 может быть водой H2O, но могло бы иметь формулу H4O2 или еще более сложную, но кратную H2O.
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
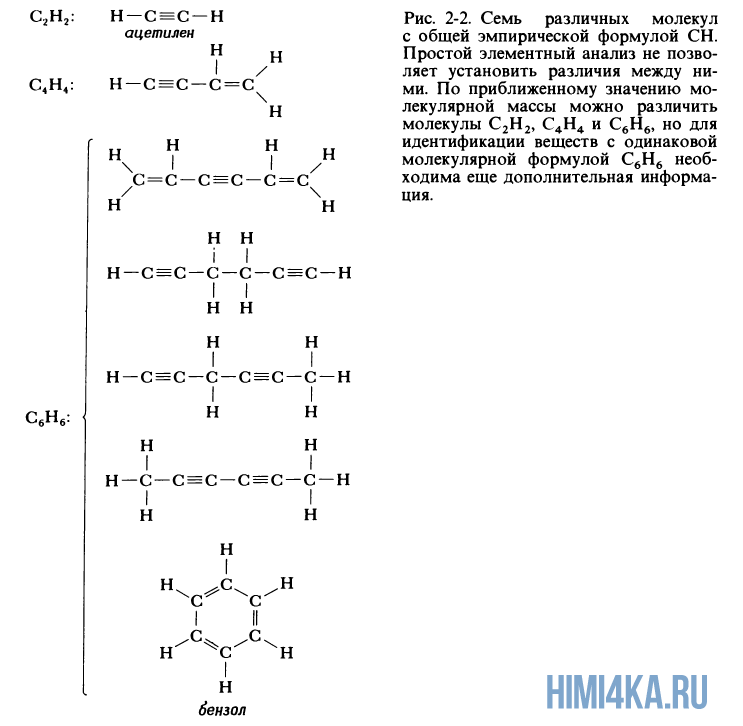
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Решение:
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
- 40,00 г углерода / 12,011 г/моль = 3,330 моля углерода
- 6,71 г водорода / 1,008 г/моль = 6,66 моля водорода
- 53,29 г кислорода / 15,999 г/моль = 3,331 моля кислорода
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
- 12,011 + (2×1,008) + 15,999 = 30,026 г/моль
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.
