Загрузить PDF
Загрузить PDF
Если вам задали домашнее задание, в котором требуется найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow придет вам на помощь! Сначала прочтите базовые знания, которые необходимы вам для нахождения эмпирической формулы, а затем просмотрите пример во второй части статьи.
-

1
Узнайте, что такое эмпирическая формула. В химии ЭФ – это самый простой способ описания соединения – по сути это список элементов, образующих соединение с учетом их процентного содержания. Нужно обратить внимание, что эта простейшая формула не описывает порядок атомов в соединении, она просто указывает, из каких элементов оно состоит.[1]
For example:- Соединение, состоящее из 40,92% углерода; 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3H4O3 (пример того, как найти ЭФ этого соединения будет рассмотрен во второй части).
-

2
Усвойте термин ‘процентный состав’. ‘Процентным составом’ называется процентное содержание каждого отдельного атома во всем рассматриваемом соединении. Чтобы найти эмпирическую формулу соединения, необходимо знать процентный состав соединения. Если вы находите эмпирическую формулу в качестве домашнего задания, то проценты, скорее всего, будут даны.
- Чтобы найти процентный состав химического соединения в лаборатории, его подвергают некоторым физическим экспериментам, а затем – количественному анализу. Если вы не находитесь в лаборатории, вам не нужно делать эти эксперименты.
-

3
Имейте в виду, что вам придется иметь дело с грамм-атомами. Грамм-атом – это определенное количество вещества, масса которого равна его атомной массе. Чтобы найти грамм-атом, нужно воспользоваться следующим уравнением: Процентное содержание элемента в соединении делится на атомную массу элемента.[2]
- Допустим, к примеру, что у нас есть соединение, содержащее 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет иметь 40,92 / 12 = 3,41.
-

4
Знайте, как находить атомное соотношение. Работая с соединением, у вас будет получаться больше одного грамм-атома. После нахождения всех грамм-атомов вашего соединения, посмотрите на них. Для того, чтобы найти атомное соотношение, вам нужно будет выбрать наименьшее значение грамм-атома, которые вы вычислили. Затем нужно будет разделить все грамм-атомы на наименьший грамм-атом. Например:
- Допустим вы работаете с соединением, содержащим три грамм-атома: 1,5; 2 и 2,5. Наименьшее из этих чисел – 1,5. Поэтому, чтобы найти соотношение атомов, вы должны разделить все числа на 1,5 и поставить между ними знак отношения :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Следовательно, соотношение атомов равно 1 : 1,33 : 1,66.
-

5
Разберитесь, как переводить значения отношений атомов в целые числа. Записывая эмпирическую формулу, вы должны использовать целые числа. Это значит, что вы не можете использовать числа вроде 1,33. После того, как вы найдете отношение атомов, вам нужно перевести дробные числа (вроде 1,33) в целые (например, 3). Для этого вам нужно найти целое число, умножив на которое каждое число атомного соотношения, вы получите целые числа. Например:
- Попробуйте 2. Умножьте числа атомного соотношения (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не подходит.
- Попробуйте 3. Если вы умножите 1, 1,33 и 1,66 на 3, у вас получится 3, 4 и 5 соответственно. Следовательно, атомное соотношение целых чисел имеет вид 3 : 4 : 5.
-

6
Разберитесь, что значат эти целые числа для эмпирической формулы. Соотношение целых чисел, которое мы только что нашли, подходит для эмпирической формулы. Эти три числа являются маленькими числами, которые записываются под каждой буквой, представляющей отдельный элемент химического соединения. Например, наша рассчитанная эмпирическая формула будет иметь вид:
- X3Y4Z5
Реклама
-

1
Определите процентный состав соединения. Если вы пытаетесь найти эмпирическую формулу для домашней работы, то вам, вероятнее всего, будет дан процентный состав, вам просто нужно знать, как он выглядит. Например:
- Допустим, в задании просят рассмотреть образец витамина C. В него входят 40,92% углерода, 4,58% водорода 54,5% кислорода — это и есть процентный состав.
- 40,92% витамина C состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.
-

2
Найдите значения грамм-атомов в соединении. Как было сказано в части 1, уравнение для нахождения количества грамм-атомов имеет вид: Процентное содержание элемента в соединении (%) деленное на атомную массу элемента. В нашем примере есть углерод, атомная масса которого 12, водород, с атомной массой 1, и кислород, с атомной массой 16.
- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41
-

3
Выясните атомное соотношение. Найдите наименьший грамм-атом из всех вычисленных. В нашем примере – это 3,41 (углерод или кислород – у них одинаковое значение). Затем вы должны разделить все значения грамм-атомов на это число. Соотношение будет выглядеть следующим образом: значение для углерода : значение для водорода : значение для кислорода.
- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение – 1 : 1.34 : 1.
-

4
Переведите соотношение в целые числа. Если ваше атомное соотношение состоит из целых чисел, то вы можете пропустить этот шаг. В нашем примере, однако, нам нужно превратить 1,34 в целое число. Наименьшее число, которое можно умножить числа в атомном соотношении – это 3.
- 1 x 3 = 3 (подходит, так как 3 – целое число).
- 1,34 x 3 = 4 (4 – также целое число).
- 1 x 3 = 3 (и снова, 3 – это целое число).
- Следовательно, полученное соотношение целых чисел имеет вид углерод (C) : водород (H) : кислород (O) = 3 : 4 : 3
-

5
Запишите эмпирическую формулу. Для этого, все что вам нужно – это записать букву каждого компонента, в нашем случае – C для углерода, H для водорода и O для кислорода, с сопутствующими им числами в виде нижних индексов. В нашем примере эмпирическая формула имеет вид:
- C3H4O3
Реклама
Советы
- Молекулярная формула отражает общее количество присутствующих атомов, тогда как эмпирическая отражает наименьшее соотношение между отдельными атомами.
- Если вам нужно найти процентное соотношение в лаборатории, то вы должны будете провести над образцом соединения спектрометрические эксперименты.
Реклама
Об этой статье
Эту страницу просматривали 22 042 раза.
Была ли эта статья полезной?
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.

Содержание
- Анализ химического состава вещества
- Эмпирическая формула вещества
- Определение формулы вещества
Анализ химического состава вещества
Анализ химического состава вещества или элементный анализ выполняют так: сначала разлагают исходное химическое соединение на отдельные элементы, а затем измеряют их относительные количества, выраженных в граммах на 100 грамм исходного вещества, либо в весовых (массовых) процентах. На практике это можно проделать, например, с углеводородом — соединением, содержащим лишь атомы углерода C и водорода H. Если известное количество углеводорода сжечь в кислороде, то образуется CO2 (диоксид углерода) и H2O, количество которых нужно затем измерить.
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Решение:
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
- (12,011/44,010)×100 = 27,29% углерода
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
- 27,29%×68,58 г = 18,72 г углерода
Аналогичный расчет содержания H в воде дает
- (2×1,008/18,015)×100 = 11,19% водорода
- 11,19%×56,15 г = 6,283 г водорода
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Решение:
- (100 г / 25,0 г)×18,72 г углерода = 74,88 г углерода на 100 г образца
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Решение:
- (18,72 г углерода / 25,00 г образца)×100% = 74,88% углерода
- (6,28 г водорода / 25,00 г образца)×100% = 25,12% водорода
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Решение:
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
- 74,88 г углерода / 12,011 г/моль = 6,234 моля углерода
- 25,12 г водорода / 1,008 г/моль = 24,92 моля водорода
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Решение:
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
- 11,19 г водорода / 1,008 г/моль = 11,10 моля водорода
- 88,81 г кислорода / 15,999 г/моля = 5,551 моля кислорода
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
Одним лишь элементным анализом невозможно определить правильную молекулярную формулу соединения. Например, с результатами вычислений в примере 4 согласуется формула метана -CH4, но те же аналитические результаты могли бы согласоваться с молекулярными формулами C2H8, C3H12 или C4H16, если бы подобные молекулы существовали. Вещество в примере 5 может быть водой H2O, но могло бы иметь формулу H4O2 или еще более сложную, но кратную H2O.
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
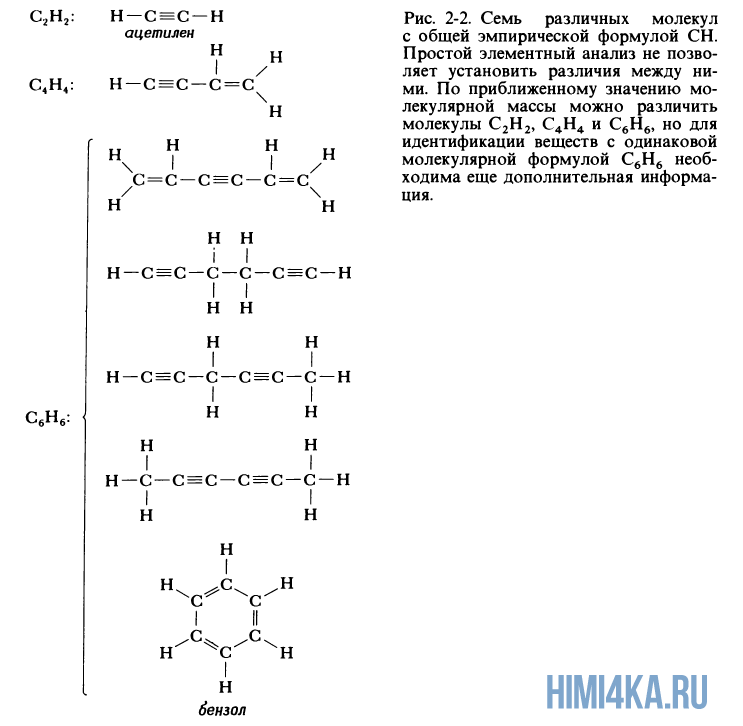
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Решение:
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
- 40,00 г углерода / 12,011 г/моль = 3,330 моля углерода
- 6,71 г водорода / 1,008 г/моль = 6,66 моля водорода
- 53,29 г кислорода / 15,999 г/моль = 3,331 моля кислорода
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
- 12,011 + (2×1,008) + 15,999 = 30,026 г/моль
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.
From Wikipedia, the free encyclopedia
This article is about analytical chemistry. For observation rather than theory, see Empirical relationship.
In chemistry, the empirical formula of a chemical compound is the simplest whole number ratio of atoms present in a compound.[1] A simple example of this concept is that the empirical formula of sulfur monoxide, or SO, would simply be SO, as is the empirical formula of disulfur dioxide, S2O2. Thus, sulfur monoxide and disulfur dioxide, both compounds of sulfur and oxygen, have the same empirical formula. However, their molecular formulas, which express the number of atoms in each molecule of a chemical compound, are not the same.
An empirical formula makes no mention of the arrangement or number of atoms. It is standard for many ionic compounds, like calcium chloride (CaCl2), and for macromolecules, such as silicon dioxide (SiO2).
The molecular formula, on the other hand, shows the number of each type of atom in a molecule.[2] The structural formula shows the arrangement of the molecule. It is also possible for different types of compounds to have equal empirical formulas.
Samples are analyzed in specific elemental analysis tests to determine what percent of a particular element the sample is composed of.
Examples[edit]
- Glucose (C6H12O6), ribose (C5H10O5), Acetic acid (C2H4O2), and formaldehyde (CH2O) all have different molecular formulas but the same empirical formula: CH2O. This is the actual molecular formula for formaldehyde, but acetic acid has double the number of atoms, ribose has five times the number of atoms, and glucose has six times the number of atoms.
- The chemical compound n-hexane has the structural formula CH3CH2CH2CH2CH2CH3, which shows that it has 6 carbon atoms arranged in a chain, and 14 hydrogen atoms. Hexane’s molecular formula is C6H14, and its empirical formula is C3H7 showing a C:H ratio of 3:7.
Calculation example[edit]
A chemical analysis of a sample of methyl acetate provides the following elemental data: 48.64% carbon (C), 8.16% hydrogen (H), and 43.20% oxygen (O). For the purposes of determining empirical formulas, it’s assumed that we have 100 grams of the compound. If this is the case, the percentages will be equal to the mass of each element in grams.
- Step 1: Change each percentage to an expression of the mass of each element in grams. That is, 48.64% C becomes 48.64 g C, 8.16% H becomes 8.16 g H, and 43.20% O becomes 43.20 g O.
- Step 2: Convert the amount of each element in grams to its amount in moles
- Step 3: Divide each of the resulting values by the smallest of these values (2.7)
- Step 4: If necessary, multiply these numbers by integers in order to get whole numbers; if an operation is done to one of the numbers, it must be done to all of them.
Thus, the empirical formula of methyl acetate is C3H6O2
. This formula also happens to be methyl acetate’s molecular formula.
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (2006–) “Empirical formula”. doi:10.1351/goldbook.E02063
- ^ MONITOR., WHOLE SKY, URL., OCLC 796720402, retrieved 2022-12-31
Download Article
Download Article
If you have been assigned homework where you have to find the empirical formula of a compound, but you have no idea how to get started, never fear! wikiHow is here to help! First, take a look at the basic knowledge you need to have to find the empirical formula, and then walk through an example in Part 2.
-

1
Know what the empirical formula is. In chemistry, the EF is the simplest way to describe a compound—it is basically a list of the elements that make up a compound, organized by percentage. It’s important to note that this simple formula does not describe the arrangement of the atoms within the compound, it simply states which elements compound is made of. For example:[1]
- A compound that is made up of 40.92% Carbon, 4.58% hydrogen, and 54.5% Oxygen would have an empirical formula of C3H4O3 (we will go through an example of how to find the EF of this compound in Part Two).
-

2
Understand the term ‘percent composition’. ‘Percentage composition’ refers to the percent of each individual atom in the whole compound that we are looking at. To find the empirical formula of a compound, we must know the percentage composition of the compound. If you are finding the empirical formula for homework, you will most likely be given the percentages.[2]
- In a chemistry lab, to find the percentage composition, the compound would be examined through some physical experiments and then quantitative analysis. Unless you are in a lab, you will not need to actually do these experiments.
Advertisement
-

3
Be aware that you will be dealing with gram atoms. A gram atom is the specific amount of an element that’s weight in grams equals its atomic mass. To find a gram atom, the equation is: The percent of the element in the compound (%) divided by the element’s atomic mass.[3]
- For example, let’s say that we have a compound that is made up of 40.92% carbon. The atomic mass of carbon is 12 so our equation would be 40.92 / 12 = 3.41.
-

4
Know how to find the atomic ratio.[4]
When you are working with a compound, you will have more than one gram atom to calculate. After you have found all of the gram atoms in your compound, look at all of them. To find the atomic ratio, you will have to pick out the gram atom that is the smallest out of all of the gram atoms that you calculated. You will then divide all of your gram atoms by the smallest gram atom. For example:- Let’s say that we are working with a compound that has three gram atoms: 1.5, 2 and 2.5. The smallest gram atom out of those three numbers is 1.5. So to find the atomic ratio, you must divide all of the numbers by 1.5 and then separate them with the symbol for ratio :.
- 1.5 / 1.5 = 1. 2 / 1.5 = 1.33. 2.5 / 1.5 = 1.66. So your atomic ratio is 1 : 1.33 : 1.66.
-

5
Understand how to convert numbers of atomic ratio into whole numbers. When writing an empirical formula, you need whole numbers. This means you can’t use a number like 1.33. After you have found your atomic ratio, you need to convert any partial numbers (again, like 1.33) into whole numbers (like 3). To do this, you have to find a whole number that can be multiplied by each individual number in your atomic ratio to get a whole number.[5]
For example:- Try 2. Multiply the numbers in your atomic ratio (1, 1.33, and 1.66) by 2. You get 2, 2.66, and 3.32. These are not whole numbers so 2 doesn’t work.
- Try 3. You get 3, 4, and 5 when you multiply 1, 1.33, and 1.66 by 3. Therefore, your atomic ratio of whole numbers is 3 : 4 : 5.
-

6
Understand what those whole numbers mean for the empirical formula. The whole number ratio that we just solved actually fits in to the empirical formula. Those three whole numbers are the little numbers that hang at the foot of each letter that represents a separate element of the compound. For example, our made up empirical formula would look like:[6]
- X3Y4Z5
Advertisement
-

1
Determine the percentage composition of your compound. If you are trying to find the empirical formula for a homework assignment, you will most likely be given the percentage composition—you just need to know where to look. For example:[7]
- Let’s say that the assignment asks you to look at a sample of vitamin C. It lists 40.92% Carbon, 4.58% hydrogen 54.5% Oxygen—this is the percent composition.
- 40.92% of the vitamin C is made up of carbon, while the rest is made up of 4.58% hydrogen and 54.5% oxygen.
-

2
Find the number of gram atoms in the compound. As discussed in Part 1, the equation for finding the number of gram atoms is: The percent of the element in the compound (%) divided by the element’s atomic mass. For our example, the atomic mass of carbon is 12, hydrogen is 1 and oxygen is 16.
- Number of gram atoms of carbon = 40.92 / 12 = 3.41
- Number of gram atoms of hydrogen = 04.58 / 01 = 4.58
- Number of gram atoms of oxygen = 54.50 / 16 = 3.41
-

3
Figure out the atomic ratio. Look for the gram atom that is the smallest of all of the gram atoms that we just calculated. For our example, this is 3.41 (carbon or oxygen—they both have the same value). You must then divide all of the gram atom values by this number.[8]
You write the ratio like this: value Carbon : value Hydrogen : value Oxygen.- Carbon: 3.41 / 3.41 = 1
- Hydrogen: 4.58 / 3.41 = 1.34
- Oxygen: 3.41 / 3.41 = 1
- The atomic ratio is 1 : 1.34 : 1.
-

4
Convert the ratio to whole numbers. If your atomic ratio has whole numbers you can skip this step. For our example, however, we have to convert 1.34 to a whole number. Our smallest whole number that can be multiplied with the numbers in our atomic ratio to create whole numbers is 3.[9]
- 1 x 3 = 3 (this works because 3 is a whole number).
- 1.34 x 3 = 4 (4 is also a whole number).
- 1 x 3 = 3 (again, 3 is a whole number).
- Our whole number ratio is therefore Carbon(C) : Hydrogen(H) : Oxygen(O) = 3 : 4 : 3
-

5
Write down the empirical formula. To do this, all you have to do is write the letters of each component, in this case C for carbon, H for hydrogen, and O for oxygen, with their whole number counter parts as subscripts.[10]
The empirical formula for our example is:- C3H4O3
Advertisement
Add New Question
-
Question
How do I calculate empirical formula?

It is the simplest ratio of elements in the compound. I.e. C2H6 (Ethane) has a ratio of 2 to 6. If you simplify you get 1 to 3, the the empirical formula of Ethane is CH3.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
The molecular formula represents the total number of elements present whereas the empirical formula represents the smallest ratio between the individual atoms.[11]
-
If you were to find the percent compositions in a lab, you would use spectrometric experiments on the sample compound.[12]
Thanks for submitting a tip for review!
Advertisement
References
About This Article
Article SummaryX
To find the empirical formula of a compound, start by multiplying the percentage composition of each element by its atomic mass. For example, if a compound is 40.92 percent carbon, multiply 40.92 by 12, its atomic mass, to get 3.4. Next, divide each element’s gram atoms by the smallest weight to find the atomic ratio, then convert it to whole numbers. For example, if the atomic weights were 3.41, 4.58, and 3.41, the atomic ratio would be 1:1.34:1. Finally, write the letters of each component with their ratio amounts as subscripts. To learn how to find the percent composition of a compound if it’s not given to you, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 65,076 times.
Did this article help you?
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023









