Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 950 363 раза.
Была ли эта статья полезной?
В течение прошедших веков учеными разных стран мира совершались великие открытия в различных направлениях науки. К настоящему времени в физике накопилось множество законов, зависимостей и констант, которые принято обозначать именными символами и размерностью.
Попытки ученых классифицировать и систематизировать столь значительное количество физических величин не принесли желаемого результата. Предлагаемые системы физических величин оказывались либо слишком сложными для понимания, либо область их применения по отношению к величинам была весьма ограничена. Поэтому до настоящего времени представить научной общественности систему физических величин в доступной и наглядной форме, наподобие таблицы периодического закона химических элементов Д.И.Менделеева, еще не удавалось никому.
В результате проведения ряда исследований автор данной статьи пришел к выводу, что данную проблему можно решить, если базироваться на структурных «родственных» взаимосвязях между величинами разделов физики, на «иерархическое» распределение, которых, влияет масса той или иной величины.
Такой метод распределения позволил классифицировать величины по группам и подгруппам и создать логическую систему физических величин на основе международных единиц СИ (См. таблицу).
Физические величины были классифицированы автором по следующим группам: I – механические и пространственно-временные; II – физико-химические, теплофизические и температурные; III – световые, акустические, ионизирующие и ядерные; IV– электрические и магнитные величины.
Группы I-IV были разделены, по влиянию массы на величины, на подгруппы: a – массивные; b – немассивные; с – контр-массивные; d – немассивные субтильные величины.
Различие числовых значений в показателях степени физических единиц легли в основу идеи создания трехмерной системы, на ортогональных осях, которой, единицы расположены следующим образом. На оси Х: кандела (J), килограмм (М), метр (L); на оси Y: радиан (R)*, ампер (A), секунда (T); на оси Z: стерадиан (S)**, моль (N), кельвин (K) (рис. 1).
Для представления системы в виде таблицы, числа показателей степени физических единиц с оси абсцисс были перенесены в пронумерованные столбцы, с оси ординат в пронумерованные строки, а с оси аппликат в пронумерованные римскими цифрами I-IX
*, ** – дополнительные единицы радиан и стерадиан в системе СИ не имеют своей размерности, поэтому, для удобства работы с единицами вновь созданной системы, автором было принято решение присвоить радиану размерность R, а стерадиану размерность S.
Таблица (компактный вариант)
Физические величины, в зависимости от числовых показателей степени физических единиц:
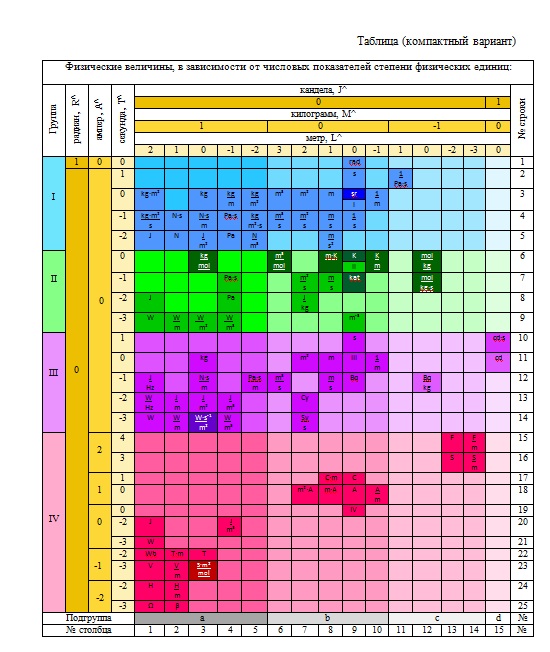
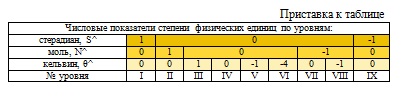
Уровни приставки к таблице, имитирующей ось Z. Причем физические единицы с меньшей вариацией чисел в показателях степени расположены с внешней стороны шапки таблицы (J, R, S), а с наибольшей вариацией с внутренней стороны (L, T, θ). Соответственно промежуточное значение в шапке таблицы заняли единицы M, А, N.
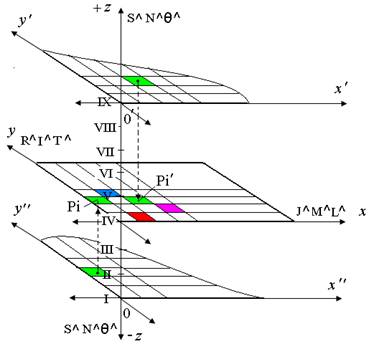
Рис. 1. Конструкция трехмерной системы физических единиц СИ
Из девяти уровней созданной системы основным является уровень IV, так как он содержит наиболее распространенные единицы (килограмм, метр, секунда, ампер, а также кандела и радиан) и на нем располагаются более 80% всех известных науке физических величин. Величины, содержащие единицы стерадиан (S), моль (N) и кельвин (K) в зависимости от показателей их степени находятся на уровнях I-III, V-IX и отображаются на уровне IV таблицы только в виде проекций (рис. 1). Это такие величины, как: kg/mol; К/m; lx•s и другие.
При внесении в трехмерную систему всех известных современной науке физических величин (включая величины с дробными показателями степени) таблица может оказаться весьма громоздкой, поэтому целесообразно на практике использовать несколько вариантов таблиц системы:
– компактная таблица (вариант показан в данной статье) – для довузовского и общего образования, она содержит только те физические величины, которые применяются в общеобразовательных учебных программах;
– развернутая таблица – для высшего образования, используется в учебных программах высших технических учебных заведений;
– полная таблица – для ученых и специалистов научно-исследовательских центров, используется в качестве нормативно-справочного материала.
Предложенная система позволяет каждой физической величины сообщать научно-значимую информацию о себе: наименование*; обозначение (символ); формулу размерности**; отношение величины к той или иной физической группе; влияние на величину массы (подгруппы); координационный номер в таблице. Среди них важнейшим элементом информации является формула размерности – полная размерность величины, так как именно она показывает отношение и степень взаимосвязи физических единиц между собой.
*,**- поскольку такие элементы информации как наименование и формула размерности физических величин занимают много место в ячейке, то для сохранения компактности таблицы они содержаться в специальном Приложении.
Трехмерная система физических СИ величин отличается своей универсальностью. Она способна расширяться при вводе в таблицу новых величин, содержать безразмерные величины (ячейки, обозначенные римск. цифрами I-IV) и величины с дробными показателями степени (в таблице не показаны), а ее конструкция, принципы и метод построения могут быть использованы при создании подобных логических систем в МКС, СГС, МКГСС и др. Конструктивные особенности системы позволяет сделать таблицу развернутой или наоборот свернутой компактной (например, для ее печатания на бумаге стандартного книжного формата). Система значительно облегчает поиск требуемых физических величин в занятых ячейках таблицы, а пустые ячейки ждут своего часа для заполнения ее новыми физическими величинами, пока еще не открытыми наукой.
Автор: Е.Бессонов
Как определить состав атома с помощью таблица Менделеева?
Наталия Волчкова
Ученик
(114),
закрыт
12 лет назад
Дополнен 12 лет назад
Что такое орбиталь?
Дополнен 12 лет назад
Виды орбиталей!
Лучший ответ
Константин Олешко
Гуру
(3495)
12 лет назад
Атомная орбиталь – область пространства, в которой наиболее вероятно, в соответствии с волновой функцией, дислоцируются электроны. Только два электрона, в соответствии с принципом Паули.
В зависимости от оболочки, бывают: s, p, d, f… и т. д. орбитали. Отличаются орбитальным квантовым числом. Орбитали одной оболочки вырождены по энергии.
Насчет таблицы –
http://ru.wikipedia.org/wiki/Зарядовое_число .
http://ru.wikipedia.org/wiki/Периодический_закон#Периодические_свойства_химических_элементов
Источник: Сколько необразованных школьников, неспособных даже вопрос в поисковике написать…
Остальные ответы
I Am Dubbed
Просветленный
(20880)
12 лет назад
если имеется в виду число протонов и нейтронов в ядре, то по порядковому номеру и атомному весу
распределение электронов по орбиталям тоже там обычно написано, кроме того, его можно, если мне память не изменяет, понять из положения элемента
Arthur Arthur Arthur
Мастер
(2462)
12 лет назад
Номера элементам даны не просто так и не в случайном порядке!
Источник: Периодический закон Д. И. Менделеева.
Похожие вопросы
![]()
![]()
Заряд ядра равен количеству протонов в нем. Количество протонов о можно определить по периодической таблице Менделеева. Он равен порядковому номеру элемента.
По формуле: q = e*Z
где e – заряд одного протона,
Z- число протонов( порядковый номер в таблице ).
автор вопроса выбрал этот ответ лучшим
![]()
ЧипИДейл
[36.5K]
2 года назад
Для того, чтобы узнать заряд ядра атома какого-либо химического элемента, необходимо будет заглянуть в периодическую таблицу Менделеева. В ней для каждого элемента определен порядковый номер. Этот номер равен количеству протонов в ядре элемента. А заряд ядра атома как раз и равен количеству протонов. Соответственно делаем вывод, что заряд ядра атома равен порядковому (зарядному) числу, который указывается для каждого вещества в периодической таблице Менделеева.
Самый маленький заряд ядра имеет Водород (обозначается буквой «H»), распололоженный в таблице под номером 1. А самый большой заряд у элемента, который называется Оганесон (обозначается, как «Og») с атомным номером 118.
![]()
владсандрович
[766K]
4 года назад
Заряд в ядре приравнивается к количеству того числа протонов которые содержатся в нем. Их количество определяется исходя из данных которые дает периодическая таблица Менделеева. И в ней что бы увидеть их число, нужно смотреть на порядковый номер элемента.
Вот формуле для расчета: q = e*Z
В которой “e” , является зарядом одного протона.
Литера “Z”- как раз таки является тем числом протонов, которое располагается порядковым номером в таблице.
![]()
Существует три вида элементарных частиц. Протоны и нейтроны находятся в ядре атома, а электроны движутся по орбиталям, поэтому их не учитываем. Нейтроны не имеют какого-либо заряда, его имеют только протоны. Каждый протон имеет заряд +1.
И чтобы определить, какой заряд имеет ядро некого атома, нужно умножить +1 на порядковый номер вещества в таблице Менделеева.
Ряд ядра всегда положительный.
![]()
Алекс98
[60K]
2 года назад
Ох уж эта физика. Еще со школы помню, что заряд ядра автора равен количеству в нем протонов.
Количество протонов определяется по периодической таблице Менделеева и равняется порядковому номеру элементов.
Знаете ответ?
Нахождение числа нейтронов, протонов и электронов в атоме .
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
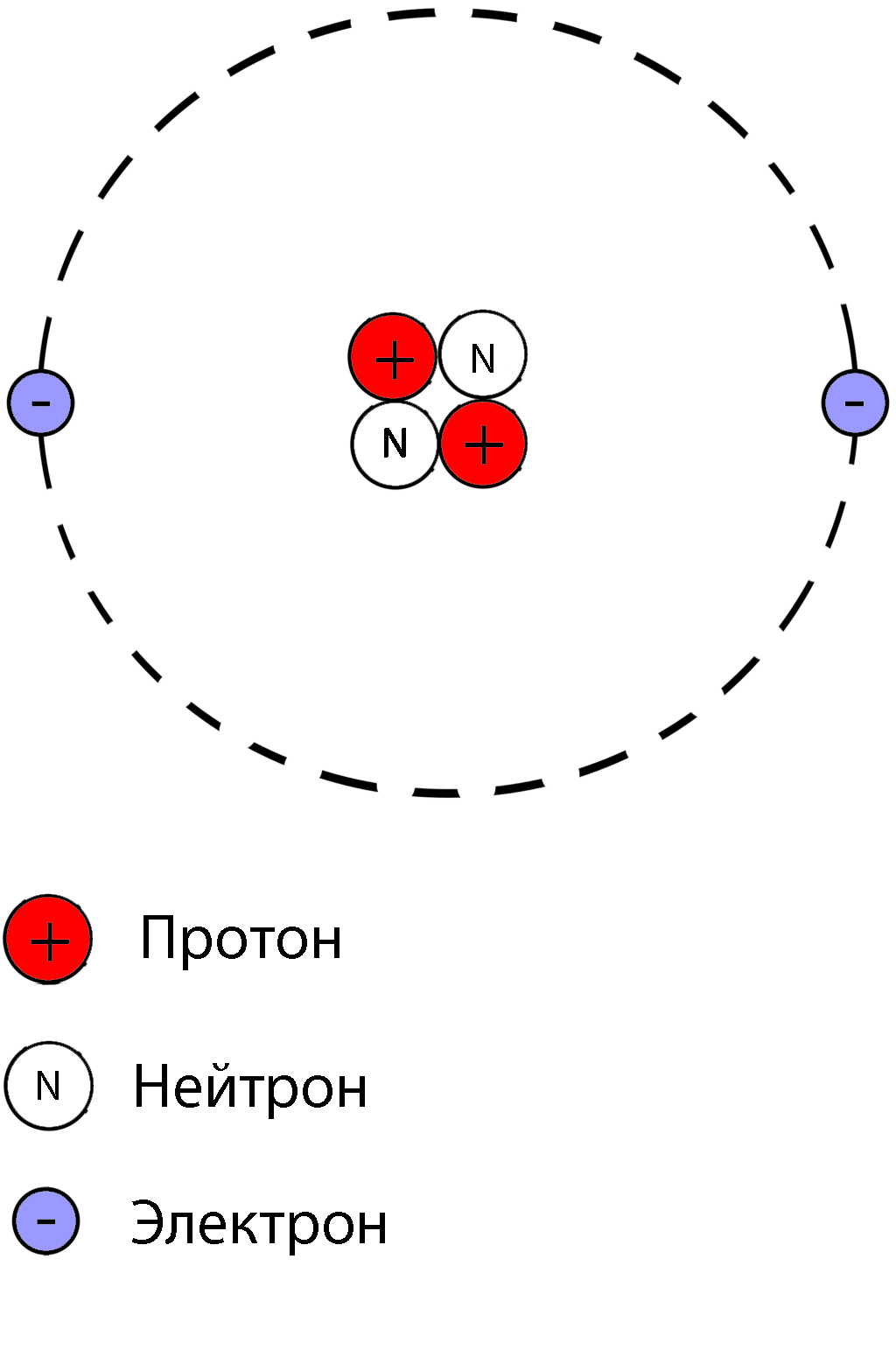
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме водорода
После чего начертим модель атома водорода
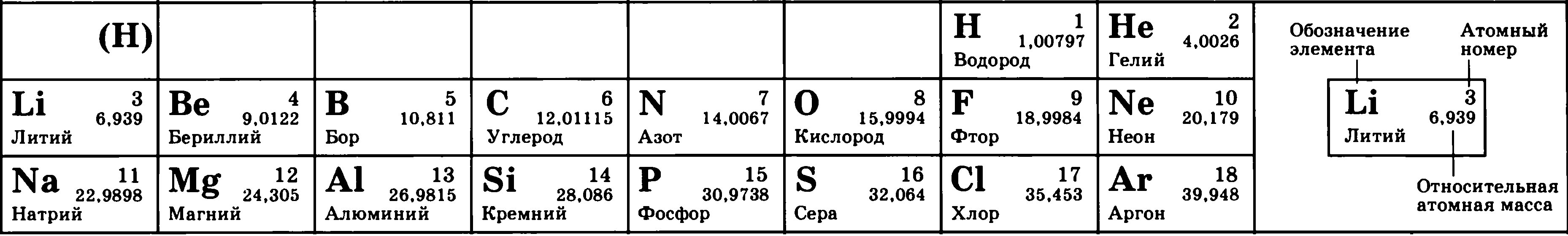
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
Количество нейтронов=1-1=0
В атоме водорода нет нейтронов
Модель атома водорода:
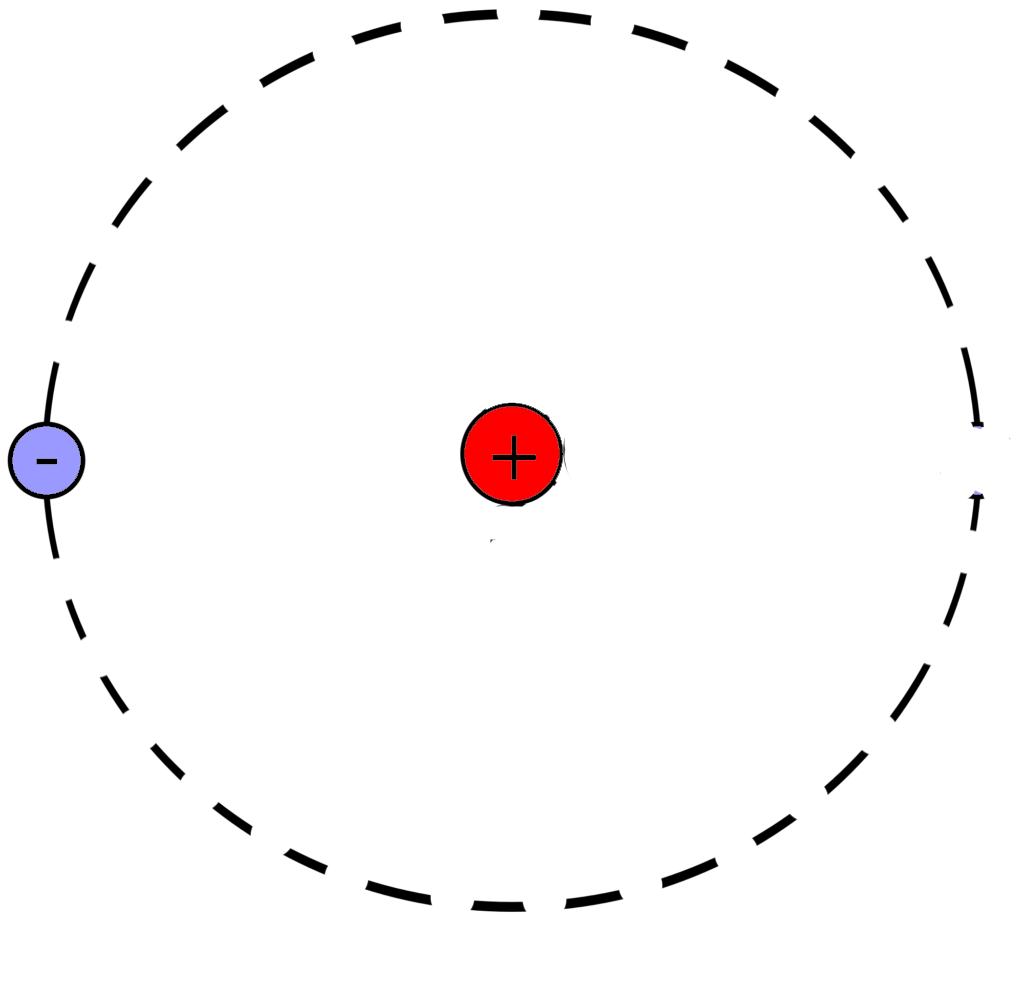
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме гелия
После чего начертим модель атома гелия

Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
Количество нейтронов=4-2=2
В атоме гелия 2 нейтрона
Модель атома гелия:
Задача 1.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.

Показать ответ
Показать решение
Видеорешение
Задача 2.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме углерода.

Показать ответ
Показать решение
Видеорешение
Задача 3.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме азота.

Показать ответ
Показать решение
Видеорешение
Задача 4.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме кислорода.
Атомную массу округлить до 16.

Показать ответ
Показать решение
Видеорешение
Как мы видим в таблице Менделеева выше стоит порядковый номер, то есть заряд, который равен числу протонов
и электронов , а под ним расположена атомная масса.
Из каких-то непонятных соображений в ядерных реакциях или просто в одиночном обозначении элемента
сверху стоит масса, а снизу заряд(номер).
То есть все наоборот
( _{6}^{12}textrm{C} ;;;;;;;;; ) (12) это масса, (6) это заряд (номер)
( _{Z}^{M}textrm{C} ;;;;;;;;; ) (M) это масса, (Z) это заряд (номер)
Задача 5.
Найти количество протонов, нейтронов и электронов в атоме фтора
( _{9}^{19}textrm{F} )
Показать ответ
Показать решение
Видеорешение
Задача 6.
Найти количество протонов, нейтронов и электронов в атоме алюминия
( _{13}^{27}textrm{Al} )
Показать ответ
Показать решение
Видеорешение
Изотопы это атомы одного и того же химического элемента, они имеют одинаковый заряд,
но разное количество нейтронов
Изотопы кислорода:
( _{8}^{16}textrm{O} , ;;;; _{8}^{17}textrm{O} , ;;;; _{8}^{18}textrm{O} )
