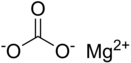| Карбонат магния | ||
|---|---|---|
|
||
| Общие | ||
| Хим. формула | MgCO3 | |
| Физические свойства | ||
| Состояние | белое гигроскопическое вещество | |
| Молярная масса | 84.3139 г/моль | |
| Плотность |
(ангидрид) 2.958 г/см³ (пентагидрат) 1.73 г/см³ |
|
| Термические свойства | ||
| Температура | ||
| • плавления | (с разл.) 540 °C | |
| Энтальпия | ||
| • образования | −1111.69 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде |
(25 °C, ангидрид) 0.0012 г/100 мл (20 °C, пентагидрат) 0.375 г/100 мл |
|
| Оптические свойства | ||
| Показатель преломления |
(ангидрид) 1.717 (тригидрат) 1.412 |
|
| Структура | ||
| Кристаллическая структура | тригональная | |
| Классификация | ||
| Рег. номер CAS |
546-93-0 (ангидрид) 13717-00-5 (моногидрат) 5145-48-2 (дигидрат) 14457-83-1 (тригидрат) 61042-72-6 (пентагидрат) |
|
| PubChem | 11029 | |
| Рег. номер EINECS | 208-915-9 | |
| SMILES |
C(=O)([O-])[O-].[Mg+2] |
|
| InChI |
InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 ZLNQQNXFFQJAID-UHFFFAOYSA-L |
|
| Кодекс Алиментариус | E504(i) и E504 | |
| RTECS | OM2470000 | |
| ChEBI | 31793 | |
| ChemSpider | 10563 | |
| Безопасность | ||
| NFPA 704 |
0 1 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты.
Свойства[править | править код]
Белые кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3.
Распространённость в природе[править | править код]
Карбонат магния широко распространён в природе в виде минерала магнезита. Кроме того, присутствует в стереоме иглокожих.
Применение[править | править код]
Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов.
В медицине и в качестве пищевой добавки E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O
Спортивная магнезия 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надёжности хвата.
Карбонат магния необходим в производстве стекла, цемента, кирпича.
См. также[править | править код]
- Сульфат магния (лекарство)
- Цитрат магния
Формула карбоната магния
Определение и формула карбоната магния
Мало растворяется в холодной воде. Разлагается в горячей воде, разбавленных сильных кислотах,концентрированной фтороводородной кислоте. Реагирует с оксидом углерода (IV) в растворе с образованием гидрокарбоната магния (MgHCO3), который определяет временную жесткость природных вод. Переводится в раствор действием карбоната аммония.

Рис. 1. Карбонат магния. Внешний вид.
Химическая формула карбоната магния
Химическая формула карбоната магния – MgCO3. Она показывает, что в составе молекулы этого сложного вещества находится один атом магния (Ar = 24 а.е.м.), один атом углерода (Ar = 12 а.е.м.) и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу карбоната магния:
Mr(MgCO3) = Ar(Mg) + Ar(C) + 3×Ar(O);
Mr(MgCO3) = 24 + 12 + 3×16 = 36 +48 = 84.
Структурная (графическая) формула карбоната магния
Структурная (графическая) формула карбоната магния является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:

Ионная формула
Карбонат магния электролит, т.е. в водном растворе под действием электрического тока он диссоциирует на ионы согласно следующему уравнению:
MgCO3↔Mg2+ + CO32-.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Физические свойства
Карбонат магния MgCO3 — соль магния и угольной кислоты. Белый, при умеренном нагревании разлагается. Мало растворяется в холодной воде. Разлагается в горячей воде.
Относительная молекулярная масса Mr = 84,31; относительная плотность для тв. и ж. состояния d= 3,037;
Способ получения
1. Карбонат магния можно получить путем взаимодействия сульфата магния и гидрокарбоната калия, образуется карбонат магния, сульфат калия, вода и углекислый газ:
MgSO4 + 2KHCO3 = MgCO3↓ + K2SO4 + H2O + CO2↑
Качественная реакция
Качественная реакция на карбонат магния — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
Химические свойства
1. Карбонат магния разлагается при температуре выше 350 — 650º С, с образованием оксида магния и углекислого газа:
MgCO3 = MgO + CO2
2. Карбонат магния вступает в реакцию со многими сложными веществами:
2.1. Карбонат магния реагирует с горячей водой, образуя гидроксокарбонат магния и углекислый газ:
2MgCO3 + H2O = Mg2CO3(OH)2↓ + CO2↑
2.2. Карбонат магния реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
2.2.2. Карбонат магния реагирует с концентрированной и горячей плавиковой кислотой. Взаимодействие карбоната магния с плавиковой кислотой приводит к образованию фторида магния, воды и углекислого газа:
MgCO3 + 2HF = MgF2↓ + CO2↑ + H2O
2.3. Карбонат магния может взаимодействовать с солями:
2.3.1. Карбонат магния взаимодействует при кипении с концентрированным раствором сульфата аммония. При этом образуется сульфат магния, аммиак, углекислый газ и вода:
MgCO3 + (NH4)2SO4 = MgSO4 + 2NH3↑ + CO2↑ + H2O
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Карбонат магния – CaCO3
Гидрокарбонат железа (II) – Fe(HCO3)2
Сульфат железа (III) – Fe2(SO4)3
Гидрофосфат кальция – CaHPO4
Основной хлорид магния (гидроксохлорид магния) – Mg(OH)Cl
2. Даны химические формулы веществ: HBr, NaHSO4, Cu2O, Fe(OH)3, Fe(NO3)3, Ca(HCO3)2, N2O5, H3BO3, Li2O, SO2, Ba(OH)2, Ca3(PO4)2, Cu(OH)2. Начертите в тетради таблицу и поместите формулы в соответствующие графы.
3. Назовите следующие соли: NaCl, Al(NO3)3, K3PO4, Na2SO4, Na2S, Na2SO3, FeSO4, AgNO3, Fe2(SO4)3, Na2CO3, NaHCO3.
4. Составьте схему «Получение солей» и проиллюстрируйте ее уравнениями химических реакций. Обсудите итог работы с соседом по парте.
5. Напишите уравнения реакций нейтрализации, в результате которых образуются следующие соли: а) AlCl3; б) BaSO4; в) Ba(NO3)2; г) Na3PO4; д) NaNO3; е) NaHSO4; ж) KH2PO4; з) K2HPO4.
Тестовые задания.