Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 сентября 2022 года; проверки требуют 3 правки.
| Оксид цинка | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Цинка оксид |
| Хим. формула |
 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1975 °C |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления |
2,015 и 2,068CRC Handbook of Chemistry and Physics. — 92nd. — CRC Press, 2011. — ISBN 978-1439855119. |
| Структура | |
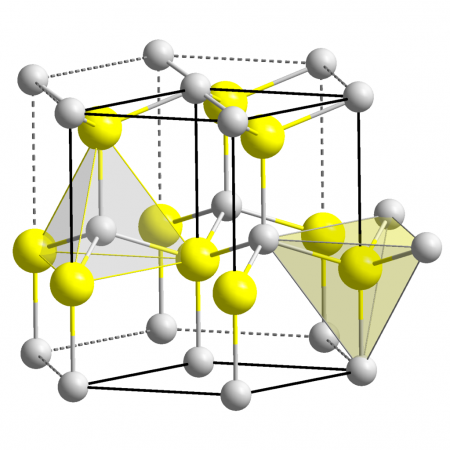
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| Классификация | |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES |
O=[Zn] |
| InChI |
InChI=1S/O.Zn XLOMVQKBTHCTTD-UHFFFAOYSA-N |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Безопасность | |
| Предельная концентрация |
аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) |
H410 |
| Меры предостор. (P) |
P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |
|
| NFPA 704 |
1 2 0
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ци́нка (о́кись цинка) 
Свойства[править | править код]
Физические свойства[править | править код]
- Теплопроводность: 54 Вт/(м·К)[2].
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
Эффективная масса носителей заряда mp 0,59me; mn 0,24me.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
При температурах 1350—1800 °C оксид цинка сублимируется, сублимация идет через механизм разложения оксида цинка на цинк и кислород в высокотемпературной зоне и образование оксида в низкотемпературной зоне, скорости сублимации зависят от состава газовой среды, в которой она проводится[3].
Химические свойства[править | править код]
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, ![{displaystyle {ce {Na2[Zn(OH)4],}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5fe0c645cfa870a55ab8ce7fe8d2b33ab3da9cd1)
![{displaystyle {ce {Ba2[Zn(OH)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6942d7642b58bf88a659f6ebc05118ea434b7300)
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент[4].
Нахождение в природе[править | править код]
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение[править | править код]
Применение[править | править код]
Оксид цинка широко применяют в химической и фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в солнцезащитных кремах, в косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности[править | править код]
- Активатор вулканизации некоторых типов каучуков.
- Вулканизирующий агент хлоропреновых каучуков.
- Катализатор получения метанола.
- Белый пигмент при производстве красок и эмалей (в настоящее время (2007 год) вытесняется нетоксичным диоксидом титана
).
- Наполнитель и пигмент в производстве:
- резины;
- пластмасс;
- бумаги;
- парфюмерных и косметических средств.
- Добавка к кормам для животных.
- В производстве стекла и красок на основе жидкого стекла;
- Как один из компонентов преобразователя ржавчины[источник не указан 1602 дня].
Известно также, что оксид цинка обладает фотокаталитической активностью[источник не указан 1602 дня], что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется[источник не указан 1602 дня].
В электронике[править | править код]
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров[источник не указан 1602 дня]. На основе оксида цинка в комбинации с нитридом галлия создан светодиод голубого цвета[6][7].
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры[8][9].
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине[править | править код]

В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность[править | править код]
Соединение малотоксично, но его пыль вредна для органов дыхания и может вызвать литейную лихорадку, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни и литья медных сплавов, содержащих цинк.
Примечания[править | править код]
- ↑ http://www.cdc.gov/niosh/npg/npgd0675.html
- ↑ Термопрокладки. Дата обращения: 8 июля 2012. Архивировано 15 марта 2011 года.
- ↑ Anthrop, Donald F.; Searcy, Alan W. (1964-08). “Sublimation and Thermodynamic Properties of Zinc Oxide”. The Journal of Physical Chemistry. 68 (8): 2335—2342. DOI:10.1021/j100790a052. eISSN 1541-5740. ISSN 0022-3654. Дата обращения 2020-09-22.
- ↑ Справочник химика. Цинковый цемент.
- ↑ S. Baruah and J. Dutta «Review: Hydrothermal growth of ZnO nanostructures» Sci. Technol. Adv. Mater. 10 (2009) 013001 скачать бесплатно (недоступная ссылка)
- ↑ Liu XY, Shan CX, Zhu H, Li BH, Jiang MM, Yu SF, Shen DZ (September 2015). “Ultraviolet Lasers Realized via Electrostatic Doping Method”. Scientific Reports. 5: 13641. Bibcode:2015NatSR…513641L. DOI:10.1038/srep13641. PMC 4555170. PMID 26324054.
- ↑ Bakin A, El-Shaer A, Mofor AC, Al-Suleiman M, Schlenker E, Waag A (2007). “ZnMgO-ZnO quantum wells embedded in ZnO nanopillars: Towards realisation of nano-LEDs”. Physica Status Solidi C. 4 (1): 158—161. Bibcode:2007PSSCR…4..158B. DOI:10.1002/pssc.200673557.
- ↑ Wang HT, Kang BS, Ren F, Tien LC, Sadik PW, Norton DP, Pearton SJ, Lin J (2005). “Hydrogen-selective sensing at room temperature with ZnO nanorods”. Applied Physics Letters. 86 (24): 243503. Bibcode:2005ApPhL..86x3503W. DOI:10.1063/1.1949707.
- ↑ Tien LC, Sadik PW, Norton DP, Voss LF, Pearton SJ, Wang HT, et al. (2005). “Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods”. Applied Physics Letters. 87 (22): 222106. Bibcode:2005ApPhL..87v2106T. DOI:10.1063/1.2136070.
Литература[править | править код]
- Перельман В. И. Краткий справочник химика. — М.—Л.: Химия, 1964.
- Бовина Л. А. и др. Физика соединений AIIBVI / под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, Гл. ред. физ.-мат. лит., 1986. — 319, [1] с.: рис., табл. — 2600 экз.
- Статья «Цинка окись» в Большой советской энциклопедии.
Дополнительная литература[править | править код]
- Özgür Ü., Alivov Ya. I., Liu C., Teke A., Reshchikov M. A., Doğan S., Avrutin V., Cho S.-J., Morkoç H. A comprehensive review of ZnO materials and devices // Journal of Applied Physics. — 2005. — Vol. 98. — P. 041301. — ISSN 00218979. — doi:10.1063/1.1992666.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами:
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
Zn(OН)2 → ZnO + H2O
3. Оксид цинка можно получить разложением нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Химические свойства
Оксид цинка — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например, оксид цинка взаимодействует с оксидом натрия:
ZnO + Na2O → Na2ZnO2
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом оксид цинка проявляет кислотные свойства.
Например, оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
ZnO + 2NaOH → Na2ZnO2 + H2O
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами. При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
ZnO + SO3 → ZnSO4
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства.
Например, оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната бария:
ZnO + BaCO3 → BaZnO2 + СО2
Оксид цинка – это белый кристаллический порошок, состоящий из молекул цинка и кислорода (ZnO).
К какому классу относится оксид цинка? Химическое соединение – оксид цинка – относится к классу неорганических соединений, а именно к классу оксидов.
Модификации ZnO
Оксид цинка 1 не существует в природе. Значительно более стабильным является оксид цинка II (ZnO). Оксид цинка II образуется при соединении металлического цинка с кислородом при нагревании до 800-1000 °C. Формула оксида цинка II (ZnO) указывает на то, что цинк в нем имеет степень окисления II.
Оксид цинка 2 – оксид цинка II(ZnO) в данном соединении цинк находится в степени окисления +2. Он является наиболее распространенной формой данного соединения.
Оксид цинка 3 – оксид цинка III (Zn2O3) также не является стабильным соединением, и его существование вызывает споры среди ученых. Некоторые исследования указывают на то, что Zn2O3 может быть получен при определенных условиях, например, при электрохимическом окислении ZnO в кислотной среде. Однако другие исследования указывают на то, что данное соединение может быть скорее смесью ZnO и ZnO2. В любом случае, оксид цинка III не имеет широкого промышленного применения и не является так же важным, как ZnO.
Оксид цинка 4 – оксид цинка IV (ZnO2) не существует в природе, и его синтезировать довольно сложно. Фактически, многие источники утверждают, что оксид цинка IV не существует вообще, так как он термодинамически нестабилен и разлагается до оксида цинка II (ZnO) и кислорода (O2) при нагревании.
Цинка оксид 5. Максимальная степень окисления цинка, которая может быть достигнута в оксиде, равна 4. Поэтому такой модификации не существует.
Оксид цинка – физические свойства
- Точка плавления: 1975°C.
- Точка кипения: 2360°C.
- Плотность: 5,61 г/см³.
- Растворимость: практически нерастворим в воде и нерастворим в этиловом спирте, но растворим в кислотах и щелочах.
- Химическая формула: ZnO.
- Молекулярный вес: 81,38 г/моль.
- Кристаллическая структура: шестигранная решетка (wurtzite).
- Индекс преломления: 2,008 – 2,029.
- Электрические свойства: полупроводник с широкой запрещенной зоной (около 3,3 электрон-вольт)
- Магнитные свойства: Zno не обладает магнитными свойствами.
Масса оксида цинка зависит от его количества, которое задается в условии задачи.
Масса оксида цинка может быть рассчитана по формуле:
масса = молярная масса x количество вещества.
Молярная масса (ZnO) равна 81,39 г/моль. Таким образом, если задано количество вещества оксида цинка, его массу можно рассчитать по указанной формуле. Если задано количество вещества, равное 0,5 моль, то его масса будет равна: масса = 81,39 г/моль x 0,5 моль = 40,695 г.
Масса оксида цинка будет равна примерно 40,7 г.
Химические свойства оксида цинка
Степень окисления атома цинка в оксиде цинка (ZnO) равна +2.
Валентность (валентная составляющая) атома в оксиде Zn (оксид цинка валентность) также равна +2. Это связано с тем, что атом цинка в данном соединении образует две ковалентные связи с кислородом, каждая из которых вносит заряд -1, тогда как у атома цинка заряд +2. Валентность атома цинка в оксиде соответствует заряду его ядра.
Оксид цинка, какой оксид – ZnO является основным оксидом.
Оксид цинка амфотерный, он способен проявлять свойства как основания, так и кислоты в реакциях с соответствующими реагентами. Это свойство связано с тем, что ZnO может реагировать как с кислотами, так и с основаниями, в зависимости от условий реакции. Сильные кислоты, такие как HCl или H2SO4, могут растворять ZnO, образуя соли цинка и воду, тогда как сильные основания, такие как NaOH или KOH, также могут растворять его, образуя гидроксид цинка и соответствующие соли.
Оксид цинка (ZnO) – химические свойства:
- Свойства основания: оксид цинка взаимодействует с кислотами, образуя соли и воду.
ZnO + H2SO4 → ZnSO4 + H2O ZnO + 2HCl → ZnCl2 + H2O.
- Свойства окислителя: ZnO может взаимодействовать с некоторыми веществами, выступая в роли окислителя. С металлами низкой активности, такими как медь и серебро: 2Ag + ZnO → 2AgO + Zn Cu + ZnO → CuO + Zn.
- Нерастворимость в воде: Zno практически не растворим в воде, но может образовывать слабый основной раствор в щелочах.
- Свойства катализатора: ZnO может быть использован в качестве катализатора при реакциях, таких как дегидрирование алканов, превращение метанола в водород и углекислый газ, а также гидрогенирование органических соединений. Например: CH3OH + ZnO → Zn + H2O + CH2O (превращение метанола в формальдегид)
- Свойства редокс-систем: ZnO может взаимодействовать с другими веществами в редокс-реакциях, таких как восстановление металлов или окисление соединений. Например: ZnO + C → Zn + CO (восстановление оксида цинка углеродом) 2ZnO + 2CO → 2Zn + 2CO2 (восстановление оксида цинка угарным газом) ZnO + H2 → Zn + H2O (восстановление оксида цинка водородом).
Оксид цинка кислота – ZnO не является кислотой, поскольку он не может выступать в реакциях как донор протона (H+). Напротив, он обладает основными свойствами, так как реагирует с кислотами, образуя соли цинка и воду. Однако, следует отметить, что оксид цинка является амфотерным веществом, то есть способным проявлять свойства как основания, так и кислоты в зависимости от условий реакции.
Какие с оксидом цинка реагируют вещества
Кислоты: реагирует с кислотами, образуя соответствующие цинковые соли и воду. Например:
ZnO + 2 HCl → ZnCl2 + H2O
Металлы. Оксид цинка взаимодействует с некоторыми металлами, образуя соответствующие цинковые сплавы.
ZnO + Cu → Zn + CuO
Вода: ZnO может растворяться в воде, образуя щелочную среду из-за образования гидроксида цинка. Реакция происходит следующим образом:
ZnO + H2O → Zn(OH)2
Карбонаты: ZnO может реагировать с карбонатами, образуя соответствующие цинковые карбонаты. Например:
ZnO + CO2 + H2O → ZnCO3 · 2H2O
Оксид цинка +и оксид натрия
Реакция между оксидом цинка (ZnO) и оксидом натрия (Na2O) происходит при нагревании с образованием соединения натрия и цинка – натрийцинкат (Na2ZnO2):
ZnO + Na2O → Na2ZnO2
Уравнение реакции можно сократить наименьшими целыми числами:
2 ZnO + Na2O → Na2ZnO2
Взаимодействие цинка +с оксидами
2 Fe2O3 + 3 Zn → 3 Zn
Цинк может взаимодействовать с оксидами алюминия (Al2O3) и меди (CuO), образуя соответствующие соли цинка:
2 Al2O3 + 3 Zn → 3 ZnO + 4 Al
Zn + CuO → ZnO + Cu.
Образование продуктов реакции зависит от конкретных условий реакции, таких как температура, давление, наличие катализаторов и т.д.
Сульфид цинка оксид цинка
Сульфид цинка (ZnS) и ZnO могут реагировать между собой, образуя оксисульфид цинка (ZnO·ZnS), который является соединением оксида и сульфида цинка. Реакция может происходить при нагревании сульфида цинка в присутствии кислорода или воздуха:
2 ZnS + 3 O2 → 2 ZnO·ZnS.
Также оксид и сульфид цинка могут реагировать в присутствии кислоты, например, соляной кислоты или серной кислоты, образуя соответствующие соли и выделяя газы:
ZnS + 2 HCl → ZnCl2 + H2S↑
ZnO + H2SO4 → ZnSO4 + H2O
Здесь ZnCl2 и ZnSO4 представляют собой хлорид цинка и сульфат цинка, соответственно.
Оксид цинка +и гидроксид натрия
Реакция между оксидом цинка (ZnO) и гидроксидом натрия (NaOH) приводит к образованию гидроксида цинка (Zn(OH)2) и натрия цинката (Na2ZnO2):
ZnO + 2NaOH → Na2ZnO2 + H2O
2ZnO + 2NaOH + 2H2O → 2Na[Zn(OH)4]
При этом, если количество NaOH ограничено, то в результате образуется гидроксид цинка (Zn(OH)2):
ZnO + NaOH + H2O → Na[Zn(OH)3]
Эти реакции показывают, что оксид может реагировать с гидроксидом натрия, образуя гидроксид цинка и натрия цинкат.
Оксид цинка +с серой
Рассматриваемое соединение может реагировать с серой при высоких температурах, образуя сульфид цинка:
ZnO + S → ZnS + O.
Реакция оксида цинка с кислотой
Оксид цинка (ZnO) реагирует с соляной кислотой (HCl), образуя соответствующую соль и воду. Оксид цинка уравнение реакции:
ZnO + 2 HCl → ZnCl2 + H2O
В данной реакции ZnO выступает в роли основания, принимая на себя протон от кислоты, и образуя соль цинка (ZnCl2) и воду (H2O). Оксид нейтрализует кислоту. Эта реакция происходит быстро и с выделением тепла.
Реакция оксида цинка (ZnO) с азотной кислотой (HNO3) приводит к образованию цинкового нитрата (Zn(NO3)2) и воды (H2O):
ZnO + 2HNO3 → Zn(NO3)2 + H2O
Реакция оксида цинка с серной кислотой (H2SO4) может происходить при различных условиях. В зависимости от концентрации серной кислоты и температуры, могут образовываться различные продукты. При растворении ZnO в разбавленной серной кислоте (H2SO4) образуется сульфат цинка (ZnSO4) и вода (H2O):
ZnO + H2SO4 → ZnSO4 + H2O
Однако при нагревании концентрированной серной кислоты с оксидом цинка может происходить более сложная реакция, которая приводит к образованию оксида дицинка (Zn2O2SO4) и воды:
2ZnO + 2H2SO4 → Zn2O2SO4 + 2H2O
Эта реакция может использоваться для получения Zn2O2SO4 в лабораторных условиях.
Оксид цинка, гидроксид цинка реакция
Реакция между оксидом цинка и водой приводит к образованию гидроксида цинка:
ZnO + H2O → Zn(OH)2.
Гидроксид цинка можно также получить при нейтрализации раствора цинковой соли (например, цинкового нитрата) щелочью:
Zn(NO3)2 + 2 NaOH → Zn(OH)2 + 2 NaNO3
Обратная реакция, т.е. распад гидроксида Zn на оксид и воду, происходит при нагревании:
Zn(OH)2 → ZnO + H2O
Цинк, оксид цинка, хлорид цинка, гидроксид цинка – что общего и в чем различие
Все перечисленные вещества содержат цинк в своем составе.
Цинков оксид (ZnO) – это белый порошок, который используется в качестве пигмента и наполнителя в различных промышленных областях, а также в косметике и солнцезащитных средствах.
Цинка хлорид (ZnCl2) – это белый порошок, который используется в качестве дезинфицирующего средства, в производстве клеев и пластмасс, а также в качестве катализатора в химических реакциях.
Цинковый гидроксид (Zn(OH)2) – это белый порошок, который используется в качестве коагулянта для очистки воды, а также в производстве красок и лаков.
Однако химически эти вещества различаются в своей структуре и свойствах.
Цинк оксид (ZnO) – это соединение цинка с кислородом. Оно имеет кристаллическую структуру и обладает свойствами полупроводника.
Хлорид цинка (ZnCl2) – это соль, состоящая из ионов цинка и хлорида. Она имеет высокую растворимость в воде и обладает высокой степенью гигроскопичности.
Гидроксид цинка (Zn(OH)2). Гидроксид цинка образуется в результате реакции цинка с водой. Он является слабой щелочью и обладает свойствами коагулянта.
Все перечисленные вещества содержат цинк, они имеют разную химическую структуру и свойства, что делает их уникальными в различных применениях.
Эти соединения имеют широкое применение в различных отраслях промышленности и быта благодаря свойствам цинка, таким как его антибактериальные и противовоспалительные свойства, а также способность улучшать состояние кожи и волос.
Цинк, оксид цинка, хлорид цинка – гидроксид цинка, можно ли получить из перечисленных химикатов гидроксид цинка?
Один из способов получения гидроксида цинка – это растворение цинка или оксида цинка в кислоте и последующее осаждение гидроксида цинка добавлением гидроксида натрия или другого щелочного раствора.
Zn + 2HCl → ZnCl2 + H2↑.
ZnO + 2HCl → ZnCl2 + H2O.
Затем можно добавить гидроксид натрия (NaOH) или другой щелочный раствор, чтобы осадить гидроксид цинка:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
Хлорид цинка также можно использовать для получения гидроксида цинка путем осаждения его с помощью гидроксида натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
Гидроксид цинка можно получить из перечисленных химических соединений цинка, если провести соответствующие реакции.
Гидроксид цинка, оксид цинка – вода
Гидроксид цинка (Zn(OH)2), оксид цинка (ZnO) и вода (H2O) – это все соединения цинка и кислорода или воды.
Химически, гидроксид цинка и оксид цинка являются соединениями цинка с кислородом, но различаются по количеству связанных с ним атомов водорода. Гидроксид цинка содержит два атома водорода, а оксид цинка не содержит водорода вообще.
С практической точки зрения, гидроксид цинка и оксид цинка имеют различные свойства и применения. Гидроксид цинка используется в качестве антибактериального и противогрибкового средства в косметике, в то время как оксид цинка используется в качестве солнцезащитного средства в косметике и других продуктах для защиты от УФ-лучей.
Вода, с другой стороны, является важнейшим растворителем, участвует во многих химических реакциях и не имеет никакого отношения к цинку и его соединениям.
Оксид цинка может реагировать с водой, образуя цинковый гидроксид.
ZnO + H2O → Zn(OH)2
При добавлении воды к оксиду цинка, образуется цинковый гидроксид. Эта реакция является экзотермической, то есть выделяет тепло.
Цинк, оксид цинка, нитрат цинка – гидроксид
Все вещества содержат элемент цинк (Zn), но являются разными соединениями с разными свойствами.
Цинковый оксид (ZnO) – это белый порошок, который используется в качестве пигмента в косметике и красках, а также в производстве резиновых изделий, керамики, стекла и других материалов. Он также используется в медицине как противовоспалительное и противомикробное средство.
Цинковый нитрат (Zn(NO3)2) – это белый кристаллический порошок, который используется в качестве катализатора, в производстве пищевых добавок и удобрений, а также в медицине для лечения грибковых инфекций и как антисептик.
Цинковый гидроксид (Zn(OH)2) – это белый кристаллический порошок, который используется в качестве катализатора, в производстве красителей и пластмасс, а также как антисептик и противогрибковое средство.
Все три соединения содержат цинк, который является химическим элементом с атомным номером 30 в периодической таблице элементов. Также все три соединения имеют сходные физические свойства, такие как белый цвет и не растворимость в воде, но каждое из них имеет уникальные свойства и применения в различных отраслях промышленности и медицине.
Цинк, оксид цинка и нитрат цинка могут быть использованы для получения гидроксида цинка. Один из способов получения гидроксида цинка – это растворение цинка или оксида цинка в кислоте и последующее осаждение гидроксида цинка добавлением гидроксида натрия или другого щелочного раствора:
Zn + 2HCl → ZnCl2 + H2↑.
ZnO + 2HCl → ZnCl2 + H2O.
Zn(NO3)2 + 2NaOH → Zn(OH)2 + 2NaNO3.
Полученный осадок гидроксида цинка можно затем отфильтровать, высушить и использовать в различных приложениях, таких как производство резиновых изделий, лаков, красок и других промышленных продуктов.
Оксид цинка – методики получения
- Обжиг цинковых руд: Этот метод включает нагревание цинковых руд в печах до температуры около 1000 градусов Цельсия. В результате обжига образуется ZnO, который может быть выделен из продуктов обжига.
- Химический метод: ZnO может быть получен путем реакции гидроксида цинка или карбоната цинка с кислотами или щелочами. Например, растворение карбоната цинка в серной кислоте:
ZnCO3 + H2SO4 → ZnSO4 + CO2 + H2O
1.Электрохимический метод: Оксид цинка образуется путем электролиза водных растворов солей Zn, таких как сульфат Zn. При электролизе водного раствора сульфата цинка на аноде образуется кислород, а на катоде — металлический цинк. При этом образуется оксид цинка в виде белого порошка:
2ZnSO4 + 2H2O → 2ZnO + 2H2SO4 + O2
2.Промышленный метод: ZnO также может быть получен в результате промышленного процесса горения цинковых испарителей. В результате горения образуется тонкодисперсный порошок цинкового оксида, который может быть отделен от продуктов горения.
3.Метод золь-гель: Этот метод включает диспергирование цинковой соли в органическом растворе, за которым следует обработка смеси органического раствора и цинковой соли теплом или ультразвуком. В результате образуется цинковый оксид в виде геля, который может быть затем отожжен для получения ZnO.
Оксид цинка – области применения
- Производство резин и пластмасс: применяется в качестве заполнителя и стабилизатора при производстве резин и пластмасс.
- Производство керамики: используется в качестве главного компонента при производстве электрокерамики, которая применяется в электронике и других отраслях.
- Производство стекла: применяется в качестве катализатора при производстве стекла – окна, зеркала и другие изделия.
- Косметическая и фармацевтическая промышленность – используется в качестве ингредиента в косметических и фармацевтических продуктах, таких как кремы, лосьоны, пудры и прочее, благодаря его свойствам защиты кожи от ультрафиолетовых лучей и антисептическим свойствам.
- Производство красок – в производстве красок, покрытий и пигментов, благодаря своей белизне и способности усиливать яркость цветов.
- Производство аккумуляторов: используется в качестве катализатора и проводника при производстве аккумуляторов.
- Производство катализаторов: в качестве катализатора в химических реакциях, таких как производство синтетических материалов и других органических соединений.
- Ветеринарная медицина.
| Оксид цинка | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Цинка оксид |
| Хим. формула | ZnO |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Температура | |
| • плавления | 3587 ± 1 °F |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Показатель преломления | 2,015 и 2,068 |
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| ГОСТ | ГОСТ 10262-73 |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES |
O=[Zn] |
| InChI |
1S/O.Zn XLOMVQKBTHCTTD-UHFFFAOYSA-N |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Предельная концентрация | аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) | H410 |
| Меры предостор. (P) | P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид цинка (окись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Нахождение в природе
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В электронике
- 4.3 В медицине
- 5 Безопасность и токсичность

Свойства
Физические свойства
- Теплопроводность: 54 Вт/(м·К).
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.

Химические свойства
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, Na2[Zn(OH)4], Ba2[Zn(OH)6] и др.):
- [Zn(OH)3]− + OH− ⟶ [Zn(OH)4]2−
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
- ZnO + 4NH3 + H2O ⟶ [Zn(NH3)4](OH)2
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
- ZnO + 2NaOH ⟶ Na2ZnO2 + H2O
- ZnO + CoO ⟶ CoZnO2
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
- ZnO + B2O3 ⟶ Zn(BO2)2
- ZnO + SiO2 ⟶ ZnSiO3
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент.
Нахождение в природе
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение
- Сжиганием паров цинка в кислороде («французский процесс»).
- Термическим разложением некоторых солей цинка:
- ацетата Zn(CH3COO)2;
- гидроксида Zn(OH)2;
- карбоната ZnCO3;
- нитрата Zn(NO3)2.
- Окислительным обжигом сульфида ZnS.
- С помощью гидротермальный синтез
- Извлечением из пылей и шламов заводов чёрной металлургии, особенно перерабатывающих металлолом (он содержит значительную долю оцинкованного железа).

Применение
Оксид цинка широко применяют в химической, фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в косметических кремах для загара и косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
- Активатор вулканизации некоторых типов каучуков.
- Вулканизирующий агент хлоропреновых каучуков.
- Катализатор получения метанола.
- Белый пигмент при производстве красок и эмалей (в настоящее время (2007 г.) вытесняется нетоксичным диоксидом титана TiO2).
- Наполнитель и пигмент в производстве:
- резины;
- пластмасс;
- бумаги;
- парфюмерных и косметических средств.
- Добавка к кормам для животных.
- В производстве стекла и красок на основе жидкого стекла;
- Как один из компонентов преобразователя ржавчины.
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
В электронике
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создан светодиод голубого цвета.
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине

В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность
Соединение малотоксично, но его пыль вредна для органов дыхания, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни.
Оксид цинка, характеристика, свойства и получение, химические реакции.
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка
Физические свойства оксида цинка
Получение оксида цинка
Химические свойства оксида цинка
Химические реакции оксида цинка
Применение и использование оксида цинка
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 оС сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.)
цинкит (рус.) цинковые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5610 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,61 |
| Температура сублимации, °C | 1800 |
| Температура плавления, °C | 1975 |
| Молярная масса, г/моль | 81,408 |
| Теплопроводность, Вт/(м·К) | 54 |
* Примечание:
— нет данных.
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
- 1. сжиганием цинка в кислороде:
2Zn + О2 → 2ZnО (t > 250 oC).
- 2. путем термического разложения гидроксида цинка:
Zn(OH)2 → ZnO + H2О (t = 100-250 oC).
- 3. путем термического разложения карбоната цинка:
ZnCO3 → ZnO + CO2 (t = 200-300 oC).
- 4. путем термического разложения нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2 (t = 300-500 oC).
- 5. путем окислительного обжига сульфида цинка:
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 oC).
- 6. путем термического разложения ацетата цинка.
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 oC).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 oC.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 oC),
2ZnО + SiО2 → Zn2SiО4 (t = 900-1000 oC).
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
ZnО + SО2 → ZnSО3.
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
ZnО + B2О3 → Zn(BО2)2.
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО → Zn + CO2 (t = 700 oC).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО → BaZnО2 (t = 1100 oC).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
ZnО + CrО3 → ZnCrО4.
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
ZnО + Fe2О3 → Fe2ZnО4 (t = 800-1000 oC),
ZnО + Fe2О3 → ZnFe2О4 (t = 800-1000 oC).
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
ZnО + MoО3 → ZnMoО4.
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
2ZnО + VО2 → Zn2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
3ZnО + MnО2 → MnZn3О5 (t = 700-800 oC),
ZnО + Mn2О3 → ZnMn2О4 (t = 900 oC).
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 → ZnWО4 (t = 600-800 oC).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 oC).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
ZnO + 2HF → ZnF2 + H2O.
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
ZnO + 2HNO3 → 2Zn(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
3ZnO + 2H3PO4 → Zn3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
ZnO + 2HBr → ZnBr2 + H2O.
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
ZnO + 2HI → ZnI2 + H2O.
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 oC).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 oC).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 oC),
ZnO + 2NaOH + H2O → Na2[Zn(OН)4] (t = 90 oC).
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 oC.
23. реакция оксида цинка с гидратом аммиака:
ZnО + 4(NH3•H2O) → [Zn(NH3)4](OH)2 + 3H2O.
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
ZnО + 2NH4Cl → ZnCl2 + 2NH3 + H2O (t°).
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид цинка реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида цинка
реакции с оксидом цинка
Коэффициент востребованности
9 304

![{displaystyle {ce {[Zn(OH)3]- + OH- -> [Zn(OH)4]^{2-}.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b990d10b8bc1e36ed7dccc6b6a9b2fc1d3cb3054)
2.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c12136821e205c3f6c42331779fc8803ac9e0f57)




