Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» – краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
–
HCl соляная
кислота Cl хлорид
–
HF фтороводородная
кислота F фторид
–
HBr бромоводородная
кислота Br бромид
–
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
–
HNO3
азотная кислота NO3 нитрат
–
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
–
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Презентация может быть использована на уроке химии в 8 классе по теме “Соли” для отработки навыков составления формул солей или первичного закрепления темы “Соли“, или для проверки умения составлять формулы и давать названия солям.
На первом слайде дается алгоритм составления формул солей.
На втором слайде в овальных фигурах записаны формулы кислот и оснований, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
На третьем слайде в прямоугольниках записаны формулы килотных и основных оксидов, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами оксидов пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления. Задания расположены в порядке усложнения.
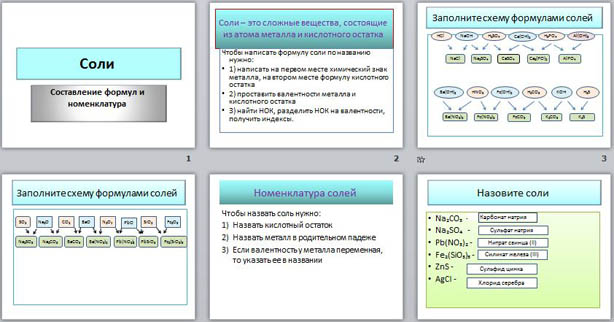
На четвертом слайде дан алгоритм составления названий солей.
На пятом слайде даны формулы солей, которые ученик должен назвать. Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Соли – это сложные вещества, состоящие из атома металла и кислотного остатка.
Чтобы написать формулу соли по названию нужно:
1) написать на первом месте химический знак металла, на втором месте формулу кислотного остатка
2) проставить валентности металла и кислотного остатка
3) найти НОК, разделить НОК на валентности, получить индексы.
Как составить формулы солей по химии
Знаток
(299),
закрыт
15 лет назад
Настя Ушанова
Профи
(712)
15 лет назад
Берешь любую кислоту заменяешь водород на нужный металл и все. Главное надо учитывать степень окисления металла. Например: КF(окисление у фтора +1);BaFдва (окисление у бария +2)
Inno4k@
Гуру
(2870)
15 лет назад
Вообще всё зависит от химического уравнения…. К примеру можешь взять основание NaOH и кислоту H3PO4 и получишь соль Na3PO4 и ещё вода будет (Н2О). Химическая формула солей состоит из мееталла и кислотного остатка.
Mozes Pombl4Мастер (1299)
15 лет назад
Скорее будет образовываться Na2HPO4, т.к. третья константа кислотности азотной кислоты крайне мала, тогда как очень велика константа гидролиза фосфата натрия по первой ступени.
Mozes Pombl4
Мастер
(1299)
15 лет назад
Разбирая химическую формулу соли, мы неприменно должны обнаружить по меньшей мери две части. Это катион и анион. Катион – составляющая частица соли, ион, имеющий положительный заряд. Анион – отрицательный. В качестве катиона могут выступать ионы металлов, ион аммония (NH4+) и ион водорода (в кислых солях, например NaHCO3). Анионом могут быть известные нам кислотные остатки, ОН группа (в основных солях, например Са (ОН) Cl ), а также составные комплексные ионы (часто это применимо для амфотерных металлов, к примеру соль Na2[Zn(OH)4] ).
Для составления формул необходимо знать заряды соответствующих ионов (это плюсик или минусик, с цифрой или без, который рисуется сверху справа у значка иона) . Далее руководствуемся правилом, что молекула соли всегда заряжена нейтрально, тоесть домножаем зарады катиона и аниона на соответствующие коэффициенты, чтобы в сумме они давали нуль. К примеру, имеем ионы Са2+ и РО4 3-, т. е. нужно домножить Са2+ на 3, а РО4 3- на 2. 3*2 + 2*(-3) = 0. Формула Са3(РО4)2.
Источник: моцке
дарья верхола
Ученик
(156)
6 лет назад
Формулы солей содержат металл и кислотный остаток, т. е. на первом месте обяъательно должен стоять металл, а на втором кислотный остаток!!!!
Формулы соли составить просто, например хлорид меди (II) – эта II – двойка, показывает, что медь двухвалентна, т. е. заряд у меди будет +2, а так как у хлора он всегда с металлами -1, то все дальше просто:
CuCl2
Нитрат натрия – натрий одновалентный металл, т. е. его степень окисления всегда +1, у нитрат – аниона всегда -1, значит формула:
NaNO3
P.S. Если не понятно, пиши в ЛС объясню по – другому)))
P.S. Если хочешь по практиковаться – пиши в ЛС, скину названия солей, а ты мне в ответ их составишь))))))
Слайд 1
Вещества Простые Сложные Металлы Неметаллы Оксиды Основание ? кислоты
Слайд 2
2 3 К какому классу соединений относятся вещества, дать им названия
Слайд 3
Задание1 На какие группы и по каким признакам можно разделить вещества , формулы которых приведены ниже ? Na 2 O ; H 2 CO 3 ; ; H 2 SiO 3 Ca (NO 3 ) 2 Ca CO 3 Na Cl Cr 2 S 3 Na OH ; О 2 ; Al 2 O 3 ; Ca (OH) 2 ; С Са O ; А l; N 2 ; Al (OH) 3 ; S ; С О 2 ; H 2 SO 3 ; SO 2 ; Ca; Na формулы запишите в схему:
Слайд 4
Вещества Простые Сложные Металлы А l , Ca , Na Неметаллы S , С , N 2 , , О 2 Оксиды Na 2 O , Al 2 O 3 , Са O , СО 2 , SO 2 Основание Ca (OH) 2 , NaOH , Al(OH) 3 Ca ( NO 3 ) 2 Ca CO 3 Na Cl Cr 2 S 3 ? кислоты H 2 CO 3 ; , H 2 SiO 3 , H 2 SO 3
Слайд 5
Задание 2 Вставьте пропущенный фрагмент. S —— S О 2 —– H 2 SO 3 Na —-Х—– Na ОН С ——- Х —- H 2 CO 3 Ca —– Ca O —– Ca (OH) 2 Х ХХ Ca CO 3
Слайд 6
проверка S —— S О 2 —– H 2 SO 3 Na —- Na 2 O —– Na ОН ? ? ? С ——- С О 2 —- H 2 CO 3 Ca —– Ca O —– Ca (OH) 2 Na 2 SO 3 Ca CO 3
Слайд 9
Цель урока: Изучить состав, названия солей, классификацию, свойства и применение. План 1.Соли. Их состав и номенклатура ( название). 2. Составление формул солей по их названиям. 3. Классификация. 4. Представители данного класса. 5. Проверка знаний. 6. Подведение итогов урока. 7. Домашнее задание.
Слайд 10
1. Соли. Их состав и номенклатура (название).
Слайд 11
СОЛИ Na OH H Cl + – + _
Слайд 12
Соли – это сложные вещества, которые состоят из ионов металла и кислотного остатка
Слайд 13
3 задание. Определить : почему у солей разное количество кислотных остатков Дайте обоснованный ответ. NaNO 3 Ca (NO 3 ) 2 Al (NO 3 ) 3
Слайд 14
3 задание. Na +1 Ca +2 Al +3 Имеют разную степень окисления. (см. таблицу растворимости)
Слайд 15
задание 4 . Определить : почему у солей разное количество ионов металла? Дайте обоснованный ответ. Na NO 3 Na 2 С O 3 Na 3 Р – O 4
Слайд 16
Так как кислотные остатки имеют свою степень окисления: (см. таблицу растворимости) NO 2 -1 – нитрит NO 3 -1 – нитрат SO 3 -2 – сульфит SO 4 -2 – сульфат С O 3 -2 – карбонат Р – O 4 -3 – фосфат Cl -1 – хлорид SiO 3 -2 -силикат
Слайд 17
Выведем общую формулу солей ? Ме + n (К. О. – m ) n
Слайд 18
Алгоритм названия солей Название Соли Название кислотного остатка Название металла в родительном падеже Кислотные остатки NO 2 -1 – нитрит NO 3 -1 – нитрат SO 3 -2 – сульфит SO 4 -2 – сульфат С O 3 -2 – карбонат Р – O 4 -3 – фосфат Cl -1 – жлорид SiO 3 -2 -силикат Стр. 76 таблица С.О. римскими цифрами + + = 8
Слайд 19
Алгоритм названия солей Fe +2 ( NO 3 -1 ) 2 – нитрат железа ( II ) Fe +3 ( NO 3 -1 ) 3 – нитрат железа ( III ) Название металла в родительном падеже С.О. римскими цифрами Название Соли Название кислотного остатка = + + Назовите соль: Zn SO 4 -2 Al Cl 3 Cu ( NO 3 -1 ) 2
Слайд 20
задание 5 . НАЗОВИТЕ СОЛИ Na Cl Fe +2 SO 4 Al 3 ( PO 4 ) 3 Ca (NO 3 ) 2 Cu +2 CO 3 Cr 2 +3 S 3 Na 2 SO 4 Ba (NO 3 ) 2
Слайд 21
задание 5 . НАЗОВИТЕ СОЛИ Na Cl – хлорид натрия Fe +2 SO 4 – сульфат железа ( II ) Al 3 ( PO 4 ) 3 – фосфат алюминия Ca (NO 3 ) 2 – нитрат кальция Cu +2 CO 3 – карбонат меди ( II ) Cr 2 +3 S 3 – сульфид хрома ( III ) Na 2 SO 4 – сульфат натрия Ba (NO 3 ) 2 – нитрат бария
Слайд 22
Контрольное задание1 Установите соответствие между формулой вещества и его названием ФОРМУЛА ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА 1 Na 2 SO 4 А Сульфид меди ( I) 2 Cu 2 S Б Сульфид меди ( II ) 3 Cu S В Сульфат натрия 1 2 3 В А Б
Слайд 23
2. Составление формул солей по их названиям.
Слайд 24
1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Алгоритм составления формул солей : Составить химическую формулу сульфата железа ( III ) (первый способ) Fe SO 4 Соли – это сложные вещества, которые состоят из ионов металла и кислотного остатка Первый пункт выполнили переходим ко второму
Слайд 25
2 . Над знаками химических элементов поставь их степень окисления. Пример: Fe SO 4 +3 -2 Второй пункт выполнили переходим к третьему
Слайд 26
7 42 35 28 21 14 7 7 42 6 30 12 6 6 6 6 35 30 5 20 15 10 5 5 28 24 20 4 12 4 4 4 21 6 15 12 3 6 3 3 14 6 10 4 6 2 2 2 7 6 5 4 3 2 1 1 7 6 5 4 3 2 1 Таблица для определения Н.О.К. 3 . Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример: Составить химическую формулу сульфата железа ( III ). Fe SO 4 +3 -2 6 Третий пункт выполнили переходим ко четвертому Н.О.К. (наименьшее общее кратное) – это число, которое делится на исходные числа без остатка.
Слайд 27
4. Раздели Н.О.К. на степень окисления каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу сульфата железа ( III ).. Fe ( SO 4 ) +3 -2 2 3 6 2 3 Формула составлена 6 6 3 2 : : = =
Слайд 28
Составить формулу сульфата алюминия: (второй способ) Составьте формулы: Упр. 3 стр. 78 Al 2 + SO 4 3 9 3 2
Слайд 29
Составьте формулу хлорида кальция Са Cl 2 Составьте формулу нитрата натрия Na NO 3 Zn( SO 4 ) 2 Cu NO 3 Составьте формулу сульфата цинка Составьте формулу хлорида свинца ( II ) Составьте формулу нитрата меди ( I ) Pb Cl 2 Контрольное задание 2
Слайд 30
3. Отдельные Представители стр.77 в таблицу 2 хлорид натрия название формула Нахождение в природе Значение и применение хлорид натрия
Слайд 31
NaCl
Слайд 32
“Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман
Слайд 33
За 4 года человек съедает пуд соли (в год человек с пищей потребляет 3-5,5 кг соли)
Слайд 34
Соль в геральдике российских городов Герб Бахмута Герб Солигалича Герб Сольвычегодска Герб Энгельса Герб Усолья-Сибирского Герб Дрогобыча
Слайд 35
Добыча соли из соляных шахт из соленых озер
Слайд 36
На озере Баскунчак ежегодно добывается около 5 млн. тонн соли
Слайд 37
Применение NaCl
Слайд 38
Д/З: CaCO 3
Слайд 39
Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет
Слайд 40
Большой Барьерный риф в Австралии
Слайд 41
Меловые горы
Слайд 42
Минералы карбоната кальция находятся в горных породах: Известняк Мел Мрамор Мрамор Мрамор Мрамор Травертин
Слайд 43
Мрамор – строительный материал Единственное в России здание, полностью построенное из нешлифованного мрамора — железнодорожный вокзал в городе Слюдянка Иркутской области
Слайд 44
Д/З: Фосфат кальция – основа минералов фосфоритов и апатитов
Слайд 45
3.КЛАССИФИКАЦИЯ: а)по растворимости СОЛИ
Слайд 46
Лабораторный опыт. №1 Определите растворимость солей Для этого: -прибавьте в первую пробирку к хлориду натрия 5-10 мл воды ; прибавьте во вторую пробирку к карбонату кальция 5-10 мл воды Что произошло? Вывод:
Слайд 47
3.КЛАССИФИКАЦИЯ: а)по растворимости NaCl CaCO 3 таблица растворимости СОЛИ Растворимые Нерастворимые
Слайд 48
а)по составу СОЛИ ? ? ?
Слайд 49
Лабораторный опыт. №2 Определите в какой из трех пробирок находятся кислота, в какой щелочь, в какой соль, хлорид натрия. прибавьте в пробирку №1 универсальный лакмус прибавьте в пробирку №2 универсальный лакмус прибавьте в пробирку №3 универсальный лакмус Что произошло? Результаты опыта оформите в таблицу:
Слайд 50
Изменение окраски индикатора Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы кислот можно распознать среди растворов других веществ. Это реакции с индикаторами. Название индикатора Окраска индикатора универсального лакмуса В кислой среде ( H +1 ) В нейтральной среде ( H +1 = О H -1 ) В щелочной среде (О H -1 )
Слайд 51
Что сделали Что наблюдали Вывод Контрольное задание3 Ответте на вопросы: 1.Какая окраска индикатора в растворе хлорида натрия. Почему? 2.Раствор хлорида натрия. является : кислым, щелочным или нейтральным? 3. Следовательно соль хлорид натрия какая?
Слайд 52
а)по составу NaCl Ba(NO 3 ) 2 СОЛИ средние Кислые ? Основные ?
Слайд 53
Подведем итоги?
Слайд 54
Контрольное задание – итоговое Часть А (задания с выбором ответа) 1. Соли – это сложные вещества: А) состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид- ионов. Б) состоящие из ионов металлов и кислотных остатков; В) состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2; Г) молекулы, которых состоят из ионов водорода и кислотных остатков. 2. Хлорид железа ( III ) имеет формулу: А) FeCl 3 ; B ) Fe 2 O 3 ; Б) FeCl 2 ; Г) FeO .
Слайд 55
Контрольное задание – итоговое Часть В Выбери лишнее вещество и объясни почему? Игра « Третий лишний» 1. Ba SO 4 ; Ca CO 3 ; NaCl . 2. NaCl, Na 2 SO 4 , NaOH 3 Al 2 (SO 4 ) 3 , H 2 SO 4 , CaSO 4 4. Cu(NO 3 ) 2 , CuO, CuCl 2 5. CaCl 2 , PbS, Ba SO 4 .
Слайд 56
Контрольное задание – итоговое Часть А Г А Часть В объясни почему? 1. NaCl . т.к… 2. NaOH т.к… 3 H 2 SO 4 , т.к… 4. CuO, т.к… 5. CaCl 2 т.к…
Слайд 57
Домашнее задание §,21 упр.3 стр. 78 Составить презентацию фосфата кальция или опорный конспект в форме таблицы
Слайд 58
Рефлексия 1. Сегодня я узнал… 2. Было интересно… 3. Было трудно… 4. Я выполнял задания… 5. Я понял, что… 6. Теперь я могу… 7. Я почувствовал, что… 8. Я приобрёл… 9. Я научился… 10. У меня получилось… 11. Я смог… 12. Попробую… 13. Меня удивило… 14.Урок мне дал для жизни… 15. Мне захотелось…
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Содержание
-
1.
Правила составления формул солей 8 класс -
2.
2. На второе место – кислотный остатокПравила -
3.
2. На второе место – кислотный остатокПравила -
4.
2. На второе место – кислотный остатокПравила -
5.
Слайд 5 -
6.
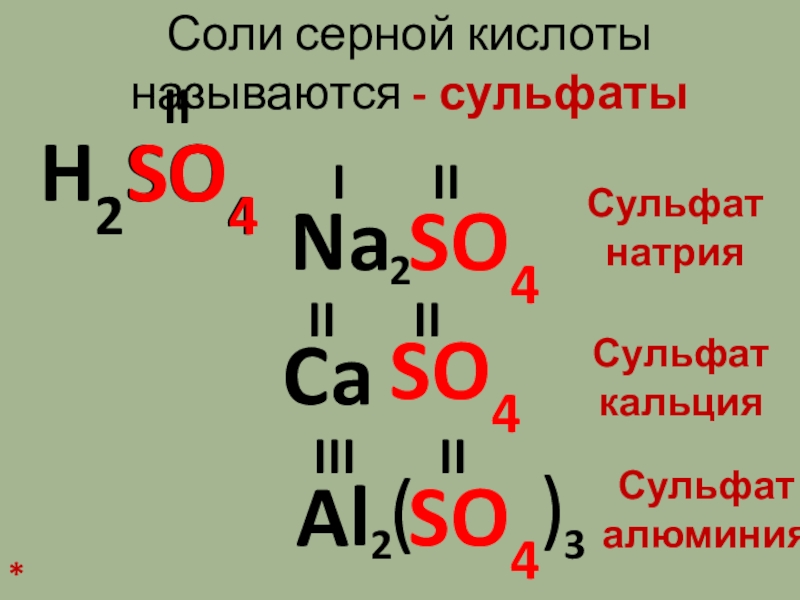
Соли серной кислоты называются – сульфатыH2SO4SO4IISO4CaNaSO4AlSO4IIIIIIIIIIII22()3Сульфат натрияСульфат кальцияСульфат алюминия* -
7.
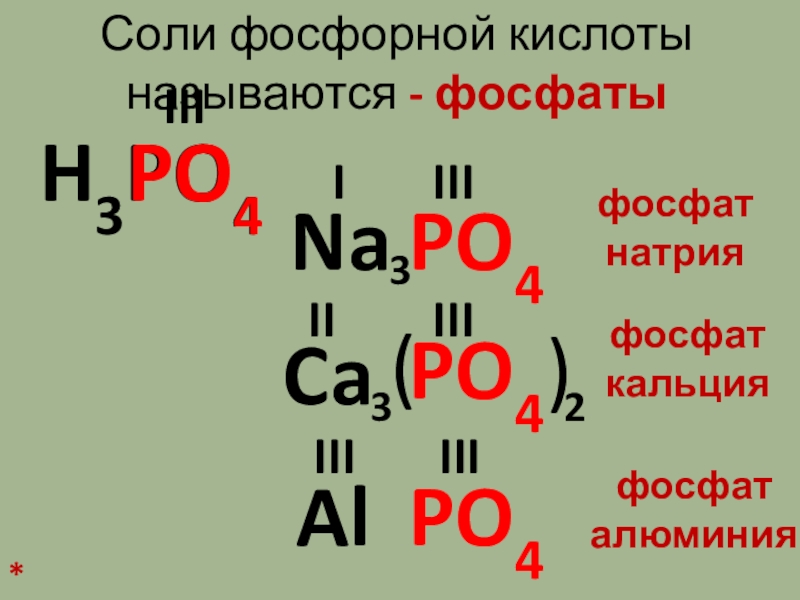
Соли фосфорной кислоты называются – фосфатыH3PO4PO4IIIPO4CaNaPO4AlPO4IIIIIIIIIIIIIII32 ()3фосфат натрияфосфаткальцияфосфаталюминия* -
8.
Соли угольной кислоты называются – карбонатыH2СO3СO3IIСO3CaNaСO3AlСO3IIIIIIIIIIII2карбонатнатриякарбонаткальциякарбонаталюминия* ()23 -
9.
Слайд 9
2. На второе место – кислотный остатокПравила составления формул солей:1. На первое место в формуле соли пишется металл3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислоте
Слайд 1Что такое соль?
*
Соли – сложные вещества, состоящие из атомов металла и

Слайд 22. На второе место – кислотный остаток
Правила составления
формул солей:
1. На
первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислоте
Нитрат алюминия
Al
NO3
(
)
III
I
3

Слайд 32. На второе место – кислотный остаток
Правила составления
формул солей:
1. На
первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислоте
Силикат калия
K
SiO3
I
II
2

Слайд 42. На второе место – кислотный остаток
Правила составления
формул солей:
1. На
первое место в формуле соли пишется металл
3. Валентность металла равна номеру группы, а валентность кислотного остатка определяем по кислоте
Фосфат магния
Mg
PO4
II
III
3
2
(
)

Слайд 6Соли серной кислоты называются – сульфаты
H2SO4
SO4
II
SO4
Ca
Na
SO4
Al
SO4
II
II
II
I
II
III
2
2
(
)
3
Сульфат
натрия
Сульфат
кальция
Сульфат
алюминия
*
Слайд 7Соли фосфорной кислоты называются – фосфаты
H3PO4
PO4
III
PO4
Ca
Na
PO4
Al
PO4
III
III
III
I
II
III
3
2
(
)
3
фосфат
натрия
фосфат
кальция
фосфат
алюминия
*
Слайд 8Соли угольной кислоты называются – карбонаты
H2СO3
СO3
II
СO3
Ca
Na
СO3
Al
СO3
II
II
II
I
II
III
2
карбонат
натрия
карбонат
кальция
карбонат
алюминия
*
(
)
2
3

