Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
Щёлочь – понятие более узкое, гидроксид – более широкое. То есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
Например, гидроксид натрия NaOH. Натрий находится в первой группе периодической таблицы, это щелочной металл. Поэтому NaOH – это щёлочь. Но если вы назовёте его гидроксидом, ошибкой это не будет.
Другой пример. Гидроксид меди (II) Сu(OH)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу Менделеева. Медь находится в первой группе, но не в основной, а в побочной! Медь – не щелочной металл!). То есть назвать Сu(OH)2 щёлочью будет ошибкой, это гидроксид.
Как составить формулу гидроксида
Первым делом вспоминаем про валентность, без неё в химии никуда. Далее нужно понять, что группа ОН – это цельная структурная единица. Составляя формулу, мы всегда заключаем её в скобки (если ОН группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
Также сразу запомните, что
группа –ОН всегда имеет валентность I.
Чтобы этот факт навсегда врезался вам в память, запомните следующее. Группа –ОН образуется из воды. Формула воды Н2О, это всем известно. Выглядит молекула воды так: Н-О-Н. То есть в ней две части Н– и –ОН. Каждая из этих частей имеет валентность I, это видно и из формулы:
Нам здесь важно, что гидроксильная группа имеет валентность I. Это надо запомнить.
Теперь переходим к практике и решению химии.
Пример 1.
Составьте формулу гидроксида калия.
Это очень просто. Калий в таблице Менделеева находится в первой группе в основной подгруппе, он имеет валентность I. Группа –ОН также имеет валентность I. Следовательно, формула гидроксида калия КОН.
Пример 2.
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3.
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как определить формулу высшего гидроксида?
Я видел формулу Э(ОН)n, где n это группа, но также и слышал что эти вещества не все устойчивые, например формула высшего гидроксида мышьяка H₃AsO₄, а это слабо похоже на общую формулу.
Объясните, пожалуйста как их определять.
Вопрос Как определить формулу высшего гидроксида?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 10 – 11 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.

Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
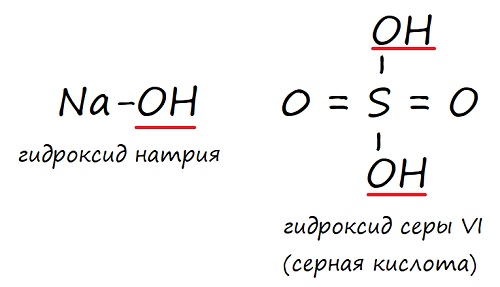
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 8) Ca(OH)2 9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
