Как составлять графические формулы
В графических (структурных) формулах электронная пара, образующая связь между атомами, обозначается черточкой. Графические формулы дают наглядное представление о порядке связей между атомами вещества и особенно широко используются в органической химии. Углеводороды при одинаковом наборе атомов могут сильно отличаться по строению молекул. Эти различия хорошо отражают структурные формулы.
Инструкция
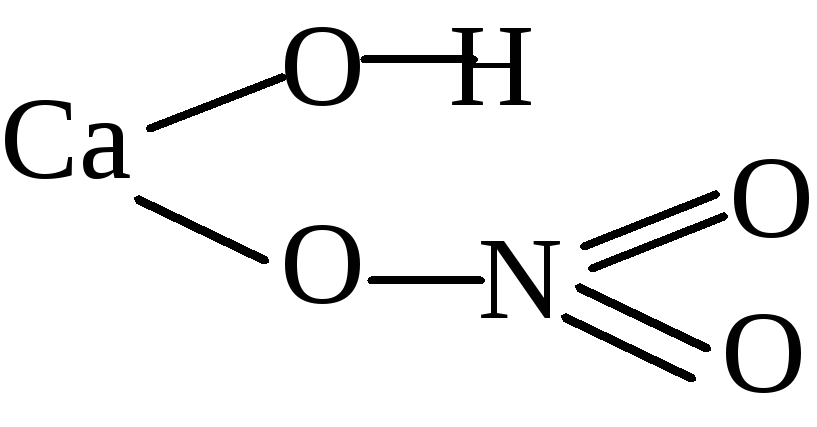
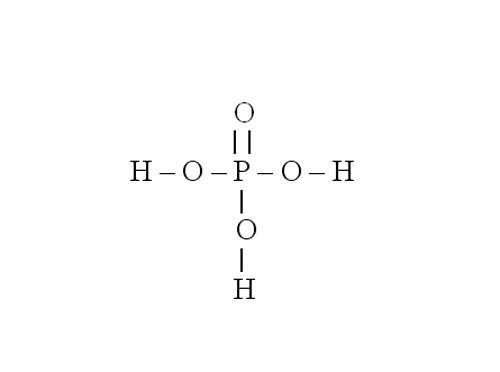
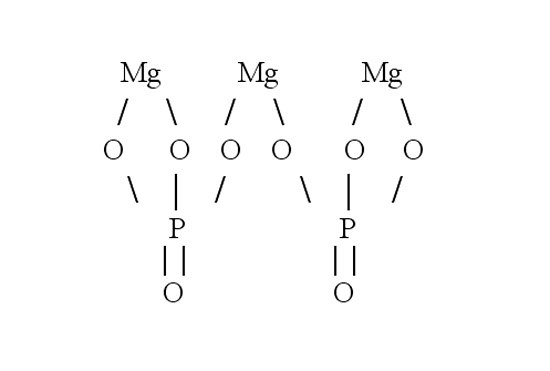
Рассмотрите порядок составления графической формулы на примере фосфата магния. Его химическая формула – Mg3(PO4)2. Сначала нарисуйте структурную формулу для ортофосфорной кислоты, которая образовала эту соль. Для этого определите валентность фосфора в H3PO4. Водород является донором электронов, он одновалентен. Кислород – акцептор электронов, у него валентность равна 2. Значит, четыре молекулы кислорода присоединяют восемь электронов. Три из них дает водород, остальные пять – фосфор. Следовательно, фосфор пятивалентен.
Напишите символ фосфора. От него нужно нарисовать пять черточек, обозначающих электронные связи. Три из них забирают группы –OH. Остаются еще две черточки и один атом кислорода, с которым фосфор и соединяется двойной связью.
Затем составьте графическую формулу фосфата магния. В молекуле соли три атома металла связаны с двумя кислотными остатками. Запишите в строку три символа, обозначающих магний. Магний двухвалентен – от каждого символа должны отходить по две черточки-связи. В молекуле соли магний вытесняет из кислоты водород и встает на его место. Каждый кислотный остаток забирает по три связи. Чтобы проверить себя, сосчитайте количество атомов в получившейся структурной формуле. Оно должно совпасть с числом атомов в химической формуле.
В органической химии при написании графических формул принято не обозначать связь с атомами водорода. На рисунке показаны примеры таких структурных формул органических соединений.
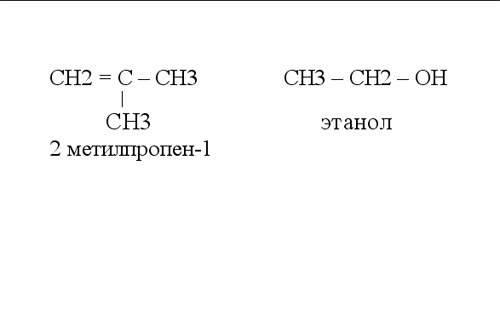
Видео по теме
Источники:
- графические формулы атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Эмпирические
формулы дают информацию о качественном
и количественном составе соединений.
Взаимное расположение атомов в молекуле
вещества отражают структурно-графические
формулы, однако они не показывают
пространственное расположение атомов.
При
составлении структурно-графических
формул можно руководствоваться
следующими правилами:
1.
Элементы соединяются в соответствии с
их валентностью.
2.
Черточка в формуле обозначает единичную
химическую связь, количество черточек
соответствует валентности, например:
K2O
записывается так: K‑O
‑K
.
3.
Состав кислот и оснований следует
начинать изображать с центрального
атома,
|
например H4SiO4 |
|
4.
Если в молекуле кислоты содержится
больше атомов кислорода, чем водорода,
то «избыточные» атомы кислорода соединены
с центральным атомом двойной связью,
|
например: |
|
5.
При написании графических формул солей
исходят из графических формул кислот,
заменяя атомы водорода на атомы металла,
учитывая его валентность, например:
|
Na3PO4 |
|
Fe2(SO4)3 |
|
|
KHCO3 |
|
||
|
CaOHNO3 |
|
Структурно-графические
формулы некоторых кислот приведены в
табл. 5.
2.4. Общие химические свойства основных классов неорганических веществ
Оксиды
‑
вещества, состоящие из атомов двух
элементов, один из которых – кислород
в степени окисления (–2). По
химическим свойствам их подразделяют
на индифферентные, или несолеобразующие
(CO,
NO),
и солеобразующие, которые бывают
основными, кислотными и амфотерными.
Химические
свойства основных оксидов
1.
Взаимодействуют с кислотами с образованием
соли и воды, например:
MgO
+ 2HCl
= MgCl2
+ H2O.
2.
Взаимодействие с кислотными оксидами
с образованием солей:
CaO
+ CO2
= CaCO3.
3.
Оксиды щелочных и щелочноземельных
металлов взаимодействуют с водой с
образованием растворимых в воде
оснований – щелочей:
K2O
+ H2O
= 2KOH.
Химические
свойства кислотных оксидов
1.
Общим свойством всех кислотных оксидов
является их способность взаимодействовать
с основаниями с образованием соли и
воды:
СО2
+ 2NaOH
= Na2CO3
+ Н2О.
2.
Кислотные оксиды взаимодействуют с
основными оксидами с образованием
солей.
3.
Большинство кислотных оксидов
взаимодействует с водой с образованием
кислот:
SО3
+ Н2О
= H2SO4.
Очень
немногие кислотные оксиды не взаимодействуют
с водой. Наиболее известный из них оксид
кремния (SiO2).
Химические
свойства амфотерных оксидов
1.
Амфотерные оксиды взаимодействуют с
кислотами с образованием солей и воды.
ZnO
+ 2HNO3
= Zn(NO3)2
+ 2Н2О.
В
этих реакциях амфотерные оксиды играют
роль основных.
2.
Амфотерные оксиды взаимодействуют с
щелочами с образованием солей и воды.
ZnO
+ 2КОН
K2ZnO2
+ Н2О,
ZnO
+ 2КОН + H2O
K2[Zn(OH)4].
В
этих реакциях амфотерные оксиды играют
роль кислотных.
3.
Амфотерные оксиды при нагревании
взаимодействуют с кислотными оксидами
с образованием солей:
ZnO
+ CO2
= ZnCO3.
4.
Амфотерные оксиды при нагревании
взаимодействуют с основными оксидами
с образованием солей:
ZnO
+ Na2O
= Na2ZnO2.
Получение
оксидов
Оксиды
могут быть получены различными способами:
1.
Взаимодействием простых веществ с
кислородом:
2Mg
+ О2
= 2MgO;
2.
Разложением некоторых оксокислот:
H2SO3
=
SO2
+ Н2О.
3.
Разложением нерастворимых оснований:
Сu(OH)2CuO
+ H2O.
4.
Разложением некоторых солей:
СаСО3
СаО + СО2.
Основания
‑
сложные
вещества, при диссоциации которых в
воде образуются гидроксид-ионы и никаких
других анионов.
По
растворимости в воде основания делятся
на две группы: нерастворимые [Fe(OH)3,
Си(ОН)2
и др.] и растворимые в воде [КОН, NaOH,
Са(ОН)2,
Ва(ОН)2
], или щелочи.
Химические
свойства оснований
Общие
свойства оснований объясняются наличием
в растворах анионов ОН–,
которые образуются в результате
электролитической диссоциации молекул
оснований:
NaOHNa+
+ OH–.
1.
Водные растворы щелочей изменяют окраску
индикаторов.
Таблица
6 ‑ Изменение
цвета индикаторов в растворах
щелочей
и кислот
|
Индикатор |
Цвет |
Цвет |
Цвет |
|
Лакмус |
Фиолетовый |
Синий |
Красный |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метилоранж |
Оранжевый |
Желтый |
Красный |
2.
Основания взаимодействуют с кислотами
с образованием соли и воды (реакция
нейтрализации). Например:
КОН
+ НС1= КС1 + Н2О;
Fe(OH)2
+2HNO3
= Fe(NO3)2
+ 2Н2О.
3.
Щелочи взаимодействуют с кислотными
оксидами с образованием соли и воды:
Са(ОН)2
+ СО2
= СаСО2
+ Н2О.
4.
Растворы щелочей взаимодействуют с
растворами солей, если в результате
образуется нерастворимое основание
или нерастворимая соль. Например:
2NaOH
+ CuSO4
= Cu(OH)2↓
+ Na2SO4;
Ва(ОН)2
+ Na2SO4
= 2NaOH
+ BaSO4↓.
5.
Нерастворимые основания при нагревании
разлагаются на основный оксид и воду.
2Fе(ОН)3
Fе2О3
+ ЗН2О.
6.
Растворы щелочей взаимодействуют с
металлами, которые образуют амфотерные
оксиды и гидроксиды (Zn,
Al
и др.).
2AI
+ 2КОН + 6Н2О
= 2K[A1(OH)4]
+ 3H2↑.
Получение
оснований
-
Получение
растворимых
оснований:
а)
взаимодействием щелочных и щелочноземельных
металлов с водой:
2Na
+ 2Н2О
= 2NaOH
+ Н2↑;
б)
взаимодействием оксидов щелочных и
щелочноземельных металлов с
водой:
Na2O
+ Н2О
= 2NaOH.
2.
Получение нерастворимых
оснований
действием щелочей на растворимые соли
металлов:
2NaOH
+
FeSO4
= Fe(OH)2↓
+ Na2SO4.
Кислоты
‑ сложные вещества, при диссоциации
которых в воде, образуются ионы водорода
(гидроксония) и никаких других катионов.
Химические
свойства
Общие
свойства кислот в водных растворах
обусловлены присутствием ионов Н+
(вернее H3O+),
которые образуются в результате
электролитической диссоциации молекул
кислот:
1.
Кислоты одинаково изменяют цвет
индикаторов (табл. 7).
2.
Кислоты взаимодействуют с основаниями.
Например:
Н3РО4
+ 3NaOH=Na3PO4+ЗН2О;
Н3РО4
+ 2NaOH
= Na2HPO4
+ 2Н2О;
Н3РО4
+ NaOH
= NaH2PO4
+ Н2О;
2НС1
+ Сu(ОН)2
= СuС12
+ 2Н2О;
НС1
+ Сu(ОН)2
= СuОНСl
+ Н2О.
3.
Кислоты взаимодействуют с основными
оксидам:
2НСl
+ СаО = СаС12
+ Н2О;
H2SO4
+Fe2O3=Fe2(SO4)3+
ЗН2О.
4.
Кислоты взаимодействуют с амфотерными
оксидами:
2HNO3
+ ZnO
= Zn(NO3)2
+ Н2О.
5.
Кислоты взаимодействуют с некоторыми
средними солями с образованием новой
соли и новой кислоты, реакции возможны
в том случае, если в результате образуется
нерастворимая соль или более слабая
(или более летучая) кислота, чем исходная.
Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl
+ H2SO4
= HCl + Na2SO4.
6.
Кислоты взаимодействуют с металлами.
Характер продуктов этих реакций зависит
от природы и концентрации кислоты и от
активности металла. Например, разбавленная
серная кислота, хлороводородная кислота
и другие кислоты‑неокислители
взаимодействуют с металлами, которые
находятся в электрохимическом ряду
напряжения левее водорода. В результате
реакции образуются соль и газообразный
водород:
H2SO4
(разб))
+ Zn
= ZnSO4
+ Н2↑;
НС1
+ Mg
= MgО
+ H2↑.
Кислоты-окислители
(концентрированная серная кислота,
азотная кислота HNO3
любой концентрации) взаимодействуют и
с металлами, стоящими в ряду напряжения
после водорода с образованием соли и
продукта восстановления кислоты.
Например:
2H2SO4
(конц)
+ Zn = ZnSO4
+SO2↑+
2H2O;
Получение
кислот
1.
Бескислородные кислоты получают путем
синтеза из простых веществ и последующим
растворением продукта в воде.
S
+ Н2
= Н2S.
2.
Оксокислоты получают взаимодействием
кислотных оксидов с водой.
SO3
+ Н2О
= H2SО4.
3.
Большинство кислот можно получить
взаимодействием солей с кислотами.
Na2SiО3
+ H2SO4
= H2SiО3
+ Na2SO4.
Амфотерные
гидроксиды
1.
В нейтральной среде (чистая вода)
амфотерные гидроксиды практически не
растворяются и не диссоциируют на
ионы.
Они растворяются в кислотах и щелочах.
Диссоциацию амфотерных гидроксидов в
кислой и щелочной средах можно выразить
следующими уравнениями:
Zn
+ OH–
Zn(OH)
H+
+ ZnO
А13+
+ ЗОН–
Al(OH)3
H+
+ AlO+
H2O
2.
Амфотерные гидроксиды взаимодействуют
как с кислотами, так и со щелочами,
образуя соль и воду.
Взаимодействие
амфотерных гидроксидов с кислотам:
Zn(OH)2
+ 2НCl
+ ZnCl2
+ 2Н2О;
Sn(OH)2+
H2SO4
= SnSO4
+ 2Н2О.
Взаимодействие
амфотерных гидроксидов со щелочами:
Zn(OH)2
+ 2NaOH
Na2ZnO2
+ 2H2O;
А1(ОН)3
+ NaOH
NаАlO2
+ 2Н2О;
Zn(OH)2
+ 2NaOH
Na2[Zn(OH)4];
Pb(OH)2
+ 2NaOH
Na2[Pb(OH)4].
Соли
–
продукты замещения атомов водорода в
молекуле кислоты на атомы металла или
замещения гидроксид-иона в молекуле
основания кислотными остатками.
Общие химические
свойства солей
1. Соли в водных
растворах диссоциируют на ионы:
а)
средние соли диссоциируют на катионы
металлов и анионы кислотных остатков:
NaCN
=Na++СN–
;
Ва(СН3СОО)2
= Ва2+
+ 2(СН3СОО)–
.
6)
кислые
соли диссоциируют на катионы металла
и сложные
анионы:
KHSО3
= К+
+ HSO32-;
NaH2PO4
=
Na+
+ Н2РО4–.
в)
основные соли диссоциируют на сложные
катионы и анионы кислотных остатков:
АlОН(СН3СОО)2
=
АlОН2+
+ 2СН3СОО–.
2.
Соли взаимодействуют с металлами с
образованием новой соли и нового металла.
Данный металл может вытеснять из
растворов солей только те металлы,
которые находятся правее его в
электрохимическом ряду напряжения:
CuSO4
+
Fe
= FeSO4
+ Сu.
3.
Растворимые соли взаимодействуют со
щелочами с образованием новой соли и
нового основания. Реакция возможна,
если образующееся основание или соль
выпадают в осадок. Например:
FeCl3+3КОН=Fe(OH)3↓+3КС1;
К2СО3+Ba(OH)2=ВаCO3↓+
2КОН.
4. Соли взаимодействуют
с кислотами с образованием новой более
слабой кислоты или новой нерастворимой
соли:
Na2CO3
+ 2HC1 = 2NaCl + CO2↑
+ H2O.
При
взаимодействии соли с кислотой, образующей
данную соль, получается кислая соль
(это возможно в том случае, если соль
образована многоосновной кислотой).
Например:
Na2S
+ H2S
= 2NaHS;
CaCO3
+ CO2+
H2O
= Ca(HCО3)2
.
5.
Соли могут взаимодействовать между
собой с образованием новых солей, если
одна из солей выпадает в осадок:
AgNO3
+ KC1
= AgCl↓
+ KNO3.
6. Многие соли
разлагаются при нагревании:
MgCО3
MgO
+
CО2↑;
2NaNO3
2NaNO2
+ O2↑.
7.
Основные соли взаимодействуют с кислотами
с образованием средних солей и воды:
Fe(OH)2NO3+HNO3=FeOH(NO3)2+H2O;
FeOH(NO3)2+HNO3=Fe(NO3)3
+ H2O.
8.
Кислые соли взаимодействуют с щелочами
с образованием средних солей и воды:
NaHSO4
+ NaOH
= Na2SO3
+ H2O;
КН2РО4
+ КОН = К2НРО4
+ Н2О.
Получение солей
Все
способы получения солей основаны на
химических свойствах важнейших классов
неорганических соединений. Десять
классических способов получения солей
представлены в табл. 8. Кроме общих
способов получения солей, возможны и
некоторые частные способы:
1.
Взаимодействие металлов, оксиды и
гидроксиды которых являются амфотерными,
с щелочами.
2. Сплавление солей
с некоторыми кислотными оксидами.
K2CO3
+ SiO2
K2SiO3
+ CO2↑.
3. Взаимодействие
щелочей с галогенами:
2КОН
+Сl2
KCl
+KClO
+ H2O;
4. Взаимодействие
галогенидов с галогенами:
2КВг
+ Cl2
= 2КС1 +Вг2
Таблица
8 ‑ Основные
способы получения солей
|
Неметалл |
Кислотный |
Кислота |
Соль |
|
|
Металл |
Соль |
– |
Соль + … |
Соль +металл |
|
Основный |
– |
Соль |
Соль |
– |
|
Основание |
– |
Соль + вода |
Соль + вода |
Соль |
|
Соль |
– |
– |
Соль |
Соль + соль |
При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
ГРАФИЧЕСКИЕ ФОРМУЛЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Очень часто формулы молекул оксидов, оснований, кислот, амфотерных гидроксидов и солей изображают графически. Для этого необходимо знать валентность каждого элемента, входящего в состав молекулы. Валентность элементов изображается черточками. Число черточек, отходящих от химического знака элементов, равно его валентности, например, Н , О =, Al и т.д.
Так как в молекуле свободные валентности отсутствуют, то надо так составить формулу, чтобы число черточек одного элемента соответствовало числу черточек другого элемента. Валентность разных атомов в молекуле взаимонасыщенна (отсутствуют свободные черточки), например, оксид натрия Na2O, в котором натрий одновалентен, а кислород двухвалентен.
Тогда графическая формула оксида имеет вид:
Na – O – Na
От атома кислорода отходят две черточки, от каждого атома натрия – по одной.
Графическая формула оксида алюминия Al2O3 имеет вид:
O = Al – O – Al = O
Алюминий трехвалентен, а кислород двухвалентен. От каждого атома алюминия отходят три черточки, от атома кислорода – две.
Графические формулы оснований
K – O – H H – O – Ba – O – H H – O – Al – О – Н
׀
O – H
KOH Ba(OH)2 Al(OH)3
гидроксид калия гидроксид бария гидроксид алюминия
В молекуле оснований атомы водорода связаны с кислородом.
Графические формулы кислот
В молекулах кислородосодержащих кислот атомы водорода, способные замещаться металлом, связаны с атомом неметалла через кислород:


H – O ׀׀ ׀׀
O О
HNO3 H2CO3 H3PO4
азотная кислота угольная кислота ортофосфорная кислота
В состав уксусной кислоты СН3СООН входят четыре атома водорода, но только один из них связан с кислородом, поэтому в уксусной кислоте только один атом водорода, соединенный с атомом кислорода, способен замещаться атомом металла:
Н О
׀ ׀׀
Н – С – С – О – Н
׀
Н
Графические изображения солей
Графическое изображение формул средних и особенно кислых солей часто вызывает затруднения. При их составлении нужно сначала написать графическое изображение формулы кислоты и затем заменить в ней полностью (нормальная соль) или частично (кислая соль) атомы водорода атомами металла. Если в молекулу соли входит несколько кислотных остатков, например, Mg(NO3)2, то нужно писать рядом столько формул кислоты, сколько кислотных остатков входит в молекулу соли, и заменить в них полностью атомы водорода атомами металла.
Графическая формула средней (нормальной) соли Mg(NO3)2 имеет вид:
HNO3 Mg(NO3)2
азотная кислота нитрат магния
O
׀׀
O – N = O
Mg
O – N = O
׀׀
O
O
׀׀
H – O – N = O
Mg
H – O – N = O
׀׀
O
Графическая формула кислой соли КHCO3 имеет вид:
Н2СО3 КНCO3
угольная кислота гидрокарбонат калия
К H – O – С – O – Н
׀׀
O
К – O – С – O – Н
׀׀
O
При составлении основных солей нужно сначала написать графическую формулу основания и затем заменить в ней частично гидроксогруппы ОН
Графическая формула основной соли MgOHNO3 имеет вид:
Mg(OH)2 HNO3 MgOHNO3
гидроксид магния азотная кислота гидроксонитрат магния
O
׀׀
H – O – Mg – O – N = O
O
׀׀
H – O – Mg – O – H H – O – N = O

Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула – это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является “валентность“. Валентность – это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций – 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую – 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм