Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
1) несолеобразующие
2) основные
3) кислотные
4) амфотерные
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
|
Оксид неметалла |
Оксид металла |
|
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам |
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
|
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 |
2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
|
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
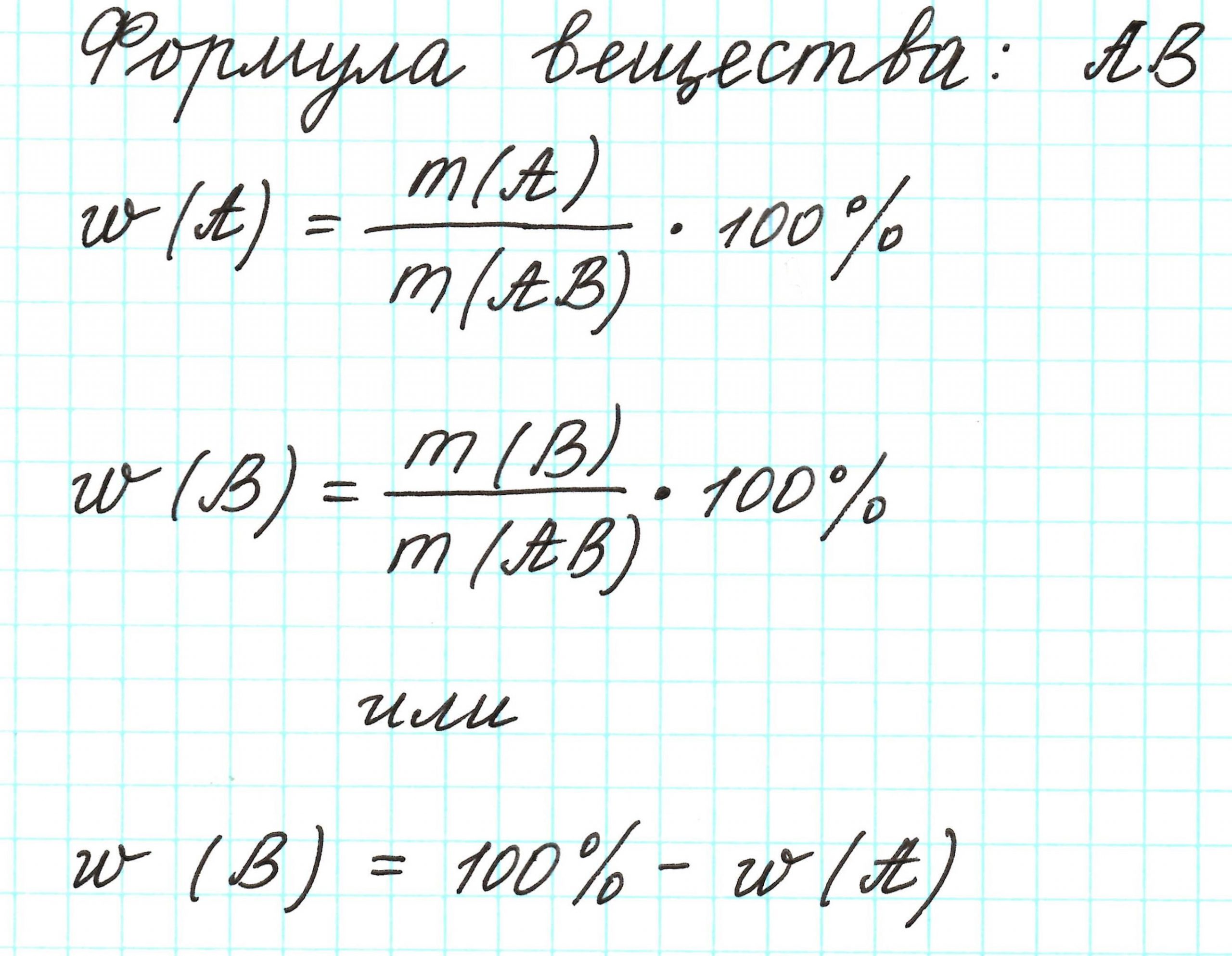
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
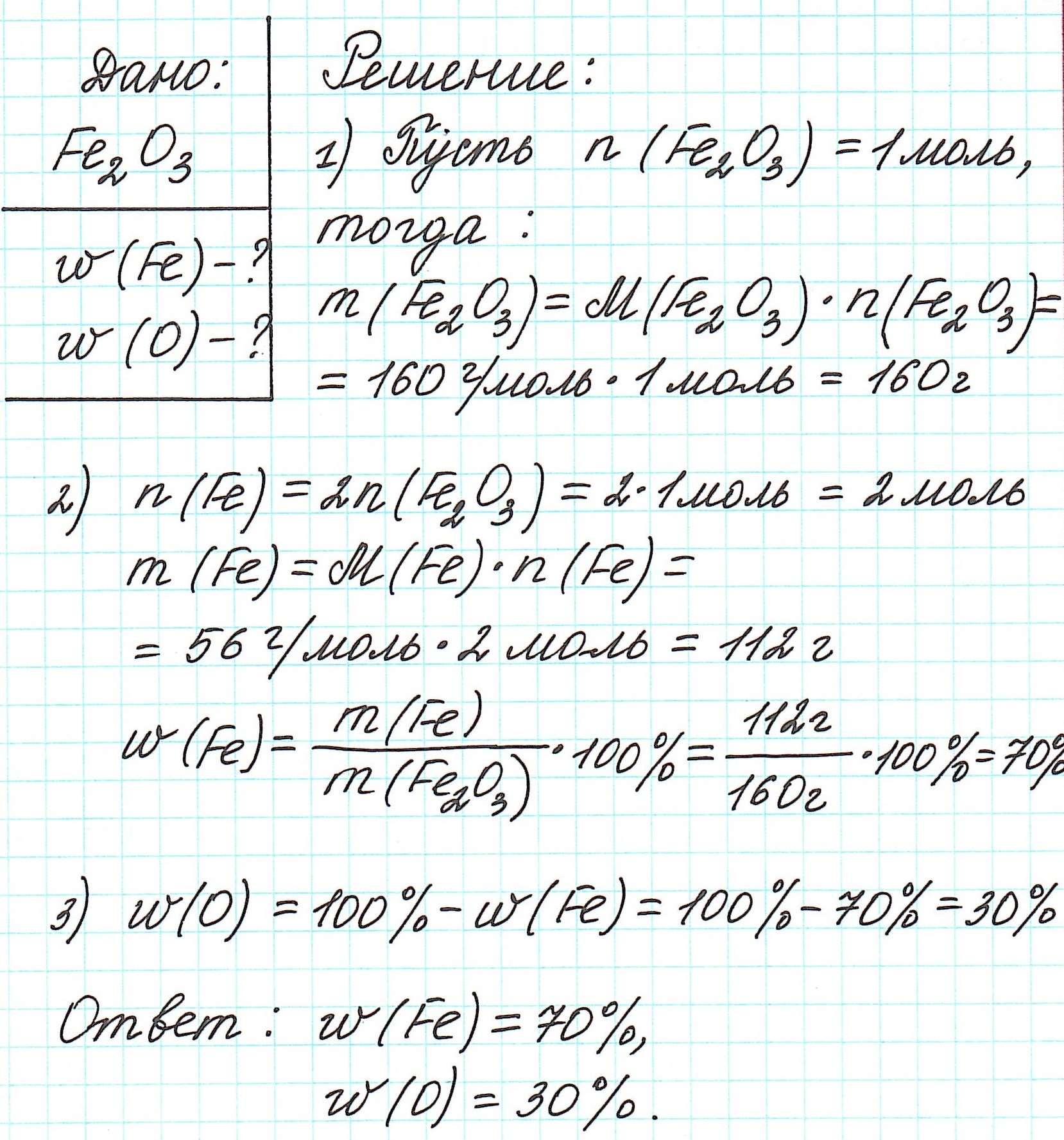
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
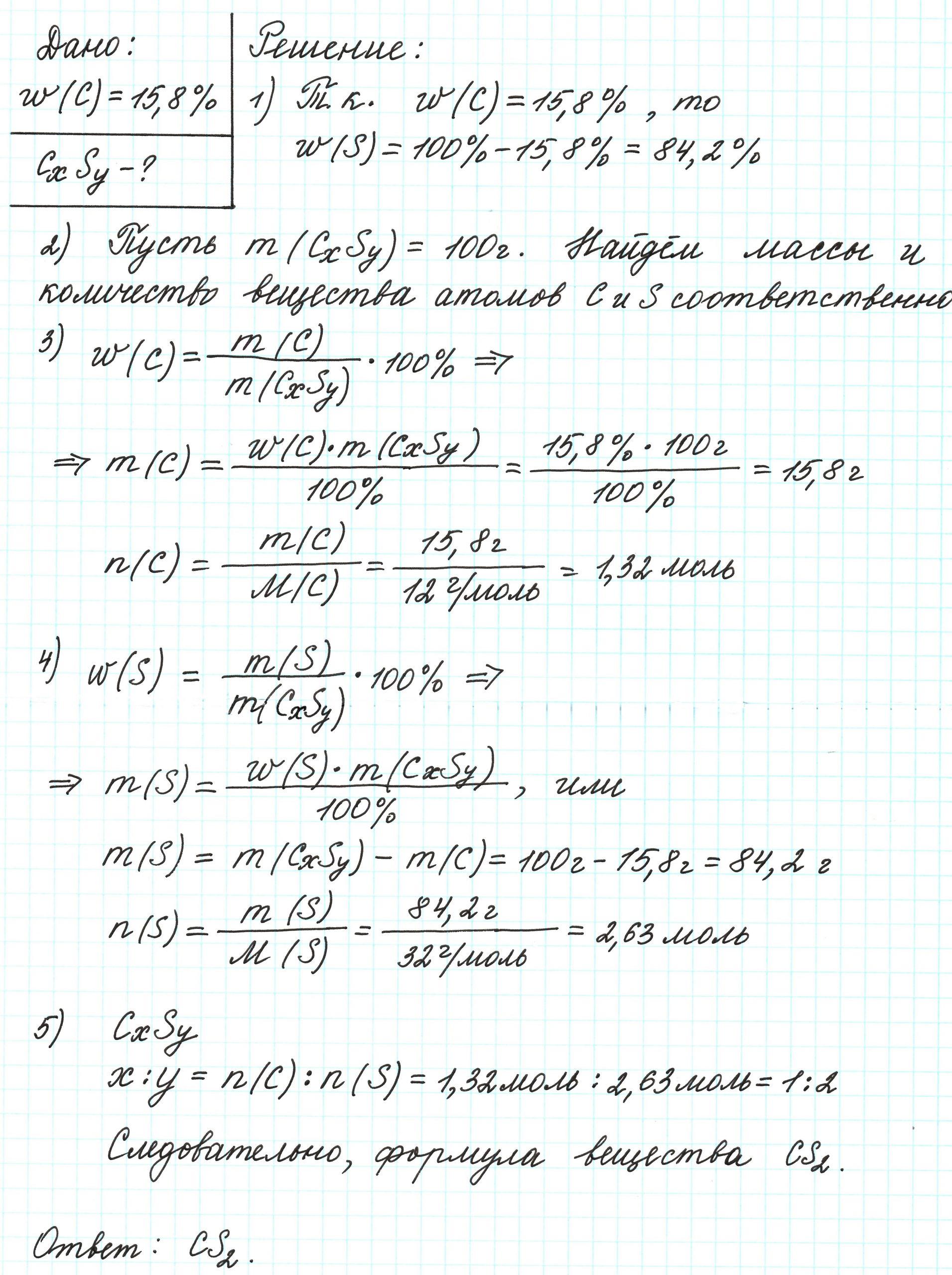
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.

Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
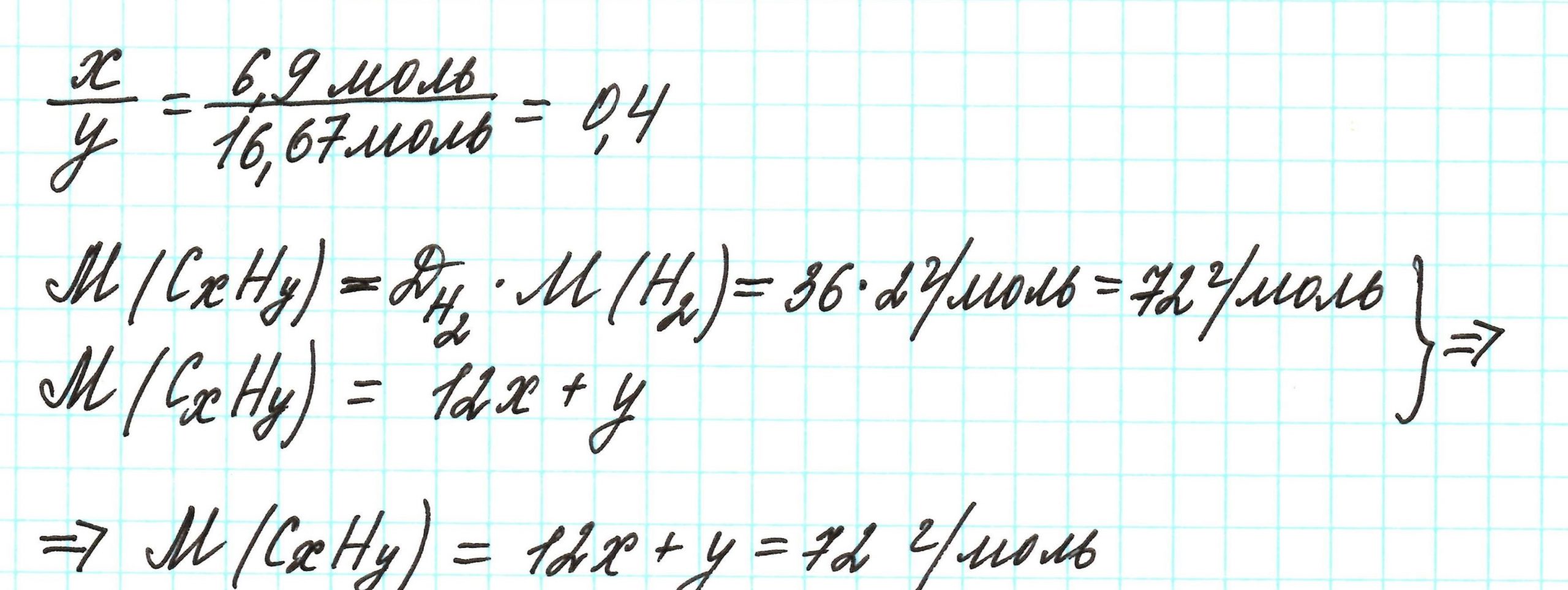

Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
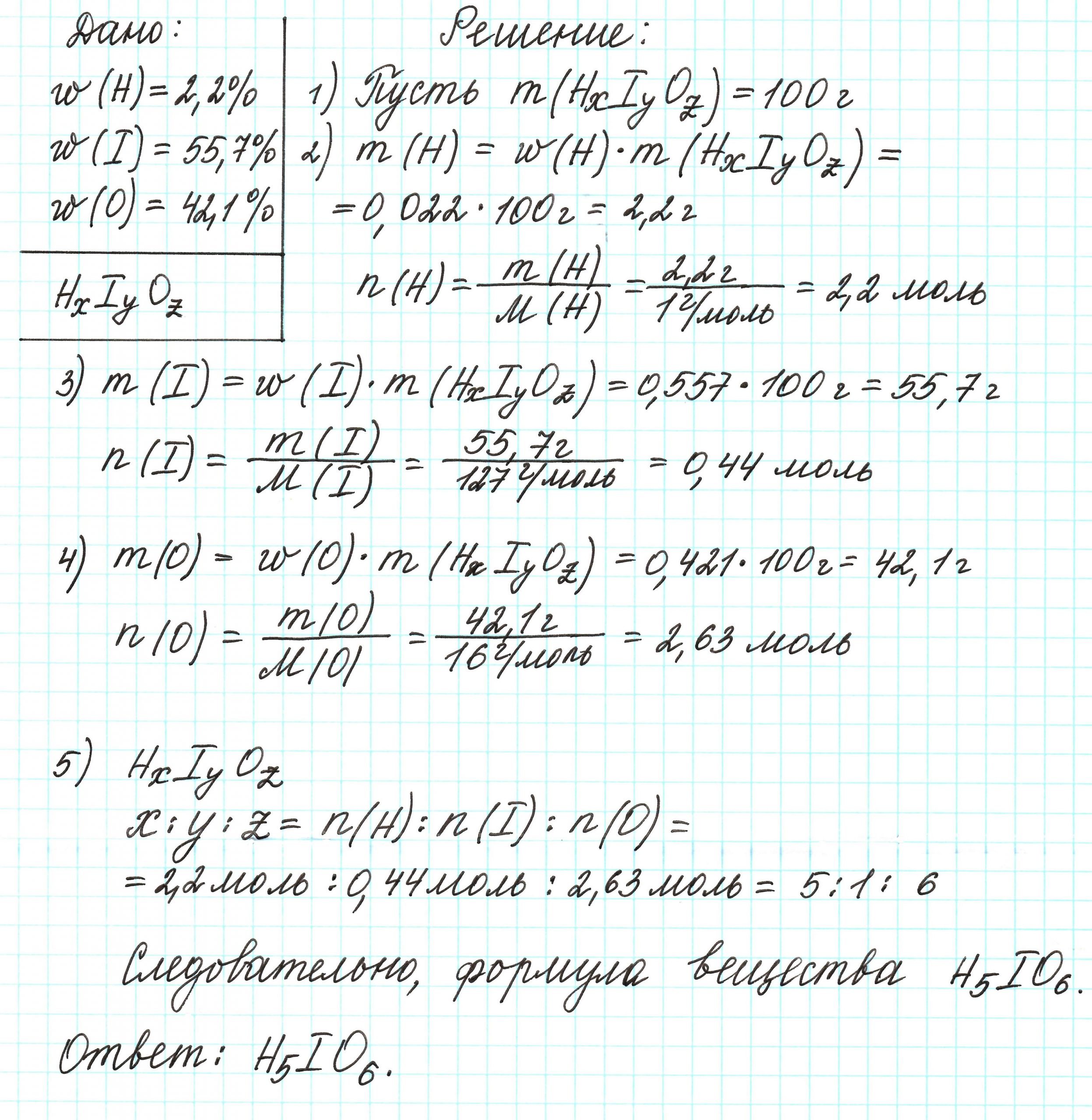
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
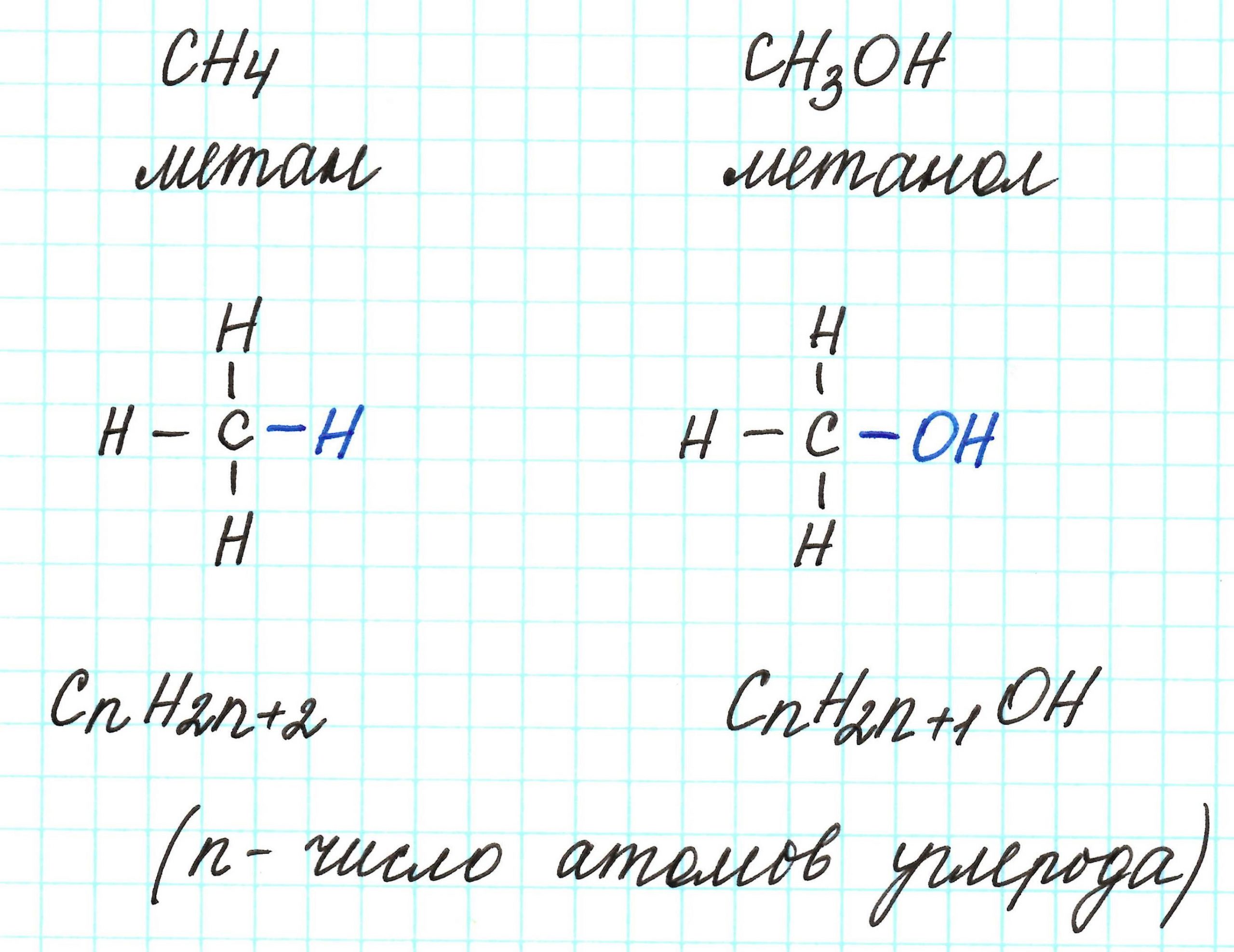
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
 Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?

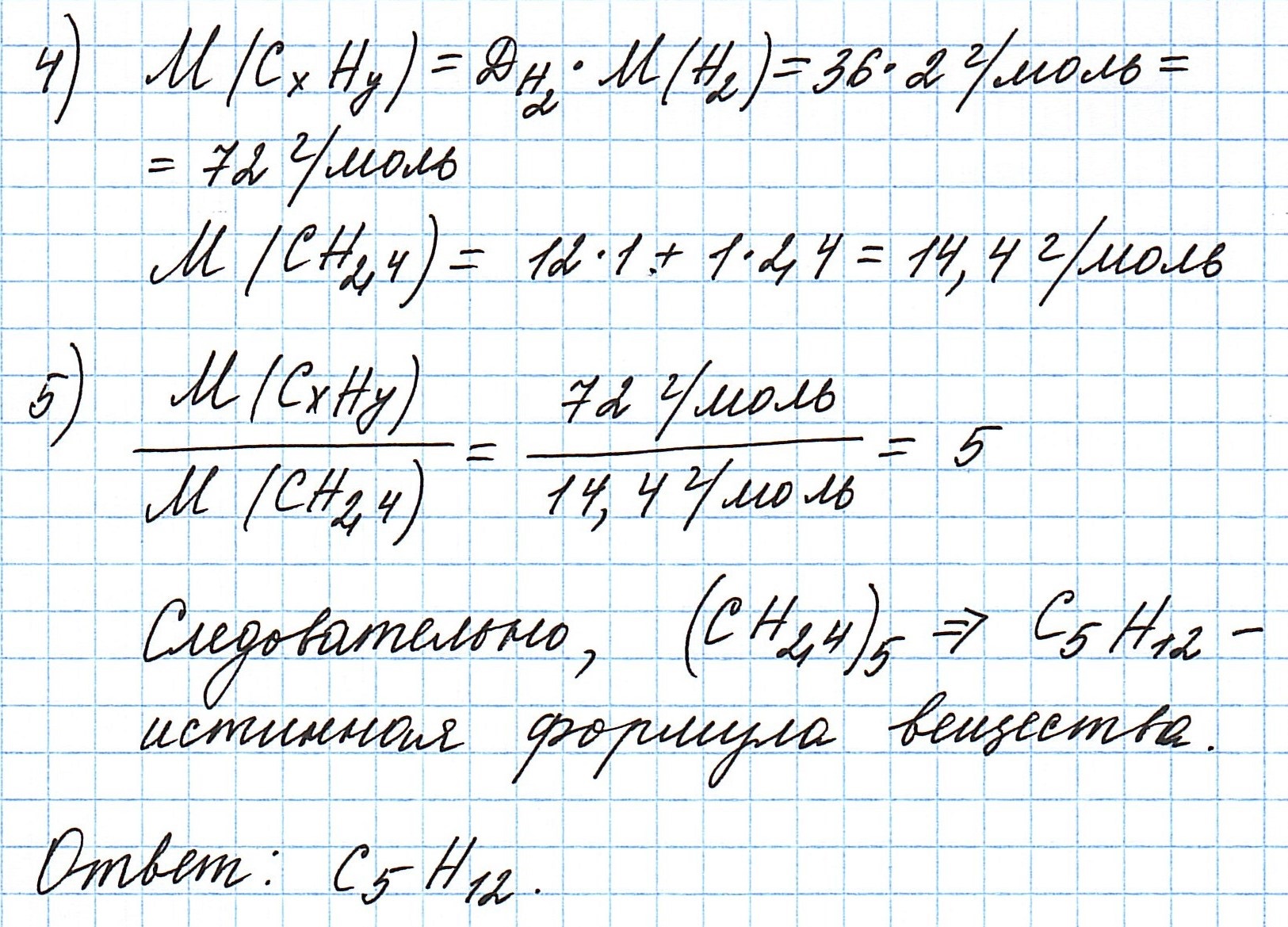
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.


Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.


5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.

Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.

Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.

Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.

Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Как узнать какой ставить коэффицент в химическом уравнении?
Анонимный вопрос
14 октября 2020 · 2,4 K
Готовлю к ОГЭ и ЕГЭ по химии онлайн. Выпустил более 2000 учеников, провожу бесплатные и… · 21 окт 2020
Есть два основных метода:
- Метод подбора для несложных реакций, когда мы расставляем коэффициенты, находя несоответствия в количестве атомов слева и справа в схеме реакции:
H2 + O2 = H2O
1.Видим, что слева и справа различается количество кислорода. Слева его 2, а справа 1. Значит нужно поставить 2 на воду.
H2 + O2 = 2H2O
- Теперь не сходится водород, слева его 2, справа 4. Нужно поставить 2 на водород:
2H2 + O2 = 2H2O
Вуаля, всё уравнено 🙂
Есть ещё метод электронного баланса, который нужен для уравнивания окислительно-восстановительных реакций. Его ты сможешь изучить на моих занятиях 🙂
2,7 K
Комментировать ответ…Комментировать…
если я правильно понимаю вопрос, то ориентироваться надо на то, чтобы и справа и слева в уравнении было одинаковое количество атомов каждого вещества (по принципу сохранения материи)
1,2 K
Комментировать ответ…Комментировать…
Просмотров 8.5к. Опубликовано 04.09.2022
Простые вещества, такие как Cl2и О2 в этом случае не происходит сдвига электронов и степень окисления равна нулю.
Качественная характеристика окислительно-восстановительных реакций
Окислительно-восстановительные реакции являются наиболее распространенными химическими реакциями в природе. К ним относятся, например, фотосинтез, метаболизм и биологические процессы, а также сжигание топлива, производство металлов и многие другие реакции.
Реакции восстановления давно и успешно используются человечеством для самых разных целей, но сама теория электронов в окислительно-восстановительных процессах возникла совсем недавно, т.е. в начале 20 века.
Для того чтобы перейти к современной теории окислительно-восстановительных процессов, необходимо ввести различные понятия, такие как сила, степень окисления и структура электронной оболочки атома. Мы уже сталкивались с этими понятиями при изучении таких модулей, как периодический закон Менделеева, основные принципы атомной структуры элементов, химическая связь и молекулярная структура. Давайте теперь рассмотрим их более подробно.
Валентность
Живучесть — это сложное понятие, которое возникает с понятием химической связи и определяется как свойство атома соединяться с определенным количеством атомов другого элемента или вытеснять их, т.е. способность атома образовывать химические связи в соединении.
Изначально валентность определялась по водороду (считался как 1) или кислороду (валентность 2).
Впоследствии были выделены положительные и отрицательные значения. Количественно, положительная валентность — это число электронов, поставляемых атомом, а отрицательная валентность — это число электронов, которые должны быть присоединены к атому для выполнения правила октавы (т.е. для завершения внешнего энергетического уровня).
Совсем недавно в понятие жизненной силы стали включать природу химических связей, образующихся при объединении людей.
Как правило, наибольшая интенсивность данных соответствует номеру группы в периодической таблице.
Однако, как и во всех правилах, есть исключения.
Например, медь и золото находятся в первой группе периодической таблицы, и их интенсивность должна быть равна номеру группы, т.е. 1, тогда как на практике медь имеет максимальную интенсивность 2, а золото — 3.
Степень окисления
Степень окисления, иногда называемая окислительным числом, электрохимической валентностью или состоянием окисления, является относительным понятием.
Например, при расчете степеней окисления большинство соединений вообще не являются ионными, а молекулами считаются только ионы.
Количественно, степень окисления атомов элемента в соединении определяется числом электронов, присоединенных к атомам или смещенных с них.
Таким образом, если смещения электронов не происходит, степень окисления будет равна нулю, отрицательной — если электроны смещены в сторону конкретного атома, и положительной — если они смещены в сторону от конкретного атома.
Нахождение степени окисления химического вещества — простое занятие, требующее лишь внимания и знания основных правил и исключений. Для того чтобы разобраться в исключениях и использовать специальные таблицы, не требуется много времени.
Как расставлять и как определить степень окисления элементов
Атомы и молекулы играют важную роль в химических процессах, а их свойства определяют последствия химических реакций. Одним из важных свойств атомов является их число окисления. Это упрощает метод расчета переноса электронов на частицы. Как определить степень окисления или типичный заряд частицы и какие правила для этого нужно знать?

Все химические реакции происходят в результате взаимодействия атомов различных веществ. Свойства мелких частиц определяют процесс реакции и ее последствия.
Термин окисление в химии относится к реакции, в которой группа атомов или один из них теряет или приобретает электрон. В случае усиления реакция называется «восстановлением».
Состояние окисления — это количественная мера перераспределения электронов в реакции. Другими словами, в процессе окисления электроны внутри атома уменьшаются или увеличиваются и перераспределяются между другими взаимодействующими частицами, а степень окисления показывает, как именно они реорганизуются. Это понятие тесно связано с электроотрицательностью частиц, т.е. их способностью притягивать и отталкивать свободные ионы.
Это интересно! Что такое алканы: структура и химические свойства
Определение степени окисления зависит от свойств и характеристик каждого вещества, поэтому процесс расчета нельзя однозначно охарактеризовать как простой или сложный, но результаты помогают документировать процесс обычных окислительно-восстановительных реакций. Важно понимать, что результаты расчета являются следствием переноса электронов, не имеют физического смысла и не представляют фактический заряд ядра.
Важно знать! Обратите внимание, что в неорганической химии термин валентность часто используется вместо состояния окисления элемента, что не является ошибкой, но второй термин более распространен.
Понятия и правила расчета движения электронов лежат в основе классификации химических веществ (номенклатуры), описания их свойств и синтеза типов связей. Однако часто этот термин используется для описания и проведения окислительно-восстановительных реакций.
Правила определения степени окисления
Как узнать состояние окисления? Имея дело с окислительно-восстановительными реакциями, важно знать, что типичный заряд частицы всегда равен численно выраженному значению электрона. Эта специфика обусловлена предположением, что электронная пара, образующая связь, всегда полностью смещается к наиболее отрицательной частице. Если мы говорим об ионной связи, то следует понимать, что в случае реакций ковалентной связи электроны поровну распределяются между одними и теми же частицами.
Число окисления может иметь как положительное, так и отрицательное значение. Важно отметить, что во время реакции атомы должны стать нейтральными. Для этого необходимо добавить электрон, если ион положительный, или удалить его, если он отрицательный. Чтобы указать на это значение при записи типа, принято писать арабскую цифру с соответствующим символом над названием предмета. Например, или и т.д.
Следует отметить, что заряд металла всегда положительный и в большинстве случаев его можно определить с помощью таблицы Менделеева. Существует несколько характеристик, которые необходимо учитывать для правильного определения цены
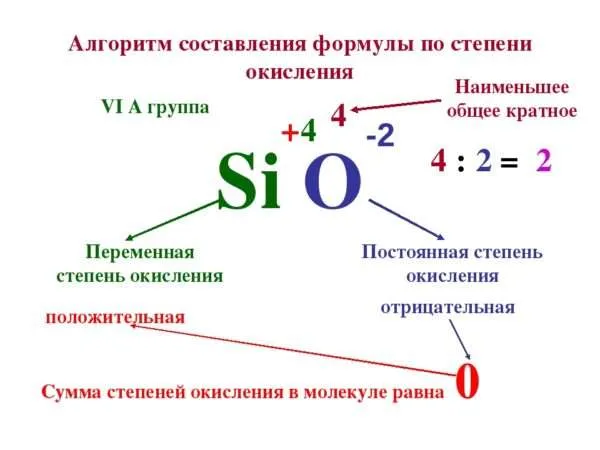
Как определить степень окисления
- У простых элементов всегда равна нулю: или .
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение +3.
Запомнив эти свойства, очень легко определить номер окисления элемента, независимо от его атомной сложности или количества уровней.
Полезное видео: определение степени окисления
Регулярные таблицы Менделеева содержат практически всю информацию, необходимую для работы с химическими веществами. Например, студенты используют их только для описания химических реакций. Например, чтобы определить максимальные положительные и отрицательные числа окисления, им нужно проверить названия химических веществ в таблице.
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Поэтому очень легко найти стандартные пределы погрузки для того или иного товара. Такие действия можно выполнить с помощью расчетов, основанных на таблице Менделеева.
Это важно знать! Элемент может одновременно иметь множество различных значений окисления.
Существует два основных способа определения уровня окисления. Примеры приведены ниже. Первый метод требует знания и умения применять химические законы. Как с помощью этого метода можно определить степень окисления?

Правила определения состояния окисления.
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Курс химии: что такое галоген?
В качестве примера рассмотрим соединение ионов алюминия с общим зарядом, равным нулю. Правила химии подтверждают тот факт, что число окисления иона Cl равно -1, и в этом случае в соединении их три. Поэтому, чтобы нейтрализовать все соединение, ион al должен иметь значение +3.
Этот метод очень хорош тем, что, суммируя все уровни окисления вместе, всегда можно контролировать точность раствора.
Второй метод можно применять без знания химических законов.
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, где отдельные S не определены.
Это интересно! Курс химии: катионы и анионы — что это такое?
Для того чтобы все степени окисления были одинаковыми, необходимо
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
С ионом NH4 + ион, вид азотной нагрузки — x + (+1) x 4 = 1. Ясно, что x = -3, т.е. степень окисления азота равна -3.
Таблица окисления химических элементов

Таблицы химического окисления используются для определения состояния загрузки индивида в реакции окисления. В зависимости от качества индивида элемент может иметь положительное или отрицательное состояние окисления.
Что такое степень окисления
Элементарная нагрузка элемента в композитном материале называется его состоянием окисления. Величина нагрузки индивидуума регистрируется в окислительно-восстановительной реакции, чтобы понять, какие элементы восстанавливаются и какие окислители восстанавливаются.
Степень окисления связана с электричеством и указывает на способность человека принимать или отдавать электроны. Чем выше значение электронов, тем больше способность человека потреблять электроны в реакции.

Рисунок 1. Ряд электрических свойств.
Для состояния окисления существует три значения.
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степень окисления в реакции между натрием и хлором составляет
В реакциях с неметаллическими металлами металл всегда является восстановителем, а неметалл — окислителем.
Как определить
Существует таблица, показывающая все возможные состояния окисления элементов.
Состояние окисления
В качестве альтернативы используйте эту версию таблицы в уроке.
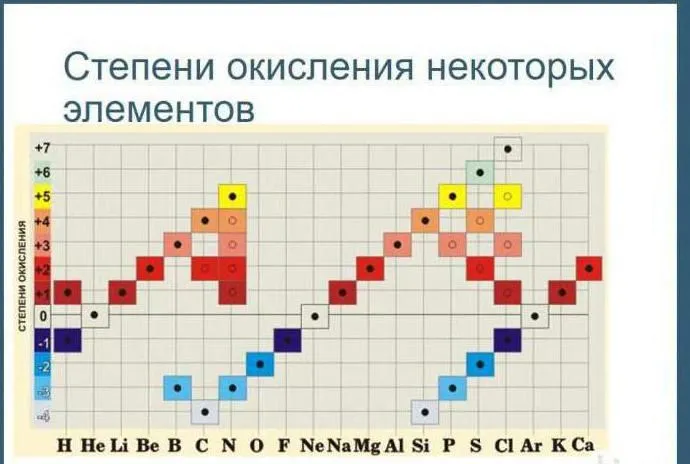
Рисунок 2.Таблица окисления.
В качестве альтернативы, степень окисления химического элемента можно определить по периодической таблице Менделеева.
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
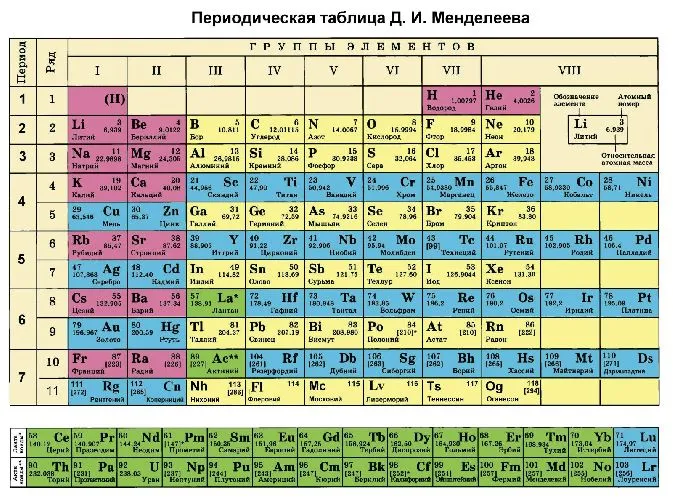
Рисунок 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степень окисления. Например, кремний относится к группе IV и имеет максимальную степень окисления +4 и минимальную -4. К неметаллическим соединениям (так3co2, sic) окислительные среды — это неметаллы с отрицательной степенью окисления или высшей электризуемостью. Например, в Союзе PCL3Фосфор имеет степень окисления +3, а хлор -1. Электроны фосфора составляют 2,19, а хлора — 3,16.
Второе правило не применяется к щелочным и щелочноземельным металлам, которые всегда имеют положительную степень окисления, равную номеру группы. Исключение составляют магний и бериллий (+1 и +2). Состояние окисления также является постоянным.
Другие металлы не имеют стабильного состояния окисления. В большинстве реакций они выступают в качестве восстановителей. В редких случаях это могут сделать окислители с отрицательной степенью окисления.
Фтор является сильнейшим окислителем. Его степень окисления всегда равна -1.
Для соединений определяется, состоят ли они из ионов. Для многоатомных ионов сумма всех степеней окисления равна их нагрузке. Найдите эту сумму из таблицы растворителей и приравняйте ее к известному числу окисления.
Как расставлять степень окисления в солях
Соль состоит из металла и одного или нескольких кислотных остатков. Метод определения такой же, как и для кислых кислот.
Металл, непосредственно образующий соль, находится в главной подгруппе, и его степень равна номеру группы. Это означает, что они всегда остаются стабильными.
В качестве примера рассмотрим расположение степеней окисления нитрата натрия. Соль образована элементами главной подгруппы в группе 1, поэтому ее степень окисления положительна и равна 1. В нитрате кислород имеет значение -2. Чтобы получить числовое значение, сначала строится уравнение с неизвестными, учитывающее все отрицательные и положительные значения, +1 +x-6 = 0. Решив уравнение, можно прийти к тому, что число положительное и равно + 5. Такова цена азота. Таблица является ключом к расчету степени окисления.

Основные термины и понятия

Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
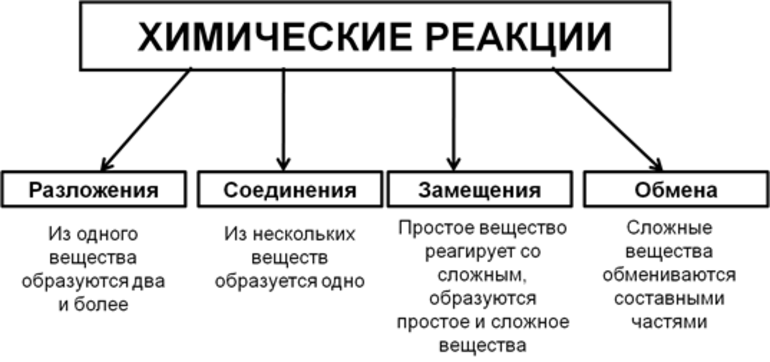
Всего существует 4 типа химического взаимодействия веществ:
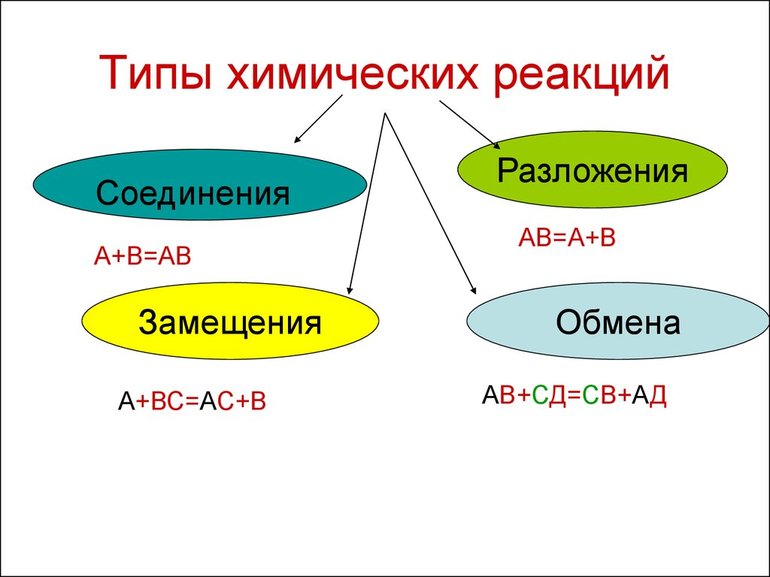
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс

Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
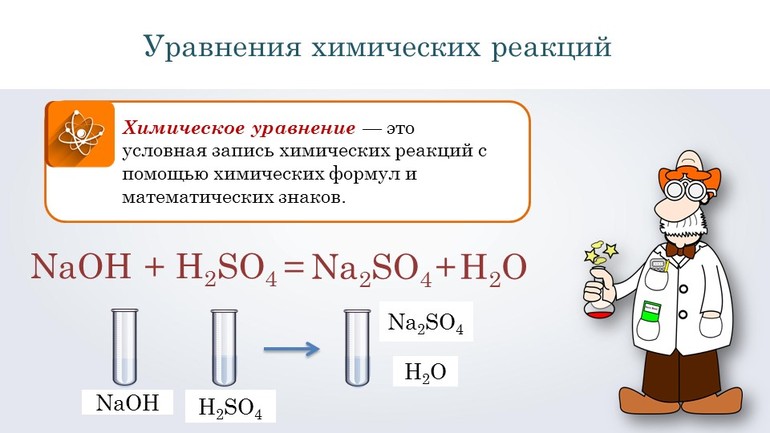
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
-
Уравнение можно сократить на 16H+ и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO–3 + 4 H+ = Fe3+ + 2SO2-4 + 5NO + 2H2O.
- Добавив в обе части нужное количество ионов, записывают молекулярное уравнение: FeS2 + 8HNO3 = Fe (NO 3) 3 + 2H2SO4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта

Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
