Рассчитать объем азота.
Рассчитать объем азота (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем азота (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула азота N₂.
Расчет объема азота (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 140 кг азота
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Рассчитать объем азота (газа) при нормальных условиях:
Рассчитать объем азота (газа):
Теория:
Рассчитать объем азота (газа) при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(N₂) = 2·14 = 28 г/моль.
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем азота (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(N2) = 2·14 = 28 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 140 кг азота:
Рассчитайте объем для 140 кг азота (газа) при нормальных условиях.
V = m · Vm / M = 140 000 грамм · 22,4 л/моль / 28 г/моль = 112 000 литров или 112 м3.
Рассчитайте объем для 140 кг азота (газа) при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 140 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 28 г/моль) = 420 064,85 литров или 420,06485 м3.
Рассчитать объем газа: азота, водорода, воздуха, гелия, озона, кислорода, углекислого газа, хлора
Коэффициент востребованности
2 179
Молярный
объём – это объём 1 моль вещества. Понятие молярного
объема применимо для газов. Например, если взять 1 моль воды, то мы
не взвешиваем на весах 18 г воды, т.к. это совершенно неудобно, а зная, что
плотность воды 1 г/мл, мы измеряем её объем цилиндром или мензуркой.
Молярный
объем воды в таком случае будет равен 18 мл/моль. Молярный
объём твёрдых веществ и жидкостей зависит от их плотности. Молярный
объём воды, кислоты, сахара и соли отличается между собой, потому что и
плотности их тоже отличаются.
Если
взять 1 моль кислорода, 1 моль углекислого газа, 1 моль водорода, то при
одинаковых нормальных условиях они будут занимать одинаковый объем,
равный 22,4 л. Эти газы также будут содержать и одинаковое число частиц,
т.е. 6,02 · 1023. Нормальными условиями или н.у. принято
считать температуру 0 0С (градусов по Цельсию) и давление 760 мм.
рт. ст. (миллиметров ртутного столба) или 101,3 кПа (килопаскаля).
Следовательно,
молярный объём – это объём газа количеством 1 моль. Обозначается молярный
объём, как и любой другой объем, но с символом Vm.
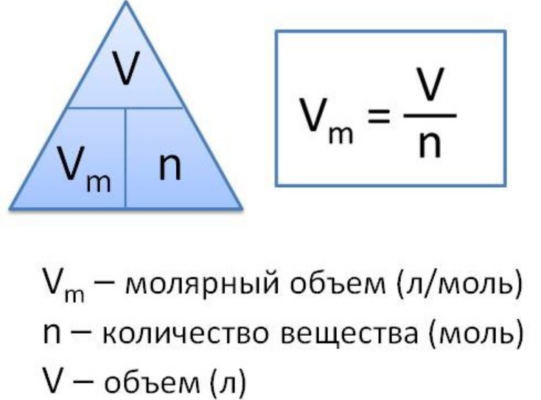
Кроме
того, молярный объём – это физическая величина, равная отношению объёма
вещества к количеству вещества. Это можно записать в виде формулы:
Vm
=
V
–
это объём газа, n
–
это количество вещества.
Из
этого выражения можно найти и V.
V=
n
· Vm
Единицей
измерения молярного объёма является л/моль, и т.к. это величина
постоянная при нормальных условиях, то молярный объём равен 22,4 л/моль.
Объём
1 кмоля называют киломолярным объёмом и измеряют в м3/кмоль,
т.е. он равен 22,4 м3/кмоль, а объём 1 ммоля называют миллимолярным
объёмом, измеряют его в мл/ммоль, т.е. миллимолярный объём равен 22,
4 мл/ммоль.
Используя
новые формулы, решим задачи.
1.
Найдите объём азота (N2)
количеством 2 моль.
Найдем объем азота (N2)
количеством 2 моль. По условию нам дано количество вещества азота – 2 моль.
Найти необходимо его объем. Для решения задачи используем формулу нахождения
объема газа через количество вещества, т.е. нужно молярный объем умножить на
количество вещества. Подставляем значения в формулу, т.е. 22,4 литра на моль
умножаем на 2 моль, в результате получаем 44,8 литра. Следовательно, 2 моль
азота занимает объем 44,8 л.
2.
Найдите количество вещества озона (O3)
объёмом 67,2 л.
По
условию задачи нам дан объем озона – 67,2 литра, найти нужно количество
вещества озона. Для решения задачи используем формулу: объем, разделенный на
молярный объем, подставим значения в формулу, т.е. 67,2 литра делим на 22,4
литра на моль, получаем результат – 3 моль. Поэтому 3 моль озона занимают объем
67,2 л.
Рассчитайте количество вещества, массу и объём (н. у.) порции азота
N
2
, содержащей
9
,
03
∗
10
23
атомов азота.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §19. Примените свои знания. Номер №8
Решение
Дано:
N (N) =
9
,
03
∗
10
23
Найти:
n − ?
m − ?
V − ?
Решение:
Зная количество атомов, найдем количество вещества: n = N : Na.
n (
N
2
) =
9
,
03
∗
10
23
:
6
,
02
∗
10
23
= 1,5 моль
Зная количества азота, можем найти массу: m = n * M.
m (
N
2
) = 1,5 моль * 28 г/моль = 42 г
Зная количество вещества, найдем объем газа: V = n * Vm.
V (
N
2
) = 1,5 моль * 22,4 л/моль = 33,6 л
Ответ: n = 1,5 моль; m = 42 г; V = 33,6 л.
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?