Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 января 2020 года; проверки требуют 3 правки.
| Хлорид свинца(IV) | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид свинца |
| Традиционные названия | Четыреххлористый свинец |
| Хим. формула | PbCl4 |
| Рац. формула | PbCl4 |
| Физические свойства | |
| Состояние | жёлтая маслянистая жидкость |
| Молярная масса | 349,01 г/моль |
| Плотность | 3,18 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -7 °C |
| • кипения | взрыв. 105 °C |
| Энтальпия | |
| • образования | -328,9 кДж/моль |
| Классификация | |
| Рег. номер CAS | 13463-30-4 |
| PubChem | 123310 |
| SMILES |
Cl[Pb](Cl)(Cl)Cl |
| InChI |
InChI=1S/4ClH.Pb/h4*1H;/q;;;;+4/p-4 PJYXVICYYHGLSW-UHFFFAOYSA-J |
| ChemSpider | 109913 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлорид свинца(IV) — бинарное неорганическое соединение, соль металла свинца и соляной кислоты с формулой PbCl4, жёлтая маслянистая жидкость, реагирует с водой.
Получение[править | править код]
- Разложение на холоде в концентрированной серной кислоте гексахлоросвинцовой кислоты или её соли:
- Действие на холоде хлористого водорода на оксид свинца:
Физические свойства[править | править код]
Хлорид свинца(IV) — это жёлтая маслянистая жидкость, реагирует с водой, при 100°С разлагается со взрывом [1]. На холоде замерзает.
Химические свойства[править | править код]
- При нагревании разлагается (может со взрывом):
- Гидролизуется водой:
- Растворяется в концентрированной соляной кислоте:
- Разлагается щелочами:
- С хлоридами калия и аммония образует гексахлороплюмбаты[1]:
Примечания[править | править код]
- ↑ Лидин, 2000, с. 135.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Запишите формулы следующих солей: карбоната лития, сульфида свинца(II), нитрата железа(III), хлорида свинца(IV), фосфата магния, нитрата алюминия. Какие из них растворимы в воде?

reshalka.com
ГДЗ Химия 7 класс класс Габриелян. §25. Проверьте свои знания. Номер №3
Решение
$Li_{2}CO_{3}$ − карбонат лития, растворима
$SnS$ − сульфида свинца(II), нерастворима
$Fe(NO_{3})_{3}$ − нитрата железа(III), растворима
$SnCl_{4}$ − хлорида свинца(IV), растворима
$Ma_{3}(PO_{4})_{2}$ − фосфата магния, нерастворима
$Al(NO_{3})_{3}$ − нитрата алюминия, растворима
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Lead(IV) chloride |
|
| Systematic IUPAC name
Tetrachloroplumbane |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
|
PubChem CID |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
PbCl4 |
| Molar mass | 349.012 g/mol[1] |
| Appearance | yellow oily liquid[2] |
| Density | 3.2 g⋅cm−3[1] |
| Melting point | −15 °C (5 °F; 258 K)[1] stable below 0 °C (32 °F; 273 K)[2] |
| Boiling point | 50 °C (122 °F; 323 K)[1] decomposes |
|
Solubility in water |
Reacts |
| Solubility | hydrochloric acid |
| Structure | |
|
Coordination geometry |
4 |
|
Molecular shape |
tetrahedral[3] |
| Thermochemistry | |
|
Std enthalpy of |
-328.9 kJ/mol |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Lead tetrachloride, also known as lead(IV) chloride, has the molecular formula PbCl4. It is a yellow, oily liquid which is stable below 0 °C, and decomposes at 50 °C.[2] It has a tetrahedral configuration, with lead as the central atom. The Pb–Cl covalent bonds have been measured to be 247 pm and the bond energy is 243 kJ⋅mol−1.[4]
Synthesis[edit]
Lead tetrachloride can be made by reacting lead(II) chloride PbCl2, and hydrochloric acid HCl, in the presence of chlorine gas (Cl2),[5] leading to the formation of chloroplumbic acid H2PbCl6. It is then converted to the ammonium salt (NH4)2PbCl6 by adding ammonium chloride (NH4Cl). Finally, the solution is treated with concentrated sulfuric acid H2SO4, to separate out lead tetrachloride. This series of reactions is conducted at 0 °C. The following equations illustrate the reaction:
- PbCl2 + 2HCl + Cl2 → H2PbCl6
- H2PbCl6 + 2 NH4Cl → (NH4)2PbCl6 + 2HCl
- (NH4)2PbCl6 + H2SO4 → PbCl4+ 2HCl + (NH4)2SO4
Reaction with water[edit]
Unlike carbon tetrachloride, another group IV (IUPAC: group 14) chloride, lead tetrachloride reacts with water. This is because the central atom is bigger (Pb is bigger than C) so there is less cluttering and water can easily access it.[3] Also, because of the presence of empty d orbitals on the Pb atom, oxygen can bind to it before a Pb–Cl bond has to break, thus requiring less energy. The overall reaction is thus as follow:
- PbCl4 + 2H2O → PbO2(s) + 4HCl(g)
Stability[edit]
Lead tetrachloride tends to decompose further into lead dichloride and chlorine gas:[3]
- PbCl4 → PbCl2 + Cl2(g)
There are reports that this reaction can proceed explosively and that the compound is best stored under pure sulfuric acid at -80 °C in the dark.[6]
The stability of the +4 oxidation state decreases as we travel down this group of the periodic table.[3] Thus while carbon tetrachloride is a stable compound, with lead the oxidation state +2 is favored and PbCl4 quickly becomes PbCl2. Indeed, the inert pair effect causes lead to favor its +2 oxidation state: Pb atom loses all its outermost p electrons and ends up with a stable, filled s subshell.[7]
Toxicity[edit]
Lead is a cumulative poison.[4] Only limited evidence have been shown of lead’s carcinogenic effect, but lead tetrachloride, as well as all other lead compounds, is “reasonably anticipated to be human carcinogens” according to the Report on Carcinogens, Twelfth Edition (2011).[8] Lead can be absorbed by the body through several routes, primarily inhalation but also ingestion and dermal contact. Lead compounds are also teratogens.[9]
References[edit]
- ^ a b c d “Lead compounds: Lead Tetrachloride”. WebElements.com. Retrieved 10 October 2012.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 381. ISBN 978-0-08-037941-8.
- ^ a b c d “The Chlorides of Carbon, Silicon and Lead”. chemguide.co.uk. Retrieved 10 October 2012.
- ^ a b Emsley, John (2000). The Elements. Oxford: Oxford University Press. p. 114. ISBN 978-0-19-855819-4.
- ^ Neu, John T.; Gwinn, William D. (October 1958). “Raman Spectra of Germanium Tetrachloride and Lead Tetrachloride”. Journal of the American Chemical Society. 70 (10): 3464–3465. doi:10.1021/ja01190a073. PMID 18891892.
- ^ The Chemistry of Germanium: Tin and Lead E. G. Rochow, E. W. Abel Elsevier, 2014, ISBN 1483187586, ISBN 9781483187587
- ^ Miessler, Gary L. (2011). inorganic Chemistry. Boston: Prentice Hall. pp. 275, 289–290. ISBN 978-0-13-612866-3.
- ^ National Toxicology Program, Department of Health and Human Services (2011). Report on Carcinogens, Twelfth Edition (2011) – Lead and Lead Compounds (PDF). p. 251.
- ^ “Environmental Health & Safety – 1: General Information About Chemical Safety”. Princeton UNiversity. Archived from the original on 27 April 2013. Retrieved 11 October 2012.
Мастер
(1276),
закрыт
10 лет назад
лёка
Мастер
(1734)
12 лет назад
не верно многое выше!!! !
1.К2СО3
2. просто свинец и сера! без индексов!! !
3. это правильно выше
4. свинец хлор 4
5. магний три (фосфор кислород4) 3
6. алюминий (азот кислород3)3
Всё верно гарантирую
англ алфавит невосприним в ответах на сайте…. не знаешь как печатать на англ?
Лилечка
Мастер
(1893)
12 лет назад
a)карбоната калия – K+2CO2-3
сульфида свинца (II) – Pb2+S2-
нитрата железа (III) – Fe3+(NO3)-3
б) хлорида свинца (IV) – Pb4+Cl-4
фосфата магния – Mg2+2(PO4)3-3
нитрата алюминия – Al3+(NO3)-3
Эх ты… я школу 11 класс окончила в 2004 году и то помню…
raisa
Мыслитель
(7593)
12 лет назад
карбоната калия K2CO3, сульфида свинца (II) PbS, нитрата железа (III) Fe(NO3)3;
хлорида свинца (IV)PbCl4,фосфата магния Mg3(PO4)2, нитрата алюминия. Al(NO3)3
100% гарантия
Исаян Наири
Ученик
(209)
7 лет назад
a)карбоната калия – K+2CO2-3
сульфида свинца (II) – Pb2+S2-
нитрата железа (III) – Fe3+(NO3)-3
б) хлорида свинца (IV) – Pb4+Cl-4
фосфата магния – Mg2+2(PO4)3-3
нитрата алюминия – Al3+(NO3)-3
Мансур Жалмагамбетов
Ученик
(155)
2 года назад
a)карбоната калия – K+2CO2-3
сульфида свинца (II) – Pb2+S2-
нитрата железа (III) – Fe3+(NO3)-3
б) хлорида свинца (IV) – Pb4+Cl-4
фосфата магния – Mg2+2(PO4)3-3
нитрата алюминия – Al3+(NO3)-3
| Хлорид свинца IV | |
|---|---|
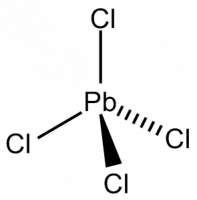 |
|
| Систематическое наименование |
Хлорид свинца |
| Традиционные названия | Четыреххлористый свинец |
| Хим. формула | PbCl4 |
| Рац. формула | PbCl4 |
| Состояние | жёлтая маслянистая жидкость |
| Молярная масса | 349,01 г/моль |
| Плотность | 3,18 г/см³ |
| Температура | |
| • плавления | -7 °C |
| • кипения | взрыв. 105 °C |
| Энтальпия | |
| • образования | -328,9 кДж/моль |
| Рег. номер CAS | 13463-30-4 |
| PubChem | 123310 |
| SMILES |
Cl[Pb](Cl)(Cl)Cl |
| InChI |
1S/4ClH.Pb/h4*1H;/q;;;;+4/p-4 PJYXVICYYHGLSW-UHFFFAOYSA-J |
| ChemSpider | 109913 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлорид свинца IV — бинарное неорганическое соединение, соль металла свинца и соляной кислоты с формулой PbCl4, жёлтая маслянистая жидкость, реагирует с водой.
Получение
- Разложение на холоде в концентрированной серной кислоте гексахлоросвинцовой кислоты или её соли:
-
- H2[PbCl6] →0oC PbCl4 + 2 HCl
- (NH4)2[PbCl6] + H2SO4 →0oC PbCl4 + (NH4)2SO4 + 2 HCl
- Действие хлористого водорода на оксид свинца:
-
- PbO2 + 4 HCl → PbCl4 + 2 H2O
Физические свойства
Хлорид свинца IV — это жёлтая маслянистая жидкость, реагирует с водой, при 100°С разлагается со взрывом.
Химические свойства
- При нагревании разлагается (может со взрывом):
-
- PbCl4 →30−100oC PbCl2 + Cl2
- Гидролизуется водой:
-
- PbCl4 + 2 H2O → PbO2 + 4 HCl
- Растворяется в концентрированной соляной кислоте:
-
- PbCl4 + 2 HCl → H2[PbCl6]
- Разлагается щелочами:
- PbCl4 + 4 NaOH → PbO2 ↓ + 4 NaCl + 2 H2O
- PbCl4 + 6 NaOH → Na2[Pb(OH)6] + 4 NaCl
Соединения свинца
- Свинец (Pb)
- 2-Этилгексаноат свинца II
- Азид свинца (Pb(N3)2) Тринитрид свинца
- Антимонат свинца II (Pb3(SbO4)2) Сурьмянокислый свинец орто
- Ацетат свинца II (Pb(CH3COO)2) Свинец уксуснокислый (свинцовый сахар)
- Ацетат свинца IV (Pb(CH3COO)4) Уксуснокислый свинец
- Ацетилацетонат свинца II (Pb(C5H7O2)2)2,4-Пентандиоат свинца
- Бензоат свинца II (Pb(C7H5O2)2) Свинец бензойнокислый
- Бромат свинца II (Pb(BrO3)2) Свинец бромноватокислый
- Бромид свинца II (PbBr2) Свинец бромистый
- Бутират свинца II (Pb(C4H7O2)2) Свинец маслянокислый
- Вольфрамат свинца II (PbWO4) Свинец вольфрамовокислый
- Гексафторосиликат свинца II (PbSiF6) Фтористые свинец-кремний
- Гексахлоросвинцовая кислота (H2[PbCl6]) Гексахлороплюмбат водород
- Гексацианоферрат II свинца (Pb2[Fe(CN)6])
- Гексацианоферрат III свинца (Pb3[Fe(CN)6]2)
- Германат свинца (Pb5Ge3O11) Свинец германиевокислый
- Гидроксид свинца II (Pb(OH)2) Гидроокись свинца
- Гидросульфат свинца II (Pb(HSO4)2) Бисульфат свинца
- Гидрофосфат свинца II (PbHPO4) Фосфорнокислый свинец кислый
- Гипофосфит свинца II (Pb(PH2O2)2) Фосфинат свинца
- Дитионат свинца II (PbS2O6) Свинец дитионовокислый
- Дихромат свинца II (PbCr2O7) Свинец хромовокислый, Бихромат свинца
- Закись свинца (Pb2O) Оксид дисвинца
- Йодат свинца II (Pb(IO3)2) Свинец йодноватокислый
- Йодид свинца II (PbI2) Свинец йодистый
- Карбонат свинца II (PbCO3) Свинец углекислый
- Лаурат свинца II (Pb(C12H23O2)2) Свинец лауриновокислый
- Линолеат свинца II (PbC36H62O4) Свинец линолевокислый
- Метаарсенат свинца II (Pb(AsO3)2) Мышьяковокислый свинец мета
- Метаарсенит свинца II (Pb(AsO2)2) Мышьяковистокислый свинец мета
- Метаборат свинца II (Pb(BO2)2) Борат свинца
- Метаванадат свинца II (Pb(VO3)2) Свинец ванадиевокислый
- Метагерманат свинца (PbGeO3)
- Метасиликат свинца (PbSiO3) Свинец кремнекислый
- Молибдат свинца (PbMoO4) Свинец молибденовокислый
- Ниобат свинца II (Pb(NbO3)2) Свинец ниобиевокислый
- Нитрат свинца II (Pb(NO3)2) Свинец азотнокислый
- Оксалат свинца II (PbC2O4) Свинец щавелевокислый
- Оксид свинца II (PbO) Свинец окись
- Оксид свинца IV (PbO2) Двуокись свинца
- Оксид-сульфат свинца II (PbO•PbSO4)
- Оксихлориды свинца II
- Олеат свинца II (Pb(C18H33O2)2) Свинец олеиновокислый
- Ортоарсенат свинца II (Pb3(AsO4)2)
- Ортосиликат свинца (Pb2SiO4) Кремнекислый свинец
- Ортофосфат свинца II (Pb3(PO4)2) Свинец фосфорнокислый
- Основной карбонат свинца (2PbCO3•Pb(OH)2) Свинцовые белила
- Перхлорат свинца II (Pb(ClO4)2) Свинец хлорнокислый
- Пироантимонат свинца II (Pb2Sb2O7)
- Пироарсенат свинца II (Pb2As2O7)
- Пирофосфат свинца II (Pb2P2O7)
- Плюмбан (PbH4) Свинцовый гидрид
- Резинат свинца II (Pb(C20H29O2)2) Свинец смолянокислый
- Свинцовый сурик
- Селенат свинца II (PbSeO4) Свинец селеновокислый
- Селенид свинца II (PbSe) Свинец селенистый
- Селенит свинца II (PbSeO3) Свинец селенистокислый
- Стеарат свинца II (Pb(C18H35O2)2) Свинец стеариновокислый
- Сульфат свинца II (PbSO4) Свинец сернокислый (Свинцовый купорос)
- Сульфат свинца IV (Pb(SO4)2) Сернокислый свинец
- Сульфид свинца II (PbS) Свинец сернистый
- Сульфид свинца IV (PbS2) Сернистый свинец
- Сульфит свинца II (PbSO3) Свинец сернистокислый
- Танталат свинца II (Pb(TaO3)2) Свинец танталовокислый
- Тартрат свинца II (PbC4H4O6) Свинец виннокислый
- Теллурид свинца (PbTe)
- Тетраоксид трисвинца (Pb3O4) Свинцовокислый свинец (Свинцовый сурик)
- Тетрафенилсвинец (Pb(C6H5)4)
- Тетраэтилсвинец (Pb(C2H5)4)
- Тиоцианат свинца II (Pb(SCN)2) Свинец роданистый
- Титанат свинца (PbTiO3) Свинец титановокислый
- Триоксид дисвинца (Pb2O3)
- Феррит свинца II (PbFe2O4) Свинец железистокислый
- Формиат свинца II (Pb(HCO2)2) Свинец муравьинокислый
- Фосфит свинца II (PbPHO3) Свинец фосфористокислый
- Фторид свинца II (PbF2) Свинец фтористый
- Фторид свинца IV (PbF4) Фтористый свинец
- Фторид-хлорид свинца II (PbClF)
- Фторсульфонат свинца II (Pb(SO3F)2) Свинец фторсульфоновокислый
- Хлорат свинца II (Pb(ClO3)2) Свинец хлорноватокислый
- Хлорид свинца II (PbCl2) Свинец хлористый
- Хлорид свинца IV (PbCl4) Хлористый свинец
- Хлорит свинца II (Pb(ClO2)2) Свинец хлористокислый
- Хромат свинца II (PbCrO4) Хромовокислый свинец
- Цианат свинца II (Pb(OCN)2) Свинец циановокислый
- Цианид свинца II (Pb(CN)2) Свинец цианистый
- Цирконат свинца II (PbZrO3) Свинец циркониевокислый
- Цитрат свинца II (Pb3(C6H5O7)2) Свинец лимоннокислый
![{mathsf {H_{2}[PbCl_{6}] {xrightarrow {0^{o}C}} PbCl_{4}+2HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d1025ed355c504d1c5d206f0ed4c73b3aa5c493)
![{mathsf {(NH_{4})_{2}[PbCl_{6}]+H_{2}SO_{4} {xrightarrow {0^{o}C}} PbCl_{4}+(NH_{4})_{2}SO_{4}+2HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/105afb7b894c1a0743d0ab960010d449e6f79f83)



![{mathsf {PbCl_{4}+2HCl {xrightarrow {}} H_{2}[PbCl_{6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d3eb2c87273368b8a000aee5207b6f62536171a)

![{mathsf {PbCl_{4}+6NaOH {xrightarrow {}} Na_{2}[Pb(OH)_{6}]+4NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e3e20a3e915242a94aff5f383a2dc5cf2972ec8)
![{displaystyle {mathsf {PbCl_{4}+2KCl xrightarrow {} K_{2}[PbCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78b1db0f0877fb3018b0db09b8bfd4b38e55f2e6)
