Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 января 2021 года; проверки требуют 20 правок.
У этого термина существуют и другие значения, см. Хлорид железа.
| Хлорид железа(III) | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид железа(III) |
| Хим. формула | FeCl3 |
| Физические свойства | |
| Состояние | твердый |
| Молярная масса | 162.5 г/моль |
| Плотность | 2,8 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 306 °C |
| • кипения | 315 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 92 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7705-08-0 |
| PubChem | 24380 |
| Рег. номер EINECS | 231-729-4 |
| SMILES |
Cl[Fe](Cl)Cl |
| InChI |
InChI=1S/3ClH.Fe/h3*1H;/q;;;+3/p-3 RBTARNINKXHZNM-UHFFFAOYSA-K |
| RTECS | LJ9100000 |
| ChEBI | 30808 |
| ChemSpider | 22792 |
| Безопасность | |
| ЛД50 | 440 мг/кг (крысы, орально) |
| Пиктограммы ECB |
|
| NFPA 704 |
0 3 0 COR |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид железа(III) гексагидрат
Хлорид железа(III) (хлорное железо, также — трихлорид железа) FeCl3 — средняя соль трёхвалентного железа и соляной кислоты, слабое амфотерное соединение.
Физические свойства[править | править код]
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли).
Tпл 309 °C.
Методы получения[править | править код]
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку[1] газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц[2]. Также можно получить трихлорид железа взаимодействием железа с хлором на свету. Так как молекулы хлора распадаются в присутствии света на высокореакционноспособные атомы-радикалы:
- Также трихлорид получается при окислении хлором хлорида железа(II):
- Также существует метод окисления оксидом серы(IV):
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
Химические свойства[править | править код]
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
- реагирует с иодоводородом:
Восстанавливается сернистым газом, сульфитами и органическими спиртами:




Применение[править | править код]
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность[править | править код]
Хлорид железа(III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
На вкус представляет терпкую безвкусную массу. Язык приобретает сильную сухость и становится губкой.
См. также[править | править код]
- Хлорид железа(II)
Примечания[править | править код]
- ↑ Взаимодействие хлора с железом — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 76. Хлор // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 184-187. — 240 с. — 1 630 000 экз.
| Хлорид железа | |
|---|---|
 |
|
| Систематическое наименование |
Хлорид железа (III) |
| Хим. формула | FeCl3 |
| Состояние | твердый |
| Молярная масса | 162.5 г/моль |
| Плотность | 2,8 г/см³ |
| Т. плав. | 306 °C |
| Т. кип. | 315 °C |
| Растворимость в воде | 92 г/100 мл |
| ГОСТ | ГОСТ 4147-74 |
| Рег. номер CAS | 7705-08-0 |
| PubChem | 24380 |
| Рег. номер EINECS | 231-729-4 |
| SMILES |
Cl[Fe](Cl)Cl |
| InChI |
1S/3ClH.Fe/h3*1H;/q;;;+3/p-3 RBTARNINKXHZNM-UHFFFAOYSA-K |
| RTECS | LJ9100000 |
| ChEBI | 30808 |
| ChemSpider | 22792 |
| ЛД50 | 440 мг/кг (крысы, орально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Хлорид железа (III), хлорное железо, также – трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Физические свойства
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6H2O — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
-
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа (II):
-
- 2FeCl2 + Cl2 → 2FeCl3
- Также существует достаточно интересный метод окисления оксидом серы (IV):
-
- 4FeCl2 + SO2↑ + 4HCl → 4FeCl3 + S + 2H2O
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие
оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
-
- Fe2O3 + 6HCl → 2FeCl3 + 3H2O + Q↑
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
-
- 2FeCl3 → 2FeCl2 + Cl2
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3 + Cl− → [FeCl4]−
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
- реагирует с иодоводородом:
-
- 2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
Применение
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность
Хлорид железа (III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
|
Соединения железа |
|---|
|
- Хлорид железа (III)
-
Хлорид железа(III) Общие Систематическое наименование Хлорид железа(III) Химическая формула FeCl3 Отн. молек. масса 162 а. е. м. Молярная масса 162.2 г/моль Физические свойства Плотность вещества 2,8 г/см³ Состояние (ст. усл.) твердый Термические свойства Температура плавления 306 °C Температура кипения 315 °C Химические свойства Растворимость в воде 92 г/100 мл Классификация номер CAS 7705-08-0 Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 См. также
Физические свойства
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа(II):
- 2FeCl2 + Cl2 → 2FeCl3
- Также существет достаточно интересный метод окисления оксидом серы(IV):
- 4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2H2O
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- 2FeCl3 → 2FeCl2 + Cl2↑
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
- FeCl3 + Cl− → [FeCl4]−
- При нагревании до 350°C с оксидом железа(III) образуется оксохлорид железа:
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Применение
Хлорид железа(III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
- Хлорид железа(II)
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое “Хлорид железа (III)” в других словарях:
-
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
-
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
-
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
-
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
-
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
-
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(NH3)6]Cl3 Физические свойства … Википедия
-
Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
-
Хлорид хрома (III) — Хлорид хрома(III) CrCl3. Свойства Фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152°С. При 600°С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). Получение В… … Википедия
-
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
-
Хлорид железа — неорганическое соединение железа с хлором: Известны следующие хлориды железа: Хлорид железа(II); Хлорид железа(III) … Википедия
Поиск химических веществ по названиям или формулам.
Категории веществ
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы). Введите часть названия или формулу для поиска: Языки: По умолчанию | Все возможные | Из списка | Хлорид железа(III)
Брутто-формула: Категории: PubChem CID: 24380 Названия Русский:
English:
German:
العربية:
Ελληνικά:
Español:
French:
Italiano:
日本語:
中文:
Português:
Latina:
Варианты формулы:
|
From Wikipedia, the free encyclopedia
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC names
Iron(III) chloride |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.846 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
FeCl3 | |
| Molar mass |
|
|
| Appearance | Green-black by reflected light; purple-red by transmitted light; yellow solid as hexahydrate; brown as aqueous solution | |
| Odor | Slight HCl | |
| Density |
|
|
| Melting point | 307.6 °C (585.7 °F; 580.8 K) (anhydrous) 37 °C (99 °F; 310 K) (hexahydrate)[1] |
|
| Boiling point |
|
|
|
Solubility in water |
912 g/L (anhydrous or hexahydrate, 25 °C)[1] | |
Solubility in
|
|
|
|
Magnetic susceptibility (χ) |
+13,450·10−6 cm3/mol[2] | |
| Viscosity | 12 cP (40% solution) | |
| Structure | ||
|
Crystal structure |
Hexagonal, hR24 | |
|
Space group |
R3, No. 148[3] | |
|
Lattice constant |
a = 0.6065 nm, b = 0.6065 nm, c = 1.742 nm α = 90°, β = 90°, γ = 120° |
|
|
Formula units (Z) |
6 | |
|
Coordination geometry |
Octahedral | |
| Hazards[5][6][Note 1] | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H302, H314 | |
|
Precautionary statements |
P234, P260, P264, P270, P273, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P390, P405, P406, P501 | |
| NFPA 704 (fire diamond) |
2 0 0 |
|
| Flash point | Non-flammable | |
| NIOSH (US health exposure limits): | ||
|
REL (Recommended) |
TWA 1 mg/m3[4] | |
| Safety data sheet (SDS) | ICSC 1499 | |
| Related compounds | ||
|
Other anions |
|
|
|
Other cations |
|
|
|
Related coagulants |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) chloride describes the inorganic compounds with the formula FeCl3(H2O)x. Also called ferric chloride, these compounds are available both in anhydrous and hydrated forms. They are common sources of iron in its +3 oxidation state. The hydrate and the anhydrous derivative have distinct properties.
Structure and properties[edit]
Anhydrous iron(III) chloride evaporates at relatively mild temperatures to give the bitetrahedral dimer.
All forms of ferric chloride are paramagnetic, owing to the presence of five unpaired electrons residing in 3d orbitals. This electronic configuration places electrons in molecular orbitals that are antibonding with respect to ligands. Thus, iron(III) chlorides are labile, undergoing rapid ligand exchange in solution. In contrast to their kinetic lability, iron(III) chlorides are thermodynamically robust, as reflected by the vigorous methods applied to their synthesis.
Anhydrous[edit]
The anhydrous compound is a crystalline solid with a melting point of 307.6 °C. The colour depends on the viewing angle: by reflected light the crystals appear dark green, but by transmitted light they appear purple-red. Anhydrous iron(III) chloride has the BiI3 structure, with octahedral Fe(III) centres interconnected by two-coordinate chloride ligands.[3]
Iron(III) chloride has a relatively low melting point and boils at around 315 °C. The vapor consists of the dimer Fe2Cl6 (like aluminium chloride) which increasingly dissociates into the monomeric FeCl3 (with D3h point group molecular symmetry) at higher temperature, in competition with its reversible decomposition to give iron(II) chloride and chlorine gas.[8]
Hydrates[edit]
In addition to the anhydrous material, ferric chloride aggressively forms hydrates upon exposure to water, reflecting its Lewis acidity. Four of these hydrates have been crystallized and examined by X-ray crystallography. They all feature trans–[FeCl2(H2O)4]+ cations, with either chloride or [FeCl4]− as the anions.[9]
- dihydrate: FeCl3·2H2O has the structural formula trans–[FeCl2(H2O)4][FeCl4].
- FeCl3·2.5H2O has the structural formula cis–[FeCl2(H2O)4][FeCl4]·H2O.
- FeCl3·3.5H2O has the structural formula cis–[FeCl2(H2O)4][FeCl4]·3H2O.
- hexahydrate: FeCl3·6H2O has the structural formula trans–[FeCl2(H2O)4]Cl·2H2O.[10]
Solution[edit]
A brown, acidic solution of iron(III) chloride.
Aqueous solutions of ferric chloride are characteristically yellow, in contrast to the pale pink solutions of [Fe(H2O)6]3+. Thus, the chloride ligand significantly influences the optical properties of the iron center. According to spectroscopic measurements, the main species in aqueous solutions of ferric chloride are the octahedral [FeCl2(H2O)4]+ (stereochemistry unspecified) and the tetrahedral [FeCl4]−.[9] The cationic aquo complex is strongly acidic:[11][9]
- [FeCl2(H2O)4)]+ ⇌ [FeCl2(OH)(H2O)3] + H+
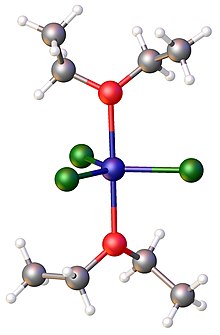
Anhydrous iron(III) chloride dissolves in diethyl ether and tetrahydrofuran forming 1:2 adducts of the formula FeCl3(ether)2. In these complexes, the iron is pentacoordinate.[12]
Preparation[edit]
Several hundred thousand kilograms of anhydrous iron(III) chloride are produced annually. The principal method, called direct chlorination, uses scrap iron as a precursor:
- 2 Fe + 3 Cl2 → 2 FeCl3
The reaction is conducted at several hundred degrees such that the product is gaseous. Using excess chlorine guarantees that the intermediate ferrous chloride is converted to the ferric state.[13] A similar but laboratory scale process also has been described.[14]
Solutions of iron(III) chloride are produced industrially both from iron and from ore, in a closed-loop process.
- Dissolving iron ore in hydrochloric acid
- Fe3O4 + 8 HCl → FeCl2 + 2 FeCl3 + 4 H2O
- Oxidation of iron(II) chloride with chlorine
- 2 FeCl2 + Cl2 → 2 FeCl3
- Oxidation of iron(II) chloride with oxygen and hydrochloric acid
- 4 FeCl2 + O2 + 4 HCl → 4 FeCl3 + 2 H2O
Heating hydrated iron(III) chloride does not yield anhydrous ferric chloride. Instead, the solid decomposes into hydrochloric acid and iron oxychloride. Hydrated iron(III) chloride can be converted to the anhydrous form by treatment with thionyl chloride.[15] Similarly, dehydration can be effected with trimethylsilyl chloride:[16]
- FeCl3·6H2O + 12 (CH3)3SiCl → FeCl3 + 6 ((CH3)3Si)2O + 12 HCl
Reactions[edit]
The reactivity of ferric chloride reveals two trends: It is a Lewis acid and an oxidizing agent.
Lewis-acid reactions[edit]
Reactions of iron(III) chlorides reflect the description of iron(III) as oxophilic and a hard Lewis acid. The rapidity of these reactions are consistent with the lability of ferric ion, reflecting its typical high-spin electronic configuration. Thus, oxalate salts react rapidly with aqueous iron(III) chloride to give [Fe(C2O4)3]3−, known as ferrioxalate. Other carboxylate sources, e.g., citrate and tartrate, bind as well to give carboxylate complexes. The affinity of iron(III) for oxygen ligands was the basis of qualitative tests for phenols. Although superseded by spectroscopic methods, the ferric chloride test is a traditional colorimetric test.[17] The affinity of iron(III) for phenols is exploited in the Trinder spot test.
Myriad other manifestations of the oxophiliicty of iron(III) chloride are available. When heated with iron(III) oxide at 350 °C it reactions to give iron oxychloride:[18]
- FeCl3 + Fe2O3 → 3FeOCl
Alkali metal alkoxides react to give the iron(III) alkoxide complexes. These products have more complicated structures that the anhydrous iron(III) chloride.[19][20] In the solid phase a variety of multinuclear complexes have been described for the nominal stoichiometric reaction between FeCl3 and sodium ethoxide:
- FeCl3 + 3 CH3CH2ONa → “Fe(OCH2CH3)3” + 3 NaCl
Iron(III) chloride forms a 1:2 adduct with Lewis bases such as triphenylphosphine oxide; e.g., FeCl3(OP(C6H5)3)2. The related 1:2 complex FeCl3(OEt2)2, where Et = C2H5), has been crystallized from ether solution.[12]
Iron(III) chloride also reacts with tetraethylammonium chloride to give the yellow salt of the tetrachloroferrate ion ((Et4N)[FeCl4]). Similarly combining FeCl3 with NaCl and KCl gives Na[FeCl4] and K[FeCl4], respectively.[21]
In addition to these simple stoichiometric reactions, the Lewis acidity of ferric chloride enables its use in a variety of acid-catalyzed reactions as described below in the section on organic chemistry.
Redox reactions[edit]
Iron(III) chloride is a mild oxidizing agent. It serves as one-electron oxidant illustrated by its reaction with copper(I) chloride to give copper(II) chloride and iron(II) chloride.
- FeCl3 + CuCl → FeCl2 + CuCl2
In a comproportionation reaction, iron(III) chloride reacts with iron powder to form iron(II) chloride:[13]
- 2 FeCl3 + Fe → 3 FeCl2
A traditional synthesis of anhydrous ferrous chloride is the reduction of FeCl3 with chlorobenzene:[22]
- 2 FeCl3 + C6H5Cl → 2 FeCl2 + C6H4Cl2 + HCl
Organometallic chemistry[edit]
The interaction of anhydrous iron(III) chloride with organolithium and organomagnesium compounds has been examined often. These studies are enabled because of the solubility of FeCl3 in etherial solvents, which are compatible with the nucleophilic alkylating agents. Such studies may be relevant to the mechanism of FeCl3-catalyzed cross coupling reactions.[23] The isolation of organoiron(III) intermediates requires low temperature reactions, lest the [FeR4]– intermediates degrade. Using methylmagnesium bromide as the alkylation agent, salts of Fe(CH3)4]– have been isolated.[24] Illustrating the sensitivity of these reactions, methyl lithium LiCH3 reacts with iron(III) chloride to give lithium tetrachloroferrate(II) Li2[FeCl4]:[25]
- 2 FeCl3 + LiCH3 → FeCl2 + Li[FeCl4] + 0.5 CH3CH3
- Li[FeCl4] + LiCH3 → Li2[FeCl4] + 0.5 CH3CH3
To a significant extent, iron(III) acetylacetonate and related beta-diketonate complexes are more widely used than FeCl3 as ether-soluble sources of ferric ion.[26] These diketonate complexes have the advantages that they do not form hydrates, unlike iron(III) chloride, and they are more soluble in relevant solvents.[23]
Cyclopentadienyl magnesium bromide undergoes a complex reaction with iron(III) chloride, resulting in ferrocene:[27]
- 3 C5H5MgBr + FeCl3 → Fe(C5H5)2 + 1/n (C5H5)n + 3 MgBrCl
This conversion, although not of practical value, was important in the history of organometallic chemistry where ferrocene is emblematic of the field.[28]
Uses[edit]
Water treatment[edit]
In the largest application iron(III) chloride is used in sewage treatment and drinking water production as a coagulant and flocculant.[29] In this application, an aqueous solution of FeCl3 is treated with base to form a floc of iron(III) hydroxide (Fe(OH)3), also formulated as FeO(OH) (ferrihydrite). This floc facilitates the separation of suspended materials, clarifying the water.[13]
Iron(III) chloride is also used to remove soluble phosphate from wastewater. Iron(III) phosphate is insoluble and thus precipitates as a solid.[30] One potential advantage to its use in water treatment, ferric ion oxidizes (deodorizes) hydrogen sulfide.[31]
Etching and metal cleaning[edit]
It is also used as a leaching agent in chloride hydrometallurgy,[32] for example in the production of Si from FeSi (Silgrain process by Elkem).[33]
In another commercial application, a solution of iron(III) chloride is useful for etching copper according to the following equation:
- 2 FeCl3 + Cu → 2 FeCl2 + CuCl2
The soluble copper(II) chloride is rinsed away, leaving a copper pattern. This chemistry is used in the production of printed circuit boards (PCB).[34]
Iron(III) chloride is used in many other hobbies involving metallic objects.[35][36][37][38][39]
Organic chemistry[edit]
Structure of FeCl3(diethylether)2. Color code: Cl=green,Fe = blue, O = red.
In industry, iron(III) chloride is used as catalyst for the reaction of ethylene with chlorine, forming ethylene dichloride (1,2-dichloroethane):[40]
- H2C=CH2 + Cl2 → ClCH2CH2Cl
Ethylene dichloride is a commodity chemical, which is mainly used for the industrial production of vinyl chloride, the monomer for making PVC.
Several reagents for organic synthesis have been developed based especially on anhydrous iron(III) chloride:
- Ferric chloride on silica gel is a reagent that has high reactivity towards several oxygen-containing functional groups. When the reagent is dry, its acidity and high affinity for water lead to dehydration and pinacol-type rearrangement reactions. When the reagent is moistened, it instead induces hydrolysis or epimerization reactions.[41]
- Ferric chloride on alumina is used to accelerate ene reactions.[42]
- Ferric chloride in conjunction with NaI in acetonitrile solution reduces organic azides to primary amines.[43]
- When mixed with sodium hydride, iron(III) chloride gives a hydride reducing agent. This reagent has been shown to convert alkenes and ketones into alkanes and alcohols, respectfully.[44]
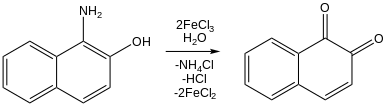
As a reagent in organic chemistry, iron(III) chloride has attracted interest for both its redox activity and its Lewis acidity. Furthermore, because they are inexpensive and relatively nontoxic, iron chlorides have been widely examined.[26] Illustrating it use as a Lewis acid, iron(III) chloride catalyses electrophilic aromatic substitution and chlorinations. In this role, its function is similar to that of aluminium chloride. In some cases, mixtures of the two are used.[45] Iron(III) chloride oxidizes naphthols to naphthoquinones:[26][46]
Histology[edit]
Iron(III) chloride is a component of useful stains, such as Carnoy’s solution, a histological fixative with many applications. Also it is used to prepare Verhoeff’s stain.
Safety[edit]
Anhydrous iron(III) chloride is harmful, highly corrosive, and acidic.[26]
Natural occurrence[edit]
The natural counterpart of FeCl3 is the rare mineral molysite, usually related to volcanic and other-type fumaroles.[47][48]
FeCl3 is also produced as an atmospheric salt aerosol by reaction between iron-rich dust and hydrochloric acid from sea salt. This iron salt aerosol causes about 5% of naturally-occurring oxidization of methane and is thought to have a range of cooling effects.[49]
The clouds of Venus are hypothesized to contain approximately 1% FeCl3 dissolved in sulfuric acid.[50][51]
Notes[edit]
- ^ An alternative GHS classification from the Japanese GHS Inter-ministerial Committee (2006)[7] notes the possibility of respiratory tract irritation from FeCl3 and differs slightly in other respects from the classification used here.
References[edit]
- ^ a b c d e f Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.69. ISBN 1-4398-5511-0.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1-4398-5511-0.
- ^ a b Hashimoto S, Forster K, Moss SC (1989). “Structure refinement of an FeCl3 crystal using a thin plate sample”. J. Appl. Crystallogr. 22 (2): 173–180. doi:10.1107/S0021889888013913.
- ^ NIOSH Pocket Guide to Chemical Hazards. “#0346”. National Institute for Occupational Safety and Health (NIOSH).
- ^ HSNO Chemical Classification Information Database, New Zealand Environmental Risk Management Authority, retrieved 19 Sep 2010
- ^ Various suppliers, collated by the Baylor College of Dentistry, Texas A&M University. (accessed 2010-09-19)
- ^ GHS classification – ID 831, Japanese GHS Inter-ministerial Committee, 2006, retrieved 19 Sep 2010
- ^ Holleman AF, Wiberg E (2001). Wiberg N (ed.). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b c Simon A. Cotton (2018). “Iron(III) Chloride and Its Coordination Chemistry”. Journal of Coordination Chemistry. 71 (21): 3415–3443. doi:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ Lind, M. D. (1967). “Crystal Structure of Ferric Chloride Hexahydrate”. The Journal of Chemical Physics. 47 (3): 990–993. Bibcode:1967JChPh..47..990L. doi:10.1063/1.1712067.
- ^ Housecroft, C. E.; Sharpe, A. G. (2012). Inorganic Chemistry (4th ed.). Prentice Hall. p. 747. ISBN 978-0-273-74275-3.
- ^ a b Spandl, Johann; Kusserow, M.; Brüdgam, I. (2003). “Alkoxo-Verbindungen des dreiwertigen Eisen: Synthese und Charakterisierung von [Fe2(Ot Bu)6], [Fe2Cl2(Ot Bu)4], [Fe2Cl4(Ot Bu)2] und [N(n Bu)4]2[Fe6OCl6(OMe)12]”. Zeitschrift für anorganische und allgemeine Chemie. 629 (6): 968–974. doi:10.1002/zaac.200300008.
- ^ a b c Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). “Iron Compounds”. Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a14_591. ISBN 3527306730.
- ^ Tarr BR, Booth HS, Dolance A (1950). Anhydrous Iron(III) Chloride. Inorganic Syntheses. Vol. 3. pp. 191–194. doi:10.1002/9780470132340.ch51.
- ^ Pray AR, Heitmiller RF, Strycker S, et al. (1990). “Anhydrous Metal Chlorides”. Inorganic Syntheses. Vol. 28. pp. 321–323. doi:10.1002/9780470132593.ch80. ISBN 9780470132593.
- ^ Boudjouk P, So JH, Ackermann MN, et al. (1992). “Solvated and Unsolvated Anhydrous Metal Chlorides from Metal Chloride Hydrates”. Inorganic Syntheses. Inorganic Syntheses. Vol. 29. pp. 108–111. doi:10.1002/9780470132609.ch26. ISBN 9780470132609.
- ^ Furniss BS, Hannaford AJ, Smith PW, et al. (1989). Vogel’s Textbook of Practical Organic Chemistry (5th ed.). New York: Longman/Wiley. ISBN 9780582462366.
- ^
Kikkawa S, Kanamaru F, Koizumi M, et al. (1984). “Layered Intercalation Compounds”. In Holt SL Jr (ed.). Inorganic Syntheses. John Wiley & Sons, Inc. pp. 86–89. doi:10.1002/9780470132531.ch17. ISBN 9780470132531. - ^ Turova NY, Turevskaya EP, Kessler VG, et al., eds. (2002). “12.22.1 Synthesis”. The Chemistry of Metal Alkoxides. Springer Science. p. 481. ISBN 0306476576.
- ^ Bradley DC, Mehrotra RC, Rothwell I, et al. (2001). “3.2.10. Alkoxides of later 3d metals”. Alkoxo and aryloxo derivatives of metals. San Diego: Academic Press. p. 69. ISBN 9780121241407. OCLC 162129468.
- ^ Cook, Charles M. Jr.; Dunn, Wendell E. Jr. (1961). “The Reaction of Ferric Chloride with Sodium and Potassium Chlorides”. J. Phys. Chem. 65 (9): 1505–1511. doi:10.1021/j100905a008.
- ^ P. Kovacic and N. O. Brace (1960). “Iron(II) Chloride”. Inorganic Syntheses. Inorganic Syntheses. Vol. 6. pp. 172–173. doi:10.1002/9780470132371.ch54. ISBN 9780470132371.
- ^ a b Mako, T. L.; Byers, J. A. (2016). “Recent Advances in Iron-Catalysed Cross Coupling Reactions and Their Mechanistic Underpinning”. Inorganic Chemistry Frontiers. 3 (6): 766–790. doi:10.1039/C5QI00295H.
- ^ Sears, Jeffrey D.; Muñoz, Salvador B.; Cuenca, Maria Camila Aguilera; Brennessel, William W.; Neidig, Michael L. (2019). “Synthesis and Characterization of a Sterically Encumbered Homoleptic Tetraalkyliron(III) Ferrate Complex”. Polyhedron. 158: 91–96. doi:10.1016/j.poly.2018.10.041. PMC 6481957. PMID 31031511. and references therein.
- ^ Berthold HJ, Spiegl HJ (1972). “Über die Bildung von Lithiumtetrachloroferrat(II) Li2FeCl4 bei der Umsetzung von Eisen(III)-chlorid mit Lithiummethyl (1:1) in ätherischer Lösung”. Z. Anorg. Allg. Chem. (in German). 391 (3): 193–202. doi:10.1002/zaac.19723910302.
- ^ a b c d White, Andrew D.; Gallou, Fabrice (2006). “Iron(III) Chloride”. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.ri054.pub2. ISBN 0471936235.
- ^ Kealy TJ, Pauson PL (1951). “A New Type of Organo-Iron Compound”. Nature. 168 (4285): 1040. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ Pauson PL (2001). “Ferrocene—how it all began”. Journal of Organometallic Chemistry. 637–639: 3–6. doi:10.1016/S0022-328X(01)01126-3.
- ^ Water Treatment Chemicals (PDF). Akzo Nobel Base Chemicals. 2007. Archived from the original (PDF) on 13 August 2010. Retrieved 26 Oct 2007.
- ^ “Phosphorus Treatment and Removal Technologies” (PDF). Minnesota Pollution Control Agency. June 2006.
- ^ Prathna, T. C.; Srivastava, Ankit (2021). “Ferric chloride for odour control: studies from wastewater treatment plants in India”. Water Practice and Technology. 16 (1): 35–41. doi:10.2166/wpt.2020.111. S2CID 229396639.
- ^ Park KH, Mohapatra D, Reddy BR (2006). “A study on the acidified ferric chloride leaching of a complex (Cu–Ni–Co–Fe) matte”. Separation and Purification Technology. 51 (3): 332–337. doi:10.1016/j.seppur.2006.02.013.
- ^ Dueñas Díez M, Fjeld M, Andersen E, et al. (2006). “Validation of a compartmental population balance model of an industrial leaching process: The Silgrain process”. Chem. Eng. Sci. 61 (1): 229–245. doi:10.1016/j.ces.2005.01.047.
- ^ Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. p. 1084. ISBN 9780750633659.
- ^ “Safer Printmaking—Intaglio”. University of Saskatchewan.
- ^ Harris, Paul; Hartman, Ron; Hartman, James (November 1, 2002). “Etching Iron Meteorites”. Meteorite Times. Retrieved October 14, 2016.
- ^ Lockwood, Mike. “A message about mirror coating and recoating”.
- ^ “Buffalo Nickel No Date Value Guides (Year Reveal Tutorial)”.
- ^ Scott, David; Schwab, Roland (2019). “3.1.4. Etching”. Metallography in Archaeology and Art. Cultural Heritage Science. Springer. doi:10.1007/978-3-030-11265-3. ISBN 978-3-030-11265-3. S2CID 201676001.
- ^ Dreher, Eberhard-Ludwig; Beutel, Klaus K.; Myers, John D.; Lübbe, Thomas; Krieger, Shannon; Pottenger, Lynn H. (2014). “Chloroethanes and Chloroethylenes”. Ullmann’s Encyclopedia of Industrial Chemistry. pp. 1–81. doi:10.1002/14356007.o06_o01.pub2. ISBN 9783527306732.
- ^ White, Andrew D. (2001). “Iron(III) Chloride-Silica Gel”. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.ri059. ISBN 0471936235.
- ^ White, Andrew D. (2001). “Iron(III) Chloride-Alumina”. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.ri057. ISBN 0471936235.
- ^ Kamal A, Ramana K, Ankati H, et al. (2002). “Mild and efficient reduction of azides to amines: synthesis of fused [2,1-b]quinazolines”. Tetrahedron Lett. 43 (38): 6861–6863. doi:10.1016/S0040-4039(02)01454-5.
- ^ White, Andrew D. (2001). “Iron(III) Chloride-Sodium Hydride”. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.ri060. ISBN 0471936235.
- ^ Riddell, W. A.; Noller, C. R. (1932). “Mixed Catalysis in the Friedel and Crafts Reaction. The Yields in Typical Reactions using Ferric Chloride–Aluminum Chloride Mixtures as Catalysts”. J. Am. Chem. Soc. 54 (1): 290–294. doi:10.1021/ja01340a043.
- ^ Louis F. Fieser (1937). “1,2-Naphthoquinone”. Organic Syntheses. 17: 68. doi:10.15227/orgsyn.017.0068.
- ^ “Molysite”. www.mindat.org.
- ^ “List of Minerals”. www.ima-mineralogy.org. March 21, 2011.
- ^ Oeste, Franz Dietrich; de Richter, Renaud; Ming, Tingzhen; Caillol, Sylvain (January 13, 2017). “Climate engineering by mimicking natural dust climate control: the iron salt aerosol method”. Earth System Dynamics. 8 (1): 1–54. Bibcode:2017ESD…..8….1O. doi:10.5194/esd-8-1-2017 – via esd.copernicus.org.
- ^ Krasnopolsky, V. A.; Parshev, V. A. (1981). “Chemical composition of the atmosphere of Venus”. Nature. 292 (5824): 610–613. Bibcode:1981Natur.292..610K. doi:10.1038/292610a0. S2CID 4369293.
- ^ Krasnopolsky, Vladimir A. (2006). “Chemical composition of Venus atmosphere and clouds: Some unsolved problems”. Planetary and Space Science. 54 (13–14): 1352–1359. Bibcode:2006P&SS…54.1352K. doi:10.1016/j.pss.2006.04.019.
Further reading[edit]
- Lide DR, ed. (1990). CRC Handbook of Chemistry and Physics (71st ed.). Ann Arbor, MI, USA: CRC Press. ISBN 9780849304712.
- Stecher PG, Finkel MJ, Siegmund OH, eds. (1960). The Merck Index of Chemicals and Drugs (7th ed.). Rahway, NJ, USA: Merck & Co.
- Nicholls D (1974). Complexes and First-Row Transition Elements, Macmillan Press, London, 1973. A Macmillan chemistry text. London: Macmillan Press. ISBN 9780333170885.
- Wells AF (1984). Structural Inorganic Chemistry. Oxford science publications (5th ed.). Oxford, UK: Oxford University Press. ISBN 9780198553700.
- Reich HJ, Rigby HJ, eds. (1999). Acidic and Basic Reagents. Handbook of Reagents for Organic Synthesis. New York: John Wiley & Sons, Inc. ISBN 9780471979258.








![{displaystyle {mathsf {FeCl_{3}+Cl^{-}rightarrow [FeCl_{4}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9737eb1969dfe015f178b56736b0bbbf6537961b)