Химия
План урока:
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Алгоритм решения “цепочек превращений” веществ. Инструкция для учащихся 8 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 –
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 939 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 23 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 587 490 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 43. Генетическая связь между классами веществ
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 16.05.2020
- 206
- 3
- 14.04.2020
- 308
- 6
- 28.03.2020
- 868
- 5
- 14.03.2020
- 376
- 7
- 11.02.2020
- 1146
- 1
- 05.02.2020
- 1551
- 100
- 16.01.2020
- 1321
- 15
- 13.01.2020
- 363
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 17.05.2020 32062
- DOCX 19.5 кбайт
- 219 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Светлова Елена Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 3
- Всего просмотров: 66184
- Всего материалов: 42
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Университет им. Герцена и РАО создадут портрет современного школьника
Время чтения: 2 минуты
Минобрнауки создаст для вузов рекомендации по поддержке молодых семей
Время чтения: 1 минута
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Ленобласть распределит в школы прибывающих из Донбасса детей
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Только 23 февраля!
Получите новую
специальность
по низкой цене
Цена от 1220 740 руб. Промокод на скидку Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
Химические цепочки превращений: примеры и способы решения
Химические цепочки превращений – это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
- Выписав отдельно цепочку химических превращений, пронумеруйте количество необходимых реакций (они обозначены стрелочками от одного вещества к другому).
- Определите, к какому классу веществ относится каждый член цепочки и, если необходимо, выпишите на черновике отдельно в столбик каждое вещество из цепочки и его класс. В случае когда имеются неназванные вещества и их класс неизвестен, проанализируйте, какие вещества могут быть получены из исходного и какого класса вещество должно выступить исходным для следующего после неназванного вещества элемента цепочки.
- Проанализируйте, каким образом можно получить вещество этого класса из исходного для каждого элемента цепочки. В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
- Составьте схему уравнения первой из необходимых реакций. Не забудьте расставить коэффициенты в уравнении.
- Последовательно осуществите цепочку химических превращений, рассматривая каждую реакцию в отдельности. Проверьте себя, уделяя внимание оформлению реакций.
Пример решения цепочки превращений
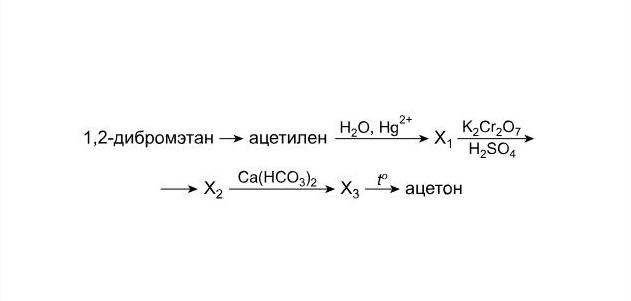
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
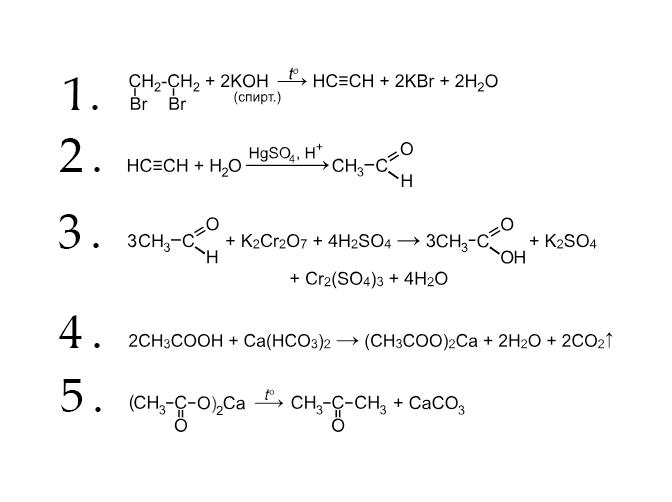
- Для того чтобы из 1,2-дибромэтана получить ацетилен, нужно воздействовать на него спиртовым раствором щелочи при нагревании. В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
- Далее, исходя из условий протекания реакции, вы делаете вывод, что это реакция М. Г. Кучерова. Она приводит к образованию ацетальдегида.
- Ацетальдегид, реагируя в присутствии серной кислоты с дихроматом калия, дает уксусную кислоту.
- Гидрокарбонат вступает в реакцию обмена с раствором кислоты.
- Полученный ацетат щелочноземельного металла при нагревании разлагается, образуя карбонат металла и кетон.
Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
[spoiler title=”источники:”]
http://infourok.ru/algoritm-resheniya-cepochek-prevrashenij-veshestv-instrukciya-dlya-uchashihsya-8-klassa-4304493.html
http://fb.ru/article/424714/himicheskie-tsepochki-prevrascheniy-primeryi-i-sposobyi-resheniya
[/spoiler]
Реакции ионного обмена – это химические взаимодействия, в которых участвуют вещества, находящиеся в состоянии водных растворов. При этом степень окисления элементов, из которых они состоят, никогда не изменяется. Такие реакции проходят только с веществами, являющимися электролитами.
Это химические соединения, обладающие свойством проводить электрический ток.
В данных процессах реагирующие вещества обмениваются ионами друг с другом. Эти ионы образуют новые устойчивые связи.
Правило Бертолле
В соответствии с этим правилом можно определить, будет ли реакция ионного обмена протекать до конца. Такая реакция будет идти, если:
- образуется твердое вещество, являющееся практически нерастворимым (его легко обнаружить по выпавшему на дне пробирки осадку):
Ba(OH)2+H2SO4→BaSO4↓+2H2O;
- происходит образование летучего газообразного вещества (пузырьки газа всплывают из раствора на поверхность):
CaCO3+2HNO3→Ca(NO3)2+CO2↑+H2O;
- образуется хорошо растворяющееся в воде вещество, являющееся слабым малодиссоциирующим электролитом (также может образовываться вода, которая тоже относится к слабым электролитам):
3NaOH+H3PO4→Na3PO4+3H2O;
- происходит формирование комплексного иона (образуется комплексная соль):
2KOH+ZnO+H2O→K2[Zn(OH)4].
Для протекания реакции достаточно выполнения хотя бы одного из приведенных здесь условий. Если же не соблюдается ни одно условие, реакция в водном растворе так и не начнется.
Как составить ионное уравнение реакции
При составлении ионных уравнений необходимо учитывать, что:
- вещества, которые не растворяются в воде, не могут диссоциировать, т.е. в таком случае реакция ионного обмена начаться не может;
- вещества, относящиеся к малорастворимым, также присутствуют в растворах, находясь в них в виде ионов;
- если в процессе реакции образуется малорастворимое соединение, при записи уравнения в ионном виде оно условно считается нерастворимым;
- суммарные значения зарядов в левой и правой частях уравнения должны иметь одинаковую величину.
Составляя ионное уравнение, нужно всегда придерживаться следующей последовательности действий:
- Записать уравнение реакции в обычном, молекулярном виде. Чтобы правильно составить формулы образующихся соединений, необходимо к положительно заряженному иону одного реагирующего вещества (это начальный элемент его формулы) присоединить отрицательный ион другого вещества. Для оставшихся ионов следует проделать аналогичную операцию.
MgCl2+2AgNO3→2AgCl+Mg(NO3)2
- Используя таблицу растворимости, определить степень растворимости каждого соединения. Эти данные нужно получить для веществ из обеих частей уравнения.
MgCl2+2AgNO3→2AgCl+Mg(NO3)2
- Составить уравнение, которое отображает процесс диссоциации соединений, считающихся растворимыми. Это нужно сделать как для исходных компонентов, так и для конечных продуктов реакции.
MgCl2↔Mg2++2Cl–
AgNO3↔Ag++NO3–
AgCl – эта соль не диссоциирует, поскольку согласно данным, полученным из таблицы растворимости, она является нерастворимой:
Mg(NO3)2↔Mg2++2NO3–
- В соответствии с данными, полученными при выполнении предыдущего шага, составить полное ионное уравнение.
Mg2++2Cl–+2Ag++2NO3–→2AgCl↓+Mg2++2NO3–
- Записать ионное уравнение в сокращенном виде. Для этого достаточно просто убрать из левой и правой частей полного ионного уравнения совпадающие и одинаковые ионы.
Mg2++ 2Cl–+ 2Ag++2NO3– → 2AgCl↓+Mg2++2NO3–
Удалив все парные ионы, получим:
Ag++Cl–→AgCl↓
Ионное уравнение наглядно отображает сущность протекания реакции. В нем содержится информация, из которой можно узнать, что же на самом деле происходит в растворе. Что касается сокращенной записи ионного уравнения, то тут стоит отметить, что в виде одного и того же ионного уравнения может быть записано несколько реакций с разными веществами. Проиллюстрируем этот факт двумя примерами.
Примеры реакций ионного обмена
| Пример 1 | Пример 2 |
|---|---|
| HNO3+KOH→KNO3+H2O | 2HCl+Ba(OH)2→BaCl2+2H2O |
| H++NO3–+K++OH–→K++NO3–+H2O | 2H++2Cl–+Ba2++2OH–→Ba2++2Cl–+2H2O |
| H++OH–→H2O | H++OH–→H2O |
Данные примеры свидетельствуют, что химические процессы, наблюдающиеся в обеих случаях, схожи по своей сути.
Следует иметь в виду, что некоторые вещества при их растворении в воде начинают активно разлагаться. В частности, к ним относятся такие соли, как сульфид алюминия (Al2S3) и трехвалентный ацетат хрома (Cr(CH3COO)3). Это значит, что такие соединения в результате проведения реакций ионного обмена получить не удастся.
Тест по теме «Реакции ионного обмена»
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Например, нитрат серебра взаимодействует с бромидом калия
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3K+ + 3Cl—
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3K+ + 3Cl—
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH— = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3—, Н2РО4— и т.п.) и катионы основных солей слабых оснований Al(OH)2+
- Комплексные катионы и анионы: [Al(OH)4]—
Например, взаимодействие сульфида цинка и серной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
н р р р
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H+ + SO42— = Zn2+ + SO42— + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H+ = Zn2+ + H2S
Например, взаимодействие гидрокарбоната натрия и гидроксида натрия
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na+ + НСО3— + Na+ + ОН— = 2Na+ + CO32- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3—+ ОН— = CO32- + H2O
Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р р
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na+ + [Al(OH)4]— + 4H+ + 4Cl— = Na+ + Cl— + Al3+ + 3Cl— + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4]— + 4H+ = Al3+ + 4H2O
Как решать ионные уравнения
В растворах электролитов реакции происходят между ионами, поэтому их называют ионными реакциями, или реакциями ионного обмена. Они описываются ионными уравнениями. Соединения, которые являются труднорастворимыми, малодиссоциированными или летучими, пишут в молекулярной форме. Если при взаимодействии растворов электролитов не образуется ни одного из указанных видов соединения, это означает, что реакции практически не протекают.

Инструкция
Рассмотрите пример образования труднорастворимого соединения.
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Или вариант в ионном виде:
2Na+ +SO42- +Ba2++ 2Cl- = BaSO4 + 2Na+ + 2Cl-
Обратите внимание, что прореагировали только ионы бария и сульфат-ионы, состояние других ионов не изменилось, поэтому это уравнение можно записать в сокращенном виде:
Ba2+ + SO42- = BaSO4
При решении ионных уравнений, необходимо соблюдать следующие правила:
– одинаковые ионы из обеих его частей исключаются;
– следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Примеры:
Написать ионные уравнения реакций взаимодействия между водными растворами следующих веществ: a) HCl и NaOH; б) AgNO3 и NaCl; в) К2СO3 и H2SO4; г) СН3СOOH и NaOH.
Решение. Запишите уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + H2O
б) AgNO3 + NaCl = AgCl + NaNO3
в) K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
г) СН3СOOH + NaOH = CH3COONa + H2O
Отметьте, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием либо слабых электролитов (Н2О), либо труднорастворимого вещества (AgCl), либо газа (СO2).
В случае варианта г) реакция идет в сторону большего связывания ионов, то есть, образования воды, хотя имеются два слабых электролита (уксусная кислота и вода). Но это происходит поскольку вода – более слабый электролит.
Исключив одинаковые ионы из левых и правых частей равенства (в случае варианта а) – ионы натрия и хлора, в случае б) – ионы натрия и нитрат-ионы, в случае в) – ионы калия и сульфат-ионы), г) – ионы натрия, получите решение этих ионных уравнений:
а) H+ + OH- = H2O
б) Ag+ + Cl- = AgCl
в) CO32- + 2H+ = CO2 + H2O
г) СН3СOOH + OH- = CH3COO- + H2O
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Загрузить PDF
Загрузить PDF
Ионные уравнения являются неотъемлемой частью химии. В них представлены лишь те компоненты, которые изменяются в ходе химической реакции. Чаще всего ионные уравнения используют для описания окислительно-восстановительных реакций, реакций обмена и нейтрализации.[1]
Чтобы записать ионное уравнение, необходимо выполнить три основных шага: сбалансировать молекулярное уравнение химической реакции, перевести его в полное ионное уравнение (то есть записать компоненты в том виде, в каком они существуют в растворе) и, наконец, записать краткое ионное уравнение.
-
1
Поймите разницу между молекулярными и ионными соединениями. Для записи ионного уравнения первым делом следует определить участвующие в реакции ионные соединения. Ионными называют те вещества, которые в водных растворах диссоциируют (распадаются) на заряженные ионы.[2]
Молекулярные соединения не распадаются на ионы. Они состоят из двух неметаллических элементов, и иногда их называют ковалентными соединениями.[3]
- Ионные соединения могут возникать между металлом и неметаллом, металлом и многоатомными ионами, либо между несколькими многоатомными ионами.
- Если вы сомневаетесь, к какой группе принадлежит то или иное соединение, посмотрите на свойства составляющих его элементов в таблице Менделеева.[4]
-
2
Определите растворимость соединения. Не все ионные соединения растворяются в водных растворах, то есть не все из них диссоциируют на отдельные ионы. Прежде чем приступить к записи уравнения, следует найти растворимость каждого соединения. Ниже приведены краткие правила растворимости. Более подробные сведения и исключения из правил можно найти в таблице растворимости.[5]
- Следуйте правилам в том порядке, в котором они приведены ниже:
- все соли Na+, K+ и NH4+ растворяются;
- все соли NO3–, C2H3O2–, ClO3– и ClO4– растворимы;
- все соли Ag+, Pb2+ и Hg22+ нерастворимы;
- все соли Cl–, Br– и I– растворяются;
- соли CO32-, O2-, S2-, OH–, PO43-, CrO42-, Cr2O72- и SO32- нерастворимы (за некоторыми исключениями);
- соли SO42- растворимы (за некоторыми исключениями).
-
3
Определите катион и анион соединения. Катионами называют положительно заряженные ионы (обычно это металлы). Анионы имеют отрицательный заряд, как правило это ионы неметаллов. Некоторые неметаллы могут образовывать не только анионы, но и катионы, в то время как атомы металлов всегда выступают в роли катионов.[6]
- Например, в соединении NaCl (поваренная соль) Na является положительно заряженным катионом, поскольку это металл, а Cl представляет собой отрицательно заряженный анион, так как это неметалл.
-
4
Определите участвующие в реакции многоатомные (сложные) ионы. Такие ионы представляют собой заряженные молекулы, между атомами которых существует такая сильная связь, что они не диссоциируют при химических реакциях.[7]
Необходимо выявить многоатомные ионы, поскольку они обладают своим зарядом и не распадаются на отдельные атомы. Многоатомные ионы могут иметь как положительный, так и отрицательный заряд.- При изучении общего курса химии вам, скорее всего, понадобится запомнить некоторые из наиболее распространенных многоатомных ионов.
- К наиболее распространенным многоатомным ионам относятся CO32-, NO3–, NO2–, SO42-, SO32-, ClO4– и ClO3–.[8]
- Существует множество других многоатомных ионов, которые можно найти в учебнике химии или интернете.[9]
Реклама
-
1
Сбалансируйте полное молекулярное уравнение. Прежде чем приступить к записи ионного уравнения, следует сбалансировать исходное молекулярное уравнение. Для этого необходимо расставить соответствующие коэффициенты перед соединениями, так чтобы число атомов каждого элемента в левой части равнялось их количеству в правой части уравнения.
- Запишите число атомов каждого элемента по обе стороны уравнения.
- Добавьте перед элементами (кроме кислорода и водорода) коэффициенты, так чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаковым.
- Сбалансируйте атомы водорода.
- Сбалансируйте атомы кислорода.
- Пересчитайте количество атомов каждого элемента по обе стороны уравнения и убедитесь, что оно одинаково.
- Например, после балансировки уравнения Cr + NiCl2 –> CrCl3 + Ni получаем 2Cr + 3NiCl2 –> 2CrCl3 + 3Ni.
-
2
Определите, в каком состоянии находится каждое вещество, которое участвует в реакции. Часто об этом можно судить по условию задачи. Есть определенные правила, которые помогают определить, в каком состоянии находится элемент или соединение.[10]
- Если в условии задачи не указано состояние того или иного элемента, используйте для его определения таблицу Менделеева.
- Если в условии сказано, что соединение находится в растворе, отметьте это (р-р).
- Если в уравнение входит вода, определите по таблице растворимости, диссоциирует ли данное ионное соединение.[11]
В случае высокой растворимости соединение диссоциирует в воде (р-р). Если соединение имеет низкую растворимость, оно останется в твердом виде (тв). - Если в реакции не участвует вода, ионное соединение останется в твердом виде (тв).
- Если в задаче фигурирует кислота или основание, они будут растворены в воде (р-р).
- В качестве примера рассмотрим реакцию 2Cr + 3NiCl2 –> 2CrCl3 + 3Ni. В чистом виде элементы Cr и Ni находятся в твердой фазе. NiCl2 и CrCl3 представляют собой растворимые ионные соединения, то есть они находятся в растворе. Таким образом, данное уравнение можно переписать в следующем виде: 2Cr(тв) + 3NiCl2(р-р) –> 2CrCl3(р-р) + 3Ni(тв).
-
3
Определите, какие соединения диссоциируют (разделяются на катионы и анионы) в растворе. При диссоциации соединение распадается на положительный (катион) и отрицательный (анион) компоненты. Эти компоненты затем войдут в ионное уравнение химической реакции.
- Не диссоциируют твердые тела, жидкости, газы, молекулярные соединения, ионные соединения с низкой растворимостью, многоатомные ионы и слабые кислоты.
- Полностью диссоциируют ионные соединения с высокой растворимостью (используйте таблицу растворимости) и сильные кислоты (HCl(р-р), HBr(р-р), HI(р-р), H2SO4(р-р), HClO4(р-р) и HNO3(р-р)).[12]
- Учтите, что хотя многоатомные ионы не диссоциируют, они могут входить в состав ионного соединения и отделиться от него в растворе.
-
4
Посчитайте заряд каждого диссоциировавшего иона. При этом помните, что металлы образуют положительно заряженные катионы, а атомы неметаллов превращаются в отрицательные анионы. Определите заряды элементов по таблице Менделеева. Необходимо также сбалансировать все заряды в нейтральных соединениях.
- В приведенном выше примере NiCl2 диссоциирует на Ni2+ и Cl–, а CrCl3 распадается на Cr3+ и Cl–.
- Ион никеля имеет заряд 2+, поскольку он соединен с двумя ионами хлора, каждый из которых имеет единичный отрицательный заряд. При этом один ион Ni должен сбалансировать два отрицательно заряженных иона Cl. Ион Cr имеет заряд 3+, так как он должен нейтрализовать три отрицательно заряженных иона Cl.
- Помните о том, что многоатомные ионы имеют свои собственные заряды.[13]
-
5
Перепишите уравнение так, чтобы все растворимые соединения были разделены на отдельные ионы. Все что диссоциирует или ионизируется (например, сильные кислоты) распадется на два отдельных иона. При этом вещество останется в растворенном состоянии (р-р). Проверьте, чтобы уравнение было сбалансировано.
- Твердые вещества, жидкости, газы, слабые кислоты и ионные соединения с низкой растворимостью не изменят своего состояния и не разделятся на ионы. Оставьте их в прежнем виде.
- Молекулярные соединения просто рассеются в растворе, и их состояние изменится на растворенное (р-р). Есть три молекулярных соединения, которые не перейдут в состояние (р-р), это CH4(г), C3H8(г) и C8H18(ж).
- Для рассматриваемой реакции полное ионное уравнение запишется в следующем виде: 2Cr(тв) + 3Ni2+(р-р) + 6Cl–(р-р) –> 2Cr3+(р-р) + 6Cl–(р-р) + 3Ni(тв). Если хлор не входит в состав соединения, он распадается на отдельные атомы, поэтому мы умножили количество ионов Cl на 6 с обеих сторон уравнения.
-
6
Сократите одинаковые ионы в левой и правой части уравнения. Можно вычеркнуть лишь те ионы, которые полностью идентичны с обеих сторон уравнения (имеют одинаковые заряды, нижние индексы и так далее). Перепишите уравнение без этих ионов.
- В нашем примере обе части уравнения содержат 6 ионов Cl–, которые можно вычеркнуть. Таким образом, получаем краткое ионное уравнение: 2Cr(тв) + 3Ni2+(р-р) –> 2Cr3+(р-р) + 3Ni(тв).
- Проверьте результат. Суммарные заряды левой и правой частей ионного уравнения должны быть равны.
Реклама
Советы
- Приучите себя всегда записывать агрегатное состояние всех компонентов во всех уравнениях химических реакций.
Реклама
Об этой статье
Эту страницу просматривали 71 906 раз.