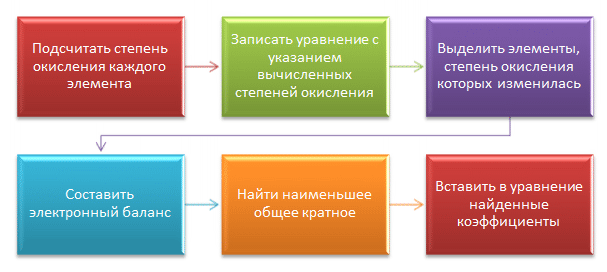
Алгоритм метода:
Краткий алгоритм:
Шаг 1:
а) находим “простые” степени окисления
б) находим “сложные” степени окисления
Шаг 2:
Переписываем уравнение со степенями окисления. Подчеркиваем РОЗОВЫМ все элементы, которые меняют степень окисления ВО ВСЕХ СОЕДИНЕНИЯХ, где они присутствуют. Если видим, что элемент работает в двух ролях, дублируем в формуле соединения для каждой роли.
Шаг 3:
а) Рисуем “образец” картинки для Н2О
б) Рисуем картинку для текущей реакции. Определяем окислитель и восстановитель
в) Разрешаем все роли в реакции: ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ, НЕЙТРАЛЬНЫЙ ЭЛЕМЕНТ (если есть)
Шаг 4:
Составляем уравнения электронного балланса (с описанием роли в начале строки). подчеркиваем ВНУТРЕННИЕ коэффициенты
Шаг 5:
Отчеркиваем черту справа. Первая колонка – количество электронов в реакции. Вторая – общее число. Третья – приведенные коэффициенты
Шаг 6:
а) ставим коэффициенты около веществ, участвующих в роли окислителя и восстановителя, учитывая внутренние. Фиксируем эти коэффициенты.
б) Ставим коэффициенты у “простых” веществ: сначала у “необычных” веществ, потом у “минимальных” (Н, О).
в)
_____________________________
Пример 1
Даны компоненты реакции:
Ag + HNO3 → AgNO3 + NO + H2O
Шаг 1.
Определим известные степени окисления по правилам
Ag0 + H+1N O-23 → Ag N O-23 + N O-2 + H+12O-2
Используя правило 0 заряда молекул, найдем следующие степени окисления:
найдем степень оксиления N:
H+1N+5O-23 ,
Зная, что N+5
Найдем степень окисления Ag
Ag+1N+5O-23
Шаг 2.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции. Подчеркиваем ВСЕ элементы, которые меняют степени окисления, во ВСЕХ соединениях, чтобы их не терять
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Видим, что N работает в двух ролях, поэтому разбиваем эти роли:
Ag0 + H+1N+5O-23 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Шаг 3.
Вспоминаем картинку для определения ролей:
Рисуем картинку для наших веществ, смотрим направление стрелок, вычисляем окислитель и восстановитель:
Определяем роли в формуле:
Ag0 + H+1N+5O-23 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Шаг 4:
Составляем уравнения электронного балланса:
Восстановитель: Ag0 – 1e = Ag+1
Окислитель: N+5 +3e = N+2
Шаг 5:
Отчеркиваем вертикальной чертой, и пишем количество электронов, находим наименьшее общее кратное:
Восстановитель: Ag0 – 1e = Ag+1 | 1 3
| 3
Окислитель: N+5 +3e = N+2 | 3 1
Убеждаемся, что внутри уравнений нет самостоятельных (оранжевых) коэффициентов!
Шаг 6:
Начинаем уравнивать. Сначала пишем 3 для Ag и 1 для N-окислителя:
3 Ag0 + 1 H+1N+5O-23 + H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + H+12O-2
Далее мы можем трогать только те части, которые не задействованы в окислении – восстановлении
Справа больше N
3 Ag0 + 1 H+1N+5O-23 + 3 H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + H+12O-2
Слева больше H
3 Ag0 + 1 H+1N+5O-23 + 3 H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + 2 H+12O-2
Составляем таблицу с элементами:
| Элемент | Слева | Справа |
| Ag-восст | 3 | 3 |
| H+ | 1+3=4 | 2*2=4 |
| N-окисл | 1 | 1 |
| N+5 | 3 | 3 |
| О-2 | 3+3*3=12 | 3*3+1+2=12 |
Убеждаемся, что все совпало
Приводим реакцию в окончательный вид, складывая одинаковые вещества:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Проверяем, что все коэффициенты не имеют общего делителя!
_____________________________
Пример 2:
Дано уравнение
Cl2 + KOH = KCl + KClO3 + H2O
Шаг 1.
Определим известные степени окисления по правилам
Cl02 + KO-2H+1 → KCl + KClO-23 + H+12O-2
Найдем степень окисления K
K+1O-2H+1
Зная K+1
K+1Cl-1 и K+1Cl+5O-23
Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 2.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции. Подчеркиваем ВСЕ элементы, которые меняют степени окисления, во ВСЕХ соединениях, чтобы их не терять
Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Видим, что Cl работает в двух ролях, поэтому разбиваем эти роли:
Cl02 + Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 3.
Вспоминаем картинку для определения ролей:
Рисуем картинку для наших веществ, смотрим направление стрелок, вычисляем окислитель и восстановитель:
Определяем роли в формуле:
Cl02 + Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 4:
Составляем уравнения электронного балланса:
Окислитель: Cl20 + 2e— = 2 Cl—
Восстановитель: Cl20 – 10e— = 2 Cl+5
Шаг 5:
Отчеркиваем вертикальной чертой, и пишем количество электронов, находим наименьшее общее кратное:
Окислитель: Cl20 + 2e— = 2 Cl— | 2 5
| 10
Восстановитель: Cl20 – 10e— = 2 Cl+5 | 10 1
Шаг 6:
Начинаем уравнивать. Сначала пишем 1 для Cl-восстановителя и 5 для Сl-окислителя, не забывая домножения на оранжевые внутренние коэффициенты!!! :
5 Cl02 + 1 Cl02 + K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + H+12O-2
Далее мы можем трогать только те части, которые не задействованы в окислении – восстановлении
Справа больше K
5 Cl02 + 1 Cl02 + 12 K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + H+12O-2
Слева больше Н и О
5 Cl02 + 1 Cl02 + 12 K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + 6 H+12O-2
Составляем таблицу с элементами:
| Элемент | Слева | Справа |
| Cl-восст | 5*2=10 | 2*5=10 |
| H+ | 12 | 6*2=12 |
| Cl-окисл | 1*2=2 | 2*1=2 |
| K+ | 12 | 2*5+2*1=12 |
| O-2 | 12 | 2*1*3+6=12 |
Убеждаемся, что все совпало
Складываем одинаковые вещества:
6 Cl2 + 12 KOH → 10 KCl + 2 KClO3 + 6 H2O
Проверяем, что все коэффициенты не имеют общего делителя!
Находим общий делитель – 2. Делим:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
источники примеров:
http://profmeter.com.ua/communication/learning/course/course6/lesson326/ – пример №1 (пр. А)
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html – пример №2 (из задачи 5)
Делаем на занятии
KClO3 = KCl + KClO4
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
Zn + H2SO4(конц) = ZnSO4 + SO2 + H2O
(ответ http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html)
HCl + MnO2 Cl2 + MnCl2 + H2O
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
(ответ http://www.alhimikov.net/elektronbuch/Page-28.html)
Метод электронного баланса и уравнения химических реакций
В 20 задании ОГЭ по химии необходимо полностью предоставить решение. Решение 20 задания – составление уравнения химической реакции методом электронного баланса.
Теория к заданию №20 ОГЭ по химии
Об окислительно-восстановительных реакциях мы уже с Вами говорили в 14 задании ОГЭ по химии. Теперь рассмотрим метод электронного баланса на типовом примере, но перед этим узнаем, что это за метод и как им пользоваться.
Метод электронного баланса
Метод электронного баланса – метод уравнивания химических реакций, основанный на изменении степеней окисления атомов в химических соединениях.
Алгоритм наших действий выглядит следующим образом:
- Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
- Выбираем только те элементы, которые поменяли степень окисления
- Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
- Находим наименьшее общее кратное для переданных электронов
- Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
Итак, составляем электронный баланс. В данной реакции у нас меняют степени окисления сера и йод.
Сера находилась в степени окисления +6, а в продуктах – -2. Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
1 | S+6 + 8ē → S–2
4 | 2I–1 – 2ē → I2
Сера забирает 8 электронов, а йод отдает только два – общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
Как производится метод электронного баланса?
Метод электронного баланса
Анонимный вопрос
21 декабря 2018 · 52,5 K
Получил математическое и богословское образование. Есть дети, соответсвенно и опыт их… · 12 янв 2019
Метод электронного баланса используется для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций. Суть метода заключается в том, что количество электронов, отданных восстановителями равно количеству электронов, принятых окислителями.
Алгоритм:
-
В схеме реакции определяем, какие вещества – окислители, а какие – восстановители.
-
Определяем, сколько электронов отдал каждый восстановитель, и сколько принял каждый окислитель.
-
Отдельно суммируем число отданных электронов и принятых.
-
Находим наименьшее общее кратное, и расставляем коэффициенты так, чтобы количество отданных электронов равнялось количеству принятых (учитываем количество атомов окислителей и восстановителей в веществах).
-
Перенеся коэффициенты в схему реакции, также уравниваем количество атомов тех элементов, которые не меняли степень окисления.
Пример (в скобках указано количество принятых или отданных электронов):
Дана реакция: FeS + O2 = Fe2O3 + SO2
-
Здесь железо и сера – окислители, кислород – восстановитель.
-
Fe(+2) – 1e = Fe (+3) , S(-2) – 6e = S(+4), т.е. железо отдаёт один электрон, сера отдаёт четыре.
O2 +4e = 2O(-2), кислород принимает четыре электрона. -
Получаем, что окислители отдали 7 электронов: Fe(+2) + S(-2) – 7e = Fe(+3) + S(+4), а восстановитель принял 4 электрона.
-
Наименьшее общее кратное для 7 и 4 – это 28, коэффициенты получаются такими:
4Fe(+2) + 4S(-2) + 7O2 = 4Fe(+3) + 4S(+4) + 14O(-2) -
Уравнение приобретает вид: 4FeS + 7O2 = 2Fe2O3 + 4SO2
55,4 K
Комментировать ответ…Комментировать…
…
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции