: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Что на роду написано, того не миновать?
Редактирование генома в терапии наследственных заболеваний
Наследственность – это своего рода фатализм нашего времени. Расшифровка последовательности ДНК сродни предсказанию судьбы человека. Нам говорят, что гены определяют все: от цвета глаз до склонности к девиантному поведению. Добавьте к этому болезни, передающиеся по наследству, и мутации, связанные с риском развития таких болезней, как рак. Но можно ли пойти наперекор зловещему року и изменить судьбу, записанную на «скрижалях» ДНК? Да, это возможно, и если не сегодня, то в недалеком будущем. Генетическая инженерия занимается этими проблемами уже несколько десятков лет, однако в последние годы вокруг редактирования геномов возник особый ажиотаж. Что же изменилось? Ответ на этот вопрос – аббревиатура CRISPR/Cas
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Но какое отношение имеет это к наследственным болезням человека? Все дело в механизме действия системы CRISPR. Бактериофаги впрыскивают в клетку бактерии свою ДНК, которая многократно копируется и упаковывается в белковую оболочку за счет «хозяина» – таким образом на свет появляются новые бактериофаги. Защитная система бактерии, включающая белок-«ножницы» Cas, распознает чужую ДНК в случае, если она уже встречалась с ней раньше, и разрезает ее. Захватчики побеждены.
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
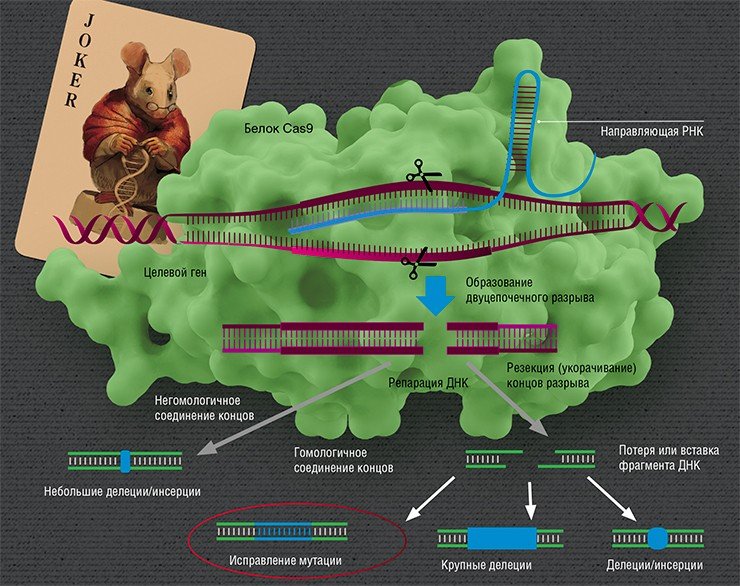
Так в руках ученых оказался простой и эффективный инструмент, позволяющий направленно вносить изменения в ДНК живой клетки, т. е. переписывать те самые «скрижали». С тех пор вышли сотни научных статей, свидетельствующих о том, что эта система работает в самых различных видах организмов, позволяет вносить разрывы в любые последовательности генов, в том числе несущие мутации, вызывающие наследственные болезни (Немудрый, 2014).
Ремонтируем ДНК направленно
Но вот ДНК разрезана – что дальше? Дальше идет «ремонт» (репарация). Вообще разрывы в ДНК не такая уж и редкость: ежесуточно в каждой клетке человека под действием активных форм кислорода их возникает около 10 тысяч, и клетка их тщательно «штопает», восстанавливая целостность ДНК (Helbock et al., 1998). Но эти разрывы случайны, в отличие от действия CRISPR/Cas.
Существуют «терапевтические» мутации, предотвращающие развитие заболеваний. Например, мутации в гене CCR 5 предотвращают заражение клеток ВИЧ (Genovese et al., 2014, Liu et al., 1996), а мутация A673T в гене APP – развитие болезни Альцгеймера (Jonsson et al., 2012). С помощью системы CRISPR/Cas можно внести в геном необходимые изменения, «сломав» целевые гены либо внеся целевые замены (Cox et al., 2015)
Направленные разрывы, внесенные CRISPR/Cas, могут быть репарированы по-разному: существует несколько способов, отличающихся механизмом, точностью и т. п. В зависимости от пути репарации можно получить следующие результаты. Во-первых, «сломать» ген, если при репарации ДНК произойдет мутация. Такого эффекта можно добиться, если репарация произойдет, например, по механизму соединения негомологичных концов, для которого характерна неточность. Также возможно добиться крупной делеции (утраты фрагмента ДНК) и удалить участок либо целый ген.
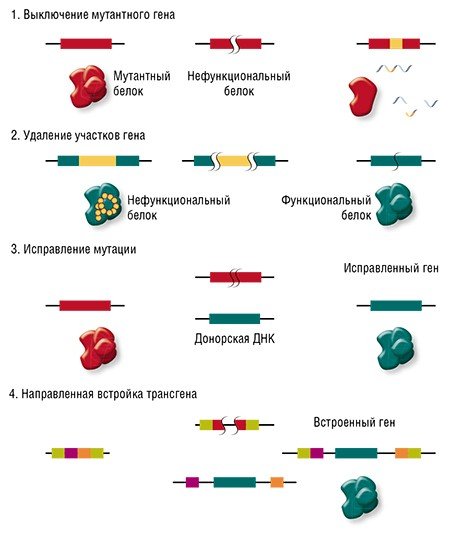
Сестринская хромосома присутствует в клетке в единичном экземпляре, а копий «донорной» ДНК можно доставить множество, что дает искусственной ДНК конкурентное преимущество, пусть она и отличается немного от поврежденного участка. Таким образом можно «исправить», к примеру, мутацию, или вставить небольшой новый фрагмент ДНК.
И вот здесь мы вплотную подходим к терапии генетических заболеваний. Начнем с того, что все такие патологии отличаются друг от друга: они вызваны мутациями в разных генах, да и сами мутации могут иметь различную природу и давать разный эффект в одном и том же гене. Соответственно, есть разные варианты применения геномного редактирования: ген можно «сломать» или просто удалить мутантный участок, «исправить» мутацию или, напротив, добавить в геном полезные «терапевтические» мутации или даже новый дополнительный трансген.
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
Работаем «в пробирке» и в организме
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
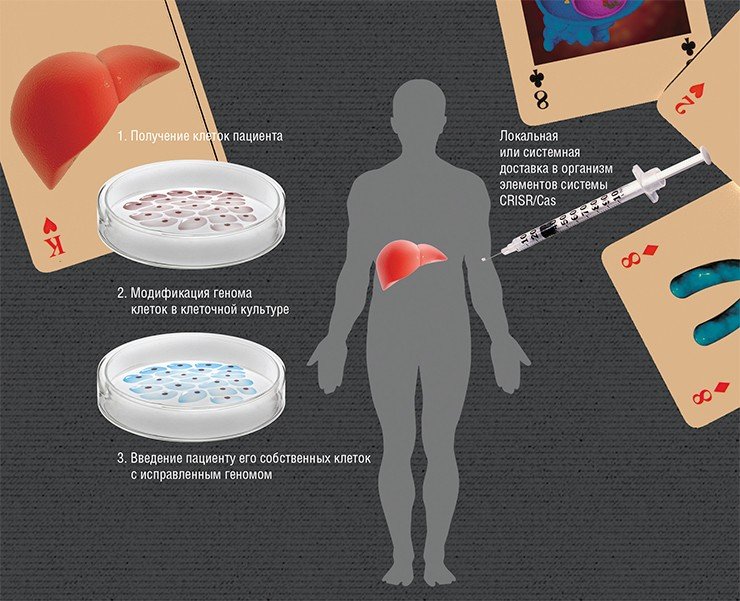
Суть редактирования геномов ex vivo («вне живого») заключается во введении в организм «здоровых» клеток, в которых, к примеру, будет синтезироваться нужный белок. Но если вводить клетки, взятые даже от здорового донора, то организм пациента с большой вероятностью их отторгнет. Поэтому нужно взять клетки самого пациента и изменить в них мутантный ген, а потом ввести их обратно. Наиболее разработан этот подход для заболеваний крови, поскольку забор и пересадка костного мозга, где идет кроветворение, практикуется с 1959 г.
Но что делать в случае, если «дефектные» клетки не так просто получить? Например, если болезнь проявляется в головном мозге? Вдобавок не все типы клеток способны пережить все процедуры в чашке Петри вне организма. Здесь на помощь приходит другая крайне перспективная технология нашего времени, связанная с получением так называемых индуцированных плюрипотентных стволовых клеток (ИПСК).
Плюрипотентные стволовые клетки бессмертны: теоретически они могут делиться бесконечно и при действии определенных стимулов образовывать любые клетки тканей и органов взрослого организма. Используя необходимый набор стимулов, можно направить развитие стволовых клеток в определенный тип клеток, например, в нейроны. Этот процесс называют направленной дифференцировкой
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Но зачем тратить время и деньги на извлечение и культивирование клеток, если можно все сделать прямо «на месте»? Ведь система CRISR/Cas в силу своей универсальности теоретически способна работать непосредственно в клетках живого организма. Главная проблема – это эффективно и безопасно доставить элементы этой системы в нужное место.
Сегодня наиболее часто для доставки генов CRISPR/Cas в организм используются вирусные частицы. В качестве таких носителей обычно выступают аденоассоциированные вирусы – дефектные вирусы, способные размножаться только в присутствии «помощников»-аденовирусов. Эти вирусы эффективно заражают клетки человека, но не вызывают у него никаких патологий. А вирусные частицы, в геном которых встроены гены CRISPR/Сas, после заражения уже не могут размножаться. При этом разные серотипы этих вирусов имеют «склонность» к разным тканям. Например, серотип AAV8 предпочитает ткани печени, а уже сегодня можно создать искусственные серотипы, нацеленные на любой орган.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Всегда есть это «но». Технология CRISPR/Cas начала применяться для редактирования геномов млекопитающих пять лет назад. На сегодня получено колоссальное количество данных, достигнут огромный прогресс на пути к клиническому применению, но все же остается ряд вопросов, которые необходимо будет решить для каждого конкретного генетического заболевания. Например, какая доставка будет оптимальна? Приживутся ли введенные клетки? Какова будет эффективность и безопасность лечения? И etc. …
Возьмем для примера пару вопросов из этого списка и посмотрим, какие конкретные ответы на них уже получены в научном сообществе. Одна из проблем использования CRISPR/Cas связана с возможностью нецелевых эффектов: система может вносить разрывы в участки, отличающиеся от целевого на несколько «букв» – нуклеотидов, что чревато риском возникновения нежданных мутаций. Особенно остро вопрос безопасности стоит при редактировании геномов in vivo, когда проверить результат предварительно невозможно.
Для решения этой проблемы лидирующие группы ученых под руководством Д. Дудны, Ф. Чжана и К. Джуна независимо друг от друга создали мутантные «улучшенные» варианты белка Cas9 с повышенной специфичностью, частота нецелевых эффектов которых упала на несколько порядков.
С помощью технологии геномного редактирования можно не только лечить наследственные заболевания, но и создавать «дизайнерских» детей. Ведь если можно исправить ген, вызывающий болезнь, то почему бы не изменить ген, регулирующий цвет глаз, продолжительность жизни, наконец, интеллект? Уже сегодня в Китае с помощью CRISPR/Cas выведены собаки породы бигль, у которых «выключен» ген, кодирующий миостатин – фактор, подавляющий рост мышечной ткани. В результате эти животные отличаются повышенной мускулистостью. А что мешает «выключить» этот ген в эмбрионе человека?
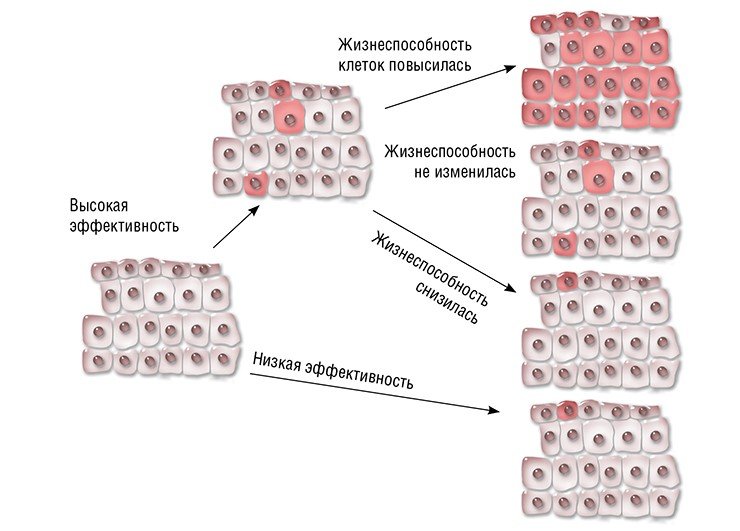
Что касается эффективности терапии, то все зависит от особенностей самого заболевания и мутации, его вызывающей. Возможны три варианта: после исправления мутации жизнеспособность клеток увеличится, не изменится или ухудшится. В первом случае исправленные клетки получают конкурентное преимущество и могут постепенно заместить мутантные. Например, на линии мышей с наследственным заболеванием печени – тирозинемией I типа – было показано, что при системной доставке CRISPR/Cas непосредственно в организм животного мутация «исправляется» в 6 % клеток печени. Даже такого небольшого количества клеток достаточно, чтобы предотвратить падение веса и привести в норму биохимические показатели печени животных. А более жизнеспособные клетки с исправленной мутацией начинают «обживать» печень.
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Классическими же модельными заболеваниями в исследованиях по терапии с помощью геномного редактирования являются гемоглобинопатии и мышечная дистрофия Дюшенна. Именно на этих заболеваниях была подтверждена работоспособность концепций такого лечения, показано, что клетки с исправленной мутацией демонстрируют «здоровый» фенотип. В случае мышечной дистрофии Дюшенна такие клетки не только успешно встраивались в мышечную ткань взрослых мышей, но и улучшали функциональные показатели всей мышцы в целом.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
Можно ожидать, что уже в ближайшее десятилетие новая технология найдет и клиническое применение. Так, в 2016 г. в Китае стартовали первые клинические испытания нового метода иммунотерапии метастазирующего немелкоклеточного рака легкого, в котором используются T-лимфоциты с «отредактированным» геномом.
С. М. ЗАКИЯН: «НАМ БЫЛ БРОШЕН ВЫЗОВ, И МЫ ДОЛЖНЫ НА НЕГО ОТВЕТИТЬ!» Исследования по применению системы CRISPR/Cas для терапии наследственных заболеваний начались в лаборатории эпигенетики развития ИЦиГ СО РАН под руководством С. М. Закияна в 2013 г., буквально сразу после выхода первых публикаций на эту тему.
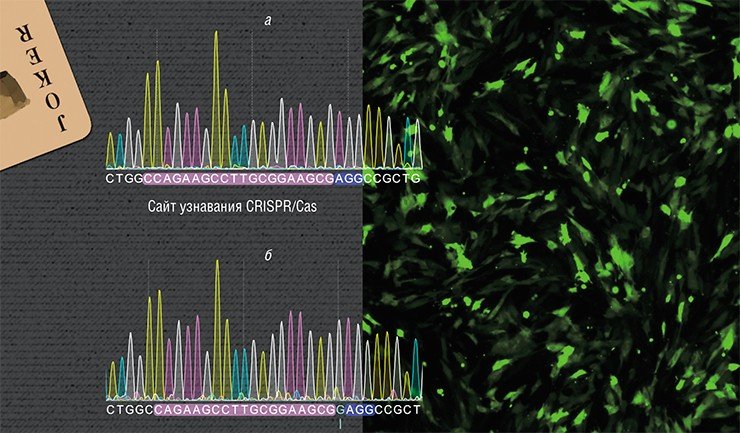
Исследования ведутся на лабораторных крысах линии Brattleboro – модели генетически детерминированного заболевания, при котором наблюдается дефицит гормона аргинин-вазопрессина. В результате у животных развивается наследственный несахарный диабет с характерным для него чрезмерным потреблением жидкости. На сегодня уже получена линия клеток с исправленной мутацией в гене, кодирующем этот гормон.
В данном случае задача усложнялась тем, что ген вазопрессина по последовательности нуклеотидов схож с геном другого гормона – окситоцина. Более того, на участке, в котором возникла мутация у крыс Brattleboro, эти гены практически идентичны. Тем не менее удалось добиться специфичного действия CRISPR/Cas в гене вазопрессина без нецелевых двунитевых разрывов ДНК в гене окситоцина. На следующем этапе предполагается вводить исправленные клетки в организм животных для оценки терапевтического эффекта
Возможности, которые дает нам технология CRISPR/Cas, пугающие и захватывающие одновременно. Сначала китайские исследователи, а затем их коллеги из США смогли внести изменения в эмбрионы человека. Недавно группа американских ученых под руководством Ш. Миталипова «исправила» в человеческом эмбрионе мутацию, вызывающую гипертрофическую кардиомиопатию (Ma et al., 2017). Эти эмбрионы были получены специально в результате искусственного оплодотворения, для которого были использованы здоровая яйцеклетка и сперматозоиды носителя мутации. Согласно современным нормам, зародыши были выведены из эксперимента на стадии бластоцисты. Однако с помощью современных репродуктивных технологий уже сегодня можно было бы имплантировать такие эмбрионы суррогатным матерям.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Литература
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Успешное применение CRISPR/Cas9 системы для редактирования генома эмбриона
Генетические анализы в настоящее время направлены на предупреждение наследственного заболевания или своевременное вмешательство для снижения или предотвращения негативного эффекта заболевания. Это связано с тем, что развитие инструментов для фактического исправления мутации в гене, вызывающем наследственное заболевание, отстает от методов диагностики.
В чем же сложность исправления мутации в гене? У человека примерно 30 000 генов, взрослый человек состоит в среднем из 4 триллионов клеток, некоторые из них ежедневно обновляются. Для полного «исцеления» нужно исправить мутацию в каждой клетке организма и при этом не «испортить» другие гены. Тут и начинаются сложности.
Первая задача – это сам механизм исправления гена. Для исправления генетической «ошибки», приводящей к заболеванию, нужны весьма специфические инструменты – молекулярные «ножницы», которые разрежут ДНК в строго указанном месте, и «пинцет», который вместо вырезанного фрагмента с ошибкой вставит правильный кусок ДНК. Вся система клетки направлена на сохранение генетической информации в неизменном виде. ДНК, которая является материальным носителем этой информации, сама по себе в клетке не работает – это инструкция по построению разных функциональных молекул и их применению. Это значит, что любая попытка внести изменения в ДНК воспринимается клеткой как нападение, от которого она может защищаться разными способами. Некоторые вирусы научились встраиваться в ДНК человека в обход этой защиты. Их инструменты можно использовать для привнесения в ДНК клетки здорового гена целиком, с которого будет синтезироваться правильно работающий белок. Однако вирусы не заботятся о том, чтобы не испортить другие гены в чужом геноме при встройке, поэтому такой метод исправления мутаций может быть опасен нарушением других, здоровых генов.
Также есть специальные системы внутри клетки, которые помогают разным белкам, работающим с ДНК, находить нужные гены, следят за цельностью длинных молекул ДНК и т.д. Эти белки умеют распознавать определенную последовательность нуклеотидов, то есть их можно настроить так, чтобы они работали с высокой точностью только с тем участком, который нужно исправить. Однако проблема таких молекулярных ножниц заключается в том, что они очень большие и доставить их в клетки организма человека очень сложно.
Самая остроумная и многообещающая идея направляемых «молекулярных ножниц» основана на использовании свойств защитной системы бактерий. Еще в 1987 году в ДНК бактерий нашли необычные последовательности, которые позже назовут CRISPR-кассетами. Однако на тот момент разобрать их структуру и понять функцию не удалось. До 2006 года эти последовательности активно использовали для классификации бактерий, так как они значительно различаются не только между видами, но даже между штаммами – они были своеобразными генетическими карточками каждого бактериального штамма. Но в 2006 году, объединив данные о структуре CRISPR-кассет и ассоциированных с ними белков cas, исследователи поняли функцию всей этой системы, а также механизм ее работы. CRISPR/Cas система бактерий – это защитный механизм, предохраняющий одноклеточный организм от проникновения чужой ДНК. В ДНК CRISPR-кассеты хранится информация о вирусах, которые раньше попадались этой бактерии или ее предкам, в виде небольших фрагментов ДНК этих вирусов. С помощью этих фрагментов клетка вырабатывает сигнальные РНК, распознающие проникшую вирусную ДНК и направляющие к ней cas-белки, которые разрежут ее на небольшие безопасные для клетки куски. Получается, что эта система позволяет разрезать ДНК, но только в определенном месте в соответствии с тем, где укажут небольшие молекулы РНК. При использовании этого механизма для исправления мутации в клетку человека нужно доставить лишь небольшой (по сравнению с описанными выше собственными белками клетки) белок cas9 и «руководящую» РНК, которая укажет место мутации.
Второй задачей «починки» гена является доставка инструментов до всех клеток, чтобы исправить ошибку в каждой клетке организма. К этой задаче подходят с двух сторон. С одной стороны, в каждом типе клеток каждого органа работают разные гены. Это значит, что исправлять ген нужно не во всех клетках организма, а только в тех, в которых этот ген необходим для полноценного выполнения функций ткани или органа. Такой подход значительно ограничивает количество клеток, в которые нужно доставить инструментарий и позволяет подобрать наиболее эффективный способ в зависимости от особенностей этих клеток, тканей, органов. С другой стороны, наш организм изначально развивается из одной клетки и на ранних этапах развития эмбрион состоит всего из нескольких клеток. И если внести изменение на таком этапе, то с высокой эффективностью можно получить эмбрион с исправленной мутацией во всех клетках, а значит из него вырастет здоровый человек.
Несмотря на кажущуюся простоту идеи использовать систему CRISPR/Cas9 для исправления мутации на стадии зиготы (оплодотворенной яйцеклетки, из которой развивается эмбрион), такая процедура была успешно проведена только недавно. Исследователи из Китая представили результаты работы, в которой описали применение CRISPR/Cas9 для исправления точечной мутации в гене HBB, вызывающей β-талассемию, и мутации в гене G6PD, связанной с развитием дефицита глюкозо-6-фосфатдегидрогеназы, на самой ранней стадии развития эмбриона – в зиготе.
Процедура по исправлению мутации на стадии зиготы проводилась при искусственном оплодотворении. В более ранних исследованиях оценивали эффективность редактирования генома с помощью системы CRISPR/Cas9 на нежизнеспособных зиготах с тремя пронуклеусами (результат некорректоного оплодотворения). Он оказался не слишком впечатляющим – исправление мутации наблюдали только 20% случаев.
В последней же работе провели процедуру редактирования генома на нормальных зиготах. При этом оказалось, что для мутации в гене HBB в 50% и для гена G6PD в 100% случаев мутация была исправлена. Это говорит о том, что система работает на потенциально жизнеспособных зиготах и может быть эффективна.
Важно понимать, что у этой работы есть как технические ограничения: малое количество образцов, отсутствие проверки на способность имплантироваться и нормально развиваться во время беременности, так и этические. В настоящее время эту систему планируют использовать для исследования влияния разных генов и мутаций в них на ранние стадии развития эмбриона, выявления функции разных генов в процессе имплантации эмбриона, что, возможно, позволит повысить эффективность процедур ЭКО.
Авторы: Вероника Юрьева, стажер
Светлана Жикривецкая, биолог-исследователь
Научные статьи-источники:
Bianconi E et al. An estimation of the number of cells in the human body. Ann Hum Biol, 2013
Tang L et al. CRISPR/Cas9-mediated gene editing in human zygotes using Cas9 protein. Mol Genet Genomics, 2017
В конце XX века тогда еще начинающие британские биохакеры совершили настоящий прорыв в генетике и предоставили любому человеку возможность с помощью ДНК-теста узнать больше о своих далеких предках и загадочной наследственности. Тогда, правда, только избранные могли объяснить, зачем и кому это нужно, — генетика была интересна лишь узкой группе специалистов, работающих с редкими заболеваниями. Но теперь за простым любопытством стоит более глобальная задача — разобраться в своей наследственности. А причина этому — надвигающийся тренд на тотальное оздоровление, исцеление и персонализированную медицину.
Сегодня эксперты уже не сомневаются в том, что генетика — основополагающая наука медицины будущего, хотя ее технологии и без того кажутся чем-то из мира научной фантастики. Перспективы развития генетики в России обсудят на площадках форума «БИОТЕХМЕД», который пройдет 16 и 17 сентября в Геленджике. В преддверии этого события «РБК Стиль» пообщался с одним из экспертов форума — врачом-генетиком Екатериной Захаровой — и узнал у нее, как работает ДНК, какие особенности мы можем унаследовать от родителей и безопасно ли вмешательство генетиков в организм.
Екатерина Захарова
Заведующая лабораторией наследственных болезней обмена веществ ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», член экспертного совета по редким болезням при комитете Государственной думы по охране здоровья
Как устроена клетка
Со школьных времен всем известно, что организм человека состоит из множества клеток, в каждой из которых есть ядро — именно там хранится генетическая информация. Ее мы наследуем от родителей и дальше передаем своим детям. В материальном обличии эта информация представлена в виде той самой нити ДНК — дезоксирибонуклеиновой кислоты. Эта макромолекула была открыта достаточно давно, но то, что именно в ней хранится генетическая информация, стало известно только в XX веке.
Дезоксирибонуклеиновая кислота (ДНК) — макромолекула, которая хранит и передает из поколения в поколение генетическую программу функционирования живых организмов. Биологическая информация в ДНК представлена в виде уникального генетического кода, состоящего из последовательности нуклеотидов.

© DrAfter123/gettyimages.com
Зачем нужна ДНК
Говоря о том, зачем нам ДНК и что она делает, можно привести аналогию: каждый белок в нашем организме синтезируется по определенному «рецепту». В нем указано, сколько должно быть аминокислот, в какой последовательности они будут соединяться и куда дальше последуют. В таком случае ДНК — это поваренная книга, в которой записаны рецепты всех наших белков, а мутация — это повреждение белка или изменение текста поваренной книги. Если в рецепте появляется опечатка, то белок получается «неправильный» и не выполняет свои функции должным образом, отчего страдает как клетка, так и весь организм, что приводит к развитию заболевания.
Во всех наших клетках хранятся одинаковые гены. Но функции у клеток разные: одни, например, синтезируют гемоглобин, другие занимаются мышечными белками, третьи — нервными. Это обеспечивается с помощью системы регуляции активности генов: она способна «включать» одни гены и оставлять в молчании другие.
Чем генетика отличается от наследственности
Генетика — большая и очень разнообразная наука. Клиническая генетика изучает, как проявляются наследственные болезни, популяционная — наше происхождение и особенности каждого народа. А вот наследственность — понятие уже более узкое. Люди давно заметили, что есть признаки, которые ярко проявляются у представителей одной семьи и передаются из поколения в поколение.
Если вспомнить живопись и портреты членов династии испанских Габсбургов, то многим сразу придут на ум их наследственные приметы: выступающая «габсбургская губа» и гипертрофированная нижняя челюсть, которая, говорят, даже мешала монарху нормально пережевывать пищу. Совершенно очевидно, что эти признаки связаны с изменениями определенных генов в известном роду.
Что еще хранится в ДНК
Информация, закодированная в ДНК, способна рассказать как о заболеваниях, так и о цвете волос, форме глаз, группе крови и даже вкусовых предпочтениях. Например, в ходе генетических исследований ученые обнаружили, что всех людей можно разделить на две категории: тех, кто любит капусту брокколи, и тех, кто ее просто ненавидит. Оказалось, что у второй группы есть определенные повреждения в гене, ответственные за восприятие этого вкуса, — им брокколи кажется горькой и неприятной.
В ДНК также могут быть записаны наши пагубные привычки, склонность к полноте или употреблению алкоголя. Изменения в некоторых генах делают нас более восприимчивыми к этим факторам. Но, как правило, за них отвечает не один, а сразу множество взаимосвязанных генов. Кроме того, врачи уверены, что более существенную роль в данном вопросе играют воспитание и другие социальные факторы.

© DrAfter123/gettyimages.com
Можно ли унаследовать интеллектуальные способности
Считается, что интеллектуальные и эмоциональные способности будущего ребенка определяются большим набором генов, и предсказать, какую именно комбинацию они составят, наука пока не в состоянии. Поэтому утверждать, что у гениальных родителей рождаются только гениальные дети, нельзя. Хотя такой миф до сих пор существует: некоторые женщины даже продолжают выбирать себе избранника, исходя из его интеллектуальных способностей, или искать какого-нибудь выдающегося донора — нобелевского лауреата.
Однако есть теория, согласно которой IQ будущего ребенка в большей степени определяется матерью, поскольку в тех областях мозга, которые отвечают за интеллект, чаще активируется ген, наследуемый от нее. А вот за эмоциональное состояние и характер чаще отвечает отец. И в этом случае нобелевский лауреат может оказаться не самым лучшим кандидатом на отцовство.
Как наследуются болезни
Болезни могут наследоваться по-разному. В некоторых случаях патология должна быть у одного из родителей, который, в свою очередь, передает ее детям (с вероятностью 50%). В других болезнь наследуется только по женской линии, и в итоге страдают ей мальчики, а девочки остаются ее здоровыми носительницами. Есть и заболевания, которые переносят оба родителя — у них больной ребенок может появиться на свет только в 25% случаев.
Кроме того, существует множество патологий, которые не наследуются, а появляются случайным образом. Например, в одной половой клетке матери или отца происходят изменения без особых на то причин, и в семье, где никогда не встречались с генетическими заболеваниями, может родиться малыш с синдромом Дауна (хромосомной патологией) или ахондроплазией — моногенным заболеванием, которое проявляется как карликовость. В такой ситуации одна из главных задач врача-генетика — выяснить, как наследуется болезнь, проинформировать семью о возможных рисках рождения больного ребенка, а также рассказать, что можно сделать, чтобы ребенок родился здоровым.
© DrAfter123/gettyimages.com
Наследуются ли онкологические заболевания
Большинство онкологических заболеваний — это мутации в генах. Однако они возникают не в половых, а в соматических клетках и не передаются по наследству. В таком случае на их развитие большое влияние оказывают именно внешние факторы: курение, радиация и канцерогенные химические вещества.
Но, к сожалению, есть отдельные виды онкозаболеваний, к которым приводит мутация в генах: они переходят от родителей к ребенку. Самый известный пример — рак молочной железы, за появление которого отвечают гены BRCA1 и BRCA2. В группу риска попадает подавляющее большинство девушек и женщин, у которых в семье были случаи рака молочной железы, поскольку наличие мутации в генах сильно повышает риск развития этого заболевания в определенном возрасте. Это означает, что рак может появиться вне зависимости от образа жизни, занятий спортом и сбалансированности рациона.
Как разгадать свои гены
Попытаться разобрать загадочную ДНК и узнать больше о своих генах можно при помощи генетических тестов. Как правило, их рекомендуют проводить в первую очередь тем семьям, где уже были зафиксированы случаи наследственных заболеваний. Но есть скрининг-тесты, которые проводятся для всех, вне зависимости от того, есть ли вероятность возникновения наследственного заболевания. Например, сейчас у всех беременных женщин есть возможность сдать анализы на определение генетических заболеваний у эмбриона. Скрининг на раннем сроке проводится специально для того, чтобы определить, входят ли будущая мама и ее малыш в группу риска. Дальше назначаются дополнительные обследования, которые подтверждают или опровергают развитие патологии. В ходе беременности не менее важно своевременно делать УЗИ, потому что пороки развития у плода встречаются намного чаще, чем любые наследственные заболевания.
Будущие родители должны осознавать, что комбинации их генов не всегда могут привести к идеальному результату. Но с некоторыми из наследственных патологий ребенок может жить совершенно нормально, поэтому пугаться их не стоит.
Может ли врач исправить наследственность
Если представить, что врач на начальном этапе сможет скомбинировать гены так, чтобы исправить недочеты в хромосомах будущего ребенка, родители, наверное, согласятся. Хотя стоит взять в расчет то, что часто двигателями прогресса, науки и искусства становятся именно неординарные люди. У талантливых художников, поэтов или музыкантов неоднократно были зафиксированы особенности развития, и если бы отбор по таким критериям существовал сотни лет назад, то мир лишился бы практически всех гениев.
Сейчас мы знаем многое о геноме человека и уже научились читать его последовательность. Но вот понять смысл этого «текста» можем далеко не всегда. Так же, как не всегда знаем, повлияет ли положительно наше вмешательство в структуру одного гена на работу других. Больше того, функция многих участков ДНК до сих пор остается не изучена.

© DrAfter123/gettyimages.com
ЭКО и дети из пробирки
Когда начинаешь работать с чем-то малоизвестным (а это часто встречается в генетике), всегда возникает вопрос о том, что делать правильно и этично, а что нет. Сегодня в цивилизованных странах накладывается запрет на генетические манипуляции с половыми клетками, потому что мы не знаем, как их изменения могут передаваться дальше и к каким последствиям это приведет. И, конечно, нельзя проводить эксперименты на живых эмбрионах.
Пока что в случае обнаружения какого-либо генетического заболевания врач может только предложить пренатальную или предимплантационную диагностику — метод, позволяющий произвести генетическую экспертизу одной клетки эмбриона перед процедурой ЭКО (экстракорпорального оплодотворения). Задача такой диагностики — предоставить возможность рождения здоровых детей в семьях, где существует высокий риск рождения ребенка с тяжелыми заболеваниями. Но у любых современных технологий, включая ЭКО, есть свои риски. Даже после подсадки эмбрион может не прижиться. При этом среди нас уже растет множество детей, которые появились благодаря искусственному оплодотворению, и они совершенно ничем не отличаются от обычных малышей.
Что происходит с эволюцией
В глобальном плане человеческие гены могут со временем мутировать и видоизменяться. И онкологические заболевания — одна из самых ярких иллюстраций этого процесса. Теперь, когда продолжительность жизни выросла, увеличилась и вероятность появления опухолей. С другой стороны, прогресс тоже не стоит на месте: появляется все больше методов диагностики и лечения, которые помогают справляться с тяжелыми недугами.
Еще до недавнего времени выявление генетических заболеваний было непростой задачей. Однако методы секвенирования уже позволяют «читать» ДНК не по одной букве-нуклеотиду, а разбирать все буквы одновременно. Так можно выявлять и мутации, передающиеся по наследству и новые, от появления которых не застрахован никто. Конечно, некоторые окружающие факторы тоже могут влиять на то, как ведут себя наши гены. Это и экология, и пища, и привычки. Их изучением наука тоже занимается активно.
Куда движется генетика
Генетика становится всеобъемлющей: по одной капле крови теперь можно определить все, что веками записывалось в ДНК человека. Вместо сотрудников диагностикой занимаются математические алгоритмы. Вполне возможно, что через некоторое время генетическая экспертиза станет обычным делом и без нее не будет обходиться даже рядовой прием у врача-терапевта.
И наверняка будет создаваться все больше препаратов, основанных на принципах персонализированной медицины, которые подбираются в зависимости от особенностей метаболизма пациента и его мутаций. Что же касается детей на заказ, то наука должна помогать нам корректировать гены только в случаях тяжелых наследственных заболеваний, а не для того, чтобы выбирать пол ребенка и цвет его глаз или особенности поведения. В этом вопросе нужно позволить природе комбинировать наши гены для появления на свет совершенно неповторимого чудесного существа — человека.
Что такое «плохая наследсвенность», и можно ли ее исправить: разбираемся вместе с врачом
Сегодня генетика отвечает на многие вопросы, связанные с появлением тех или заболеваний и несовершенств внешности. Но можно ли скорректировать то негативное, что может быть прописано в ДНК?
355
Зачастую человек предполагает, что болезни, проблемы с внешним видом, склонность к зависимостям — это последствие «плохих» генов. Такая предопределенность пугает и возникает вопрос: возможно ли исправить плохую наследственность. Экспертным мнением на этот счет делится Константин Главатских — руководитель направления «Генетика» Лаборатории «Гемотест».
Существует ли «плохая наследственность»?
Начнем с главного: в медицине не существует такого понятия, как «плохая наследственность». Ученые постепенно расшифровывают геном человека и доказывают, что некоторые мутации генов создают риск развития патологий. Другими словами, закладывают предрасположенность.
Однако наличие генетической предрасположенности необязательно приводит к развитию заболевания. Большинство хронических болезней возникают, когда сочетаются несколько неблагоприятных факторов: генетика, образ жизни, влияние окружающей среды. В медицине такие заболевания называются многофакторными. К ним относятся, например, сахарный диабет, бронхиальная астма, шизофрения, псориаз, язва желудка. Поэтому при наличии подобных заболеваний у родственников, важно проверить генетическую предрасположенность и получить рекомендации врача, чтобы не допустить развития болезни.
Генетика и онкология
Это же относится к онкологии. Например, самая распространенное злокачественное заболевание у женщин — рак молочной железы. Для женщины, у которой мать или сестра столкнулись с этим заболеванием, риск заболеть выше 1,5-3 раза. В большинстве случаев наследственный рак молочной железы развивается, когда из поколения в поколение передаются мутации в генах BRCA1 и BRCA2.
По данным Лаборатории «Гемотест», у каждой двадцатой женщины, которая прошла ПЦР-исследование на гены BRCA1 и BRCA2, обнаружена опасная мутация генов. Это указывает на риск развития рака молочной железы как у пациентки, так и у ее детей и ближайших родственников.
Носители опасных вариантов BRCA1 и BRCA2 должны чаще и тщательнее проверять здоровье молочных желез, а также исключить факторы риска, которые связаны с образом жизни — курение, злоупотребление алкоголем, ожирение.
Генетика и красота
Что касается с проблем с внешним видом и поведением, голословно обвинить генетику — заманчивое, но на практике непродуктивное решение. Только результат лабораторного теста дает основание говорить про генетическую предрасположенность. Во всех остальных случаях это субъективная оценка человека, попытка на основе личного наблюдения объяснить негативное поведение, состояние здоровья, эмоции.
Мутации генов могут привести к раннему появлению морщин. Их формируют варианты ряда генов (COL1A1, ELN, MMP1, MMP3 и пр.), из-за которых нарушается синтез белка коллагена. В этом случае профессиональный косметолог подберет наиболее эффективное косметическое средство и процедуры, а нутрициолог составит богатый белками рацион, который поддержит синтез коллагена (читайте также: «Что сделать в молодости, чтобы отсрочить появление первых морщин»).
Генетика и гормоны
Гены COMT и ANKK1 могут иметь отклонения, из-за которых нарушается синтез гормона дофамина. На этом фоне у человека снижается стрессоустойчивость и когнитивные функции, но при этом повышается склонность к курению, алкоголизму и прочим зависимостям. Зная такую генетическую предрасположенность, человек может корректировать образ и условия жизни.
Можно ли улучшить наследственность?
Умение оценивать риски для здоровья должно быть базовым навыком современного человека. Каждый из нас является носителем сразу нескольких генетических мутаций, которые никак не проявляются, но важно знать о них и обезопасить себя. Такой ответственный подход позволяет также защитить здоровье будущих детей.
Если родители являются носителями одинаковой генетической поломки, то с вероятностью в 25% у них родится ребенок с тяжелым моногенным заболеванием. Однако еще на этапе планировании беременности можно узнать об этих генных мутациях и в случае необходимости минимизировать риски.
Полезным будет записаться на консультацию к генетику, который поможет проанализировать вашу семейную родословную и определить персональные риски развития тех или иных заболеваний в семье (читайте также: «5 важных вопросов генетику, которые вы всегда хотели задать»).
Руководитель направления «Генетика» Лаборатории «Гемотест».
Личный сайт
Биоинженерия — что это такое? Что можно сделать с генами сегодня и каковы перспективы у генетической модификации человека? Насколько этично вмешиваться в геном?
MedAboutMe предлагает поговорить на темы, вызывающие жаркие дискуссии среди ученых.
Ребёнок с подправленными генами: сверхчеловек или биоробот?
Наследственные заболевания — одна из бед человечества. Многие из них неизлечимы, а порой и смертельны. Небольшое нарушение в ДНК — и ребёнок рождается больным или нежизнеспособным.
Хорошо было бы уметь исправлять эти поломки, правда? А заодно подправлять гены так, чтобы малыш обладал большей устойчивостью к другим болезням. А если бы еще научиться программировать его внешность, интеллект, таланты, характер…
Так и до расы сверхлюдей недалеко. Прекрасная перспектива для человечества, не правда ли?
Но вот только у многих эта перспектива вызывает не радость, а неприятный холодок где-то в подсознании. Сверхчеловек, говорите? Совершенный, идеальный… а несовершенным куда деваться? Вымирать тихонько на задворках?
Но пока беспокоиться рано, ведь наука только недавно начала пытаться освоить методы генетической модификации человеческих эмбрионов. Давайте посмотрим, что уже умеют делать ученые, и взвесим плюсы и минусы генной инженерии в приложении к человеку, а не к какой-нибудь там капусте или персикам.
Наследственные болезни и устойчивость организма к инфекциям: первые шаги
В ноябре 2018 года в СМИ появилось сообщение о том, что в Китае родились первые дети с модифицированным геномом. Близняшки Нана и Лулу подверглись на стадии эмбрионов некоторому вмешательству генетиков, в результате чего приобрели врожденный иммунитет к ВИЧ. О рождении генно-модифицированных девочек заявил известный генетик Хэ Цзянкуй из Шэньчжэньского университета.
Правда, официального подтверждения появления ГМО-близняшек пока нет. Их никто не видел, так как, по словам Хэ, родители настаивают на анонимности. Клиника, в которой Хэ якобы проводил работу, также не подтвердила факта рождения детей с модифицированными генами. Не опубликовано и результатов эксперимента, чтобы научное сообщество могло ознакомиться с ним более детально. По некоторым сведениям, ведущие научные издания, в числе которых авторитетные и известные Science и Nature, отказались публиковать результаты работы китайских исследователей по этическим соображениям.
Тем не менее набор супружеских пар для проведения эксперимента действительно проводился в Шэньчженьском университете. Целью являлось получение эмбрионов, устойчивых к заражению ВИЧ. Известно, что люди, у которых в ДНК отсутствует небольшой участок, обозначаемый как CCR5, невосприимчивы к этой опасной инфекции. Ученые намеревались удалить этот участок из ДНК методами генной инженерии на ранних стадиях развития эмбрионов.
В Китае проводились и другие попытки «редактирования» генома: в университете Сунь Ят Сена генетики пытались исправить гены, отвечающие за развитие у человека наследственной болезни под названием «бета-талассемия». Для этого использовалась разработанная несколько лет назад технология CRISPR/Cas9. Чтобы не вдаваться в дебри молекулярной генетики, суть этого метода можно описать как copy-paste, «вырезать-вставить». Белок Cas9 разрезает в нужном месте ДНК, а специальная РНК (которую ученые научились синтезировать уже довольно давно) определяет и само место, и то, что нужно вставить в разрез. За основу технологии CRISPR/Cas9 была взята система борьбы с вирусами, которой обладали некоторые бактерии. Работает метод просто и считается, что довольно надежно.
Но из 86 эмбрионов удалось получить всего 4 правильно «исправленных». По крайней мере, на заданном участке. А в других местах большой молекулы? Все ли в порядке осталось там?
Именно этот вопрос и не дает покоя тем, кто пытается заглянуть в будущее чуть дальше завтрашнего дня. Ведь все потомки генетически модифицированного ребёнка получат ДНК с изменениями. И неизвестно еще, к каким последствиям это может привести через поколение-другое…
Родители детей с наследственными болезнями очень надеются, что наука сможет однажды помочь тем, в чьих генах имеются поврежденные участки, вызывающие недуг. Но не повредит ли генная модификация другим участкам ДНК?
С растениями и животными проще: из множества полученных результатов можно просто выбрать самые удачные, а остальные уничтожить. С человеческим эмбрионом так обращаться нельзя, ведь для родителей он может быть единственным и неповторимым, драгоценным, уникальным.
Именно поэтому во многих странах генетическое редактирование генома человека запрещено законом.
Этика в генетике
Генетические модификации всегда вызывали споры. Допустимо ли вмешиваться в основу основ, обладая лишь начальными, по сути, познаниями и энтузиазмом? Особенно, когда речь идет о человеке…
Многие страны приняли законы, ограничивающие или запрещающие генную модификацию человеческого генома. В США, например, государство не поддерживает подобных исследований, даже заявки на них не рассматриваются. Но в частных лабораториях ученые могут работать над этими вопросами, с привлечением частных же инвестиций. Недавно был принят закон в Великобритании, разрешающий проведение исследований в данной области, и это до сих пор вызывает споры в британском научном сообществе.
Что же беспокоит ученых, философов и правозащитников?
В первую очередь, отсутствие четкого международного законодательства, регулирующего работы с геномом человека. Многие ученые уверены, что клинические эксперименты с человеческими генами должны быть запрещены, пока не будут хорошо изучены последствия вмешательства. Другие, хотя и соглашаются с необходимостью регулирования, не верят в действенность запретов. «Те, кто захочет заниматься генным модифицированием, обойдут запреты и ограничительные законы и правила. И будет лучше, если исследования будут вестись открыто» — говорят они.
С этической точки зрения вопросов еще больше. Первым встает туманный призрак евгеники — учения сэра Гальтона об улучшении человеческой природы. За ним маячит воспоминание о расовых чистках германских нацистов и их попытках вывести людей особенной породы — истинных арийцев, «белокурых бестий».
Ведь, если станет возможным исключить генетические болезни, сделать потомство более здоровым, то, наверное, можно будет изменить и другие черты? Обеспечить детям высокий интеллект, особенные физические параметры, определенные черты характера, сделать их более «качественными». Сверхлюдьми. По сравнению с которыми все остальные станут… кем? Существами второго сорта, не способными конкурировать с представителями «улучшенной породы»?
А сохранится ли у ГМО-потомства то, что мы называем человечностью? Если личность определяет имеющийся набор генов, то его изменение не повлечет ли за собой и изменение сущности человека?
Кроме того, не будут ли нарушены права того ребёнка, который родится с измененным геномом, ведь его согласия на «редактирование» генов никто не спрашивает?
Всемирно известный ученый Стивен Хокинг, сам страдавший всю жизнь от неизлечимого заболевания, считал, что одной из вероятных причин «Конца света» может стать появление расы сверхлюдей. И многие с ним согласны.
Но другие ученые полагают вполне допустимым редактирование человеческого генома с целью устранения серьезных наследственных заболеваний и соглашаются только с тем, что недопустимы попытки усовершенствования генома для создания потомства с «улучшенными характеристиками». Правда, грань между лечением и улучшением очень зыбкая и допускает множество разночтений.
Вопросов пока гораздо больше, чем ответов. Станет ли человечество здоровее, избавившись от ряда наследственных болезней, или начнет распадаться на расы «улучшенных» людей с определенной специализацией? Покажет время.
Комментарий эксперта
Кэти Ниакан, биолог, первой получила разрешение на работу с геномом человека
Вокруг нашей работы слишком много ажиотажа. Речи пока не идет о внесении в геном каких-либо серьезных изменений. Мы находимся на этапе, когда хотим для начала понять, что нужно для развития эмбриона в нормального ребёнка с хорошим здоровьем, какие гены участвуют в этом процессе, почему происходят выкидыши, и почему некоторые пары остаются бесплодными. Необходимо хорошо изучить самые ранние стадии развития человеческого эмбриона. Это поможет, в частности, увеличить процент успешности процедуры ЭКО.
Мы будем работать с эмбрионами не более чем семидневного возраста, пожертвованными для исследований добровольцами. По истечении 7 дней после оплодотворения зародыши будут уничтожены.
Комментарий эксперта
Марси Дарновски, директор некоммерческой организации Center for Genetics and Society
Генетическая природа человека изучена еще слишком мало, чтобы можно было предвидеть последствия генных модификаций, даже если они совершаются с самыми благими целями. Подправив один участок, можно повредить другой, и неизвестно, к чему это приведет в будущем.
Родителей, мечтающих «дать детям самое лучшее», и имеющих для этого материальные возможности, всегда хватает. Такие родители с легкостью могут согласиться платить за внесение «улучшений» в гены своего потомства, а спрос всегда рождает предложение. И представьте, что станет с обществом, и без того неоднородным, если в нем начнут массово появляться «дизайнерские дети». Мы просто откроем двери к еще одной разновидности дискриминации по признаку «правильной» и «неправильной» генетики.
Комментарий эксперта
Альта Чаро, профессор права и биоэтики
Пока нам неизвестно, могут ли преимущества редактирования генома превысить сопутствующие риски. В любом случае, попытки «улучшить» гены будут доступны немногим, а это несправедливо. Совершенно правильно, что сегодня в США законодательно запрещены попытки дать жизнь эмбрионам с исправленной генетикой.
Акушерство / Под ред. Савельевой Г.М. – 2000
Пропедевтика внутренних болезней / Мухин Н.А., Моисеев В.С. – 2008