Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
You have by this time most likely seen a few chemical formulas and some kind of representation of the associated molecular structures. For example, the simple molecule carbon dioxide, or CO2, can be represented as a carbon atom joined to two oxygen atoms by junctions called double bonds: O=C=O.
Carbon dioxide, like a lot of compounds in nature, comes in only one form or shape. That is, given a molecular formula like C3H3O3, you would be able to associate it with a unique three-dimensional structure, that of the important metabolic compound pyruvate.
Some formulas, though, give rise to more than one spatial arrangement. Compounds with the same molecular formula but different shapes are called isomers, and because these are so plentiful in the world of hydrocarbons, learning to predict how many isomers a kind of molecule called an alkane can have is a great place to learn about these tricky compounds.
What Are Isomers?
Isomers come in two basic types. Stereoisomers are isomers that differ in their spatial arrangements but have their bonds in the same places.
If this sounds like a contradiction, imagine molecules that are mirror images; these can’t be superimposed directly on each other, so they’re different, yet the bonds between their respective atoms are in corresponding places. An example is the two forms of the amino acid alanine. These are called D-alanine and L-alanine, loosely meaning “right” and “left.”
Structural isomers are isomers in which the bonding sequence of the atoms is different. Unlike the case with stereoisomers, this can result in completely different compounds (as with butane and 2-methylpropane, both of which have the formula C4H10) or in closely related species (such as very large alkanes with small branches).
Branch isomers are a kind of structural isomer found in organic molecules (i.e., those that contain carbon). Carbon can bind to other carbon atoms in addition to bonding to hydrogen atoms, so once a carbon “chain” bordered by a hydrogen atom chain grows long enough for the atoms to move more freely in space, secondary carbon chains may appear at one or more points from one end. As you might expect, this significantly affects the chemical behavior of these molecules.
What Are Alkanes?
Alkanes are compounds containing only carbon and hydrogen atoms joined in single bonds. Since each carbon atom can form four bonds, the door is open to a wealth of isomers within this class of organic compounds, found in abundance in fossil fuels.
The simplest alkane is methane (CH4), followed by ethane (C2H6) and propane (C3H8). In fact, the formula for all alkanes is CnH2n + 2.
You have already seen that butane (C4H10) has an isomer, 2-methylpentane. These are the only two isomers of this molecule. C5H10, on the other hand, has three isomers, while C6H14 has nine. There is no “number of chain isomers formula” for alkanes, and the number quickly grows cumbersome (for example, decane, or C10H22, has a whopping 75 isomers). Instead, you should be able to construct a few of them given a particular alkane formula.
Isomer Combination Formula Calculator
For an example of a program that acts as a combination generator for isomers so that you can see their respective physical structure in space, see the Resources.
Note that if you try to input a formula for which there is no isomer, the program quickly returns a null result. You may want to experiment with drawing some of these prospective compounds to see why they are impossible to generate, given basic chemical bonding principles.
Гомологи и изомеры. Что это такое и как их строить?
Знаток
(305),
закрыт
11 лет назад
rafael ahmetov
Высший разум
(122431)
11 лет назад
Изомеры – это вещества имеющие одинаковый атомный состав, но порядок соединения атомов между собой различается.
Гомологи – это в принципе бесконечный ряд веществ, относящихся к одному и тому же классу, отличающихся друг от друга на некоторое количество атомов углерода и удвоенное количество атомов водорода (в простейшем случае группы -СН2-). Формулы гомологов получаются так, в формуле исходного вещества разрываешь одну ординарную (простую, или сигма) связь и вставляешь туда группу (-СН2-).
Например, был этиловый спирт (этанол) СН3-СН2-ОН. В формуле этого вещества (1- три связи С-Н в метильной группе) , (2 – две связи С-Н в метиленовой группе) , (3 – одна О-Н связь в гидроксильной группе) , (4 – одна С-С- связь) , (5 – одна С-О) связь. Разрывая любую из них, и вставляя группу (-СН2-) получаем:
1) СН3-СН2-СН2-ОН – пропиловый спирт (пропанол) , тоже относится к классу спиртов, является гомологом этанола.
2) СН3-СН (СН3)-ОН – тоже получился спирт, но строение его отличается от спирта, полученного в случае 1. Это соединение называется изопропиловый спирт (изопропанол, т. е изомер пропанола, или 1-метилэтанол) . Изопропанол является гомологом по отношению к этанолу. Пропанол и изопропанол являются изомерами по отношению друг к другу.
3) СН3-СН2-О-СН3. Получилось вещество того же состава, что и в предыдущих двух случаях, но оно не относится к классу спиртов, а относится к классу простых эфиров. Называется этилметиловый эфир или метилэтиловый эфир. Это вещество является межклассовым изомером по отношению к пропанолу и изопропанолу, но гомологом этанола не является.
4) СН3-СН2-СН2-ОН, опять получился пропанол.
5) СН3-СН2-СН2-ОН, опять пропанол.
Таким образом, у этанола два следующих (высших гомолога) – пропанол и изопропанол.
Далее, аналогично из пропанола можно получить три бутанола (нормальный или первичный бутанол СН3-СН2-СН2-СН2-ОН, вторичный бутанол или бутанол-2 СН3-СН2-СН (ОН) -СН3, изобутанол или 2-метилпропанол СН3-СН (СН3)-СН2-ОН) . Из изопропанола можно получить также три бутанола (вторичный бутанол, изобутанол и третичный бутанол СН3-С (СН3)2-ОН) . Все 4 бутанола являются изомерами по отношению друг к другу, кроме того, все 4 бутанола, оба пропанола и этанол являются гомологами по отношению друг к другу. Гомолог, можно получить не только добавляя группу (-СН2), но и исключая из молекулы группу (-СН2). Так из этанола можно получить СН3-ОН – метанол, он тоже является гомологом по отношению к этанолу. Если продолжим так и дальше, то исключив из молекулы метанола группу (-СН2) получим Н-О-Н, т. е. молекулу воды. Вода не относится к классу спиртов, и не считается гомологом метанола.
Таким образом, метанол, этанол, два пропанола, четыре бутанола образуют гомологический ряд. Этот ряд можно бесконечно (по крайней мере формально) продолжить – пентанолы, гексанолы и т. д. до бесконечности. При желании можешь потренироваться, и получить все пентанолы (их 8 различных изомеров).
Like Oops
Мыслитель
(7948)
11 лет назад
Гомологи – это вещества с разным количеством атомов водорода и углерода. Они отличаются на группу (количество групп) СН2 на главной, прямой, основной линии.
Изомеры – это вещества с ОДИНАКОВЫМ количеством атомов водорода и углерода, но отличающиеся по строению (что и видно в структурных формулах) .
И.А. Голованов
Оракул
(75274)
11 лет назад
Грубо
У гомологов могут нарастать хоть до бесконечности неактивные навески в каком то из хвостов
изомеры – атомный состав одинаков, а соединение между атомами разное.
(обычно в углеводородах, но может быть в любых)
Изомери́я (от др.-греч. ἴσος — равный + μέρος — доля, часть) — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Исторические сведения[править | править код]
В итоге дискуссии Ю. Либиха и Ф. Вёлера в 1823 году было установлено, что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO (англ.) (рус.) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть, в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия[править | править код]
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеродной цепи (углеродного скелета)[править | править код]
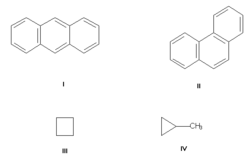
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия[править | править код]
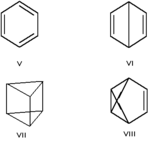
Валентная изомерия — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы (межклассовая изомерия)[править | править код]
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Изомерия положения[править | править код]
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Метамерия[править | править код]
Метамерия — вид структурной изомерии, для которого характерно различное распределение углеродных атомов между несколькими углеводородными радикалами, разделёнными в молекуле гетероатомом. Метамерия известна в рядах алифатических простых эфиров, сложных эфиров, тиоспиртов и аминов. В настоящее время термин используется редко.
На данный вид изомерии ещё указывал А. М. Бутлеров, называя его «изомерия нецельных структур».
Пример: CH3CH2OCH2CH3 — диэтиловый эфир и CH3OCH2CH2CH3 — метилпропиловый эфир.
Пространственная изомерия (стереоизомерия)[править | править код]
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Для обозначения пространственных изомеров разных типов разработана стереохимическая номенклатура, собранная в разделе E номенклатурных правил ИЮПАК по химии[источник не указан 4501 день].
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерия (оптическая изомерия)[править | править код]
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идёт об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
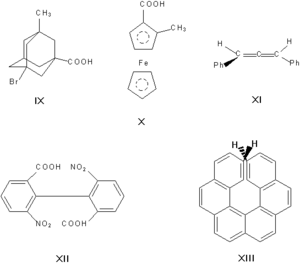
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Диастереомерия[править | править код]
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия[править | править код]
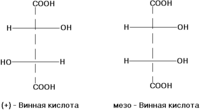
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)[править | править код]
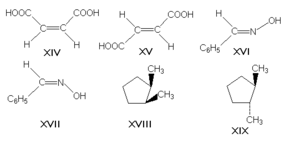
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Изомеризация[править | править код]
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (−)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров это обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы[какие?].
См. также[править | править код]
- Таутомерия
- Хиральность
- Асимметрический атом
- Модели орбиталей
- Разделение энантиомеров
Литература[править | править код]
- Физер Л., Физер М. Органическая химия. Углубленный курс. т. 1. пер. с англ., Под ред. д. х. н. Н. С. Вульфсона. Изд. «Химия». М., 1969.
- Пальм В. А. Введение в теоретическую органическую химию, М., 1974;
- Соколов В. И. Введение в теоретическую стереохимию, М., 1979;
- Сланина 3. Теоретические аспекты явления изомерии в химии, пер. с чешского, М., 1984;
- Потапов В. М. Стереохимия М., 1988.
- Большой энциклопедический словарь. Химия. Изд.: Большая Российская энциклопедия, 2003, ISBN 5-85270-253-6
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.