: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Что на роду написано, того не миновать?
Редактирование генома в терапии наследственных заболеваний
Наследственность – это своего рода фатализм нашего времени. Расшифровка последовательности ДНК сродни предсказанию судьбы человека. Нам говорят, что гены определяют все: от цвета глаз до склонности к девиантному поведению. Добавьте к этому болезни, передающиеся по наследству, и мутации, связанные с риском развития таких болезней, как рак. Но можно ли пойти наперекор зловещему року и изменить судьбу, записанную на «скрижалях» ДНК? Да, это возможно, и если не сегодня, то в недалеком будущем. Генетическая инженерия занимается этими проблемами уже несколько десятков лет, однако в последние годы вокруг редактирования геномов возник особый ажиотаж. Что же изменилось? Ответ на этот вопрос – аббревиатура CRISPR/Cas
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Но какое отношение имеет это к наследственным болезням человека? Все дело в механизме действия системы CRISPR. Бактериофаги впрыскивают в клетку бактерии свою ДНК, которая многократно копируется и упаковывается в белковую оболочку за счет «хозяина» – таким образом на свет появляются новые бактериофаги. Защитная система бактерии, включающая белок-«ножницы» Cas, распознает чужую ДНК в случае, если она уже встречалась с ней раньше, и разрезает ее. Захватчики побеждены.
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Так в руках ученых оказался простой и эффективный инструмент, позволяющий направленно вносить изменения в ДНК живой клетки, т. е. переписывать те самые «скрижали». С тех пор вышли сотни научных статей, свидетельствующих о том, что эта система работает в самых различных видах организмов, позволяет вносить разрывы в любые последовательности генов, в том числе несущие мутации, вызывающие наследственные болезни (Немудрый, 2014).
Ремонтируем ДНК направленно
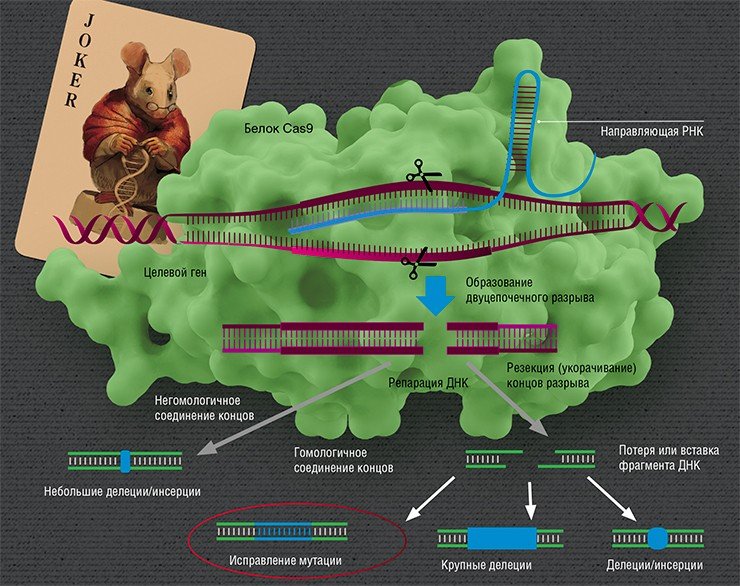
Но вот ДНК разрезана – что дальше? Дальше идет «ремонт» (репарация). Вообще разрывы в ДНК не такая уж и редкость: ежесуточно в каждой клетке человека под действием активных форм кислорода их возникает около 10 тысяч, и клетка их тщательно «штопает», восстанавливая целостность ДНК (Helbock et al., 1998). Но эти разрывы случайны, в отличие от действия CRISPR/Cas.
Существуют «терапевтические» мутации, предотвращающие развитие заболеваний. Например, мутации в гене CCR 5 предотвращают заражение клеток ВИЧ (Genovese et al., 2014, Liu et al., 1996), а мутация A673T в гене APP – развитие болезни Альцгеймера (Jonsson et al., 2012). С помощью системы CRISPR/Cas можно внести в геном необходимые изменения, «сломав» целевые гены либо внеся целевые замены (Cox et al., 2015)
Направленные разрывы, внесенные CRISPR/Cas, могут быть репарированы по-разному: существует несколько способов, отличающихся механизмом, точностью и т. п. В зависимости от пути репарации можно получить следующие результаты. Во-первых, «сломать» ген, если при репарации ДНК произойдет мутация. Такого эффекта можно добиться, если репарация произойдет, например, по механизму соединения негомологичных концов, для которого характерна неточность. Также возможно добиться крупной делеции (утраты фрагмента ДНК) и удалить участок либо целый ген.
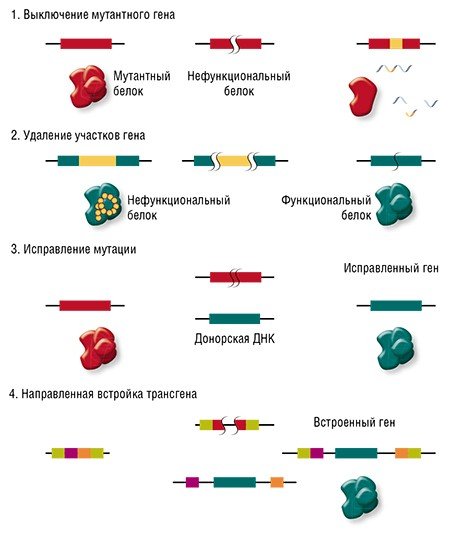
Сестринская хромосома присутствует в клетке в единичном экземпляре, а копий «донорной» ДНК можно доставить множество, что дает искусственной ДНК конкурентное преимущество, пусть она и отличается немного от поврежденного участка. Таким образом можно «исправить», к примеру, мутацию, или вставить небольшой новый фрагмент ДНК.
И вот здесь мы вплотную подходим к терапии генетических заболеваний. Начнем с того, что все такие патологии отличаются друг от друга: они вызваны мутациями в разных генах, да и сами мутации могут иметь различную природу и давать разный эффект в одном и том же гене. Соответственно, есть разные варианты применения геномного редактирования: ген можно «сломать» или просто удалить мутантный участок, «исправить» мутацию или, напротив, добавить в геном полезные «терапевтические» мутации или даже новый дополнительный трансген.
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
Работаем «в пробирке» и в организме
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
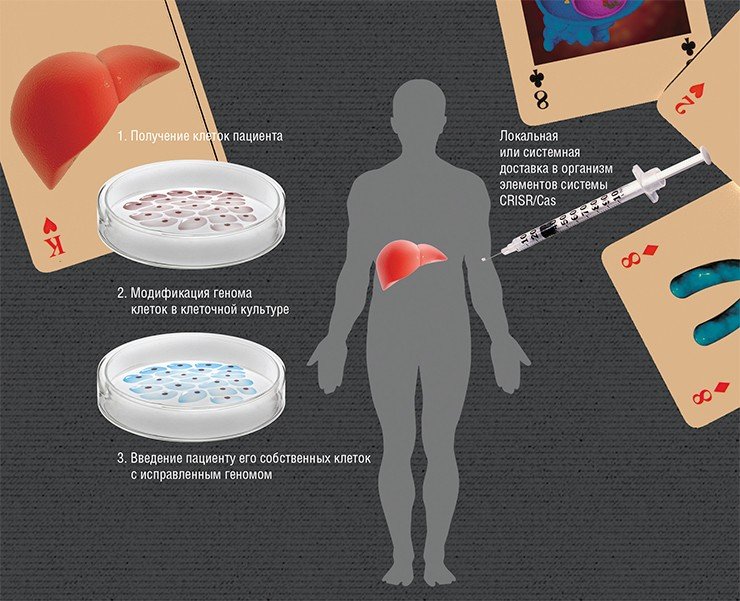
Суть редактирования геномов ex vivo («вне живого») заключается во введении в организм «здоровых» клеток, в которых, к примеру, будет синтезироваться нужный белок. Но если вводить клетки, взятые даже от здорового донора, то организм пациента с большой вероятностью их отторгнет. Поэтому нужно взять клетки самого пациента и изменить в них мутантный ген, а потом ввести их обратно. Наиболее разработан этот подход для заболеваний крови, поскольку забор и пересадка костного мозга, где идет кроветворение, практикуется с 1959 г.
Но что делать в случае, если «дефектные» клетки не так просто получить? Например, если болезнь проявляется в головном мозге? Вдобавок не все типы клеток способны пережить все процедуры в чашке Петри вне организма. Здесь на помощь приходит другая крайне перспективная технология нашего времени, связанная с получением так называемых индуцированных плюрипотентных стволовых клеток (ИПСК).
Плюрипотентные стволовые клетки бессмертны: теоретически они могут делиться бесконечно и при действии определенных стимулов образовывать любые клетки тканей и органов взрослого организма. Используя необходимый набор стимулов, можно направить развитие стволовых клеток в определенный тип клеток, например, в нейроны. Этот процесс называют направленной дифференцировкой
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Но зачем тратить время и деньги на извлечение и культивирование клеток, если можно все сделать прямо «на месте»? Ведь система CRISR/Cas в силу своей универсальности теоретически способна работать непосредственно в клетках живого организма. Главная проблема – это эффективно и безопасно доставить элементы этой системы в нужное место.
Сегодня наиболее часто для доставки генов CRISPR/Cas в организм используются вирусные частицы. В качестве таких носителей обычно выступают аденоассоциированные вирусы – дефектные вирусы, способные размножаться только в присутствии «помощников»-аденовирусов. Эти вирусы эффективно заражают клетки человека, но не вызывают у него никаких патологий. А вирусные частицы, в геном которых встроены гены CRISPR/Сas, после заражения уже не могут размножаться. При этом разные серотипы этих вирусов имеют «склонность» к разным тканям. Например, серотип AAV8 предпочитает ткани печени, а уже сегодня можно создать искусственные серотипы, нацеленные на любой орган.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Всегда есть это «но». Технология CRISPR/Cas начала применяться для редактирования геномов млекопитающих пять лет назад. На сегодня получено колоссальное количество данных, достигнут огромный прогресс на пути к клиническому применению, но все же остается ряд вопросов, которые необходимо будет решить для каждого конкретного генетического заболевания. Например, какая доставка будет оптимальна? Приживутся ли введенные клетки? Какова будет эффективность и безопасность лечения? И etc. …
Возьмем для примера пару вопросов из этого списка и посмотрим, какие конкретные ответы на них уже получены в научном сообществе. Одна из проблем использования CRISPR/Cas связана с возможностью нецелевых эффектов: система может вносить разрывы в участки, отличающиеся от целевого на несколько «букв» – нуклеотидов, что чревато риском возникновения нежданных мутаций. Особенно остро вопрос безопасности стоит при редактировании геномов in vivo, когда проверить результат предварительно невозможно.
Для решения этой проблемы лидирующие группы ученых под руководством Д. Дудны, Ф. Чжана и К. Джуна независимо друг от друга создали мутантные «улучшенные» варианты белка Cas9 с повышенной специфичностью, частота нецелевых эффектов которых упала на несколько порядков.
С помощью технологии геномного редактирования можно не только лечить наследственные заболевания, но и создавать «дизайнерских» детей. Ведь если можно исправить ген, вызывающий болезнь, то почему бы не изменить ген, регулирующий цвет глаз, продолжительность жизни, наконец, интеллект? Уже сегодня в Китае с помощью CRISPR/Cas выведены собаки породы бигль, у которых «выключен» ген, кодирующий миостатин – фактор, подавляющий рост мышечной ткани. В результате эти животные отличаются повышенной мускулистостью. А что мешает «выключить» этот ген в эмбрионе человека?
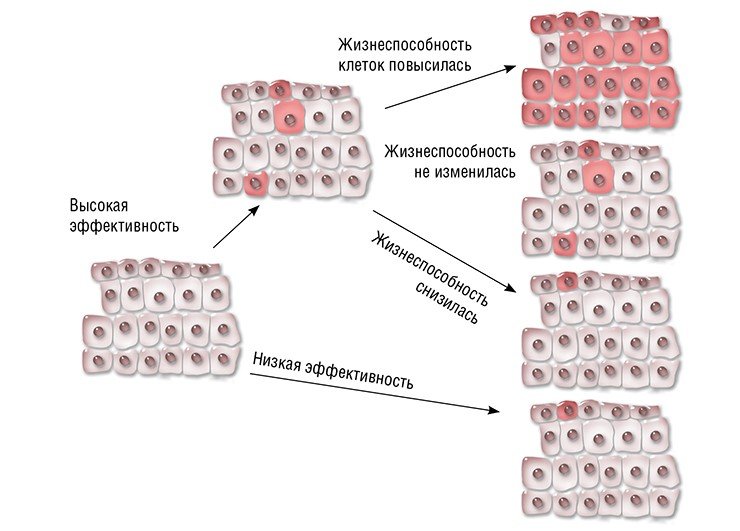
Что касается эффективности терапии, то все зависит от особенностей самого заболевания и мутации, его вызывающей. Возможны три варианта: после исправления мутации жизнеспособность клеток увеличится, не изменится или ухудшится. В первом случае исправленные клетки получают конкурентное преимущество и могут постепенно заместить мутантные. Например, на линии мышей с наследственным заболеванием печени – тирозинемией I типа – было показано, что при системной доставке CRISPR/Cas непосредственно в организм животного мутация «исправляется» в 6 % клеток печени. Даже такого небольшого количества клеток достаточно, чтобы предотвратить падение веса и привести в норму биохимические показатели печени животных. А более жизнеспособные клетки с исправленной мутацией начинают «обживать» печень.
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Классическими же модельными заболеваниями в исследованиях по терапии с помощью геномного редактирования являются гемоглобинопатии и мышечная дистрофия Дюшенна. Именно на этих заболеваниях была подтверждена работоспособность концепций такого лечения, показано, что клетки с исправленной мутацией демонстрируют «здоровый» фенотип. В случае мышечной дистрофии Дюшенна такие клетки не только успешно встраивались в мышечную ткань взрослых мышей, но и улучшали функциональные показатели всей мышцы в целом.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
Можно ожидать, что уже в ближайшее десятилетие новая технология найдет и клиническое применение. Так, в 2016 г. в Китае стартовали первые клинические испытания нового метода иммунотерапии метастазирующего немелкоклеточного рака легкого, в котором используются T-лимфоциты с «отредактированным» геномом.
С. М. ЗАКИЯН: «НАМ БЫЛ БРОШЕН ВЫЗОВ, И МЫ ДОЛЖНЫ НА НЕГО ОТВЕТИТЬ!» Исследования по применению системы CRISPR/Cas для терапии наследственных заболеваний начались в лаборатории эпигенетики развития ИЦиГ СО РАН под руководством С. М. Закияна в 2013 г., буквально сразу после выхода первых публикаций на эту тему.
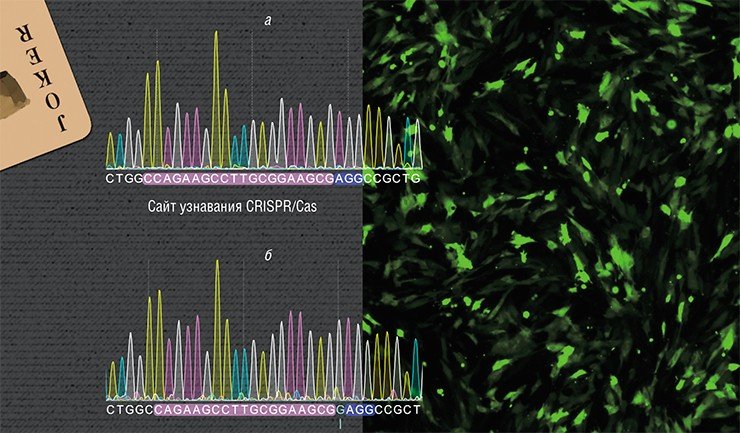
Исследования ведутся на лабораторных крысах линии Brattleboro – модели генетически детерминированного заболевания, при котором наблюдается дефицит гормона аргинин-вазопрессина. В результате у животных развивается наследственный несахарный диабет с характерным для него чрезмерным потреблением жидкости. На сегодня уже получена линия клеток с исправленной мутацией в гене, кодирующем этот гормон.
В данном случае задача усложнялась тем, что ген вазопрессина по последовательности нуклеотидов схож с геном другого гормона – окситоцина. Более того, на участке, в котором возникла мутация у крыс Brattleboro, эти гены практически идентичны. Тем не менее удалось добиться специфичного действия CRISPR/Cas в гене вазопрессина без нецелевых двунитевых разрывов ДНК в гене окситоцина. На следующем этапе предполагается вводить исправленные клетки в организм животных для оценки терапевтического эффекта
Возможности, которые дает нам технология CRISPR/Cas, пугающие и захватывающие одновременно. Сначала китайские исследователи, а затем их коллеги из США смогли внести изменения в эмбрионы человека. Недавно группа американских ученых под руководством Ш. Миталипова «исправила» в человеческом эмбрионе мутацию, вызывающую гипертрофическую кардиомиопатию (Ma et al., 2017). Эти эмбрионы были получены специально в результате искусственного оплодотворения, для которого были использованы здоровая яйцеклетка и сперматозоиды носителя мутации. Согласно современным нормам, зародыши были выведены из эксперимента на стадии бластоцисты. Однако с помощью современных репродуктивных технологий уже сегодня можно было бы имплантировать такие эмбрионы суррогатным матерям.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Литература
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Успешное применение CRISPR/Cas9 системы для редактирования генома эмбриона
Генетические анализы в настоящее время направлены на предупреждение наследственного заболевания или своевременное вмешательство для снижения или предотвращения негативного эффекта заболевания. Это связано с тем, что развитие инструментов для фактического исправления мутации в гене, вызывающем наследственное заболевание, отстает от методов диагностики.
В чем же сложность исправления мутации в гене? У человека примерно 30 000 генов, взрослый человек состоит в среднем из 4 триллионов клеток, некоторые из них ежедневно обновляются. Для полного «исцеления» нужно исправить мутацию в каждой клетке организма и при этом не «испортить» другие гены. Тут и начинаются сложности.
Первая задача – это сам механизм исправления гена. Для исправления генетической «ошибки», приводящей к заболеванию, нужны весьма специфические инструменты – молекулярные «ножницы», которые разрежут ДНК в строго указанном месте, и «пинцет», который вместо вырезанного фрагмента с ошибкой вставит правильный кусок ДНК. Вся система клетки направлена на сохранение генетической информации в неизменном виде. ДНК, которая является материальным носителем этой информации, сама по себе в клетке не работает – это инструкция по построению разных функциональных молекул и их применению. Это значит, что любая попытка внести изменения в ДНК воспринимается клеткой как нападение, от которого она может защищаться разными способами. Некоторые вирусы научились встраиваться в ДНК человека в обход этой защиты. Их инструменты можно использовать для привнесения в ДНК клетки здорового гена целиком, с которого будет синтезироваться правильно работающий белок. Однако вирусы не заботятся о том, чтобы не испортить другие гены в чужом геноме при встройке, поэтому такой метод исправления мутаций может быть опасен нарушением других, здоровых генов.
Также есть специальные системы внутри клетки, которые помогают разным белкам, работающим с ДНК, находить нужные гены, следят за цельностью длинных молекул ДНК и т.д. Эти белки умеют распознавать определенную последовательность нуклеотидов, то есть их можно настроить так, чтобы они работали с высокой точностью только с тем участком, который нужно исправить. Однако проблема таких молекулярных ножниц заключается в том, что они очень большие и доставить их в клетки организма человека очень сложно.
Самая остроумная и многообещающая идея направляемых «молекулярных ножниц» основана на использовании свойств защитной системы бактерий. Еще в 1987 году в ДНК бактерий нашли необычные последовательности, которые позже назовут CRISPR-кассетами. Однако на тот момент разобрать их структуру и понять функцию не удалось. До 2006 года эти последовательности активно использовали для классификации бактерий, так как они значительно различаются не только между видами, но даже между штаммами – они были своеобразными генетическими карточками каждого бактериального штамма. Но в 2006 году, объединив данные о структуре CRISPR-кассет и ассоциированных с ними белков cas, исследователи поняли функцию всей этой системы, а также механизм ее работы. CRISPR/Cas система бактерий – это защитный механизм, предохраняющий одноклеточный организм от проникновения чужой ДНК. В ДНК CRISPR-кассеты хранится информация о вирусах, которые раньше попадались этой бактерии или ее предкам, в виде небольших фрагментов ДНК этих вирусов. С помощью этих фрагментов клетка вырабатывает сигнальные РНК, распознающие проникшую вирусную ДНК и направляющие к ней cas-белки, которые разрежут ее на небольшие безопасные для клетки куски. Получается, что эта система позволяет разрезать ДНК, но только в определенном месте в соответствии с тем, где укажут небольшие молекулы РНК. При использовании этого механизма для исправления мутации в клетку человека нужно доставить лишь небольшой (по сравнению с описанными выше собственными белками клетки) белок cas9 и «руководящую» РНК, которая укажет место мутации.
Второй задачей «починки» гена является доставка инструментов до всех клеток, чтобы исправить ошибку в каждой клетке организма. К этой задаче подходят с двух сторон. С одной стороны, в каждом типе клеток каждого органа работают разные гены. Это значит, что исправлять ген нужно не во всех клетках организма, а только в тех, в которых этот ген необходим для полноценного выполнения функций ткани или органа. Такой подход значительно ограничивает количество клеток, в которые нужно доставить инструментарий и позволяет подобрать наиболее эффективный способ в зависимости от особенностей этих клеток, тканей, органов. С другой стороны, наш организм изначально развивается из одной клетки и на ранних этапах развития эмбрион состоит всего из нескольких клеток. И если внести изменение на таком этапе, то с высокой эффективностью можно получить эмбрион с исправленной мутацией во всех клетках, а значит из него вырастет здоровый человек.
Несмотря на кажущуюся простоту идеи использовать систему CRISPR/Cas9 для исправления мутации на стадии зиготы (оплодотворенной яйцеклетки, из которой развивается эмбрион), такая процедура была успешно проведена только недавно. Исследователи из Китая представили результаты работы, в которой описали применение CRISPR/Cas9 для исправления точечной мутации в гене HBB, вызывающей β-талассемию, и мутации в гене G6PD, связанной с развитием дефицита глюкозо-6-фосфатдегидрогеназы, на самой ранней стадии развития эмбриона – в зиготе.
Процедура по исправлению мутации на стадии зиготы проводилась при искусственном оплодотворении. В более ранних исследованиях оценивали эффективность редактирования генома с помощью системы CRISPR/Cas9 на нежизнеспособных зиготах с тремя пронуклеусами (результат некорректоного оплодотворения). Он оказался не слишком впечатляющим – исправление мутации наблюдали только 20% случаев.
В последней же работе провели процедуру редактирования генома на нормальных зиготах. При этом оказалось, что для мутации в гене HBB в 50% и для гена G6PD в 100% случаев мутация была исправлена. Это говорит о том, что система работает на потенциально жизнеспособных зиготах и может быть эффективна.
Важно понимать, что у этой работы есть как технические ограничения: малое количество образцов, отсутствие проверки на способность имплантироваться и нормально развиваться во время беременности, так и этические. В настоящее время эту систему планируют использовать для исследования влияния разных генов и мутаций в них на ранние стадии развития эмбриона, выявления функции разных генов в процессе имплантации эмбриона, что, возможно, позволит повысить эффективность процедур ЭКО.
Авторы: Вероника Юрьева, стажер
Светлана Жикривецкая, биолог-исследователь
Научные статьи-источники:
Bianconi E et al. An estimation of the number of cells in the human body. Ann Hum Biol, 2013
Tang L et al. CRISPR/Cas9-mediated gene editing in human zygotes using Cas9 protein. Mol Genet Genomics, 2017
Введение
Актуальность данной работы обусловлена стремительным развитием молекулярной генетики и созданных ею генетических технологий. Расширились возможности генной терапии заболеваний, появились методы редактирования геномов, в том числе генома человека [1, 2]. Современные геномные технологии позволили лечить заболевания, считавшиеся ранее неизлечимыми, способствовали развитию персонализированного подхода к диагностике заболевания и лечению пациента с учетом индивидуальных характеристик его генома [3].
Методы генной инженерии
Генная инженерия позволила создавать определенные геномные конструкции бактерий, но испытывала нехватку методов при работе с геномами высших организмов. Подходы к редактированию генома человека появились лишь в конце прошлого века. С целью обеспечения адресной доставки гена в клетки-мишени стали использовать рекомбинантные носители (векторы), чаще всего сконструированные на основе вирусов, подвергшихся специальной модификации с целью повышения их безопасности для человека. Чаще всего применяются рекомбинантные аденовирусы, ретровирусы, аденоассоциированные вирусы, лентивирусы и ряд других [4–7].
Путем введения модификаций в геном ретровируса, т. е. вставки измененных человеческих генов, можно добиться внедрения в геном хозяина таких элементов. Однако отсутствие специфичности встраивания являлось существенным недостатком. Поэтому находкой стал разработанный в 2012–2013 гг. метод редактирования генома CRISPR/Cas, в основе которого лежит способ защиты бактерий от вирусов-бактериофагов, выражающийся в избирательном расщеплении его ДНК, своеобразный «иммунитет» бактерий [8, 9]. В 2020 г. Д. Дудна и Э. Шарпантье за разработку данного метода в применении к клеткам человека удостоены Нобелевской премии по химии. Сначала на бактерии Streptococcus pyogenes они установили, как работает белок Cas9, а позднее показали, что с помощью этого механизма можно разрезать в адресной точке любую молекулу ДНК, в том числе и ДНК человека [8].
Создание системы CRISPR/Cas немедленно явилось мощным стимулом ее использования в России. Внедрение новой технологии произвело революцию в области генетической терапии, поскольку она позволяет намного более точно редактировать ген, чем ранее описанные инструменты, проверить ее на животных моделях и вплотную подступить к лечению генетических заболеваний у людей [7]. В настоящее время подробно описан механизм CRISPR/Cas9, включая его биохимические и структурные последствия, выделены последние улучшения в системе CRISPR/Cas9, особенно модификации белка Cas9 для настройки, рассмотрены современные приложения, в которых использовалась универсальная система CRISPR/Cas9 для редактирования генома, эпигенома или РНК различных организмов [3, 9]. С помощью CRISPR/Cas можно вносить точечные мутации, встраивать в определенные места новые гены или, наоборот, удалять участки нуклеотидных последовательностей, исправлять или заменять фрагменты генов. В современных обзорах представлено изучение технических аспектов, областей применения и перспектив этой технологии в различных областях [3, 7, 9].
Другие способы модификаций генома связаны с технологиями ZFN и TALEN [1], основанными на природных свойствах определенных белков, называемых нуклеазами. Эти ферменты умеют проводить специфическое вырезание участка исходного генома и встраивание в место разреза привнесенного с собой фрагмента исправленной ДНК. Такой способ позволяет проводить целевую модификацию нарушенных генов, гораздо более точную, чем просто ретровирусная. Отличие ZFN и TALEN заключается в использовании разных видов ферментов, но итог их работы примерно одинаков. ZFN и TALEN не нашли массового применения в медицине, прежде всего из-за трудоемкости метода. Для редактирования же генома с помощью системы CRISPR/Cas9 используется единственный белок Cas9, вносящий разрыв в ДНК, а РНК-гид, узнающую мишень на простом принципе комплементарного узнавания нуклеиновых кислот, можно создать за короткое время. Это новый уровень редактирования, более дешевый и точный. В первую очередь с помощью CRISPR/Cas9 можно лечить моногенные генетические заболевания: гемофилию, муковисцидоз, лейкемию. В этих случаях понятно, какие именно гены нужно отредактировать, но существуют заболевания с высокой наследуемостью, генетическая природа которых очень сложна. Такие многофакторные болезни — сложный результат взаимодействия разных генов и их вариантов, для лечения потребуются комплексные подходы [10].
Разделяют два способа воздействия генных конструкций на клетки-мишени — in vivo и ex vivo [11]. В первом случае — непосредственно на тканях живого организма с использованием адресной доставки нуклеиновых кислот и преодолением сложных проблем, связанных с быстрой деградацией чужеродного биологического материала. Во втором случае воздействие основано на генотерапевтической модификации вне организма стволовых клеток, клеток крови, костного мозга и др. с последующим их возвратом в системный кровоток или пораженный орган. Используя систему CRISPR/Cas9, можно было бы получить образец костного мозга пациента и вылечить его собственные кроветворные стволовые клетки и затем ввести их в организм, предварительно устранив с помощью облучения собственные пораженные кроветворные клетки. Они начнут делиться и производить здоровые кровяные клетки. Если же речь идет о редактировании, например, генов клеток опухоли печени, все гораздо сложнее. Нужно будет решить проблему доставки компонентов CRISPR/Cas9-системы именно к пораженным клеткам. Хотя многие исследования показали, что технология CRISPR/Cas9 является более эффективной, специфичной и управляемой, чем предыдущие поколения инструментов редактирования генов, ее можно еще улучшить, повысив ее общую эффективность при более высокой частоте модификаций генома и уменьшив ее нецелевые эффекты. Уже рассматривается развитие технологии CRISPR/Cas9 с особым вниманием к повышению специфичности его последовательности, уменьшению нецелевых эффектов и систем доставки [12]. В данном обзоре представлены примеры недавнего успешного применения технологии CRISPR/Cas9 в лабораторных и клинических исследованиях.
Открытие возможности перепрограммирования зрелых клеток человека и разработка инженерных эндонуклеаз для улучшения редактирования генома являются двумя наиболее впечатляющими и эффективными технологическими достижениями в современной медицине и науке [13]. У индуцированных плюрипотентных стволовых клетках человека (ИПСК) есть потенциал для создания новых модельных систем для изучения биологии развития человека, механизмов заболеваний и тестирования лекарственных препаратов. Коррекция генов в специфических для пациента ИПСК может стать новым источником для заместительной клеточной терапии [14]. Инструменты редактирования генома уже произвели революцию в биомедицинских исследованиях, в настоящее время ожидается их применение в клинике. Тем не менее широкое использование данных методов в исследованиях выявило большую непредсказуемость эффектов, необходимость обширной проверки моделей, молекулярного обоснования соотношения риска и пользы. Проблемы эти широко обсуждаются [15].
Другие наиболее часто применяемые методы генной терапии — использование антисмысловых нуклеотидов как в эксперименте, так и в клинике, метод генного «глушения», или генный сайленсинг, метод выключения генов, основанный на РНК-интерференции, использование для модуляции экспрессии генов микроРНК [16, 17]. Развивается применение оптогенетической геномной инженерии для создания животных моделей, в частности для получения генетически модифицированных мышей для биомедицинских исследований [18]. Высокоэффективная технология обеспечивает эффективную рекомбинацию ДНК, которая активируется при освещении синим светом с пространственно-временной точностью. Создана фотоактивируемая модель мыши с нокаутированной рекомбиназой Cre-loxP (мыши TRE-PA-Cre) с использованием системы CRISPR/Cas9. Модель обещает быть полезной для оптогенетической инженерии генома неинвазивным и специфичным для типа клеток методом in vivo. Особое место среди методов генной терапии занимает ДНК-вакцинация, по сравнению с традиционными вакцинами она дает возможность индукции как гуморального, так и клеточного иммунного ответа, отличается низкой эффективной дозой, а также отсутствием вирулентности, простотой и быстротой получения высоких доз вакцины, высокой устойчивостью и удобством хранения [2].
Применение технологий в клинической практике
Нейромышечные заболевания
Удалось показать, что внутривенная генная терапия с помощью вектора AAV9 может остановить спинальную мышечную атрофию 1 типа (SMA1) — прогрессирующее моногенное заболевание двигательных нейронов, которое возникает в младенчестве, что приводит к неспособности к движению и смерти или необходимости искусственной вентиляции легких в возрасте до 2 лет. Ученым удалось осуществить функциональную замену мутантного гена фактора выживаемости мотонейронов-1 (SMN1). В ноябре 2017 г. межнациональная группа специалистов и компания AveXis сообщили о том, что однократное внутривенное введение аденоассоциированного вирусного вектора, содержащего ДНК, кодирующую SMN, пациентам с SMA1 обусловило более длительное выживание и лучшую моторную функцию, чем в контрольных когортах [19].
Крупным прорывом в области генной терапии стало сообщение о том, что ученые-клиницисты сохранили жизнь девочке, родившейся с фатальным наследственным нейромышечным заболеванием SMA1, путем введения отсутствующего гена в ее спинальные нейроны. В 8 нед. она прошла курс генной терапии, который дал ее организму критически недостающий белок. Результаты испытания, в котором участвовала маленькая пациентка, явились одним из самых впечатляющих успехов в некогда проблемной области, поскольку исследователи впервые провели новый ген через гематоэнцефалический барьер [20]. Успешный клинический исход эксперимента позволил надеяться на применение генной терапии в лечении других нейрозаболеваний путем доставки генов в таргетные клетки с помощью векторов на основе аденоассоциированного вируса.
Мышечная дистрофия Дюшенна является одним из наиболее распространенных наследственных генетических заболеваний и вызвана мутациями в гене DMD, который кодирует белок дистрофин. Недавние успехи в редактировании генома и генной терапии дают надежду на развитие потенциальной терапии. Укороченные версии гена DMD могут доставляться в пораженные ткани с вирусными векторами и уже продемонстрировали многообещающие результаты на различных моделях животных. Редактирование генома с помощью системы CRISPR/Cas9 было использовано для восстановления экспрессии дистрофина путем делеций одного или нескольких экзонов гена DMD в клетках пациента и на мышиной модели. Более подробно применяемые технологии и их развитие рассмотрены в обзорах, где представлены последние достижения и перспективы по трем основным подгруппам терапии дистрофии Дюшенна, включая генную терапию, клеточную терапию и фармакологическую терапию [21–23].
Онкологические заболевания
Опухоли остаются проблемой для здоровья во всем мире, и генная терапия является серьезным подходом к их лечению. В онкологии легкость и универсальность CRISPR/Cas9 позволили идентифицировать новые гены-мишени и раскрыть некоторые механизмы устойчивости к терапии [24]. До сих пор большинство исследований проводилось на опухолях у взрослых. В последние годы технология CRISPR/Cas9 применяется в лечении редких детских злокачественных новообразований, сарком мягких тканей, в отношении которых этот подход представляется многообещающим [25]. Достигнуты успехи генной терапии в лечении отдельных видов рака [26–28], появились новые подходы к поиску критически важных генов в раковом геноме [29]. Саркомы относятся к наиболее агрессивным опухолям и обычно плохо реагируют на химиотерапию. В последние годы было показано, что специфическое слияние / мутации генов или избыточная экспрессия/активация генов участвуют в патогенезе развития саркомы. РНК-направляемая нуклеаза CRISPR/Cas9 является удобной и универсальной платформой для сайт-специфического редактирования генома и эпигеном-направленной модуляции. В настоящее время обсуждаются механизмы применения редактирования генома в случае саркомы, будущие направления исследований и проблемы, с которыми сталкиваются при реализации этих подходов [30]. Подход ex vivo к редактированию очень эффективен для многих болезненных состояний, включая рак и серповидноклеточную анемию, но в идеале редактирование генома также следует применять к заболеваниям, которые требуют модификации клеток in vivo. Однако использование технологий CRISPR in vivo может быть затруднено такими проблемами, как нецелевое редактирование, неэффективная или нецелевая доставка и стимуляция контрпродуктивных иммунных реакций. Исследования, направленные на решение этих проблем, могут заложить научную основу клинических испытаний с участием ZFN, TALEN и редактирования генома на основе CRISPR с учетом известных ограничений использования CRISPR у людей [31].
Иммунологические расстройства
Хроническая гранулематозная болезнь (ХГБ) является редким наследственным заболеванием фагоцитарных клеток. Имеются сообщения о первоначальных результатах, полученных у 9 пациентов с тяжелой формой ХГБ, которые получали ex vivo аутологичную генную терапию на основе CD34 и гемопоэтических стволовых клеток. Выжившие пациенты не имели новых инфекций, связанных с ХГБ, и 6 человек смогли прекратить антибиотикопрофилактику. Первичная цель была достигнута у 6 из 9 пациентов через 12 мес. наблюдения, что позволило считать ауто-
логичную генную терапию перспективным подходом для пациентов с ХГБ [32].
Атаксия-телеангиэктазия (AT) и синдром Айкарди — Гутьерес (САГ) являются наследственными нарушениями иммунитета с преобладающим неврологическим фенотипом. Доступные методы лечения лишь частично эффективны, прогноз при их применении неблагоприятный. ИПСК получают путем перепрограммирования соматических клеток пациента, сохраняя индивидуальное генетическое наследие донора и создавая модели заболевания конкретного пациента, полезные для исследования патогенеза, эффектов лекарств и разработки методов лечения. Исследовали цитотоксичность панели иммуномодуляторов с использованием ИПСК пациентов с AT или различными формами САГ [34]. Цитотоксические эффекты двух препаратов, предложенных для лечения соответственно AT и САГ (дексаметазон и мепакрин), были оценены после 72-часового воздействия. Данные были получены также для других иммуномодулирующих препаратов (тиогуанин, меркаптопурин, талидомид и леналидомид). Была проанализирована относительная экспрессия генов, участвующих в тестируемых лекарственных путях, и предложена инновационная модель in vitro, полезная для исследования механизмов лекарственных средств, потенциально эффективных при вышеуказанных заболеваниях [34].
Заболевания органов зрения и слуха
В последнее время генная терапия рассматривается как потенциально эффективное средство лечения заболеваний дегенерации сетчатки. Система CRISPR/Cas9 и ее комбинации с плюрипотентными стволовыми клетками уже используются в качестве мощного инструмента редактирования генома в офтальмологических исследованиях с учетом ее преимуществ и проблем [35]. Очерчены клинические пути для лечения наследственных заболеваний глаз на основе CRISPR и дан обзор важных этических последствий редактирования генов [36].
Примером может служить изучение ретинопатии у недоношенных детей [37]. Длинная некодирующая РНК (lncRNA) регулирует пролиферацию и миграцию эндотелиальных клеток сетчатки человека, а также неоваскуляризацию сетчатки при диабетической ретинопатии. Основываясь на сходстве патогенезов ретинопатии у недоношенных детей и диабетической ретинопатии, сделали вывод о сходной роли lncRNA в патогенезе двух видов ретинопатии и разработали модель на животных (мыши) для изучения патогенеза у детей. Установили, что различно экспрессируемые lncRNA могут регулировать патогенез ретинопатии у мышей через микроРНК и множественные сигнальные пути, и предложили потенциальные терапевтические мишени для генной терапии.
Потеря слуха является одним из наиболее распространенных сенсорных расстройств, затрагивающих примерно 1 из 500 новорожденных без лечения. Мутации генов внутреннего уха способствуют большей части генетической глухоты. С технологией CRISPR/Cas9 функции генов внутреннего уха могут быть эффективно изучены путем нарушения нормальных аллелей гена. Что касается генетической потери слуха, то CRISPR/Cas9 может восстанавливать измененные мутациями гены с помощью гомологичной репарации. Показали, что CRISPR/Cas9-опосредованное редактирование генома может эффективно выполняться во внутреннем ухе млекопитающих in vivo. В настоящее время обсуждаются вопросы, касающиеся применения CRISPR/Cas9 в слуховых системах, связанных с генетической потерей слуха у человека [38].
Синдром Ашера является частой причиной потери слуха и зрения у людей. Были определены три клинических подтипа, на данный момент идентифицировано 10 генов USH. Охарактеризованы несколько моделей мышей Usher, которые точно воспроизводят слуховой фенотип, связанный с синдромом Ашера, и вестибулярный фенотип, связанный с некоторыми мутациями в генах USH. За последние 10 лет появились новые методы лечения синдрома Ашера, основанные на недавнем прогрессе в передаче генов и новых инструментах редактирования генов [39]. Многообещающий успех, демонстрирующий восстановление функций слуха и равновесия, достигнут с помощью различных терапевтических стратегий на моделях животных. Однако перенос метода в клинику требует его дальнейших улучшений.
Гематологические заболевания
Гемоглобинопатии — это группа наследственных заболеваний, обусловленных генетическими нарушениями, приводящими к абберантной экспрессии гемоглобина или изменениям его структуры, что приводит к тяжелым нарушениям здоровья и смерти. Серповидноклеточная анемия и β-талассемия, наиболее распространенные формы гемоглобинопатий, обычно лечатся с помощью переливаний и фармакологических препаратов. Современная терапия гемоглобинопатий основана на трансплантации аллогенных стволовых клеток от здоровых доноров, однако она может применяться только у ограниченного числа пациентов. Новым лечебным подходом является коррекция генов с помощью нуклеазы, которая включает применение инструментов точного редактирования генома для исправления вызывающей болезнь мутации. В настоящее время представлены приложения для инженерии генома с использованием CRISPR/Cas9 и рассмотрены проблемы и перспективы применения системы CRISPR/Cas9 в качестве варианта лечения серповидноклеточной анемии [40].
Гемофилия вызывается различными мутациями в генах фактора свертывания крови, включая фактор VIII (FVIII) и фактор IX (FIX), которые кодируют ключевые белки в пути свертывания крови. Выходя за рамки культивируемых клеточных систем, исследователи сейчас вступают в эпоху прямой генной коррекции in vivo с использованием различных инструментов доставки. Уже описано текущее состояние технологии редактирования генома in vivo и ex vivo, связанной с возможной коррекцией гена гемофилии, и важные вопросы, связанные с применением технологии редактирования генов гемопоэтических стволовых клеток у пациентов с гематологическими заболеваниями [41–43].
Другие наследственные заболевания
Муковисцидоз — хроническое прогрессирующее аутосомно-рецессивное заболевание, связанное с нарушением функций секреторных эпителиальных клеток и приводящее, в частности, к обструкции дыхательных путей и протоков поджелудочной железы. Установлено, что болезнь вызывается мутацией в гене CFTR, что позволило бороться с фатальным исходом заболевания. В настоящее время обсуждаются возможности использования технологий геномного редактирования применительно к лечению муковисцидоза. Установлено, что именно система CRISPR/Cas9 смогла обеспечить более простой, быстрый и доступный по цене метод редактирования, чем применение ранее открытых нуклеаз ZFN и TALLEN [44].
Успешной оказалась попытка применения генотерапии в лечении буллезного эпидермолиза, проявляющегося при повреждении гена LAMB3 образованием пузырей и эрозий кожи при любом незначительном воздействии. Ребенку с тяжелой формой заболевания успешно трансплантировали трансгенный эпидермис. Его получали, выращивая культуры клеток эпидермиса пациента и обрабатывая их ретровирусами, несущими нормальную копию LAMB3. Опыт оказался успешным, прежних симптомов не наблюдается в течение 2 лет [45]. В последние годы предприняты попытки изучения с помощью генной терапии нейродегенеративных заболеваний — болезни Паркинсона и болезни Альцгеймера [46, 47].
Заключение
Следует отметить, что хотя система CRISPR/Cas9 обеспечивает удобное редактирование генома, сопровождаемое многими преимуществами, она поднимает существенные этические проблемы. В Китае уже сделаны первые шаги в клинических испытаниях технологий редактирования генома, основанных на CRISPR/Cas9. Использовали эмбрионы человека с мутантным геном, приводящим к β-талассемии. В результате эксперимента в 5–10% эмбрионов мутация, ответственная за возникновение болезни у взрослых людей, действительно была исправлена. Однако во всех клетках редактируемых эмбрионов возникло большое количество незапланированных и, возможно, опасных мутаций. Очевидно, что технология нуждается в значительной доработке, прежде всего в улучшении специфичности белка Cas9. Несмотря на интерес к проблеме, два главных научных журнала — Nature и Science отказались публиковать результаты китайских ученых. Возникло множество этических вопросов, которые пока так и не получили единого решения в мире по поводу того, когда же можно, а когда нельзя применять редактирование генома. Пока каждая из стран решает это по-своему. Так, в Великобритании официально разрешены первые опыты по геномному редактированию эмбрионов человека. В Китае запрещено использование преимплантационной генетической диагностики для выбора пола будущего ребенка, но такая процедура не запрещена в США. Несомненно, исследования в этом направлении будут продолжаться, а правовые нормы — разрабатываться. В России генетическим технологиям уделено особое внимание в рамках национальных проектов.
редактирование генома человека
Д. В. Ребриков1Д3И
1 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
2 Научный центр акушерства, гинекологии и перинатологии имени В. И. Кулакова, Москва
3 Институт общей генетики имени Н. И. Вавилова РАН, Москва
Быстро развивающиеся технологии редактирования генома из научно-исследовательских лабораторий уверенно переходят в клиническую практику. Разработаны принципиально новые методы изменения генома человеческих эмбрионов на ранних стадиях развития. Создан инструментарий для исправления генетических нарушений у людей в любом возрасте. Врач, по сути, становится корректором генетической инструкции по построению и функционированию организма человека. В обзоре обобщены сведения о современном состоянии технологий редактирования генома и существующих подходах к их использованию в клинической практике.
Ключевые слова: редактирование генома, генотерапия, наследственные заболевания, онкология, ВИЧ
Для корреспонденции: Денис Владимирович Ребриков 117997, г. Москва, ул. Островитянова, д. 1; drebrikov@gmail.com
Статья получена: 23.06.2016 Статья принята в печать: 25.06.2016
human genome editing
Rebrikov DV123E3
1 Pirogov Russian National Research Medical University, Moscow, Russia
2 Kulakov Federal Research Center for Obstetrics, Gynecology and Perinatology, Moscow, Russia
3 Vavilov Institute of General Genetics, Russian Academy of Sciences, Moscow, Russia
The rapidly evolving genome editing techniques are steadily moving from research laboratories to clinical practice. Fundamentally new methods of editing the genome of human embryos in the early stages of development have been developed. Tools for correction of genetic disorders in people of any age have also been created. In fact, the doctor is becoming a corrector of genetic instructions on construction and functioning of the human body. This review generalizes the data on the current state of genome editing techniques and existing approaches to applying them in clinical practice.
Keywords: genome editing, gene therapy, hereditary diseases, oncology, HIV
Correspondence should be addressed: Denis Rebrikov ul. Ostrovityanova 1, Moscow, 117997; drebrikov@gmail.com
Recieved: 23.06.2016 Accepted: 25.06.2016
Изменение геномов живых организмов происходит постоянно, определяя ход их эволюции. Человек стал вмешиваться в этот процесс тысячи лет назад, отбирая успешно культивируемые растения и выводя породы домашних животных. Генная инженерия, возникшая немногим более полувека назад, позволила создавать трансгенные организмы: переносить гены между геномами или манипулировать ими внутри одного генома. Идея использования привносимой извне ДНК для лечения наследственных заболеваний человека возникла в начале 1970-х гг. [1]. В 1980-х гг. благодаря усовершенствованию методов работы с генами и созданию эукариотических векторов появилась реальная возможность коррекции генетического материала человека в терапевтических целях, однако сообщение о первом успешном результате было опубликовано лишь в 1990 г. [2]. В том же году исследователи использовали ретровирус для доставки работающего гена аде-нозиндезаминазы в клетки четырёхлетней и девятилетней пациенток с тяжелым комбинированным иммунодефицитом. А уже с 1993 г. исследователи стали на регулярной основе применять генную терапию новорожденных с дефицитом аденозиндезаминазы (путем введения гена ADA в недифференцированные клетки пуповинной крови).
Мы живем в эру геномики, и все чаще в литературе можно встретить термин «геномная терапия». Пожалуй, следует уточнить использование терминов «генная терапия» (генотерапия) и «геномная терапия». Поскольку терминологические вопросы не являются принципиальными, можно либо считать эти термины равнозначными, либо принять «геномную терапию» в качестве варианта «генной терапии», при котором изменяется именно ядерный геном (хромосомная ДНК). Дело в том, что генная терапия может и не затрагивать хромосому: доставленный ген может работать как экстрахромосомный элемент (плазмида) или быть доставлен в виде матричной РНК (мРНК), кроме того, может быть модифицирована митохондриальная ДНК.
С 1989 по 2016 г. в мире было выполнено более 2300 клинических исследований генотерапевтических препаратов [3]. К настоящему моменту существуют более или менее эффективные подходы к генной терапии свыше 50 генетически детерминированных заболеваний человека: первичных комбинированных иммунодефицитов [4], гемофилии [5, 6], гемоглобинопатий [7-13], кистозного фиброза [14, 15], ахроматопсии [16], амавроза Лебера [17-19], эпилепсии [20], остеоартрита [21, 22], болезни Паркинсона [23-25], онкологических заболеваний [26-32].
В последние несколько лет с появлением качественно новых технологий направленного изменения генома (ИРЫв, ТА_Е№, С^БРЯ/Оаэ^ число заявок на начало клинических исследований генотерапевтических препаратов растет лавинообразно. Благодаря простоте и точности новых методов внесения изменений в геномную ДНК эукариоти-ческих клеток даже возник новый термин — редактирование генома (ведь в будущем мы, возможно, будем использовать изменение ДНК не только в терапевтических целях, но и для более праздных задач).
В качестве основных направлений применения геномной терапии можно выделить следующие: лечение наследственных (как правило, моногенных) заболеваний, лечение заболеваний, вызванных соматическими мутациями (в основном онкологических), и попытки лечения ВИЧ-инфекции путем уничтожения встроившихся в геном копий вируса или генов рецепторов, позволяющих вирусу проникнуть в клетку. Геномная терапия — это один из вариантов персонализированной медицины, когда используемый подход индивидуально подбирается к заболеванию (а иногда даже и к геному) пациента.
Федеральный закон Российской Федерации от 5 июля 1996 г. № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» определяет ге-нотерапию как совокупность генно-инженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. С появлением Федерального закона от 23 июня 2016 г. № 180-ФЗ «О биомедицинских клеточных продуктах» можно прогнозировать рост клинических исследований принципиально новых генотерапевтических препаратов в России.
Технологии редактирования генома
Несмотря на существование множества методик направленного изменения сложных эукариотических геномов, в настоящее время на практике используют лишь несколько технологий:
а) не индуцированную разрывом гомологичную рекомбинацию [33];
б) сайт-специфичную рекомбинацию (рекомбиназы и транспозазы) [34, 35];
в) индуцированную сайт-специфичной нуклеазой репарацию, где в качестве нуклеазы используют:
– искусственные (гибридные, «дизайнерские») нуклеазы с доменами «цинковых пальцев» (zinc finger nucleases, ZFNs) [36-38],
– природные или гибридные эндонуклеазы генной конверсии или мегануклеазы (homing endonucleases, HEs) [39],
– искусственные (гибридные, «дизайнерские») нукле-азы с доменами аналогов активаторов транскрипции (transcription activator-like effector nucleases, TALENs) [40],
– природные РНК-направляемые нуклеазы (RNA-guided nucleases, RGNs), в частности, CRISPR-ассоциированные нуклеазы (clustered regularly interspaced short palindromic repeats/CRISPR-associated nuclease 9, CRISPR/Cas9) с «дизайнерской» наводящей РНК [41],
– сочетания перечисленных подходов [42-44].
На рис. 1 представлена шкала времени с указанием по& ледовательности разработки некоторых технологий редактирования геномов [45].
На сегодняшний день наиболее перспективными являются подходы, основанные на использовании искусственных (гибридных, или “дизайнерских”) сайт-специфичных нуклеаз: ZFNs, TALENs и CRISPR/Cas9 [46]. Хотя изначально термин «гибридные» («дизайнерские») нуклеазы применялся к полностью «белковым» технологиям ZFN и TALEN, сегодня к этому же классу можно с уверенностью отнести и технологию CRISPR/Cas9, поскольку РНК-компонент в этой системе является «дизайнерским» (аналогично наводящим блокам доменов ZF или TALE) (рис. 2) [47].
В общем случае каждый из перечисленных инструментов редактирования генома включает три компонента: специфичный к последовательности ДНК «наводчик» (указывающий, где резать), разрезающие ДНК «ножницы» (эндонуклеазу) и собственно привносимую последовательность ДНК (нужна не всегда). Доставка в клетки
1987
Первое описание CRISPR
«5=
2010
CRISPR-Cas система типа II разрезает ДНК-мишень
2005-2006
CRISPR содержат вирусные последовательности, идентифицирование cas генов, выдвижение гипотез
2011
В систему CRISPR-Cas типа II входит tracrRNA
Cas9-единственный cas ген, необходимый для поддержания защитной функции системы типа II
-снЦ
Белки
1985-1991
“цинковые пальцы”
2007
Система CRISPR-Cas-
бактериальный
иммунитет
2012
CRISPR-Cas9 является РНК-направляемой эндонуклеазой ДНК
1979
Замена гена в клетках дрожжей
1996-2003
Использование нуклеаз типа “цинковый палец” для геномной инженерии_
Редактирование ¿–р-СНЭ-6 О-
1989-1994
Репарация разрывов в геноме с помощью НОЯ и МИБи
1985-1986
Редактирование генома человека 4ью с помощьюгомологичекой репарации
2009-2010
TAL эфферторы; TALE нуклеазы
Январь 2013
Комплекс Саэ9-РНК медиирует сайт-специфичное геномное редактирование в клетках человека и других эукариот
ьзования нженерии
С 2010 года и далее
Расширение использования TALENS в геномной инженерии
Рис. 1. Шкала времени с указанием последовательности разработки некоторых из систем редактирования геномов (Jennifer, Emmanuelle, 2014 [45], в переводе Станислава Груздева, medach.pro)
«генетической заплатки» (фрагмента ДНК под замену) требуется в тех случаях, когда необходимо добавить или заменить фрагмент генома. Однако в ряде случаев достаточно просто удалить часть последовательности. В табл. 1 указаны особенности наиболее популярных систем редактирования генома.
С помощью «наводчика» мы указываем эндонуклеазе, где необходимо внести надрез в молекулу ДНК. Сшивание же надреза происходит, как правило, за счет внутриклеточных систем репарации (в частности, репарации двуце-почечных разрывов или гомологичной рекомбинации).
Поскольку методы изменения генома, основанные на гомологичной рекомбинации, рекомбиназах и транспоза-зах, активно используют в клинической практике уже более 30 лет и они широко описаны в литературе (за методы с гомологичной рекомбинацией в 2007 г. даже была вручена Нобелевская премия), в данном обзоре мы позволим себе не приводить их детали. Рассмотрим чуть подробнее сравнительно новые подходы, основанные на гибридных нуклеазах и мегануклеазах и репарации наведенных дву-цепочечных разрывов.
Наводка нуклеазы «цинковыми пальцами»(ZFNs)
Примерно в середине 1980-х гг. (впервые в составе транскрипционного фактора ТР!!!Д Xenopus laevis) были идентифицированы небольшие домены, стабилизированные одним или несколькими ионами цинка и получившие название «цинковые пальцы». Эти домены способны эффективно и довольно специфично к последовательности связывать ДНК, РНК, белки и липиды [48]. Оказалось, что один «цинковый палец» специфично связывает триплет нуклеотидов. Если 3-6 «цинковых пальцев» с известной специфичностью соединить в один белок, можно добиться достаточно точного узнавания последовательности ДНК в 9-18 пар ну-клеотидов. Если при этом к «цинковым пальцам» добавить какую-нибудь эндонуклеазу (чаще всего используют неспецифичный к последовательности и вносящий одноце-почечный разрыв каталитический домен нуклеазы Рок! из Flavobacteпum okeanokoites), получится наводимая на цель (на конкретный сайт в ДНК) эндонуклеаза. Для получения двуцепочечного разрыва необходимо создать два таких фермента, узнающих близлежащие регионы на противоположных цепях ДНК (рис. 2).
С начала 2000-х гг. и до настоящего времени системы на основе «цинковых пальцев» успешно использовали в широком спектре практических модификаций геномов как на растительных и животных моделях, так и в терапевтических подходах (табл. 2). Преимущество метода — универсальность способа наведения нуклеазы. К его недостаткам относятся довольно высокая сложность генно-инженерной сборки гена фермента; необходимость создать
Таблица 1. Состав компонентов основного фермента систем редактирования
два фермента для каждой из цепей ДНК; токсичность, связанная с недостаточной специфичностью систем данного типа [49]; риск иммуногенности чужеродного белка [50]. В этой связи применение систем на основе «цинковых пальцев» постепенно вытесняется новыми подходами.
Гибридные мегануклеазы
В 2003 г. Epinat и соавт. предложили метод геномного редактирования, основанный на так называемых меганукле-азах [39] (рис. 2). Мегануклеазы найдены у архей, бактерий, фагов, дрожжей, водорослей и некоторых растений и представляют собой эндодезоксирибонуклеазы — небольшие белки, зеркальные мономеры или гомодимеры, характеризующиеся очень длинным сайтом распознавания последовательности двуцепочечной ДНК: примерно от 10 до 40 пар нуклеотидов. Обычно сайт такой длины встречается лишь раз на геном (или даже ни разу). Например, последовательность сайта узнавания мегануклеазы I-SCEI длиной 18 п. н. теоретически встретится один раз в геноме, превышающем по длине геном человека в 20 раз. Как правило, они находятся в составе интронов или мобильных элементов генома. Биологическая функция мега-нуклеаз неясна.
Наибольшее распространение как инструмент геномного редактирования получили представители семейства мегануклеаз LAGLIDADG, обнаруженных в митохондриях и хлоропластах одноклеточных эукариот. Достоинства метода — довольно высокая сайт-специфичность и самопроизвольная сборка димера. Недостаток — крайняя ограниченность выбора сайта воздействия.
Технология TALEN (нуклеазы, подобные аналогу активатора транскрипции)
История разработки системы TALEN связана с исследованием бактерий рода Xanthomonas. Причиной многолетнего изучения этой группы бактерий стало их патогенное воздействие на культурные растения: томаты, перец, рис и ряд других. Было установлено, что Xanthomonas секре-тируют в цитоплазму растительных клеток регуляторные белки (transcription activator-like effectors, TALE), увеличивающие восприимчивость клетки к патогену. При дальнейшем изучении механизмов действия данных белков было обнаружено, что они способны связываться с ДНК и активировать экспрессию некоторых генов, имитируя факторы транскрипции клетки-хозяина [51, 52].
Оказалось, что узнавание TALE определенного сайта в ДНК идет за счет серии небольших доменов, каждый из которых узнает один-единственный нуклеотид в последовательности сайта. Исследователи довольно быстро разобрались со специфичностью доменов к конкретным
генома и некоторые особенности систем
Технология Ограничения по последовательности «Наводчик» «Ножницы» Двуцепочечный разрыв обеспечивает:
ZFNs Практически нет 3-6 белковых домена типа «цинковый палец» Неспецифичная к последовательности эндонуклеаза (например Рек!) искусственный гетеродимер
HEs Ограниченный набор сайтов Мегануклеаза Мегануклеаза естественный зеркальный мономер или гомодимер
TALENs Практически нет 12-20 белковых доменов от «активаторов транскрипции» Неспецифичная к последовательности эндонуклеаза (например Рек!) искусственный гетеродимер
RGNs (CRISPR/Cas9) Нет РНК длиной около 40 нуклеотидов Нуклеаза Саэ9 естественный мономер
ZFN
ZFP
Мегануклеазы
TALEN Fokl
CRISPR-Cas
тттгт_
®НИ1И11-
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Fokl
ДНК
двуцепочечный разрыв ДНК в определённом месте генома
Негомологичное воссоединение концов ДНК
i
Разрушение гена
Исправление гена
Добавление гена
Рис. 2. Схема геномного редактирования на основе гибридных нуклеаз с «цинковыми пальцами», мегануклеаз, гибридных нуклеаз с TALE и CRISPR/Cas9 (Yin и соавт., 2014 [47], с дополнениями)
нуклеотидам, что позволило собирать из них «пачки», точно распознающие определенную последовательность оснований в ДНК.
Таким образом, принцип использования системы TALEN аналогичен описанной выше системе с использованием триплет-специфичных доменов «цинковых пальцев» с той лишь разницей, что в качестве «наводчика» используют нуклеотид-специфичные домены «аналогов активаторов транскрипции», соединенные в серии по 12-20 штук. В качестве нуклеазы используют тот же каталитический домен Fokl. Для получения двуцепочечного разрыва необходимо создать два таких фермента, целевые сайты посадки TALE-«наводчиков» которых должны находиться на противоположных цепях ДНК и быть разделены участком около 20 п. н. (рис. 2). Достоинствами метода являются универсальность способа наведения нуклеазы и универсальность технологии сборки «дизайнерской» нуклеазы, а недостатками — высокая сложность генно-инженерной сборки гена фермента и необходимость создавать два фермента для каждой из цепей ДНК.
Существуют и попытки «скрещивания» отдельных элементов разных технологий. Так, описаны гибриды TALE-«наводчика» и мегануклеазы (megaTALs) [42]. К ме-гануклеазам пытаются прикреплять ферменты, тем или иным способом обрабатывающие (например разрушающие) концы двуцепочечного разрыва, с целью усиления мутагенного эффекта этого разрыва и т. п. [43, 44].
В 2012 г. журнал Nature Ме^ос^ назвал методы высокоточного редактирования геномов (среди которых была и система TALEN) методическим открытием года.
Технология CRISPR/Cas9 (нуклеаза, ассоциированная с короткими регулярно расположенными палиндромными повторами)
Принципиально иной с точки зрения механизма наведения нуклеазы на цель является предложенная спустя всего несколько лет после TALEN система CRISPR/Cas9. Она отличается от описанных выше тем, что в качестве «наводчика» в ней используют не белковые домены, а молекулу РНК (single guide RNA, sgRNA) длиной около 40 нуклеотидов, состоящую из двух частей: собственно наводящей crRNA и адаптерной (транс-активационной) tracrRNA. Еще в конце 1980-х гг. в геноме бактерий и архей были обнаружены ре-
гионы СИЭРП. Оказалось, что это своеобразный элемент «иммунной системы» бактерии, защищающий ее от чужеродных ДНК (например от проникновения бактериофагов) путем считывания повторов с комплементарных ДНК фага молекул РНК, которые в ассоциации со специальной ну-клеазой разрушают геном фага. Причем бактерии умеют «запоминать» в своем геноме последовательности ДНК заражавших их вирусов с тем, чтобы в дальнейшем использовать их для считывания «наводящих» РНК [53].
Оказалось также, что последовательность этих «наводящих» РНК можно менять, делая их комплементарными любому участку ДНК без потери нуклеазной активности фермента Саэ9 (рис. 2). Более того, можно использовать саму РНК как донор «генетической заплатки», если встроить в нее соответствующую последовательность [54].
На данный момент система СП18РП/Саэ9 выглядит наиболее перспективным инструментом редактирования генома, поскольку она универсальна, довольно проста в исполнении и обладает высокой сайт-специфичностью.
У метода сразу несколько важных достоинств: универсальность способа наведения нуклеазы; отсутствие потребности в генно-инженерной сборке фермента — меняется только наводящая РНК; способность нуклеазы Саэ9 резать обе цепи ДНК; возможность встроить «генетическую заплатку» в наводящую РНК. Недостаток метода — потенциальная иммуногенность чужеродного белка.
Алгоритмы проведения геномной терапии
Терапевтические направления использования систем редактирования генома можно разделить на три группы: 1) изменение генома гамет/зиготы/бластомеров с целью получения целого организма из одной измененной клетки (фетальная генотерапия); 2) изменение генома отобранных из организма отдельных соматических клеток с целью последующего возврата в организм измененных клеток (клеточная соматическая генотерапия); 3) изменение генома отдельных групп (или всех) соматических клеток непосредственно в многоклеточном организме (тканевая соматическая генотерапия).
Если первые два подхода предполагают манипуляции с культурами клеток в лабораторных условиях (для чего на данный момент выработана широчайшая технологическая база), то для третьего направления необходимо
Выбор мишени, подбор иРНК
(Б)
Анализ генома
Фибробласты
К
Стволовые клетк|
Кардиомиоциты
Рис. 3. Алгоритмы фетальной (А) и клеточной соматической генотерапии (Б)
использовать специальные системы (желательно ткане-специфичной) доставки генно-инженерных конструкций в клетки организма.
Генно-инженерные конструкции
Как правило, гибридные нуклеазы и «генетические заплатки» (генетический материал под замену) доставляют в клетку в виде генно-инженерных конструкций, с которых уже внутри клетки нарабатываются соответствующие РНК и белки. Описаны варианты прямого введения в клетку матричной РНК, в частности, для системы CRISPR/Cas9 [55].
Типичная генетическая конструкция для системы сайт-специфичной дизайнерской нуклеазы содержит сигнал ядерной локализации, искусственный блок «наведения» («цинковые пальцы», TALE или наводящую РНК), каталитический домен нуклеазы (например Fokl) и, если требуется, фрагмент под замену.
Системы доставки генотерапевтических препаратов в клетки
С целью доставки «терапевтических» генов или генетических конструкций разработаны разнообразные вирусные и невирусные системы, распознающие большое число потенциальных тканей-мишеней (кожа, мышцы, легкие, мозг, толстая кишка, селезенка, печень, клетки крови и т. д.). Система доставки должна обеспечивать высокую эффективность поглощения генетической конструкции клетками-мишенями, устойчивость к внутриклеточному разрушению при транспорте в ядро и поддержание необходимого уровня экспрессии.
Невирусные системы включают прямое введение ДНК-конструкций в клетки и ткани (например электро-порацию), липосомы, катионные полимеры и др. Среди вирусных систем наиболее распространены системы на основе ретровирусов, лентивирусов, аденовирусов, аде-ноассоциированных вирусов и вируса простого герпеса. Адресная доставка определяется наличием на поверхности вирусных частиц или на мембране липосом специальных молекул, узнаваемых рецепторами клеток-мишеней. Такими молекулами могут быть белки вирусного капсида, антитела к поверхностным клеточным антигенам (встраивают в мембрану липосом), молекулы фолиевой кислоты
(усиленно захватываемые опухолевыми клетками) и др.
Для доставки векторов с гибридными нуклеазами также пытаются применять вирусные и невирусные способы доставки [47, 56].
Геномная терапия наследственных заболеваний
Как уже было сказано выше, терапевтические подходы, основанные на добавлении генетического материала в клетку при помощи вирусных векторов, используют с начала 1990-х гг. Эти методы позволяют восстановить наработку белка, ген которого нефункционален в обеих копиях на хромосоме. Однако изменение или удаление участков ДНК долгое время оставалось крайне сложным и невоспроизводимым подходом. С появлением «дизайнерских» нуклеаз стали бурно развиваться методы направленного изменения участков ДНК непосредственно в структуре хромосомы. На сегодняшний день предложены варианты лечения пигментного ретинита, глаукомы, гемоглобинопа-тий, мышечных дистрофий (табл. 2).
Наиболее активно развивается фетальное направление. В 2015-2016 гг. о своих планах по модификации геномов человеческих эмбрионов при помощи технологии геномного редактирования CRISPR/Cas9 заявило множество лабораторий в США, Китае, Великобритании и ряде других стран, а также несколько биотехнологических компаний: Ovascience (США), Editas Medicine (США) и др. Если у данной пары индивидов из «естественных» вариантов эмбрионов не может быть отобран потенциально здоровый генотип, возможно использование методов редактирования генома с целью добавления/исправления патогенного аллеля на стадии зиготы.
В апреле 2015 г. вышла работа Liang и соавт., в которой при помощи системы CRISPR/Cas9 на уровне зиготы производили «починку» мутантного гена бета-глобина. Из 86 взятых в эксперимент зигот починка произошла в 4-х случаях [7].
Геномная терапия соматических мутаций
«Через 20 лет химиотерапия уйдет в прошлое, — уверен глава Wellcome Trust Sanger Institute, профессор Джереми Фаррер. — Мы будем оглядываться на сегодняшние методы лечения рака и ужасаться им. Равно как сегодня
ужасаемся примерам лечения электричеством в начале прошлого века. Генетика — главное подспорье медицины в будущем. Редкие врожденные пороки, рак и даже инфекции мы будем лечить, используя геномную терапию» [57].
«Дизайнерские» нуклеазы позволяют эффективно и точно воздействовать на ДНК с целью исправления возникших мутаций, что открывает широкие возможности их использования в исправлении нарушений, повлекших опу-холеобразование [29, 30]. Предложены варианты использования системы СР18РР/Саэ9 для лечения саркомы, рака легких [31, 32]. В частности, для рака легких предложен вариант исправления или удаления мутантного варианта гена БОРЯ при помощи доставляемой вирусом системы СР18РР/Саэ9 [32].
Антивирусная терапия
Геномная терапия ВИЧ
Еще одним направлением терапевтического применения гибридных нуклеаз является борьба с ВИЧ-инфекцией. Сегодня существует два направления борьбы: удаление копий ВИЧ из генома ВИЧ-носителя и изменение генов рецепторов, через которые вирус проникает в Т-лимфоциты (в частности, гена ООН5) (табл. 2). Уничтожая копии про-вирусной ДНК в геноме, теоретически можно полностью обезвредить вирус и исключить возможность его реактивации в клетках пациента. Другой подход — нарушение гена рецептора — не позволяет вирусу заражать лимфоциты, и популяция Т-клеток пациента восстанавливается.
Одна из проблем в разработке противовирусных препаратов на основе геномного редактирования заключается в способности вируса чрезвычайно быстро менять последовательность и тем самым уходить от «наводчика», специфичного к определенной последовательности сайта атаки. Однако при правильном законодательном регулировании выпуска модификаций генотерапевтических препаратов мы легко можем обгонять ВИЧ в выпуске очередных версий «антивируса».
Борьба с не встраивающимися вирусами
Системы редактирования генома пытаются применять и для борьбы с вирусами, не интегрирующими свой генетический материал в клеточный геном. Принцип их уничтожения тот же, что и в случае с ВИЧ, но гибридная ну-клеаза атакует свободный вирусный геном. Так, описано применение системы СР18РР/Саэ9 для борьбы с вирусом гепатита В [58].
Нетерапевтические задачи геномного редактирования
Генетический допинг
Генетический допинг представляет собой вариант нетерапевтического применения редактирования генома с целью улучшения результатов в спорте высоких достижений. Не секрет, что максимальные спортивные результаты во многом определяются генетической составляющей индивида. В марафоне почти всегда побеждает спортсмен из Кении или Эфиопии, поскольку в африканской популяции этих стран наиболее развит генетически детерминированный путь метаболизма глюкозы, определяющий способность быстро бежать марафон.
Со спортивной успешностью на сегодня связывают более 150 полиморфных позиций в ДНК, из которых 93 ассоциированы с выносливостью и 62 — с силовой нагрузкой [91]. Спектр потенциальных генов воздействия при помощи геномного редактирования очень широк: эритро-поэтин, инсулиноподобный фактор роста 1, человеческий гормон роста, миостатин, эндотелиальный фактор роста, фактор роста фибробластов, эндорфины, энкефалины, гены белков цистоскелета и т. д. Для ряда этих генов уже разработаны подходы и проведены клинические испытания по введению в геном человека конкретных аллелей генов [85].
Репрогенетика
В классической интерпретации репрогенетика предполагает отбор человеческих эмбрионов с определёнными свойствами из получаемых «естественных» вариантов. Однако технология редактирования генома позволяет расширить возможности подхода за счет создания вариантов, невозможных для данной пары родителей [88]. При этом возникает множество вопросов этического свойства, которые человечеству еще предстоит решить [90].
Этические вопросы геномного редактирования и правовое регулирование
Несмотря на то, что технологии геномного редактирования с использованием «дизайнерских» нуклеаз обладают огромным потенциалом создания эффективной терапии для пациентов, страдающих от генетических заболеваний, их применение в терапевтических целях все еще находится в зачаточном состоянии. В этой связи развитие этической и нормативно-правовой базы, обеспечивающей эффективность и безопасность использования геномного
Таблица 2. Примеры заболеваний, для лечения которых используют геномное редактирование на основе дизайнерских нуклеаз
Область действия Принципы Методы Ссылка
Наследственные заболевания глаз Разрушение гена TALENs, CRISPR/Cas9 [59-63]
Гемоглобинопатии (серповиднокле-точная анемия, р-талассемия) Вставка рабочего гена р-глобина ZFNs, TALENs, CRISPR/Cas9 [7-13]
Мышечные дистрофии Вставка рабочего гена дистрофина или удаление «плохого» экзона в имеющемся гене ZFNs, TALENs, CRISPR/Cas9 [64-71]
Онкология Удаление или исправление мутантного варианта гена TALENs, CRISPR/Cas9 [29-32]
ВИЧ Вырезание копии ДНК вируса из генома человека или удаление гена рецептора, через который вирус проникает в клетку ZFNs, TALENs, CRISPR/Cas9 [72-82]
Вирус гепатита В Уничтожение генома вируса CRISPR/Cas9 [58]
Генетический допинг Добавление требуемого аллеля гена TALENs, CRISPR/Cas9 [83-87]
Репрогенетика Все виды изменений TALENs, CRISPR/Cas9 [83-87]
редактирования, чрезвычайно важно [92].
В рамках работы этических комитетов и уполномоченных государственных органов необходимо фиксировать и уточнять аспекты, оказывающие влияние на клиническую реализацию технологий редактирования генома. Эти структуры должны предложить такую «дорожную карту» развития и внедрения технологий геномного редактирования, которая позволит безопасно и быстро переводить новейшие методы в клиническую практику.
Опережающее развитие принципиально новых технологий в медицине не позволяет законодателю работать над правовой основой их использования так же, как раньше. В настоящее время назрела смена парадигмы законодательного регулирования выхода новых медицинских технологий из научно-исследовательской лаборатории в клинику. Глобализация привела к тому, что инновации распространяются по миру буквально со скоростью света. Новая перспективная медицинская технология, где бы она ни была создана, неизбежно находит развитие и используется в первую очередь в странах с более гибким или либеральным законодательством. Такие государства получают «фору» за счет раннего внедрения инновационных подходов даже с учетом рисков, заключенных в нем. Многие законодательные ограничения перехода «наука-медицина» в отдельных странах не имеют смысла, поскольку технологии, созданные в этих странах, рано или поздно попадают в «научные офшоры», откуда быстро распространяют по остальному миру, а также привлекают на территорию «офшоров» клиентов.
Некоторые страны сперва пытаются запрещать применение систем редактирования генома человека при по-
мощи «дизайнерских» нуклеаз, однако вынуждены быстро менять позицию, дабы не оказаться в хвосте технологических лидеров. После выхода в 2015 г. работы китайских авторов по редактированию генома человеческих эмбрионов методом СР18РР/Саэ9 в феврале 2016 г. группе британских ученых было дано разрешение на генетическую модификацию человеческих эмбрионов с помощью СР18РР/Саэ9 и родственных методов «дизайнерских» нуклеаз [93].
Общественное мнение на фоне внедрения технологий в отдельных юрисдикциях быстро меняется и начинает давить на собственное законодательное регулирование.
ЗАКЛЮЧЕНИЕ
Созданные за последние несколько лет методы редактирования генома представляют собой развитие существующих с конца прошлого века подходов к генной терапии. Однако можно с уверенностью утверждать, что сегодня мы наблюдаем смену парадигмы в области геномной медицины. На начало второго десятилетия XXI в. пришлось сразу несколько технологических прорывов, обладающих мощным синергетическим эффектом: усовершенствование технологий направленной клеточной дифференци-ровки, значительное удешевление и рутинное применение геномных секвенаторов и создание описанных в данном обзоре систем редактирования генома. Все это в сумме неизбежно приведет к появлению в ближайшие 3-5 лет персонализированной геномной медицины нового качества. Технологии направленного изменения генома станут рутинным инструментом врача-клинициста.
Литература
1. Friedmann T, Roblin R. Gene Therapy for Human Genetic Disease? Science. 1972; 175 (4025): 949-55. doi:10.1126/ science.175.4025.949.
2. Rosenberg SA, Aebersold P, Cornetta K, Kasid A, Morgan RA, Moen R, et al. Gene transfer into humans–immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med. 1990 Aug 30; 323 (9): 570-8. doi:10.1056/ NEJM199008303230904.
3. Gene Therapy Clinical Trials Worldwide Database [Интернет]. John Wiley and Sons Ltd., provided by the Journal of Gene Medicine. c2016 – [обновлено: февраль 2016 г.; дата обращения: июнь 2016 г.]. Доступно по ссылке: http://www.wiley.com/ legacy/wileychi/genmed/clinical/.
4. De Ravin SS, Wu X, Moir S, Anaya-O’Brien S, Kwatemaa N, Little P, et al. Lentiviral hematopoietic stem cell gene therapy for X-linked severe combined immunodeficiency. Sci Transl Med. 2016 Apr 20; 8 (335): 335ra57. doi: 10.1126/scitranslmed. aad8856.
5. Ward P, Walsh CE. Current and future prospects for hemophilia gene therapy. Expert Rev Hematol. 2016 May 26: 1-11. [Epub ahead of print].
6. Swystun LL, Lillicrap D. Gene Therapy for Coagulation Disorders. Circ Res. 2016 Apr 29; 118 (9): 1443-52. doi: 10.1161/ CIRCRESAHA.115.307015.
7. Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, et al. CRISPR/ Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 2015 May; 6 (5): 363-72. doi: 10.1007/s13238-015-0153-5. Epub 2015 Apr 18.
8. Canver MC, Orkin SH. Customizing the genome as therapy for the р-hemoglobinopathies. Blood. 2016 May 26; 127 (21): 253645. doi: 10.1182/blood-2016-01-678128. Epub 2016 Apr 6.
9. Cottle RN, Lee CM, Bao G. Treating hemoglobinopathies using gene-correction approaches: promises and challenges. Hum
Genet. 2016 Jun 17. [Epub ahead of print].
10. Tasan I, Jain S, Zhao H. Use of genome-editing tools to treat sickle cell disease. Hum Genet. 2016 Jun 1. [Epub ahead of print].
11. Osborn MJ, Belanto JJ, Tolar J, Voytas DF. Gene editing and its application for hematological diseases. Int J Hematol. 2016 May 27. [Epub ahead of print].
12. Yang Y, Zhang X, Yi L, Hou Z, Chen J, Kou X, et al. Naïve Induced Pluripotent Stem Cells Generated From p-Thalassemia Fibroblasts Allow Efficient Gene Correction With CRISPR/Cas9. Stem Cells Transl Med. 2016 Jan; 5 (1): 8-19. doi: 10.5966/sctm.2015-0157. Epub 2015 Dec 16. Erratum in: Stem Cells Transl Med. 2016 Feb; 5 (2): 267.
13. Smith EC, Orkin SH. Hemoglobin genetics: recent contributions of GWAS and gene editing. Hum Mol Genet. 2016 Jun 23. pii: ddw170. [Epub ahead of print].
14. Lee TW, Southern KW, Perry LA, Penny-Dimri JC, Aslam AA. Topical cystic fibrosis transmembrane conductance regulator gene replacement for cystic fibrosis-related lung disease. Cochrane Database Syst Rev. 2016 Jun 17; 6: CD005599.
15. Alton EW, Armstrong DK, Ashby D, Bayfield KJ, Bilton D, Bloomfield EV, et al. Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: a randomised, doubleblind, placebo-controlled, phase 2b trial. Lancet Respir Med.
2015 Sep; 3 (9): 684-91. doi:10.1016/S2213-2600(15)00245-3.
16. Ye GJ, Budzynski E, Sonnentag P, Nork TM, Sheibani N, Gurel Z, et al. Cone-Specific Promoters for Gene Therapy of Achromatopsia and Other Retinal Diseases. Hum Gene Ther.
2016 Jan; 27 (1): 72-82. doi: 10.1089/hum.2015.130.
17. Maguire AM, Simonelli F, Pierce EA, Pugh EN, Mingozzi F, Bennicelli J, et al. Safety and efficacy of gene transfer for Leber’s congenital amaurosis. N Engl J Med. 2008; 358 (21): 2240-8. doi:10.1056/NEJMoa0802315.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
18. Bainbridge JWB, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, et al. Effect of gene therapy on visual function in
Leber’s congenital amaurosis. N Engl J Med. 2008; 358 (21): 2231-9. doi:10.1056/NEJMoa0802268.
19. Hauswirth WW, Aleman TS, Kaushal S, Cideciyan AV, Schwartz SB, Wang L, et al. Treatment of Leber Congenital Amaurosis Due to RPE65Mutations by Ocular Subretinal Injection of Adeno-Associated Virus Gene Vector: Short-Term Results of a Phase I Trial. Hum Gene Ther. 2008 Oct; 19 (10): 979-90. doi:10.1089/hum.2008.107.
20. Walker MC, Schorge S, Kullmann DM, Wykes RC, Heeroma JH, Mantoan L. Gene therapy in status epilepticus. Epilepsia. 2013 Sep; 54 Suppl 6: 43-5. doi:10.1111/epi.12275.
21. Giuncamp C, Pap T, Schedel J, Pap G, Moller-Ladner U, Gay RE, Gay S. Gene therapy in osteoarthritis. Joint Bone Spine. 2000; 67 (6): 570-1.
22. Evans CH, Gouze JN, Gouze E, Robbins PD, Ghivizzani SG. Osteoarthritis gene therapy. Gene Ther. 2004 Feb; 11 (4): 379-89. doi: 10.1038/sj.gt.3302196.
23. Carlsson T, Winkler C, Burger C, Muzyczka N, Mandel RJ, Cenci A, et al. Reversal of dyskinesias in an animal model of Parkinson’s disease by continuous L-DOPA delivery using rAAV vectors. Brain. 2005 Mar; 128 (Pt 3): 559-69. doi: 10.1093/brain/ awh374.
24. Forsayeth J, Bankiewicz KS, Aminoff MJ. Gene therapy for Parkinson’s disease: Where are we now and where are we going? Expert Rev Neurother. 2010 Dec; 10 (12): 1839-45. doi: 10.1586/ ern.10.161.
25. Palfi S, Gurruchaga, JM, Ralph GS, Lepetit H, Lavisse S, Buttery PC, et al. Long-term safety and tolerability of Pro Savin, a lentiviral vector-based gene therapy for Parkinson’s disease: A dose escalation, open-label, phase 1/2 trial. Lancet. 2014 Mar 29; 383 (9923): 1138-46. doi: 10.1016/S0140-6736(13)61939-X.
26. Cross D, Burmester JK. Gene Therapy for Cancer Treatment: Past, Present and Future. Clin Med Res. 2006 Sep; 4 (3): 218-27.
27. Andersen JB, Thorgeirsson SS. A perspective on molecular therapy in cholangiocarcinoma: present status and future directions. Hepat Oncol. 2014 Jan 1; 1 (1): 143-57.
28. Amer MH. Gene therapy for cancer: present status and future perspective. Mol Cell Ther. 2014 Sep 10; 2: 27. doi: 10.1186/20528426-2-27.
29. Khan FA, Pandupuspitasari NS, Chun-Jie H, Ao Z, Jamal M, Zohaib A, et al. CRISPR/Cas9 therapeutics: a cure for cancer and other genetic diseases. Oncotarget. 2016 May 26. doi: 10.18632/ oncotarget.9646. [Epub ahead of print].
30. White MK, Khalili K. CRISPR/Cas9 and cancer targets: future possibilities and present challenges. Oncotarget. 2016 Mar 15; 7 (11): 12305-17. doi: 10.18632/oncotarget.7104.
31. Liu T, Shen JK, Li Z, Choy E, Hornicek FJ, Duan Z. Development and potential applications of CRISPR-Cas9 genome editing technology in sarcoma. Cancer Lett. 2016 Apr 1; 373 (1): 109-18. doi: 10.1016/j.canlet.2016.01.030. Epub 2016 Jan 21.
32. Tang H, Shrager JB. CRISPR/Cas-mediated genome editing to treat EGFR-mutant lung cancer: a personalized molecular surgical therapy. EMBO Mol Med. 2016 Jan 8; 8 (2): 83-5. doi: 10.15252/ emmm.201506006.
33. Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Chapter 8.5: Gene Replacement and Transgenic Animals: DNA Is Transferred into Eukaryotic Cells in Various Ways. In: Molecular Cell Biology. 4th ed. New York: W. H. Freeman; 2002. ISBN 0-7167-3136-3.
34. O’Gorman S, Fox DT, Wahl GM. Recombinase-mediated gene activation and site-specific integration in mammalian cells. Science. 1991 Mar 15; 251 (4999): 1351-5. doi: 10.1126/ science.1900642.
35. Karow M, Calos MP. The therapeutic potential of phiC31 integrase as a gene therapy system. Expert Opin Biol Ther. 2011 Oct; 11 (10): 1287-96. doi:10.1517/14712598.2011.601293.
36. Pabo CO, Peisach E, Grant RA. Design and Selection of Novel Cys2His2 Zinc Finger Proteins. Annu. Rev Biochem. 2001; 70: 313-40.
37. Maeder ML, Thibodeau-Beganny S, Osiak A, Wright DA, Anthony RM, Eichtinger M, et al. Rapid “open-source” engineering of customized zinc-finger nucleases for highly efficient gene modification. Mol Cell. 2008 Jul 25; 31 (2): 294-
301. doi: 10.1016/j.molcel.2008.06.016.
38. Carroll D. Genome engineering with zinc-finger nucleases. Genetics. 2011 Aug; 188 (4): 773-82. doi: 10.1534/ genetics.111.131433.
39. Epinat JC, Arnould S, Chames P, Rochaix P, Desfontaines D, Puzin C, et al. A novel engineered meganuclease induces homologous recombination in yeast and mammalian cells. Nucleic Acids Res. 2003 Jun 1; 31 (11): 2952-62. doi: 10.1093/ nar/gkg375.
40. Boch J. TALEs of genome targeting. Nat Biotechnol. 2011 Feb; 29 (2): 135-6. doi: 10.1038/nbt.1767.
41. Mali P, Esvelt KM, Church GM. Cas9 as a versatile tool for engineering biology. Nat Methods. 2013 Oct; 10 (10): 957-63. doi: 10.1038/nmeth.2649.
42. Boissel S, Jarjour J, Astrakhan A, Adey A, Gouble A, Duchateau P, et al. megaTALs: a rare-cleaving nuclease architecture for therapeutic genome engineering. Nucleic Acids Res. 2014 Feb; 42 (4): 2591-601. doi: 10.1093/nar/gkt1224.
43. Certo MT, Gwiazda KS, Kuhar R, Sather B, Curinga G, Mandt T, et al. Coupling endonucleases with DNA end-processing enzymes to drive gene disruption. Nat Methods. 2012 Oct; 9 (10): 973-5. doi: 10.1038/nmeth.2177.
44. Delacöte F, Perez C, Guyot V, Duhamel M, Rochon C, Ollivier N, et al. High frequency targeted mutagenesis using engineered endonucleases and DNA-end processing enzymes. PLoS One. 2013; 8 (1): e53217. doi: 10.1371/journal.pone.0053217.
45. Doudna JA, Charpentier E. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28; 346 (6213): 1258096. doi: 10.1126/science.1258096
46. Немудрый А. А., Валетдинова К. Р., Медведев С. П., Заки-ян С. М. Системы редактирования геномов TALEN и CRISPR/ Cas — инструменты открытий. Acta naturae. 2014; т. 6, 3 (22): 20-41.
47. Yin H, Kanasty RL, Eltoukhy AA, Vegas AJ, Dorkin JR, Anderson DG. Non-viral vectors for gene-based therapy. Nat Rev Genet. 2014 Aug; 15 (8): 541-55. doi: 10.1038/nrg3763. Epub 2014 Jul 15.
48. Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A. 1996 Feb 6; 93 (3): 1156-60.
49. Pattanayak V, Ramirez CL, Joung JK, Liu DR. Revealing OffTarget Cleavage Specificities of Zinc Finger Nucleases by in Vitro Selection. Nat Methods, 2011 Aug 7; 8 (9): 765-70. doi: 10.1038/ nmeth.1670.
50. Wood AJ, Lo TW, Zeitler B, Pickle CS, Ralston EJ, Lee AH, et al. Targeted Genome Editing Across Species Using ZFNs and TALENs. Science. 2011 Jul 15; 333 (6040): 307. doi: 10.1126/ science.1207773.
51. Boch J, Scholze H, Schornack S, Landgraf A, Hahn S, Kay S, et al. Breaking the Code of DNA Binding Specificity of TALType Ill Effectors. Science. 2009 Dec 11; 326 (5959): 1509-12. doi: 10.1126/science.1178811.
52. Moscou MJ, Bogdanove AJ. A Simple Cipher Governs DNA Recognition by TAL Effectors. Science. 2009 Dec 11; 326 (5959): 1501. Bibcode:2009Sci…326.1501M. doi:10.1126/ science.1178817. PMID 19933106.
53. Horvath P, Barrangou R (January 2010). “CRISPR/Cas, the immune system of bacteria and archaea”. Science 327 (5962): 167-70. doi: 10.1126/Science.1179555.
54. Swarts DC, Mosterd C, van Passel MW, Brouns SJ. CRISPR interference directs strand specific spacer acquisition. PloS One. 2012; 7 (4): e35888. doi: 10.1371/journal.pone.0035888.
55. Boroviak K, Doe B, Banerjee R, Yang F, Bradley A. Chromosome engineering in zygotes with CRISPR/Cas9. Genesis. 2016 Feb; 54 (2): 78-85. doi: 10.1002/dvg.22915. Epub 2016 Jan 25.
56. Yin H, Song CQ, Dorkin JR, Zhu LJ, Li Y, Wu Q, et al. Therapeutic genome editing by combined viral and non-viral delivery of CRISPR system components in vivo. Nat Biotechnol. 2016 Mar; 34 (3): 328-33. doi: 10.1038/nbt.3471. Epub 2016 Feb 1.
57. End of chemotherapy within 20 years as pioneering DNA project launched. The Daily Telegraph, 01.08.2014
58. Zhu W, Xie K, Xu Y, Wang L, Chen K, Zhang L, Fang J. CRISPR/ Cas9 produces anti-hepatitis B virus effect in hepatoma cells and
transgenic mouse. Virus Res. 2016 Jun 2; 217: 125-32. doi: 10.1016/j.virusres.2016.04.003. Epub 2016 Apr 2.
59. Hung SS, McCaughey T, Swann O, Pebay A, Hewitt AW. Genome engineering in ophthalmology: Application of CRISPR/Cas to the treatment of eye disease. Prog Retin Eye Res. 2016 Jun; 53; 1-20. doi: 10.1016/j.preteyeres.2016.05.001. [Epub ahead of print].
60. Bassuk AG, Zheng A, Li Y, Tsang SH, Mahajan VB. Precision Medicine: Genetic Repair of Retinitis Pigmentosa in Patient-Derived Stem Cells. Sci Rep. 2016 Jan 27; 6:19969. doi: 10.1038/ srep19969.
61. Nafissi N, Foldvari M. Neuroprotective therapies in glaucoma: II. Genetic nanotechnology tools. Front Neurosci. 2015 Oct 14; 9: 355. doi: 10.3389/fnins.2015.00355.
62. Li Y, Chan L, Nguyen HV, Tsang SH. Personalized Medicine: Cell and Gene Therapy Based on Patient-Specific iPSC-Derived Retinal Pigment Epithelium Cells. Adv Exp Med Biol. 2016; 854: 549-55. doi: 10.1007/978-3-319-17121-0_73
63. Wu WH, Tsai YT, Justus S, Lee T, Zhang L, Lin CS, et al. CRISPR repair reveals causative mutation in a preclinical model of retinitis pigmentosa. Mol Ther. 2016 May 20. doi: 10.1038/mt.2016.107. [Epub ahead of print].
64. Mendell JR, Rodino-Klapac LR. Duchenne muscular dystrophy: CRISPR/Cas9 treatment. Cell Res. 2016 May; 26 (5): 513-4. doi: 10.1038/cr.2016.28. Epub 2016 Mar 1.
65. Himeda CL, Jones TI, Jones PL. Scalpel or Straitjacket: CRISPR/ Cas9 Approaches for Muscular Dystrophies. Trends Pharmacol Sci. 2016 Apr; 37 (4): 249-51. doi: 10.1016/j.tips.2016.02.001. Epub 2016 Feb 22.
66. Iyombe-Engembe JP, Ouellet DL, Barbeau X, Rousseau J, Chapdelaine P, Lagüe P, Tremblay JP. Efficient Restoration of the Dystrophin Gene Reading Frame and Protein Structure in DMD Myoblasts Using the CinDel Method. Mol Ther Nucleic Acids. 2016 Jan 26; 5: e283. doi: 10.1038/mtna.2015.58.
67. Maggio I, Stefanucci L, Janssen JM, Liu J, Chen X, Mouly V, Gongalves MA. Selection-free gene repair after adenoviral vector transduction of designer nucleases: rescue of dystrophin synthesis in DMD muscle cell populations. Nucleic Acids Res. 2016 Feb 18; 44 (3): 1449-70. doi: 10.1093/nar/gkv1540. Epub 2016 Jan 13.
68. Kawecka K, Theodoulides M, Hasoglu Y, Jarmin S, Kymalainen H, Le-Heron A, et al. Adeno-Associated Virus (AAV) Mediated Dystrophin Gene Transfer Studies and Exon Skipping Strategies for Duchenne Muscular Dystrophy (DMD). Curr Gene Ther. 2015; 15 (4): 395-415.
69. Ousterout DG, Kabadi AM, Thakore PI, Majoros WH, Reddy TE, Gersbach CA. Multiplex CRISPR/Cas9-based genome editing for correction of dystrophin mutations that cause Duchenne muscular dystrophy. Nat Commun. 2015 Feb 18; 6: 6244. doi: 10.1038/ ncomms7244.
70. Ousterout DG, Kabadi AM, Thakore PI, Perez-Pinera P, Brown MT, Majoros WH, et al. Correction of dystrophin expression in cells from Duchenne muscular dystrophy patients through genomic excision of exon 51 by zinc finger nucleases. Mol Ther. 2015 Mar; 23 (3): 523-32. doi: 10.1038/mt.2014.234. Epub 2014 Dec 10.
71. Maggio I, Chen X, Gongalves MA. The emerging role of viral vectors as vehicles for DMD gene editing. Genome Med. 2016 May 23; 8 (1): 59. doi: 10.1186/s13073-016-0316-x.
72. Reardon S. Gene-editing method tackles HIV in first clinical test. Nature. 2014 Mar 05. doi: 10.1038/nature.2014.14813.
73. Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G, et al. Gene Editing of CCR5 in Autologous CD4 T Cells of Persons Infected with HIV. N Engl J Med. 2014 Mar 6; 370 (10): 901-10.
doi: 10.1056/NEJMoa1300662.
74. Kaminski R, Bella R, Yin C, Otte J, Ferrante P, Gendelman HE, et al. Excision of HIV-1 DNA by gene editing: a proof-of-concept in vivo study. Gene Ther. 2016 May 19. doi: 10.1038/gt.2016.41. [Epub ahead of print].
75. Ueda S, Ebina H, Kanemura Y, Misawa N, Koyanagi Y. Insufficient anti-HIV-1 potency of the CRISPR/Cas9 system for full viral replication. Microbiol Immunol. 2016 Jun 9. doi: 10.1111/13480421.12395. [Epub ahead of print].
76. Stone D, Niyonzima N, Jerome KR. Genome editing and the next generation of antiviral therapy. Hum Genet. 2016 Jun 8. [Epub ahead of print].
77. Pernet O, Yadav SS, An DS. Stem cell-based therapies for HIV/AIDS. Adv Drug Deliv Rev. 2016 May 2. pii: S0169-409X(16)30137-5. doi: 10.1016/j.addr.2016.04.027. [Epub ahead of print].
78. Kim M, Siliciano RF. Genome editing for clinical HIV isolates. Nat Biotechnol. 2016 Apr 7; 34 (4): 388-9. doi: 10.1038/nbt.3531.
79. Wang CX, Cannon PM. The clinical applications of genome editing in HIV. Blood. 2016 May 26; 127 (21): 2546-52. doi: 10.1182/ blood-2016-01-678144. Epub 2016 Apr 6.
80. Wang Z, Pan Q, Gendron P, Zhu W, Guo F, Cen S, et al. CRISPR/ Cas9-Derived Mutations Both Inhibit HIV-1 Replication and Accelerate Viral Escape. Cell Rep. 2016 Apr 19; 15 (3): 481-9. doi: 10.1016/j.celrep.2016.03.042. Epub 2016 Apr 7.
81. Wang G, Zhao N, Berkhout B, Das AT. CRISPR-Cas9 Can Inhibit HIV-1 Replication but NHEJ Repair Facilitates Virus Escape. Mol Ther. 2016 Mar; 24 (3): 522-6. doi: 10.1038/mt.2016.24. Epub 2016 Jan 22.
82. Kaminski R, Chen Y, Fischer T, Tedaldi E, Napoli A, Zhang Yet al. Elimination of HIV-1 Genomes from Human T-lymphoid Cells by CRISPR/Cas9 Gene Editing. Sci Rep. 2016 Mar 4; 6: 22555. doi: 10.1038/srep22555.
83. Momaya A, Fawal M, Estes R. Performance-enhancing substances in sports: a review of the literature. Sports Med. 2015 Apr; 45 (4): 517-31. doi: 10.1007/s40279-015-0308-9.
84. World Anti-Doping Agency. The World Anti-Doping Code: The 2015 Prohibited List of International Standards. Montreal (Quebec); 2014 Sep 20. 10 p.
85. Adis Insight [Интернет]. Cham (Switzerland): Springer International Publishing AG; [цата обращения: июнь 2016 г]. Drug Profile: Erythropoietin gene therapy — Oxford BioMedica. Доступно по ссылке: http://adisinsight.springer.com/drugs/800017416.
86. Barry P. Finding the golden genes. Science News. 2008 Jul 18.
87. Miah A. Genetically Modified Athletes: Biomedical Ethics, Gene Doping and Sport. London; New York: Routledge; 2004. 208 p.
88. Regalado A. Engineering the Perfect Baby. MIT Technology Review. 2015 Mar 5.
89. Parens E, Knowles LP. Reprogenetics and public policy. Reflections and recommendations. Hastings Cent Rep. 2003 Jul-Aug; 33 (4): S1-24.
90. Pray L. Embryo screening and the ethics of human genetic engineering. Nature Education. 2008; 1 (1): 207.
91. Ahmetov II, Egorova ES, Gabdrakhmanova LJ, Fedotovskaya ON. Genes and Athletic Performance: An Update. Med Sport Sci. 2016; 61: 41-54. doi: 10.1159/000445240. Epub 2016 Jun 10.
92. Baltimore D, Berg P, Botchan M, Carroll D, Charo RA, Church G, et al. A prudent path forward for genomic engineering and germline gene modification. Science. 2015 Apr 3; 348 (6230): 36-3. doi: 10.1126/science.aab1028.
93. Knapton S. British scientists granted permission to genetically modify human embryos. The Daily Telegraph. 2016 Feb 1.
References
1. Friedmann T, Roblin R. Gene Therapy for Human Genetic Disease? Science. 1972; 175 (4025): 949-55. doi:10.1126/ science.175.4025.949.
2. Rosenberg SA, Aebersold P, Cornetta K, Kasid A, Morgan RA, Moen R, et al. Gene transfer into humans–immunotherapy of patients with advanced melanoma, using tumor-infiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med. 1990 Aug 30; 323 (9): 570-8. doi:10.1056/ NEJM199008303230904.
3. Gene Therapy Clinical Trials Worldwide Database [Internet]. John Wiley and Sons Ltd., provided by the Journal of Gene Medicine. c2016 – [updated 2016 Feb; cited 2016 Jun]. Available from: http://www.wiley.com/legacy/wileychi/genmed/clinical/.
4. De Ravin SS, Wu X, Moir S, Anaya-O’Brien S, Kwatemaa N, Little P et al. Lentiviral hematopoietic stem cell gene therapy for X-linked severe combined immunodeficiency. Sci Transl Med. 2016 Apr 20; 8 (335): 335ra57. doi: 10.1126/scitranslmed. aad8856.
5. Ward P, Walsh CE. Current and future prospects for hemophilia gene therapy. Expert Rev Hematol. 2016 May 26: 1-11. [Epub ahead of print].
6. Swystun LL, Lillicrap D. Gene Therapy for Coagulation Disorders. Circ Res. 2016 Apr 29; 118 (9): 1443-52. doi: 10.1161/ CIRCRESAHA.115.307015.
7. Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, et al. CRISPR/ Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 2015 May; 6 (5): 363-72. doi: 10.1007/s13238-015-0153-5. Epub 2015 Apr 18.
8. Canver MC, Orkin SH. Customizing the genome as therapy for the ß-hemoglobinopathies. Blood. 2016 May 26; 127 (21): 253645. doi: 10.1182/blood-2016-01-678128. Epub 2016 Apr 6.
9. Cottle RN, Lee CM, Bao G. Treating hemoglobinopathies using gene-correction approaches: promises and challenges. Hum Genet. 2016 Jun 17. [Epub ahead of print].
10. Tasan I, Jain S, Zhao H. Use of genome-editing tools to treat sickle cell disease. Hum Genet. 2016 Jun 1. [Epub ahead of print].
11. Osborn MJ, Belanto JJ, Tolar J, Voytas DF. Gene editing and its application for hematological diseases. Int J Hematol. 2016 May 27. [Epub ahead of print].
12. Yang Y, Zhang X, Yi L, Hou Z, Chen J, Kou X, et al. Naïve Induced Pluripotent Stem Cells Generated From ß-Thalassemia Fibroblasts Allow Efficient Gene Correction With CRISPR/Cas9. Stem Cells Transl Med. 2016 Jan; 5 (1): 8-19. doi: 10.5966/sctm.2015-0157. Epub 2015 Dec 16. Erratum in: Stem Cells Transl Med. 2016 Feb; 5 (2): 267.
13. Smith EC, Orkin SH. Hemoglobin genetics: recent contributions of GWAS and gene editing. Hum Mol Genet. 2016 Jun 23. pii: ddw170. [Epub ahead of print].
14. Lee TW, Southern KW, Perry LA, Penny-Dimri JC, Aslam AA. Topical cystic fibrosis transmembrane conductance regulator gene replacement for cystic fibrosis-related lung disease. Cochrane Database Syst Rev. 2016 Jun 17; 6: CD005599.
15. Alton EW, Armstrong DK, Ashby D, Bayfield KJ, Bilton D, Bloomfield EV, et al. Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: a randomised, doubleblind, placebo-controlled, phase 2b trial. Lancet Respir Med.
2015 Sep; 3 (9): 684-91. doi:10.1016/S2213-2600(15)00245-3.
16. Ye GJ, Budzynski E, Sonnentag P, Nork TM, Sheibani N, Gurel Z, et al. Cone-Specific Promoters for Gene Therapy of Achromatopsia and Other Retinal Diseases. Hum Gene Ther.
2016 Jan; 27 (1): 72-82. doi: 10.1089/hum.2015.130.
17. Maguire AM, Simonelli F, Pierce EA, Pugh EN, Mingozzi F, Bennicelli J, et al. Safety and efficacy of gene transfer for Leber’s congenital amaurosis. N Engl J Med. 2008; 358 (21): 2240-8. doi:10.1056/NEJMoa0802315.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
18. Bainbridge JWB, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, et al. Effect of gene therapy on visual function in Leber’s congenital amaurosis. N Engl J Med. 2008; 358 (21): 2231-9. doi:10.1056/NEJMoa0802268.
19. Hauswirth WW, Aleman TS, Kaushal S, Cideciyan AV, Schwartz SB, Wang L, et al. Treatment of Leber Congenital
Amaurosis Due to RPE65Mutations by Ocular Subretinal Injection of Adeno-Associated Virus Gene Vector: Short-Term Results of a Phase I Trial. Hum Gene Ther. 2008 Oct; 19 (10): 979-90. doi:10.1089/hum.2008.107.
20. Walker MC, Schorge S, Kullmann DM, Wykes RC, Heeroma JH, Mantoan L. Gene therapy in status epilepticus. Epilepsia. 2013 Sep; 54 Suppl 6: 43-5. doi:10.1111/epi.12275.
21. Giuncamp C, Pap T, Schedel J, Pap G, Moller-Ladner U, Gay RE, Gay S. Gene therapy in osteoarthritis. Joint Bone Spine. 2000; 67 (6): 570-1.
22. Evans CH, Gouze JN, Gouze E, Robbins PD, Ghivizzani SG. Osteoarthritis gene therapy. Gene Ther. 2004 Feb; 11 (4): 379-89. doi: 10.1038/sj.gt.3302196.
23. Carlsson T, Winkler C, Burger C, Muzyczka N, Mandel RJ, Cenci A, et al. Reversal of dyskinesias in an animal model of Parkinson’s disease by continuous L-DOPA delivery using rAAV vectors. Brain. 2005 Mar; 128 (Pt 3): 559-69. doi: 10.1093/brain/ awh374.
24. Forsayeth J, Bankiewicz KS, Aminoff MJ. Gene therapy for Parkinson’s disease: Where are we now and where are we going? Expert Rev Neurother. 2010 Dec; 10 (12): 1839-45. doi: 10.1586/ ern.10.161.
25. Palfi S, Gurruchaga, JM, Ralph GS, Lepetit H, Lavisse S, Buttery PC, et al. Long-term safety and tolerability of Pro Savin, a lentiviral vector-based gene therapy for Parkinson’s disease: A dose escalation, open-label, phase 1/2 trial. Lancet. 2014 Mar 29; 383 (9923): 1138-46. doi: 10.1016/S0140-6736(13)61939-X.
26. Cross D, Burmester JK. Gene Therapy for Cancer Treatment: Past, Present and Future. Clin Med Res. 2006 Sep; 4 (3): 218-27.
27. Andersen JB, Thorgeirsson SS. A perspective on molecular therapy in cholangiocarcinoma: present status and future directions. Hepat Oncol. 2014 Jan 1; 1 (1): 143-57.
28. Amer MH. Gene therapy for cancer: present status and future perspective. Mol Cell Ther. 2014 Sep 10; 2: 27. doi: 10.1186/20528426-2-27.
29. Khan FA, Pandupuspitasari NS, Chun-Jie H, Ao Z, Jamal M, Zohaib A, et al. CRISPR/Cas9 therapeutics: a cure for cancer and other genetic diseases. Oncotarget. 2016 May 26. doi: 10.18632/ oncotarget.9646. [Epub ahead of print].
30. White MK, Khalili K. CRISPR/Cas9 and cancer targets: future possibilities and present challenges. Oncotarget. 2016 Mar 15; 7 (11): 12305-17. doi: 10.18632/oncotarget.7104.
31. Liu T, Shen JK, Li Z, Choy E, Hornicek FJ, Duan Z. Development and potential applications of CRISPR-Cas9 genome editing technology in sarcoma. Cancer Lett. 2016 Apr 1; 373 (1): 109-18. doi: 10.1016/j.canlet.2016.01.030. Epub 2016 Jan 21.
32. Tang H, Shrager JB. CRISPR/Cas-mediated genome editing to treat EGFR-mutant lung cancer: a personalized molecular surgical therapy. EMBO Mol Med. 2016 Jan 8; 8 (2): 83-5. doi: 10.15252/ emmm.201506006.
33. Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J. Chapter 8.5: Gene Replacement and Transgenic Animals: DNA Is Transferred into Eukaryotic Cells in Various Ways. In: Molecular Cell Biology. 4th ed. New York: W. H. Freeman; 2002. ISBN 0-7167-3136-3.
34. O’Gorman S, Fox DT, Wahl GM. Recombinase-mediated gene activation and site-specific integration in mammalian cells. Science. 1991 Mar 15; 251 (4999): 1351-5. doi: 10.1126/ science.1900642.
35. Karow M, Calos MP. The therapeutic potential of phiC31 integrase as a gene therapy system. Expert Opin Biol Ther. 2011 Oct; 11 (10): 1287-96. doi:10.1517/14712598.2011.601293.
36. Pabo CO, Peisach E, Grant RA. Design and Selection of Novel Cys2His2 Zinc Finger Proteins. Annu. Rev Biochem. 2001; 70: 313-40.
37. Maeder ML, Thibodeau-Beganny S, Osiak A, Wright DA, Anthony RM, Eichtinger M, et al. Rapid “open-source” engineering of customized zinc-finger nucleases for highly efficient gene modification. Mol Cell. 2008 Jul 25; 31 (2): 294301. doi: 10.1016/j.molcel.2008.06.016.
38. Carroll D. Genome engineering with zinc-finger nucleases.
Genetics. 2011 Aug; 188 (4): 773-82. doi: 10.1534/ genetics.111.131433.
39. Epinat JC, Arnould S, Chames P, Rochaix P, Desfontaines D, Puzin C, et al. A novel engineered meganuclease induces homologous recombination in yeast and mammalian cells. Nucleic Acids Res. 2003 Jun 1; 31 (11): 2952-62. doi: 10.1093/ nar/gkg375.
40. Boch J. TALEs of genome targeting. Nat Biotechnol. 2011 Feb; 29 (2): 135-6. doi: 10.1038/nbt.1767.
41. Mali P, Esvelt KM, Church GM. Cas9 as a versatile tool for engineering biology. Nat Methods. 2013 Oct; 10 (10): 957-63. doi: 10.1038/nmeth.2649.
42. Boissel S, Jarjour J, Astrakhan A, Adey A, Gouble A, Duchateau P, et al. megaTALs: a rare-cleaving nuclease architecture for therapeutic genome engineering. Nucleic Acids Res. 2014 Feb; 42 (4): 2591-601. doi: 10.1093/nar/gkt1224.
43. Certo MT, Gwiazda KS, Kuhar R, Sather B, Curinga G, Mandt T, et al. Coupling endonucleases with DNA end-processing enzymes to drive gene disruption. Nat Methods. 2012 Oct; 9 (10): 973-5. doi: 10.1038/nmeth.2177.
44. Delacöte F, Perez C, Guyot V, Duhamel M, Rochon C, Ollivier N, et al. High frequency targeted mutagenesis using engineered endonucleases and DNA-end processing enzymes. PLoS One. 2013; 8 (1): e53217. doi: 10.1371/journal.pone.0053217.
45. Doudna JA, Charpentier E. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28; 346 (6213): 1258096. doi: 10.1126/science.1258096
46. Nemudriy AA, Valetdinova KR, Medvedev SP, Zakiyan SM. Sistemy redaktirovaniya genomov TALEN i CRISPR/Cas — instrumenty otkrytiy. Acta naturae. 2014; vol. 6, 3 (22): 20-41.
47. Yin H, Kanasty RL, Eltoukhy AA, Vegas AJ, Dorkin JR, Anderson DG. Non-viral vectors for gene-based therapy. Nat Rev Genet. 2014 Aug; 15 (8): 541-55. doi: 10.1038/nrg3763. Epub 2014 Jul 15.
48. Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A. 1996 Feb 6; 93 (3): 1156-60.
49. Pattanayak V, Ramirez CL, Joung JK, Liu DR. Revealing OffTarget Cleavage Specificities of Zinc Finger Nucleases by in Vitro Selection. Nat Methods, 2011 Aug 7; 8 (9): 765-70. doi: 10.1038/ nmeth.1670.
50. Wood AJ, Lo TW, Zeitler B, Pickle CS, Ralston EJ, Lee AH, et al. Targeted Genome Editing Across Species Using ZFNs and TALENs. Science. 2011 Jul 15; 333 (6040): 307. doi: 10.1126/ science.1207773.
51. Boch J, Scholze H, Schornack S, Landgraf A, Hahn S, Kay S, et al. Breaking the Code of DNA Binding Specificity of TALType III Effectors. Science. 2009 Dec 11; 326 (5959): 1509-12. doi: 10.1126/science.1178811.
52. Moscou MJ, Bogdanove AJ. A Simple Cipher Governs DNA Recognition by TAL Effectors. Science. 2009 Dec 11; 326 (5959): 1501. Bibcode:2009Sci…326.1501M. doi:10.1126/ science.1178817. PMID 19933106.
53. Horvath P, Barrangou R (January 2010). “CRISPR/Cas, the immune system of bacteria and archaea”. Science 327 (5962): 167-70. doi: 10.1126/Science.1179555.
54. Swarts DC, Mosterd C, van Passel MW, Brouns SJ. CRISPR interference directs strand specific spacer acquisition. PloS One. 2012; 7 (4): e35888. doi: 10.1371/journal.pone.0035888.
55. Boroviak K, Doe B, Banerjee R, Yang F, Bradley A. Chromosome engineering in zygotes with CRISPR/Cas9. Genesis. 2016 Feb; 54 (2): 78-85. doi: 10.1002/dvg.22915. Epub 2016 Jan 25.
56. Yin H, Song CQ, Dorkin JR, Zhu LJ, Li Y, Wu Q, et al. Therapeutic genome editing by combined viral and non-viral delivery of CRISPR system components in vivo. Nat Biotechnol. 2016 Mar; 34 (3): 328-33. doi: 10.1038/nbt.3471. Epub 2016 Feb 1.
57. End of chemotherapy within 20 years as pioneering DNA project launched. The Daily Telegraph, 01.08.2014
58. Zhu W, Xie K, Xu Y, Wang L, Chen K, Zhang L, Fang J. CRISPR/ Cas9 produces anti-hepatitis B virus effect in hepatoma cells and transgenic mouse. Virus Res. 2016 Jun 2; 217: 125-32. doi: 10.1016/j.virusres.2016.04.003. Epub 2016 Apr 2.
59. Hung SS, McCaughey T, Swann O, Pebay A, Hewitt AW. Genome
engineering in ophthalmology: Application of CRISPR/Cas to the treatment of eye disease. Prog Retin Eye Res. 2016 Jun; 53; 1-20. doi: 10.1016/j.preteyeres.2016.05.001. [Epub ahead of print].
60. Bassuk AG, Zheng A, Li Y, Tsang SH, Mahajan VB. Precision Medicine: Genetic Repair of Retinitis Pigmentosa in Patient-Derived Stem Cells. Sci Rep. 2016 Jan 27; 6:19969. doi: 10.1038/ srep19969.
61. Nafissi N, Foldvari M. Neuroprotective therapies in glaucoma: II. Genetic nanotechnology tools. Front Neurosci. 2015 Oct 14; 9: 355. doi: 10.3389/fnins.2015.00355.
62. Li Y, Chan L, Nguyen HV, Tsang SH. Personalized Medicine: Cell and Gene Therapy Based on Patient-Specific iPSC-Derived Retinal Pigment Epithelium Cells. Adv Exp Med Biol. 2016; 854: 549-55. doi: 10.1007/978-3-319-17121-0_73
63. Wu WH, Tsai YT, Justus S, Lee T, Zhang L, Lin CS, et al. CRISPR repair reveals causative mutation in a preclinical model of retinitis pigmentosa. Mol Ther. 2016 May 20. doi: 10.1038/mt.2016.107. [Epub ahead of print].
64. Mendell JR, Rodino-Klapac LR. Duchenne muscular dystrophy: CRISPR/Cas9 treatment. Cell Res. 2016 May; 26 (5): 513-4. doi: 10.1038/cr.2016.28. Epub 2016 Mar 1.
65. Himeda CL, Jones TI, Jones PL. Scalpel or Straitjacket: CRISPR/ Cas9 Approaches for Muscular Dystrophies. Trends Pharmacol Sci. 2016 Apr; 37 (4): 249-51. doi: 10.1016/j.tips.2016.02.001. Epub 2016 Feb 22.
66. Iyombe-Engembe JP, Ouellet DL, Barbeau X, Rousseau J, Chapdelaine P, Lagüe P, Tremblay JP. Efficient Restoration of the Dystrophin Gene Reading Frame and Protein Structure in DMD Myoblasts Using the CinDel Method. Mol Ther Nucleic Acids. 2016 Jan 26; 5: e283. doi: 10.1038/mtna.2015.58.
67. Maggio I, Stefanucci L, Janssen JM, Liu J, Chen X, Mouly V, Gongalves MA. Selection-free gene repair after adenoviral vector transduction of designer nucleases: rescue of dystrophin synthesis in DMD muscle cell populations. Nucleic Acids Res. 2016 Feb 18; 44 (3): 1449-70. doi: 10.1093/nar/gkv1540. Epub 2016 Jan 13.
68. Kawecka K, Theodoulides M, Hasoglu Y, Jarmin S, Kymalainen H, Le-Heron A, et al. Adeno-Associated Virus (AAV) Mediated Dystrophin Gene Transfer Studies and Exon Skipping Strategies for Duchenne Muscular Dystrophy (DMD). Curr Gene Ther. 2015; 15 (4): 395-415.
69. Ousterout DG, Kabadi AM, Thakore PI, Majoros WH, Reddy TE, Gersbach CA. Multiplex CRISPR/Cas9-based genome editing for correction of dystrophin mutations that cause Duchenne muscular dystrophy. Nat Commun. 2015 Feb 18; 6: 6244. doi: 10.1038/ ncomms7244.
70. Ousterout DG, Kabadi AM, Thakore PI, Perez-Pinera P, Brown MT, Majoros WH, et al. Correction of dystrophin expression in cells from Duchenne muscular dystrophy patients through genomic excision of exon 51 by zinc finger nucleases. Mol Ther. 2015 Mar; 23 (3): 523-32. doi: 10.1038/mt.2014.234. Epub 2014 Dec 10.
71. Maggio I, Chen X, Gongalves MA. The emerging role of viral vectors as vehicles for DMD gene editing. Genome Med. 2016 May 23; 8 (1): 59. doi: 10.1186/s13073-016-0316-x.
72. Reardon S. Gene-editing method tackles HIV in first clinical test. Nature. 2014 Mar 05. doi: 10.1038/nature.2014.14813.
73. Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G, et al. Gene Editing of CCR5 in Autologous CD4 T Cells of Persons Infected with HIV. N Engl J Med. 2014 Mar 6; 370 (10): 901-10. doi: 10.1056/NEJMoa1300662.
74. Kaminski R, Bella R, Yin C, Otte J, Ferrante P, Gendelman HE, et al. Excision of HIV-1 DNA by gene editing: a proof-of-concept in vivo study. Gene Ther. 2016 May 19. doi: 10.1038/gt.2016.41. [Epub ahead of print].
75. Ueda S, Ebina H, Kanemura Y, Misawa N, Koyanagi Y. Insufficient anti-HIV-1 potency of the CRISPR/Cas9 system for full viral replication. Microbiol Immunol. 2016 Jun 9. doi: 10.1111/13480421.12395. [Epub ahead of print].
76. Stone D, Niyonzima N, Jerome KR. Genome editing and the next generation of antiviral therapy. Hum Genet. 2016 Jun 8. [Epub ahead of print].
77. Pernet O, Yadav SS, An DS. Stem cell-based therapies for
HIV/AIDS. Adv Drug Deliv Rev. 2016 May 2. pii: S0169-409X(16)30137-5. doi: 10.1016/j.addr.2016.04.027. [Epub ahead of print].
78. Kim M, Siliciano RR Genome editing for clinical HIV isolates. Nat Biotechnol. 2016 Apr 7; 34 (4): 388-9. doi: 10.1038/nbt.3531.
79. Wang CX, Cannon PM. The clinical applications of genome editing in HIV. Blood. 2016 May 26; 127 (21): 2546-52. doi: 10.1182/ blood-2016-01-678144. Epub 2016 Apr 6.
80. Wang Z, Pan Q, Gendron P, Zhu W, Guo F, Cen S, et al. CRISPR/ Cas9-Derived Mutations Both Inhibit HIV-1 Replication and Accelerate Viral Escape. Cell Rep. 2016 Apr 19; 15 (3): 481-9. doi: 10.1016/j.celrep.2016.03.042. Epub 2016 Apr 7.
81. Wang G, Zhao N, Berkhout B, Das AT. CRISPR-Cas9 Can Inhibit HIV-1 Replication but NHEJ Repair Facilitates Virus Escape. Mol Ther. 2016 Mar; 24 (3): 522-6. doi: 10.1038/mt.2016.24. Epub 2016 Jan 22.
82. Kaminski R, Chen Y, Fischer T, Tedaldi E, Napoli A, Zhang Yet al. Elimination of HIV-1 Genomes from Human T-lymphoid Cells by CRISPR/Cas9 Gene Editing. Sci Rep. 2016 Mar 4; 6: 22555. doi: 10.1038/srep22555.
83. Momaya A, Fawal M, Estes R. Performance-enhancing substances in sports: a review of the literature. Sports Med. 2015 Apr; 45 (4): 517-31. doi: 10.1007/s40279-015-0308-9.
84. World Anti-Doping Agency. The World Anti-Doping Code: The 2015 Prohibited List of International Standards. Montreal
(Quebec); 2014 Sep 20. 10 p.
85. Adis Insight [Internet]. Cham (Switzerland): Springer International Publishing AG; [cited 2016 Jun]. Drug Profile: Erythropoietin gene therapy — Oxford BioMedica. Available from: http://adisinsight. springer.com/drugs/800017416.
86. Barry P. Finding the golden genes. Science News. 2008 Jul 18.
87. Miah A. Genetically Modified Athletes: Biomedical Ethics, Gene Doping and Sport. London; New York: Routledge; 2004. 208 p.
88. Regalado A. Engineering the Perfect Baby. MIT Technology Review. 2015 Mar 5.
89. Parens E, Knowles LP. Reprogenetics and public policy. Reflections and recommendations. Hastings Cent Rep. 2003 Jul-Aug; 33 (4): S1-24.
90. Pray L. Embryo screening and the ethics of human genetic engineering. Nature Education. 2008; 1 (1): 207.
91. Ahmetov II, Egorova ES, Gabdrakhmanova LJ, Fedotovskaya ON. Genes and Athletic Performance: An Update. Med Sport Sci. 2016; 61: 41-54. doi: 10.1159/000445240. Epub 2016 Jun 10.
92. Baltimore D, Berg P, Botchan M, Carroll D, Charo RA, Church G, et al. A prudent path forward for genomic engineering and germline gene modification. Science. 2015 Apr 3; 348 (6230): 36-3. doi: 10.1126/science.aab1028.
93. Knapton S. British scientists granted permission to genetically modify human embryos. The Daily Telegraph. 2016 Feb 1.
Биоинженерия — что это такое? Что можно сделать с генами сегодня и каковы перспективы у генетической модификации человека? Насколько этично вмешиваться в геном?
MedAboutMe предлагает поговорить на темы, вызывающие жаркие дискуссии среди ученых.
Ребёнок с подправленными генами: сверхчеловек или биоробот?
Наследственные заболевания — одна из бед человечества. Многие из них неизлечимы, а порой и смертельны. Небольшое нарушение в ДНК — и ребёнок рождается больным или нежизнеспособным.
Хорошо было бы уметь исправлять эти поломки, правда? А заодно подправлять гены так, чтобы малыш обладал большей устойчивостью к другим болезням. А если бы еще научиться программировать его внешность, интеллект, таланты, характер…
Так и до расы сверхлюдей недалеко. Прекрасная перспектива для человечества, не правда ли?
Но вот только у многих эта перспектива вызывает не радость, а неприятный холодок где-то в подсознании. Сверхчеловек, говорите? Совершенный, идеальный… а несовершенным куда деваться? Вымирать тихонько на задворках?
Но пока беспокоиться рано, ведь наука только недавно начала пытаться освоить методы генетической модификации человеческих эмбрионов. Давайте посмотрим, что уже умеют делать ученые, и взвесим плюсы и минусы генной инженерии в приложении к человеку, а не к какой-нибудь там капусте или персикам.
Наследственные болезни и устойчивость организма к инфекциям: первые шаги
В ноябре 2018 года в СМИ появилось сообщение о том, что в Китае родились первые дети с модифицированным геномом. Близняшки Нана и Лулу подверглись на стадии эмбрионов некоторому вмешательству генетиков, в результате чего приобрели врожденный иммунитет к ВИЧ. О рождении генно-модифицированных девочек заявил известный генетик Хэ Цзянкуй из Шэньчжэньского университета.
Правда, официального подтверждения появления ГМО-близняшек пока нет. Их никто не видел, так как, по словам Хэ, родители настаивают на анонимности. Клиника, в которой Хэ якобы проводил работу, также не подтвердила факта рождения детей с модифицированными генами. Не опубликовано и результатов эксперимента, чтобы научное сообщество могло ознакомиться с ним более детально. По некоторым сведениям, ведущие научные издания, в числе которых авторитетные и известные Science и Nature, отказались публиковать результаты работы китайских исследователей по этическим соображениям.
Тем не менее набор супружеских пар для проведения эксперимента действительно проводился в Шэньчженьском университете. Целью являлось получение эмбрионов, устойчивых к заражению ВИЧ. Известно, что люди, у которых в ДНК отсутствует небольшой участок, обозначаемый как CCR5, невосприимчивы к этой опасной инфекции. Ученые намеревались удалить этот участок из ДНК методами генной инженерии на ранних стадиях развития эмбрионов.
В Китае проводились и другие попытки «редактирования» генома: в университете Сунь Ят Сена генетики пытались исправить гены, отвечающие за развитие у человека наследственной болезни под названием «бета-талассемия». Для этого использовалась разработанная несколько лет назад технология CRISPR/Cas9. Чтобы не вдаваться в дебри молекулярной генетики, суть этого метода можно описать как copy-paste, «вырезать-вставить». Белок Cas9 разрезает в нужном месте ДНК, а специальная РНК (которую ученые научились синтезировать уже довольно давно) определяет и само место, и то, что нужно вставить в разрез. За основу технологии CRISPR/Cas9 была взята система борьбы с вирусами, которой обладали некоторые бактерии. Работает метод просто и считается, что довольно надежно.
Но из 86 эмбрионов удалось получить всего 4 правильно «исправленных». По крайней мере, на заданном участке. А в других местах большой молекулы? Все ли в порядке осталось там?
Именно этот вопрос и не дает покоя тем, кто пытается заглянуть в будущее чуть дальше завтрашнего дня. Ведь все потомки генетически модифицированного ребёнка получат ДНК с изменениями. И неизвестно еще, к каким последствиям это может привести через поколение-другое…
Родители детей с наследственными болезнями очень надеются, что наука сможет однажды помочь тем, в чьих генах имеются поврежденные участки, вызывающие недуг. Но не повредит ли генная модификация другим участкам ДНК?
С растениями и животными проще: из множества полученных результатов можно просто выбрать самые удачные, а остальные уничтожить. С человеческим эмбрионом так обращаться нельзя, ведь для родителей он может быть единственным и неповторимым, драгоценным, уникальным.
Именно поэтому во многих странах генетическое редактирование генома человека запрещено законом.
Этика в генетике
Генетические модификации всегда вызывали споры. Допустимо ли вмешиваться в основу основ, обладая лишь начальными, по сути, познаниями и энтузиазмом? Особенно, когда речь идет о человеке…
Многие страны приняли законы, ограничивающие или запрещающие генную модификацию человеческого генома. В США, например, государство не поддерживает подобных исследований, даже заявки на них не рассматриваются. Но в частных лабораториях ученые могут работать над этими вопросами, с привлечением частных же инвестиций. Недавно был принят закон в Великобритании, разрешающий проведение исследований в данной области, и это до сих пор вызывает споры в британском научном сообществе.
Что же беспокоит ученых, философов и правозащитников?
В первую очередь, отсутствие четкого международного законодательства, регулирующего работы с геномом человека. Многие ученые уверены, что клинические эксперименты с человеческими генами должны быть запрещены, пока не будут хорошо изучены последствия вмешательства. Другие, хотя и соглашаются с необходимостью регулирования, не верят в действенность запретов. «Те, кто захочет заниматься генным модифицированием, обойдут запреты и ограничительные законы и правила. И будет лучше, если исследования будут вестись открыто» — говорят они.
С этической точки зрения вопросов еще больше. Первым встает туманный призрак евгеники — учения сэра Гальтона об улучшении человеческой природы. За ним маячит воспоминание о расовых чистках германских нацистов и их попытках вывести людей особенной породы — истинных арийцев, «белокурых бестий».
Ведь, если станет возможным исключить генетические болезни, сделать потомство более здоровым, то, наверное, можно будет изменить и другие черты? Обеспечить детям высокий интеллект, особенные физические параметры, определенные черты характера, сделать их более «качественными». Сверхлюдьми. По сравнению с которыми все остальные станут… кем? Существами второго сорта, не способными конкурировать с представителями «улучшенной породы»?
А сохранится ли у ГМО-потомства то, что мы называем человечностью? Если личность определяет имеющийся набор генов, то его изменение не повлечет ли за собой и изменение сущности человека?
Кроме того, не будут ли нарушены права того ребёнка, который родится с измененным геномом, ведь его согласия на «редактирование» генов никто не спрашивает?
Всемирно известный ученый Стивен Хокинг, сам страдавший всю жизнь от неизлечимого заболевания, считал, что одной из вероятных причин «Конца света» может стать появление расы сверхлюдей. И многие с ним согласны.
Но другие ученые полагают вполне допустимым редактирование человеческого генома с целью устранения серьезных наследственных заболеваний и соглашаются только с тем, что недопустимы попытки усовершенствования генома для создания потомства с «улучшенными характеристиками». Правда, грань между лечением и улучшением очень зыбкая и допускает множество разночтений.
Вопросов пока гораздо больше, чем ответов. Станет ли человечество здоровее, избавившись от ряда наследственных болезней, или начнет распадаться на расы «улучшенных» людей с определенной специализацией? Покажет время.
Комментарий эксперта
Кэти Ниакан, биолог, первой получила разрешение на работу с геномом человека
Вокруг нашей работы слишком много ажиотажа. Речи пока не идет о внесении в геном каких-либо серьезных изменений. Мы находимся на этапе, когда хотим для начала понять, что нужно для развития эмбриона в нормального ребёнка с хорошим здоровьем, какие гены участвуют в этом процессе, почему происходят выкидыши, и почему некоторые пары остаются бесплодными. Необходимо хорошо изучить самые ранние стадии развития человеческого эмбриона. Это поможет, в частности, увеличить процент успешности процедуры ЭКО.
Мы будем работать с эмбрионами не более чем семидневного возраста, пожертвованными для исследований добровольцами. По истечении 7 дней после оплодотворения зародыши будут уничтожены.
Комментарий эксперта
Марси Дарновски, директор некоммерческой организации Center for Genetics and Society
Генетическая природа человека изучена еще слишком мало, чтобы можно было предвидеть последствия генных модификаций, даже если они совершаются с самыми благими целями. Подправив один участок, можно повредить другой, и неизвестно, к чему это приведет в будущем.
Родителей, мечтающих «дать детям самое лучшее», и имеющих для этого материальные возможности, всегда хватает. Такие родители с легкостью могут согласиться платить за внесение «улучшений» в гены своего потомства, а спрос всегда рождает предложение. И представьте, что станет с обществом, и без того неоднородным, если в нем начнут массово появляться «дизайнерские дети». Мы просто откроем двери к еще одной разновидности дискриминации по признаку «правильной» и «неправильной» генетики.
Комментарий эксперта
Альта Чаро, профессор права и биоэтики
Пока нам неизвестно, могут ли преимущества редактирования генома превысить сопутствующие риски. В любом случае, попытки «улучшить» гены будут доступны немногим, а это несправедливо. Совершенно правильно, что сегодня в США законодательно запрещены попытки дать жизнь эмбрионам с исправленной генетикой.
Акушерство / Под ред. Савельевой Г.М. – 2000
Пропедевтика внутренних болезней / Мухин Н.А., Моисеев В.С. – 2008