Запрос «Периодическая система» перенаправляется сюда; см. также другие значения.

Периодическая таблица химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году и установившего зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы).
Первоначальный вариант был разработан Д. И. Менделеевым в 1869 и приведён к традиционному графическому виду в 1871 году. Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитические кривые, таблицы, геометрические фигуры и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
История открытия[править | править код]
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Иоганн Дёберейнер опубликовал найденный им «закон триад»: атомная масса многих элементов приблизительно равна среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который создал «Теллуров винт», разместив элементы на винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Эти модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии было предпринято ещё несколько попыток систематизации химических элементов, и ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Однако главное отличие его модели заключалось в том, что за основу периодичности была взята валентность, которая не является единственной и постоянной для отдельно взятого элемента, и поэтому такая таблица не могла претендовать на полноценное описание физики элементов и не отражала периодического закона.

По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»[2].
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим[3].

Д. И. Менделеев. Рукопись «Опыта системы элементов, основанной на их атомном весе и химическом сходстве». 17 февраля 1869 года (1 марта 1869 года)
В результате раскладывания этого «химического пасьянса», 17 февраля (1 марта) 1869 года был завершён самый первый целостный вариант Периодической системы химических элементов, который получил название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»[4], в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). Эта дата знаменует собой открытие Менделеевым Периодического закона, но правильнее считать эту дату началом открытия.
Согласно окончательной хронологии первых публикаций Таблицы Менделеева[5], впервые Таблица была опубликована 14-15 марта (26-27 марта) 1869 года в 1-м издании учебника Менделеева «Основы Химии» (ч. 1, вып. 2). И уже после этого, осознав во время двухнедельной поездки по провинции великое значение своего открытия, Менделеев по возвращении в Петербург заказал в середине марта в типографии «Общественная польза» отдельные листки с этой таблицей, которые были напечатаны 17 марта (29 марта) 1869 года специально для рассылки «многим химикам». Позднее, в начале мая 1869 года, «Опыт системы элементов» был напечатан с химическим обоснованием в программной статье Менделеева «Соотношение свойств с атомным весом элементов»[6] (журнал Русского химического общества).
В Европе Таблица Менделеева стала известна в апреле 1869 года: первая публикация Таблицы Менделеева в международной печати, согласно точной хронологии[5], вышла в свет 5 апреля (17 апреля) 1869 года в лейпцигском «Журнале практической химии»[7] и стала достоянием мировой науки.
И только спустя более чем полгода, в декабре 1869 года, выходит работа немецкого химика Мейера, который изменил своё решение в пользу мысли Д. И. Менделеева и в зарубежной литературе считается либо «одним из первооткрывателей», либо «независимо от Менделеева опубликовавшим этот периодический закон». Однако этот вывод тенденциозен: Л. Мейер в своих исследованиях не пошёл дальше расстановки части (28 из 63) открытых на тот момент элементов в сплошной ряд и периодического закона не формулировал вообще, в то время как Д. И. Менделеев в своей таблице оставил несколько свободных мест и предсказал ряд фундаментальных свойств ещё не открытых элементов и само их существование, а также свойства их соединений (экабор, экаалюминий, экасилиций, экамарганец — соответственно, скандий, галлий, германий, технеций). Некоторые элементы, а именно, бериллий, индий, уран, торий, церий, титан, иттрий, имели на момент работы Менделеева над Периодическим законом неправильно определённый атомный вес, и поэтому Менделеев исправил их атомные веса на основании открытого им закона. Этого не могли сделать ни Деберейнер, ни Мейер, ни Ньюлендс, ни де Шанкуртуа.
В 1871 году Менделеев в «Основах химии» (ч. 2, вып. 2) публикует второй вариант Периодической системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы[прояснить] элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, их свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото — на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было в том, что основой для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев предпринял очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), существование которых, опираясь на периодическую систему, предсказал Менделеев и с поразительной точностью описал целый ряд их физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства. Заряд ядра, который соответствует номеру элемента в периодической системе, назван числом Менделеева.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году с синтезом 118 элемента седьмой период периодической системы был завершён. Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии[8].
В период с 2003 по 2009 год ИЮПАК утвердил 113-й химический элемент, открытый специалистами японского института естественных наук «Рикэн». 28 ноября 2016 года новый элемент получил название нихоний (Nh)[9]. В тот же день элементы 115 и 117 получили названия московий (Mc) и теннессин (Ts)[9] по предложениям ОИЯИ, Национальной лаборатории Ок-Ридж, Университета Вандербильта и Ливерморской национальной лаборатории в США. Тогда же 118-й элемент получил название оганесон (Og)[9], в честь профессора Юрия Оганесяна, внёсшего вклад в исследования сверхтяжёлых элементов. Наименование было предложено коллективами Объединенного института ядерных исследований и Ливерморской национальной лаборатории[10].
Структура[править | править код]
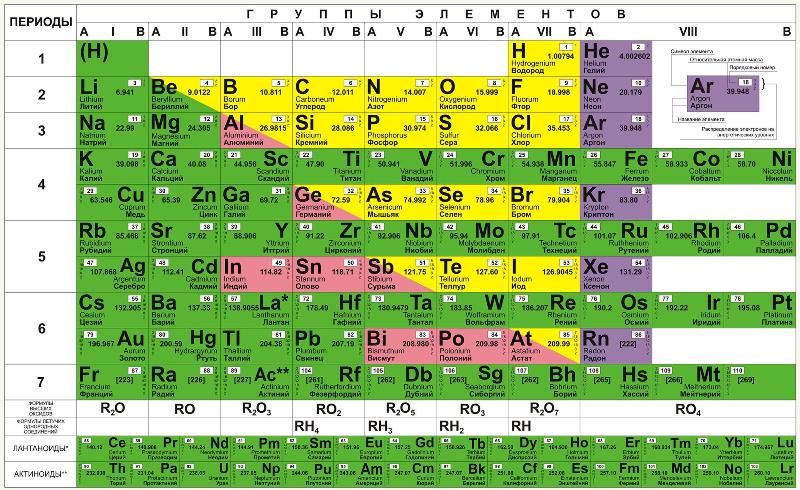
Наиболее распространёнными являются три формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород иногда помещают в 7-ю («короткая» форма) или 17-ю («длинная» форма) группу таблицы[11][12].
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного.
| Группа → Период ↓ |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 | 3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 | 11 Na Натрий |
12 Mg Магний |
13 Al Алюми- ний |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 | 19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 | 37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
43 Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 | 55 Cs Цезий |
56 Ba Барий |
* | 72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
84 Po Полоний |
85 At Астат |
86 Rn Радон |
| 7 | 87 Fr Франций |
88 Ra Радий |
** | 104 Rf Резер- фордий |
105 Db Дубний |
106 Sg Сиборгий |
107 Bh Борий |
108 Hs Хассий |
109 Mt Мейтне- рий |
110 Ds Дармшта- дтий |
111 Rg Рентге- ний |
112 Cn Копер- ниций |
113 Nh Нихоний |
114 Fl Флеровий |
115 Mc Московий |
116 Lv Ливермо- рий |
117 Ts Теннессин |
118 Og Оганесон |
| Лантаноиды * | 57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
61 Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадоли- ний |
65 Tb Тербий |
66 Dy Диспро- зий |
67 Ho Гольмий |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** | 89 Ac Актиний |
90 Th Торий |
91 Pa Протак- тиний |
92 U Уран |
93 Np Нептуний |
94 Pu Плутоний |
95 Am Америций |
96 Cm Кюрий |
97 Bk Берклий |
98 Cf Калифор- ний |
99 Es Эйнштей- ний |
100 Fm Фермий |
101 Md Менделе- вий |
102 No Нобелий |
103 Lr Лоурен- сий |
|
п • о • р Семейства химических элементов |
|||
|---|---|---|---|
| Щелочные металлы | Галогены | ||
| Щёлочноземельные металлы | Благородные газы | ||
| Переходные металлы | Лантаноиды | ||
| Постпереходные металлы | Актиноиды | ||
| Полуметаллы — металлоиды | Суперактиноиды | ||
| Другие неметаллы |
На 2022 год известны все элементы первых семи периодов таблицы; самым тяжёлым из известных элементов является оганесон (18 группа, 7 период) с атомным номером 118. Предсказано существование гипотетических сверхтяжёлых элементов с номерами от 119 и далее, которым присвоены вре́менные систематические названия: унуненний, унбинилий, унбиуний, унбибий, унбитрий, унбиквадий, унбипентий, унбигексий и т.д. Предпринимаются попытки синтезировать некоторые из этих элементов, однако ни один элемент восьмого периода пока достоверно не наблюдался.
Короткая форма таблицы, содержащая восемь групп элементов[13], была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткую форму продолжают приводить во всех школьных учебниках по химии и во всех школьных химических кабинетах, в большом числе российских справочников и пособий и после 1989 года[14]. Из современной иностранной литературы короткая форма исключена полностью, а вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации[15].
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильс Бор разрабатывал лестничную (пирамидальную) форму периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона[16][17]. Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты[18], в том числе объёмные[19].
Группы[править | править код]
Группа, или семейство — одна из колонок периодической таблицы. Для групп, как правило, характерны более выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках[20]. Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа[21]. Впрочем, в некоторых областях таблицы, например, в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные[22][23][24].
В соответствии с международной системой именования группам присваиваются номера от 1-го до 18-го в направлении слева направо — от щелочных металлов к благородным газам[25]. Ранее для их идентификации использовались римские цифры. В американской практике после римских цифр ставилась также литера А (если группа располагалась в s-блоке или p-блоке) или B (если группа находилась в d-блоке). Применявшиеся тогда идентификаторы соответствуют последней цифре современных численных указателей. К примеру, элементам группы 4 соответствовало наименование IVB, а тем, которые ныне известны как группа 14 — IVA. Похожая система использовалась и в Европе, за тем исключением, что литера А относилась к группам, до десятой включительно, а В — к группам после десятой включительно. Группы 8, 9 и 10, кроме того, часто рассматривались как одна тройная группа с идентификатором VIII. В 1988 году в действие вступила новая система нотации ИЮПАК, и прежние наименования групп вышли из употребления[26].
Некоторым из этих групп были присвоены тривиальные, несистематические названия (например, «щёлочноземельные металлы», «галогены» и т. п.); впрочем, некоторые из них используются редко. Группы с третьей по четырнадцатую включительно такими именами не располагают, и их идентифицируют либо по номеру, либо по наименованию первого представителя («титановая», «кобальтовая» и так далее), поскольку они демонстрируют меньшую степень сходства между собой или меньшее соответствие вертикальным закономерностям[25].
Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу, энергии ионизации и электроотрицательности. По направлению сверху вниз в рамках группы радиус атома возрастает (чем больше у него заполненных энергетических уровней, тем дальше от ядра располагаются валентные электроны), а энергия ионизации снижается (связи в атоме ослабевают, и, следовательно, изъять электрон становится проще), равно как и электроотрицательность (что, в свою очередь, также обусловлено возрастанием дистанции между валентными электронами и ядром)[27]. Случаются, впрочем, и исключения из этих закономерностей — к примеру, в группе 11 по направлению сверху вниз электроотрицательность возрастает, а не убывает[28].
Периоды[править | править код]
Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов[29].
В рамках периода элементы демонстрируют определённые закономерности во всех трёх названных выше аспектах (атомный радиус, энергия ионизации и электроотрицательность), а также в энергии сродства к электрону. В направлении «слева направо» атомный радиус обычно сокращается (в силу того, что у каждого последующего элемента увеличивается количество заряженных частиц, и электроны притягиваются ближе к ядру[30]), и параллельно с ним возрастает энергия ионизации (чем сильнее связь в атоме, тем больше энергии требуется на изъятие электрона). Соответствующим образом увеличивается и электроотрицательность[27]. Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой, соответственно, большим — за исключением благородных газов[31].
Блоки[править | править код]

Блоковая диаграмма периодической таблицы
Ввиду значимости внешней электронной оболочки атома различные области периодической таблицы иногда описываются как блоки, именуемые в соответствии с тем, на какой оболочке находится последний электрон[32]. S-блок включает первые две группы, то есть щелочные и щёлочноземельные металлы, а также водород и гелий; p-блок состоит из последних шести групп (с 13-й по 18-ю, согласно стандарту именования ИЮПАК, или с IIIA до VIIIA — по американской системе) и включает, помимо других элементов, все металлоиды. D-блок — это группы с 3-й по 12-ю (ИЮПАК), они же — с IIIB до IIB (американская система), в которые входят все переходные металлы. F-блок, выносимый обычно за пределы таблицы, состоит из лантаноидов и актиноидов[33].
Другие периодические закономерности[править | править код]

Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов:
- Электронная конфигурация. Организация электронов демонстрирует определённый повторяющийся периодический образец. Электроны занимают последовательность оболочек, которые идентифицируются числами (оболочка 1, оболочка 2 и т. д.), а те, в свою очередь, состоят из подуровней, определяемых литерами s, p, d, f и g. По мере увеличения атомного числа электроны постепенно заполняют эти оболочки; каждый раз, когда электрон впервые занимает новую оболочку, начинается новый период в таблице. Сходства в электронной конфигурации обусловливают подобие свойств элементов (наблюдение за которыми, собственно, и привело к открытию периодического закона)[34][35].
- Металличность / неметалличность. По мере снижения показателей энергии ионизации, электроотрицательности и энергии сродства к электрону элементы приобретают черты, характерные для металлов, а по мере их возрастания — напротив, для неметаллов[36]. В соответствии с закономерностями для упомянутых характеристик, наиболее ярко выраженные металлы располагаются в начале периода, а неметаллы — в его конце. В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. Сочетание горизонтальных и вертикальных закономерностей придаёт условной разделительной линии между металлами и неметаллами ступенчатый вид; расположенные вдоль этой линии элементы иногда определяются как металлоиды[37][38].

Свойства элементов. Стрелки указывают на повышение
Значение[править | править код]
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства. Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице[39]. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX веке в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX веке — атомной физики и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер, называемый также числом Менделеева), является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда (группы) — квантовую структуру верхней электронной оболочки, чему элементы группы и обязаны сходством химических свойств.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
По решению ООН 2019 год был объявлен Международным годом Периодической таблицы химических элементов[40].
См. также[править | править код]
- Альтернативные периодические таблицы
- Короткая форма периодической системы элементов
- Периодический закон
Примечания[править | править код]
- ↑ В книге (В. М. Потапов, Г. Н. Хомченко. «Химия». — М., 1982, стр. 26) утверждается, что их более 400.
- ↑ Евсеев, Антон. Мифы, связанные с великим ученым Дмитрием Менделеевым (рус.), Правда.Ру (18 ноября 2011). Архивировано 7 ноября 2017 года. Дата обращения: 4 ноября 2017.
- ↑ Периодический закон: предыстория, открытие, разработка. Музей-архив Д.И. Менделеева. Дата обращения: 1 сентября 2012. Архивировано из оригинала 5 марта 2016 года.
- ↑ Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417.
- ↑ 1 2 Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- ↑ Менделеев, Д. (1869). “Соотношение свойств с атомным весом элементов” [Relationship of properties of the elements to their atomic weights]. Журнал Русского Химического Общества (Journal of the Russian Chemical Society) [рус.]. 1: 60—77. Архивировано из оригинала 2021-02-27. Дата обращения 2020-05-04.
- ↑ Mendeleev, Dmitri (1869). “Versuche eines Systems der Elemente nach ihren Atomgewichten und chemischen Functionen” [System of Elements according to their Atomic Weights and Chemical Functions]. Journal für Praktische Chemie. 106: 251. Архивировано из оригинала 2021-02-26. Дата обращения 2020-05-04.
- ↑ Professor Witek Nazarewicz. Researchers Explore Limits of the Periodic Table of Elements. Sci-News.com (20 июня 2018). Дата обращения: 2 апреля 2019. Архивировано 2 апреля 2019 года.
- ↑ 1 2 3 IUPAC Announces the Names of the Elements 113, 115, 117, and 118 (англ.). ИЮПАК (30 ноября 2016). Дата обращения: 24 октября 2018. Архивировано 29 июля 2018 года.
- ↑ Два новых элемента таблицы Менделеева получили «российские» имена. ИА REGNUM. (1 декабря 2016). Дата обращения: 2 декабря 2016. Архивировано 2 декабря 2016 года.
- ↑ Некрасов Б. В., Основы общей химии, т. 1, 1973, с. 29.
- ↑ Реми Г., Курс неорганической химии, т. 1, 1963, с. 29.
- ↑ Пример Архивная копия от 18 января 2009 на Wayback Machine короткой формы таблицы.
- ↑ Аркадий Курмашин. Полтора века — от таблицы Менделеева к Периодической системе // Наука и жизнь. — 2019. — № 9. — С. 71—80.
- ↑ Сайфуллин Р. С., Сайфуллин А. Р. Новая таблица Менделеева // Химия и жизнь. — 2003. — Вып. 12. — С. 14—17.
- ↑ Например, в 1997 году Б. Ф. Маховым была опубликована книга «Симметричная квантовая Периодическая система элементов», в которой границами горизонтальных рядов, периодов и диад служат элементы со спектральным термом 1s0. Координатами конкретного элемента в таблице принят набор из четырёх квантовых чисел.
- ↑ Трифонов Д. Н. Структура и границы периодической системы. — М.: Атомиздат, 1969. — 271 с.
- ↑ Химики предложили улучшить таблицу Менделеева. Lenta.Ru (7 октября 2009). Дата обращения: 7 октября 2009. Архивировано 12 октября 2009 года.
- ↑ Дудин С. А. Атлас-определитель главных минералов и горных пород. — Екатеринбург: Издательские решения, 2016. — 78 с.
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. The essence of materials for engineers (англ.). — Sudbury, MA: Jones & Bartlett Publishers (англ.) (рус., 2010. — P. 32. — ISBN 0763778338.
- ↑ Bagnall, K. W. (1967), Recent advances in actinide and lanthanide chemistry, in Fields, PR & Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry, vol. 71, American Chemical Society, с. 1–12, DOI 10.1021/ba-1967-0071
- ↑ Day M. C., Selbin J. Theoretical inorganic chemistry (англ.). — 2nd. — New York, MA: Reinhold Book Corporation, 1969. — P. 103. — ISBN 0763778338.
- ↑ Holman J., Hill G. C. Chemistry in context (англ.). — 5th. — Walton-on-Thames: Nelson Thornes, 2000. — P. 40. — ISBN 0174482760.
- ↑ 1 2 Leigh, G. J. Nomenclature of Inorganic Chemistry: Recommendations 1990 (англ.). — Blackwell Science, 1990. — ISBN 0-632-02494-1.
- ↑ Fluck E. New Notations in the Periodic Table (англ.) // Pure Appl. Chem.. — International Union of Pure and Applied Chemistry, 1988. — Vol. 60. — P. 431—436. — doi:10.1351/pac198860030431.
- ↑ 1 2 Moore, p. 111
- ↑ Greenwood, p. 30
- ↑ Stoker, Stephen H. General, organic, and biological chemistry (англ.). — New York: Houghton Mifflin (англ.) (рус., 2007. — P. 68. — ISBN 978-0-618-73063-6.
- ↑ Mascetta, Joseph. Chemistry The Easy Way. — 4th. — New York: Hauppauge, 2003. — С. 50. — ISBN 978-0-7641-1978-1.
- ↑ Kotz, John; Treichel, Paul; Townsend, John. Chemistry and Chemical Reactivity, Volume 2 (англ.). — 7th. — Belmont: Thomson Brooks/Cole, 2009. — P. 324. — ISBN 978-0-495-38712-1.
- ↑ Gray, p. 12
- ↑ Jones, Chris. d- and f-block chemistry. — New York: J. Wiley & Sons, 2002. — С. 2. — ISBN 978-0-471-22476-1.
- ↑ Myers, R. The basics of chemistry. — Westport, CT: Greenwood Publishing Group, 2003. — С. 61—67. — ISBN 0313316643.
- ↑ Chang, Raymond. Chemistry. — 7. — New York: McGraw-Hill Education, 2002. — С. 289—310; 340—42. — ISBN 0-07-112072-6.
- ↑ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. Chemistry. — 2nd. — Harcourt Brace Jovanovich (англ.) (рус., 1975. — С. 58. — ISBN 0-15-506465-7.
- ↑ Sacks, O. Uncle Tungsten: Memories of a chemical boyhood (англ.). — New York: Alfred A. Knopf (англ.) (рус., 2009. — P. 191, 194. — ISBN 0-375-70404-3.
- ↑ Gray, p. 9
- ↑ Крицман В. А., Станцо В. В., Энциклопедический словарь юного химика, 1990, с. 180.
- ↑ Международный год Периодической таблицы химических элементов 2019 г. ЮНЕСКО. Дата обращения: 2 апреля 2019. Архивировано 2 апреля 2019 года.
Литература[править | править код]
- Менделеев Д. И. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1898. — Т. XXIII. — С. 311—323.
- Менделеев Д. И. Попытка химического понимания мирового эфира. СПб., 1905.
- Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. — М.: Просвещение, 1973. — 208 с.
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д. И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Дудин С. А. Атлас-определитель главных минералов и горных пород. — Екатеринбург: Издательские решения, 2016. — 78 с.
- Евдокимов Ю., кандидат химич. наук. К истории периодического закона. Наука и жизнь, № 5 (2009), С. 12—15.
- Крицман В. А., Станцо В. В. Энциклопедический словарь юного химика / Ведущий редактор Минина Т. П. — 2-е изд., испр. — М.: Педагогика, 1990. — 320 с. — (ЭС). — ISBN 5-7155-0292-6.
- Макареня А. А., Рысев Ю. В. Д. И. Менделеев. — М.: Просвещение, 1983. — 128 с.
- Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. — М.: Просвещение, 1969. — 160 с.
- Некрасов Б.В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. 1. — 656 с.
- Реми Г. Курс неорганической химии. — М.: Изд-во иностранной лит-ры, 1963. — Т. 1. — 920 с.
- Scerri E. R. The Periodic Table: Its Story and Its Significance (англ.). — N. Y.: Oxford University Press, 2007. — 368 p. — ISBN 978-0-19-530573-9.
Ссылки[править | править код]
- Периодическая таблица элементов (ноябрь 2016 г.) на сайте IUPAC (pdf) (англ.)
- (web.archive) periodic-tab.com Интерактивная таблица Менделеева
- Основы строения вещества. Глава 5. Структура периодической системы элементов
- Периодическая система элементов (pdf)
- Статья: Филатов Д. В. Вклад европейских учёных в становление и укрепление периодического закона // Химический портал Новосибирска, 2009
Короткая форма периодической системы химических элементов Д. И. Менделеева

Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому творчески мыслящему человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.

Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Великому русскому ученому Дмитрию Ивановичу Менделееву было всего 35 лет, когда в 1869 году он сформулировал периодический закон и создал Периодическую систему химических элементов.
Прообраз таблицы появился в первом издании учебника “Основы химии”, который разрабатывал Менделеев. По мнению историков, именно работа над учебником и заставила его задуматься над природой и взаимосвязью химических элементов и попытаться поместить их в понятную систему.
Об истории создания таблицы Менделеева и о том, почему она, как и закон, называется периодической – в материале РЕН ТВ.
Предыстория появления системы химических элементов
В далеком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем был опубликован научный труд, в котором было развенчано немало мифов об алхимии, и в котором он рассуждал о необходимости поиска неразложимых химических элементов.
Ученый также привел их список, состоящий всего из 15 элементов, но допускал мысль о том, что этот список неполный. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учеными по всему миру.
К середине XIX века было открыто 63 химических элемента и ученые всего мира не раз предпринимали попытки объединить все существовавшие вещества в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию представил химик и музыкант Джон Александр Ньюлендс, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа английского ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.

Фото: © РИА Новости
Как появились периодический закон и таблица химических элементов
Знаменитый русский ученый-энциклопедист Дмитрий Иванович Менделеев впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление.
В результате размышлений Менделеева 1 марта 1869 года был завершен самый первый вариант Периодической системы химических элементов, который получил тогда название “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”.
Как выглядела первая таблица Менделеева
В этом варианте элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов).
1 марта 1869 года знаменует собой открытие Менделеевым периодического закона, но более верным будет считать эту дату началом открытия, поскольку еще требовалось его осмысление и затем – достижение формулировки.
“Опыт системы элементов” был напечатан с химическим обоснованием в программной статье ученого “Соотношение свойств с атомным весом элементов” в “Журнале Русского физико-химического общества”. А уже в апреле 1869 года состоялась первая публикация таблицы Менделеева в международной печати – она вышла в свет в лейпцигском Journal für Practische Chemie (“Журнале практической химии”) и стала достоянием мировой науки.
В том же году эта статья из “Журнала Русского химического общества” была переведена в Zeitschrift für Chemie, а в 1872 году в журнале Annalen der Chemie und Pharmacie была опубликована развернутая статья Менделеева, посвященная его открытию, – Die periodische Gesetzmässigkeit der Elemente (“Периодическая закономерность химических элементов”).
В этой работе, датированной августом 1871 года, Дмитрий Менделеев приводит формулировку периодического закона, которая затем оставалась в силе на протяжении более сорока лет: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса”.
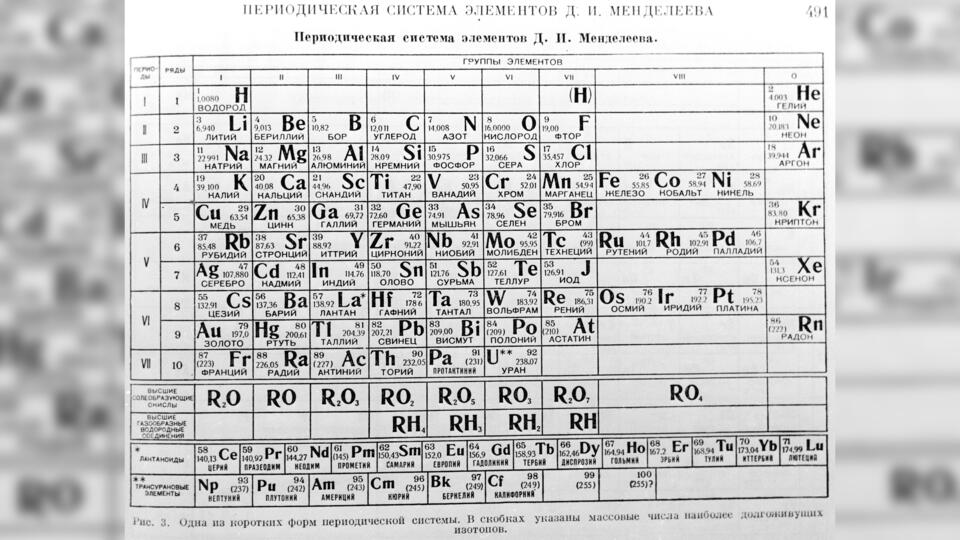
Фото: © РИА Новости/Ю. Астафьев
Почему таблица называется периодической
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов свойства начинают повторяться. Так, калий похож на натрий, фтор – на хлор, а золото схоже с серебром и медью.
Появление новых элементов в таблице Менделеева
Пользуясь периодической системой, Менделеев также предсказал открытие нескольких новых химических элементов и описал их химические и физические свойства. В дальнейшем расчеты ученого полностью подтвердились: галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году) поразительно точно соответствовали тем свойствам, которые описал Менделеев.
Затем прогнозы гениального химика продолжили реализовываться и были открыты еще восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942–1943 годы).
Кстати, в 1900 году Дмитрий Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
На сегодняшний день в Периодической системе химических элементов – 118 элементов. Последний, самый тяжелый из известных, — оганесон (Og), названный так в честь своего первооткрывателя Юрия Цолаковича Оганесяна. Научный руководитель лаборатории ядерных реакций имени Г.Н. Флерова Объединенного института ядерных исследований в Дубне стал четвертым в истории ученым, при жизни которого его именем был назван химический элемент.

Фото: © Фотохроника ТАСС
Организация Периодической системы химических элементов
Химические элементы в таблице Д.И. Менделеева расположены по рядам в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства.
Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий, с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце.
А элементы левого столбца (калий, натрий, литий и т.п.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер.
Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому.
Все элементы вплоть до № 92 встречаются в природе, а с № 93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своем первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему все должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.

Фото: © РИА Новости/Александр Лобов
Самые старые экземпляры таблицы Менделеева
В 2019 году в Сент-Эндрюсском университете Великобритании был обнаружен один из старейших образцов таблицы. Это произошло, когда доктор Алан Айткен наводил порядок в кладовке химического факультета. Факультет переехал в новое помещение в 1968 году, и с тех пор оборудование, реактивы и бумаги пылились в подсобном помещении.
Таблица лежала в кладовке среди кучи разных лабораторных принадлежностей. В какой-то момент Айткен обнаружил свернутые в трубку лекционные материалы по химии, а в них – копию Периодической таблицы химических элементов, возраст которой оценивался в 133–140 лет.
Найденная таблица аннотирована на немецком языке, слева внизу идет надпись Verlag v. Lenoir & Forster, Wien, указывающая на владельца типографии, работавшего в Вене с 1875 по 1888 год. Другая надпись – Lith. von Ant. Hartinger & Sohn, Wien – определяет литографа диаграммы, который умер в 1890 году.
Выяснить, в каком году была напечатана таблица, помогли поиски в университетском архиве. Нашлись данные о покупке таблицы профессором Томасом Пурди – пособие было куплено в октябре 1888 года. Тогда оно стоило 3 немецкие марки.
Восстановление плаката заняло немало времени: поверхность пришлось очистить от грязи и мусора, отделить таблицу от подкладки, на которой та была закреплена, обработать специальными растворами для выравнивания кислотно-щелочного баланса и устранить разрывы с помощью специальной бумаги из бруссонетии бумажной и пасты из пшеничного крахмала.
Теперь таблица находится в специальном хранилище университета, где для нее созданы подходящие условия. На самом же факультете осталась ее полномасштабная копия.
Чуть позже, но в том же 2019 году, сотрудники Санкт-Петербургского университета сообщили о своей сенсационной находке – обнаруженная ими в Большой химической аудитории таблица оказалась на 12 лет старше.
В университете рассказали, что таблица представляет собой демонстрационный вариант, изготовленный в 1876 году. Она отличается от современных вариантов. Например, в ней нет VIII группы, в которую входят инертные (благородные) газы: на момент публикации они еще не были открыты.

Фото: © wikipedia
Как появилась легенда о том, что Менделеев увидел таблицу во сне
Об известном ученом и его открытиях ходило немало баек и легенд. Одна из самых известных гласит, что Менделеев увидел свою таблицу во сне.
Сам Дмитрий Иванович об открытии периодического закона писал так:
“Заподозрив о существовании взаимосвязи между элементами еще в студенческие годы, я не уставал обдумывать эту проблему со всех сторон, собирал материалы, сравнивал и сопоставлял цифры. Наконец настало время, когда проблема созрела, когда решение, казалось, вот-вот готово было сложиться в голове. Как это всегда бывало в моей жизни, предчувствие близкого разрешения мучившего меня вопроса привело меня в возбужденное состояние. В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного за 15 лет материала.
И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне совершенно явственно представилась таблица.
Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги”.
Эта история позже и легла в основу легенды о том, что таблица Менделееву приснилась. Самому ученому такая интерпретация не нравилась.
“Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово”, – говорил он.
Научные открытия, сделанные во сне
Впрочем, история знает и другие примеры, когда ученые мужи не только не отрицали, а даже подчеркивали, что сделали свои открытия во сне.
- Так, немецкому химику Фридриху Августу Кекуле приснилась формула бензольного кольца.
- Датчанин Нильс Бор во сне очутился на Солнце, а вокруг него на огромной скорости вращались планеты. Под впечатлением от этого сновидения Бор создал планетарную модель строения атомов, за которую ему позже вручили Нобелевскую премию.
- А в середине XX века американский ученый Джеймс Уотсон увидел во сне двух переплетающихся змей. Это сновидение помогло ему первым в мире изобразить форму и структуру ДНК.
Переодическая система химических элементов, она же, “Таблица Менделеева”,была представлена самим Дмитрием Менделеевым в 1869 году. Тогда и был распространен миф о том, что якобы, упорядоченная таблица химических элементов пришла ученному химику во сне. Очень часто в консперологических передачах этот миф используется как факт и доказательство чего-то мистического и необъяснимого. И по сей день многие люди думают, что таблица действительно приснилась Дмитрию, но это вовсе не так. Иногда об этом приходилось слышать в уличных компаниях на тему религиозных споров.
И так, в следствии чего все таки родился этот миф?
Дело в том, что это вурсию распространял профессор А.А. Иностранцев, желая позабавить своих студентов. Он рассказывал, будь-то его товарищу Менделееву таблица пришла во сне, где он увидел четко расставленные элементы в том порядке, в котором они должны быть. Студенты в свою очередь пустили эту байку.
Сам, Д.И. Менделеев отрицательно относился к этим слухам, он говорил:
“Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово”.
На самом деле, ученный посветил этому открытию много лет, дней и безсонных дочей. Химические элементы были открыты и до него, но расставить их в правильном порядке и найти закономерности удалось лишь ему. Между неподдающимся закономерности химическими элементами он оставил пустые клетки и предположил, что не все состовляющие этой таблицы были открыты, в чем оказался в точности прав. А ведь до него, никому не приходило в голову оставить пустые места, в следствии и закон раньше выведен не был.
Таблица Менделеева – это одно из величайших открытий, которое изменило мир. Закон Менделеева породил сотни, а может и тысячи открытий связанных с такой наукой, как химия. В том числе и всем известную атомную бомбу, но в этом думаю его винить не стоит. Он одарил этими знаниями мир, а мир уже сам решил, в какую сторону им распорядиться.
Игорь Дмитриев
«Природа» №2, 2019
История открытия периодического закона сложна и таит в себе множество загадок. В статье рассмотрены три из них: как Д. И. Менделеев, не признававший атомную теорию, создал Периодическую систему элементов; почему он не торопился лично доложить о своем открытии научному сообществу; почему спустя год и девять месяцев после открытия периодического закона Менделеев резко изменил тематику своих исследований. Кроме того, в статье приводятся факты, противоречащие распространенной версии, согласно которой периодическая таблица явилась ее автору как озарение во сне.

Об авторе
Игорь Сергеевич Дмитриев — доктор химических наук, директор Музея-архива Д. И. Менделеева Санкт-Петербургского государственного университета. Член правления Санкт-Петербургского отделения Российского химического общества им. Д. И. Менделеева, член History of Science Society (США), член редколлегии журнала «Природа». Автор 150 научных работ, в том числе монографии «Человек эпохи перемен: очерки о Д. И. Менделееве и его времени». Область научных интересов — интеллектуальная революция XVI–XVII вв., история науки в России XVIII — начала XX в.

![]()
Дмитрий Иванович Менделеев был ученым-энциклопедистом. Однако при всем разнообразии его интересов и плодотворных начинаний открытие периодического закона представляется все же главным достижением исследователя. Вместе с тем история этого открытия (как, кстати, и сам Периодический закон) таит в себе множество неясностей и неожиданных поворотов. Назовем их (с известной долей условности) загадками. Кроме того, весьма популярна легенда, будто периодическая таблица явилась Менделееву во сне. Я остановлюсь только на трех загадках, которые можно разъяснить, опираясь на известные факты и дошедшие до нас документы.
Менделеев против атомов
Первая статья Менделеева о периодическом законе начиналась следующими словами: «Систематическое распределение элементов подвергалось в истории нашей науки многим разнообразным превратностям» [1, с. 10]. Это так. Но об одном обстоятельстве Дмитрий Иванович умолчал: проблема «систематического распределения элементов» была для научного сообщества сугубо маргинальной, а то и просто недостойной внимания серьезного ученого. К примеру, когда один из предшественников Менделеева — Джон Ньюлендс (J. Newlands) — представил Лондонскому химическому обществу свой вариант классификации элементов (так называемый закон октав), один из присутствовавших заметил: «А не пытался ли он [Ньюлендс] расположить элементы по алфавиту? Ведь любое расположение их может представлять случайные совпадения (occasional coincidences)» [2, p. 113].

Таким образом, Менделеев взялся за тему, которая в то время не только не представлялась актуальной, но и вызывала насмешки. Иначе и быть не могло, поскольку даже после Первого международного химического конгресса в Карлсруэ (сентябрь 1860 г.) далеко не все химики приняли предложенную С. Канниццаро шкалу атомных весов, практически совпадающую с современной*. Характерный пример — учебник Менделеева «Органическая химия» (второе издание: август 1863 г.). Отметив прогресс в решении вопроса об атомных весах элементов, Дмитрий Иванович предложил таблицу, в которой среди прочего приведены и такие величины атомных весов: Si = 14, Ca = 20, Ba = 68,5, Fe = 28, Zn = 32,7, Cu = 31,7 и т. д. В оправдание своего выбора он привел весьма странный аргумент: «Эти изменения столь недавно обратили на себя внимание, что не успели войти в общее употребление» [3, с. 39] Более того, в его курсе лекций по общей и неорганической химии (октябрь 1867 г.!) снова приводятся все те же Ca = 20, Al = 13,5, Cd = 56 и т. д. [4].
Но этого мало. Атом в 19-м столетии понимали не как некий «кирпич мироздания», нечто неделящееся, но как минимальное количество элемента, которое присутствует во всех его соединениях и сохраняется в ходе химических превращений. Иными словами, словом «атом» фактически обозначали стехиометрический минимум для данного элемента. При этом подразумевалось (теми, кто вообще принимал атомную гипотезу), что кроме этих «химических» атомов есть еще атомы истинные, «физические», о которых мало что известно, и одновременно молчаливо допускалась принципиальная возможность открытия ранее неизвестного соединения элемента такого состава, что придется принятый атомный вес элемента уменьшить в разы (скажем, для азота принять N = 7 или какое-то иное значение). Менделеев, вполне осознававший это обстоятельство, пошел дальше. Он всю свою научную жизнь предостерегал окружающих против увлечения атомистикой. Вот несколько подтверждающих это цитат.
«…Химики постоянно употребляют атомическую гипотезу для более ясного представления многих фактов, хотя можно было бы обойтись и без нее. <…> Но атомическую теорию не нужно принимать как настоящую гипотезу о структуре тела, в этом отношении она не привела еще почти ни к каким результатам. Она должна быть принята как облегчение рассуждений» (1864) [5, с. 25].
«…Само название (атомный вес) заключает в себе, конечно, гипотезу об атомном строении тел, но… речь идет не о названии (мне кажется, что, заменяя название „атомный вес“ названием „элементарный вес“, можно достичь устранения представления об атомах, когда речь идет об элементах), а о понятии, которое им условлено означать» (1871) [6, с. 104].
«…В атомах есть простота представления, но нет уверенности» (1906 г. — последнее издание учебника Д. И. Менделеева «Основы химии») [7, с. 485].
Итак, ученый, открывший периодический закон, согласно которому «физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости… от их атомного веса» [8, с. 907], не верил в атомную теорию. В этом состоит первая странность или загадка менделеевского открытия. Что же он тогда классифицировал? Что заложил в основание своей классификации?
Прежде всего, Менделеев еще до создания Периодической системы строго разграничил понятия «элемент» и «простое тело». Он с самого начала строил именно систему химических элементов, а не простых тел. Понятие элемента соотносилось им с наименьшим весовым количеством материи определенного вида, входящим в частицы (молекулы) тел. Элемент в понимании Менделеева — это «отвлеченное понятие», «материя, содержащаяся в простом теле и могущая без изменения в весе переходить во все тела, получающиеся из этого тела» [9, с. 199].
Менделеев подчеркивает, что элемент может принимать различные конкретные формы (например, элемент углерод может находиться в форме угля, алмаза и графита, а также входить в состав разнообразных соединений). Элемент, по мысли Менделеева, будучи «не конкретным телом», но «материально однородным» «весомым веществом с суммою ему одному принадлежащих свойств» [10, с. 239], потенциально содержит в себе весь спектр возможных форм, свойств и состояний, которые этот «стехиометрический минимум» способен выявлять и развертывать в определенных условиях. Возможность (или невозможность) образования тех или иных соединений, аллотропных модификаций, металлических или иных состояний и т. п. — все это в «свернутом» виде включено, «втянуто» в понятие элемента, в силу чего систематика элементов обретает общехимическое (а потому и общенаучное) значение. Скажем, простое тело озон — одна из актуализаций того, что потенциально наличествует в идеальном химическом объекте, — элементе кислород. Таким образом, Менделеев классифицировал «элементарные индивидуумы», природа которых определялась их атомным весом (Дмитрий Иванович предпочел бы говорить об «элементарном весе», но не пошел против устоявшейся терминологии).
Такая постановка задачи наряду с другими факторами позволила ученому создать Периодическую систему, но представление об элементарных индивидуумах помешало ему принять открытие радиоактивности, электронов и многие крупные достижения науки конца XIX — начала XX вв. Он корил современную ему научную мысль за то, что она «запуталась в ионах и электронах» [9, с. 436].
Дыра от сыра

![]()
Как известно, в понедельник 17 февраля** 1869 г., который считается днем открытия периодического закона (а если выражаться точнее, совершения Менделеевым прорыва в поисках рациональной классификации элементов), Дмитрий Иванович должен был отправиться в командировку в Тверскую губернию для того, чтобы обследовать артельные сыроварни Н. В. Верещагина (брата известного художника-баталиста). Однако полученные им после долгих поисков первые результаты в построении системы элементов вынудили его отложить поездку на 12 дней, чтобы закончить статью «Соотношение свойств с атомным весом элементов». В эти дни Менделеев упорно работал, часами стоя за конторкой. Дописав статью, он передал рукопись Н. А. Меншуткину для публикации в «Журнале Русского химического общества» (РХО) и для сообщения об открытии периодического закона на предстоящем заседании РХО; просмотрел корректуру статьи; разослал листки с «Опытом системы элементов, основанной на их атомном весе и химическом сходстве» (далее — сокращенно: «Опыт») многим отечественным и зарубежным химикам (сразу скажем, что реакции, естественно, никакой не последовало); написал предисловие к первой части «Основ химии» и 1 марта отправился на сыроварни. Меншуткин исполнил просьбу Менделеева и 6 марта сделал от его имени сообщение о периодическом законе на заседании РХО (реакции, естественно, никакой, если не считать сказанных позднее слов академика Н. Н. Зинина: «Дмитрий Иванович, пора заняться работать».
Почему Менделеев не воспользовался случаем лично сообщить в РХО о своем открытии, а поручил это сделать Меншуткину? Допустим, тяга к артельным сыроварням оказалась непреодолимой. Но ведь можно было выступить по возвращении из Тверской губернии. Менделеев же, вернувшись из поездки 12 марта, спустя восемь дней выступает в Вольном экономическом обществе с докладом… об артельном сыроварении. 10 апреля он вновь выступает публично там же, на этот раз с сообщением о доходности молочного скотоводства и о результатах анализа почв с опытных полей. Создается впечатление, что сельскохозяйственные проблемы волновали его по крайней мере не меньше, чем химические. И это тоже представляется на первый взгляд странным. Но, если вдуматься, ничего удивительного здесь нет.

![]()
Создание «Опыта» стало началом той фазы работы Менделеева, когда он, убедившись, что «способ распределения элементов по их атомному весу не противоречит естественному сходству, существующему между элементами, а напротив того, прямо на него указывает» [1, с. 18–20] и что в подмеченных им закономерностях «случайности допустить… невозможно» [7, с. 619], уже мог сформулировать первые фундаментальные выводы, составившие ядро учения о периодичности, и предложить графическое (пока несовершенное) представление почти полной для того времени системы элементов. Но самая трудная часть работы была впереди, и на нее у Менделеева ушел год и девять месяцев.
«Опыт» определенно не удовлетворял ученого, поскольку был не «естественным», а компромиссным вариантом системы элементов. Не забывал Менделеев и о весьма прохладном отношении многих коллег-химиков к чисто теоретическим, в особенности к таксономическим работам. Учитывая эти обстоятельства, он не торопился выступать с докладом о своем открытии. Но и медлить с публикацией не мог — хотя бы потому, что вопросами систематики элементов занимались в то время многие. В сложившейся ситуации Менделеев избрал единственно правильную тактику: поскольку доклад в РХО был нужен ему лишь для публикации статьи в «Журнале» Общества, его друг Меншуткин, отвечавший за издание «Журнала», был выбран им в качестве докладчика. Как заметил острый на язык и недолюбливавший Д. И. Менделеева В. В. Марковников (письмо А. М. Бутлерову от 31 октября 1867 г., т.е. периодический закон еще не открыт), «Менделеев… до такой степени привык царствовать в факультете, что не может равнодушно выслушивать каких бы то ни было возражений. Меншуткин у него не более как приказчик» [11, с. 246].

Однако анализ архивных документов показал: уже в феврале 1869 г. Менделеев создал так называемую «короткую форму» системы, которая затем воплотилась в то, что он назвал «Естественной системой элементов» и опубликовал в феврале 1871 г. (датирована 29 ноября 1870 г., доложена на заседании РХО 3 декабря того же года). И впоследствии Дмитрий Иванович делал вид, что никакого «Опыта» не было. Почему же он сразу не предложил «короткую форму» системы?
Дело в том, что эта форма объединяет в одной группе элементы, которым отвечают абсолютно разные простые тела. А кроме того, их сходные по составу «низшие» соединения (т. е. соединения, в которых элементы находятся в низших степенях окисления) также заметно различаются по свойствам. Например, в 7-й группе оказываются столь непохожие элементы, как хлор и марганец, в 6-й — сера и хром и т. д. Да, они стоят в разных подгруппах (Менделеев не использовал понятия подгруппы, он делил каждый период на два ряда, и тогда, скажем, хлор и марганец оказывались в разных рядах — первый в нечетном, второй в четном), но, тем не менее, в одной группе. В чем их сходство? Оно проявляется только в высших соединениях. Например, высшая степень окисления и хлора, и марганца равна номеру группы (7), и соответствующие высшие соединения (Cl2O7 и Mn2O7, KClO4 и KMnO4 и т. д.) проявляют сходные свойства. Менделеев об этом знал и до 1869 г. Более того, об этом знали многие химики до него, но оставался вопрос: это сходство высших (скажем, кислородных) соединений обусловлено сходством самих элементов, оказавшихся в особом, «предельном» состоянии, или же в этих соединениях так много кислорода, что он нивелирует различия в природе самих элементов?

Только к концу 1869 г. или к началу 1870-го Дмитрий Иванович понял, что предельные (высшие) формы кислородных соединений и их свойства определяются не «самими свойствами кислорода» и наличием «грани О4» [10, с. 246], т. е. особо устойчивой группировки из четырех кислородных атомов (например, H2SO4 ~ H2CrO4; HClO4 ~ HMnO4 и т. д.), но «состоянием», т.е., в конечном счете, природой элемента, образующего эти соединения. И пока Менделеев бился над этим вопросом, Лотар Мейер в марте 1870 г. в небольшой статье (датирована декабрем 1869 г.) публикует короткую форму Периодической системы (только повернутую по отношению к менделеевской на 90°). Замечу, что Мейер, создавая систему элементов, исходил из иных посылок, нежели Менделеев, что видно из первых строк статьи немецкого химика: «То, что пока еще не разложенные химические элементы абсолютно неразложимы, в настоящее время представляется по меньшей мере весьма неправдоподобным. Напротив, атомы элементов — это, по-видимому, отнюдь не последние (letzten), но лишь ближайшие составные части (die näheren Bestandtheile) молекул» [12, S. 354]. Заметим, и Мейер, и Менделеев весьма скептически относились к атомной теории, но это не помешало им создать сходные системы элементов, опираясь на принятые тогда атомные веса. Но вернемся к нашему герою.
Итак, рассуждая фактически о структурных вопросах в неструктурных терминах, описывая разнообразие валентных возможностей элементов, критикуя при этом саму концепцию валентности («атомности»), отказываясь от традиционных таксономических методов и приемов, Менделеев, идя сложным и противоречивым путем, сумел-таки прийти к естественной системе, которая не только позволяла объяснить уже известное, но и обладала мощным прогностическим потенциалом.
К ноябрю 1870 г. проблема построения естественной системы была решена. Это, разумеется, не означало, что серьезных трудностей не осталось (достаточно указать на вопрос о положении в системе редкоземельных элементов). Но главное было сделано.

![]()
Вольный сын эфира
Теперь о третьей загадке в истории создания Периодической системы. Почему Менделеев с 1872 г. переключается на совершенно иную тематику, не связанную, казалось бы, с периодическим законом? Действительно, 20 декабря 1871 г. в его рабочем дневнике появляется неожиданная запись: «Опыт. Шмидт, Кирпичев и я с насосом Ягно» [13]. Зачем Менделееву понадобились насосы? Он же открыл периодический закон, который содержал в себе колоссальный тематический ресурс для дальнейших исследований! Пожалуй, почти любой исследователь на его месте всю оставшуюся жизнь посвятил бы главным образом (если не исключительно) совершенствованию форм системы, поискам новых корреляций между разнообразными формами и состояниями простых тел и соединений в свете учения о периодичности и тому подобным вопросам, т.е. просеиванию сквозь сито этого учения всех крупных и мелких фактов и теорий. Таков был бы путь естествоиспытателя, специалиста-химика. Однако Менделеев, будучи по характеру и разнообразию своих интересов, стилю работы, мегаломании в постановке задач и профетическим наклонностям скорее натурфилософом, нежели ученым (scientist), пошел по иному пути.

![]()

Периодический закон таил в себе много загадок, «не поддающихся рациональной концепции». Одна из самых глубоких касалась физических причин явления периодичности. Поскольку свойства элементов находились в периодической зависимости от их атомных весов, то, как полагал Менделеев, объяснение природы периодичности «возможно только в смысле динамического представления, могущего и долженствующего прежде всего разъяснить самое понятие о весе». Отсюда его интерес к вопросу о «причине веса и притяжения» [8, с. 805], а также к свойствам среды, передающей свет и тяготение, т.е. к мировому эфиру. Он был глубоко убежден в том, что «объяснить и выразить периодический закон — значит объяснить и выразить причину закона кратных отношений, различия элементов и их атомности и в то же время понять, что такое масса и тяготение» [7, с. 617] Более того, изучение природы мирового эфира открывало путь к постижению природы электрических и магнитных явлений, гравитации и химического сродства, т.е. вело к разгадке самых глубоких мировых тайн, и на этом фоне открытие периодического закона представлялось Дмитрию Ивановичу лишь ступенью (возможно, не самой крутой) в реализации его великого замысла.
По мнению Менделеева, одним из способов доказательства существования эфира могло быть исследование сильно разреженных газов, ибо в этих условиях свойства «обычного» вещества перестали бы маскировать свойства эфира.
Уже с 70-х годов, — вспоминал Менделеев, — «у меня назойливо засел вопрос: да что же такое эфир в химическом смысле? Он тесно связан с периодическою системою элементов, ею и возбудился во мне»*** [14, с. 474]. На личном экземпляре «Естественной системы» (оттиск из второй части первого издания «Основ», 1871 г.) около символа водорода Менделеев делает запись: «Легче всех эфир, в миллионы раз».

Исследования по газам субсидировались Императорским Русским техническим обществом (РТО), благодаря чему у Менделеева появилась уникальная возможность реализовать широко задуманную экспериментальную программу. Однако этот цикл его работ не дал сколько-нибудь значимых результатов, хотя ученый и обещал поклониться в пояс тому, кто сделал бы больше.

![]()
Предложенное Менделеевым уравнение состояния идеального газа, которое, по уверениям авторов «Летописи», является «основным результатом [его] работы… в области физики газов» [15, с. 179], к тому времени (1874–1875) уже использовалось в литературе, а потому его выведение Менделеевым могло иметь лишь методическое значение.
Наконец — и это главное — так называемые положительные отступления от закона Бойля — Мариотта при очень низких давлениях, которым Менделеев придавал особое значение, впоследствии не подтвердились.
Кроме того, его работе препятствовали многие обстоятельства «во внешней обстановке дела»: загруженность другими занятиями (преподавание в университете, напряженный труд по выпуску второго и третьего изданий «Основ химии», изучение «нефтяных дел», ведение сельскохозяйственных опытов и т. д.), смерть в 1875 г. М. Л. Кирпичева, уход в 1877 г. других ассистентов, заболевание плевритом, неизбрание в Академию наук, наконец, семейная драма (развод с первой женой и второй брак). Все эти обстоятельства привели в итоге Дмитрия Ивановича на рубеже 1870–1880-х годов к тяжелому психологическому кризису.

Но если ограничиться чисто научной стороной ситуации, то следует сказать, что провал широко задуманной исследовательской программы по физике газов стал для Менделеева сильным ударом. Положение усугублялось тем, что в эти годы физическая химия, к которой он с молодости питал особый интерес, заметно изменила свой характер. Внимание ученых сконцентрировалось на таких вопросах, как электропроводность и ионные равновесия в растворах, скорость диффузии ионов, электродные потенциалы, химическая кинетика и т. д. В физико-химических работах все шире использовались термодинамические методы, аппарат теории дифференциальных уравнений и т. п. Серьезные изменения намечались и в физике. Все это в целом было непривычно, а подчас и чуждо Менделееву. И более всего ему были чужды даже не отдельные идеи и теории (многие из которых он критиковал вполне заслуженно), а сам стиль и строй физико-химических работ новой волны. В результате он оказался в оппозиции по отношению к многим крупным открытиям в естествознании второй половины XIX в. Открыв периодический закон и встав в конце 1871 г. перед выбором — заняться далее «химической стороной дела» (к примеру, кропотливыми аналитическими исследованиями редкоземельных элементов, которые он начал было проводить с декабря 1870 г.) или же обратиться к поискам физических причин периодичности, — Менделеев, последний великий натурфилософ 19-го столетия, пошел по второму пути, оказавшемуся тупиковым. Триумф Периодической системы стал прологом трагического одиночества ее создателя: «я опять очутился один» [16, с. 188].
И одна легенда…

Коллега и друг Д. И. Менделеева, выдающийся русский геолог А. А. Иностранцев (1843–1919), в своих «Воспоминаниях» приводит такой эпизод:
«Как-то я зашел к нему [Менделееву] по какому-то делу и застал его в превосходном настроении; он даже шутил, что было крайней редкостью. Это было вскоре после его знаменитого открытия закона периодичности элементов. Я, воспользовавшись этим благодушным настроением Д. И., обратился к нему с вопросом, что натолкнуло его на знаменитое открытие, на что он сообщил, что уже давно подозревал известную связь элементов между собой и что много и долго думал об этом. В течение последних месяцев Д. И. перепортил массу бумаги с целью отыскать в виде таблицы эту закономерность, но ничего не удавалось. В последнее время он усиленно снова занялся этим вопросом и, по его рассказу, был даже близок к этому, но окончательно все-таки ничего не выходило. Перед самым открытием закона Д. И. провозился над искомою таблицею целую ночь до утра, но в ночь ничего не вышло, он с досады бросил работу и, томимый желанием выспаться, тут же в рабочем кабинете, не раздеваясь, повалился на диван и крепко заснул. Во сне он увидел вполне ясно ту таблицу, которая позднее была напечатана. Даже во сне радость его была настолько сильна, что он сейчас же проснулся и быстро набросал эту таблицу на первом клочке бумаги, валявшемся на его конторке» [17, с. 144].

![]()
Почему этот рассказ Иностранцева вызывает сомнения? Во-первых, мемуарист работал над своими воспоминаниями в 1919 г., на 76-м году жизни, т. е. спустя полвека после описываемых им событий. Во-вторых, и это более важно, Менделеев, любивший рассказывать окружающим различные забавные и поучительные истории из своей жизни (были и небылицы), ни разу не упоминал об этом чудесном сне. В-третьих, дошедшие до нас наброски будущей системы элементов не позволяют выявить эффект внезапного озарения. На самом трудном, пиковом этапе создания «Опыта», когда Менделеев коренным образом изменил сам принцип построения системы элементов (суть закона — периодический характер изменения свойств элементов по мере возрастания их весов — к этому времени уже была ему ясна, и речь шла об адекватном графическом представлении идеи периодичности), ученый создал промежуточный вариант системы, от которого отталкивался в последующей работе и который в главной своей части практически совпал с таблицей Л. Мейера, впервые опубликованной в 1864 г. в монографии [18, S. 137], переведенной на русский язык в 1866 г.

![]()
Есть еще один момент, связанный с рассказом Иностранцева и вызывающий вопросы: о массе «перепорченной бумаги». Менделеев имел привычку хранить все, что написал, каждую мелочь, и свой архив он систематизировал сам. Но почему-то из всего, что имело отношение к истории создания «Опыта», им было сохранено только пять рукописных листков.
Разумеется, число загадок, связанных с открытием и сущностью периодического закона, много больше, но рассказ о них выходит за рамки журнальной публикации.
Литература
1. Менделеев Д. И. Периодический закон. Основные статьи. Редакция, статьи и примечания Б. М. Кедрова. М., 1958.
2. Newlands J. The Law of Octaves, and the Causes of the Numerical Relations among the AtomicWeights // Chemical News. 1866; 13: 113.
3. Менделеев Д. И. Органическая химия. Менделеев Д. И. Соч. Т. 8. Л.; М., 1948; 35–602.
4. Менделеев Д. И. Лекции по общей химии. Менделеев Д. И. Соч.: В 25 т. Л.; М. (1934–1954). 1949; 15: С. 357–439.
5. Менделеев Д. И. Избранные лекции по химии. М., 1968.
6. Менделеев Д. И. Периодическая законность химических элементов (1871). Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 102–176.
7. Менделеев Д. И. Основы химии. СПб., 1906.
8. Менделеев Д. И. Основы химии. Часть II. Менделеев Д. И. Соч.: В 25 т. Л.-М. (1934–1954). 1949; 14.
9. Менделеев Д. И. Периодический закон. Дополнительные материалы. Ред. Б. М. Кедров. М., 1960.
10. Менделеев Д. И. Периодическая законность химических элементов (1898). Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 237–273.
11. Научное наследство. Естественнонаучная серия. Т. 4. Письма русских химиков к А. М. Бутлерову. М., 1961.
12. Meyer L. Die Natur der chemischen Elemente als Function ihrer Atomgewichte. Annalen der Chemie und Pharmacie. VII. Supplementband. 1870. S. 354–364.
13. Научный архив Менделеева, СПбГУ. I-B-23-I-62, 68.
14. Менделеев Д. И. Попытка химического понимания мирового эфира. Менделеев Д. И. Периодический закон. Основные статьи. Ред. Б. М. Кедров. М., 1958; 470–517.
15. Добротин Р. Б., Карпило Н. Г., Керова Л. С., Трифонов Д. Н. Летопись жизни и деятельности Д. И. Менделеева. Отв. ред. А. В. Сторонкин. Л., 1984.
16. Тищенко В. Е., Младенцев М. Н. Дмитрий Иванович Менделеев, его жизнь и деятельность. Университетский период, 1861–1890 гг. Отв. ред. Ю. И. Соловьев. М., 1993.
17. Иностранцев А. А. Воспоминания. Подготовка текста, вступительная статья и комментарии В. А. Прозоровского и И. Л. Тихонова. СПб., 1998.
18. Meyer L. Die Modernen Theorien der Chemie und Ihre Bedeutung für die chemische Statik. Breslau, 1864.
* В настоящее время принято выражение «атомная масса», но я буду придерживаться исторической терминологии.
** Далее даты, если не оговорено, приводятся по старому стилю, для перевода в новый стиль следует прибавить 12 дней.
*** Тут Дмитрий Иванович либо запамятовал, либо слукавил. Загадка мирового эфира занимала его еще в студенческие годы. Другое дело, что открытие периодического закона усилило его интерес к этой теме.
