![]()
: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Что на роду написано, того не миновать?
Редактирование генома в терапии наследственных заболеваний
Наследственность – это своего рода фатализм нашего времени. Расшифровка последовательности ДНК сродни предсказанию судьбы человека. Нам говорят, что гены определяют все: от цвета глаз до склонности к девиантному поведению. Добавьте к этому болезни, передающиеся по наследству, и мутации, связанные с риском развития таких болезней, как рак. Но можно ли пойти наперекор зловещему року и изменить судьбу, записанную на «скрижалях» ДНК? Да, это возможно, и если не сегодня, то в недалеком будущем. Генетическая инженерия занимается этими проблемами уже несколько десятков лет, однако в последние годы вокруг редактирования геномов возник особый ажиотаж. Что же изменилось? Ответ на этот вопрос – аббревиатура CRISPR/Cas
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Но какое отношение имеет это к наследственным болезням человека? Все дело в механизме действия системы CRISPR. Бактериофаги впрыскивают в клетку бактерии свою ДНК, которая многократно копируется и упаковывается в белковую оболочку за счет «хозяина» – таким образом на свет появляются новые бактериофаги. Защитная система бактерии, включающая белок-«ножницы» Cas, распознает чужую ДНК в случае, если она уже встречалась с ней раньше, и разрезает ее. Захватчики побеждены.
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
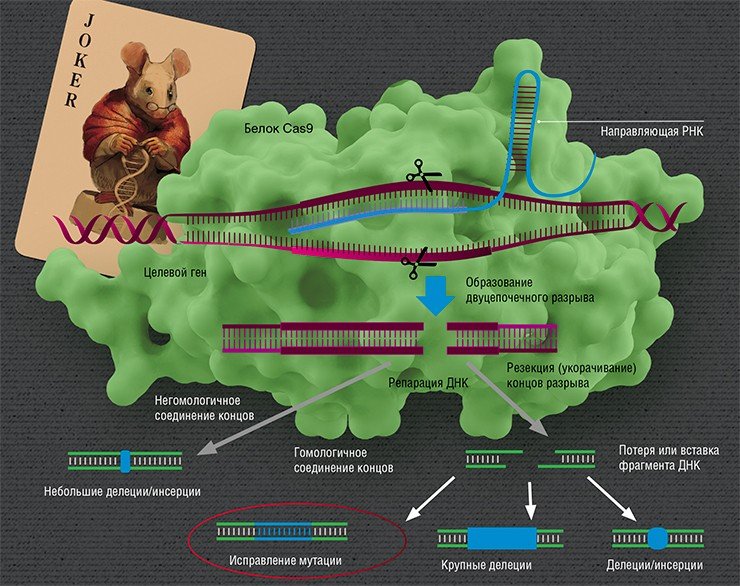
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Так в руках ученых оказался простой и эффективный инструмент, позволяющий направленно вносить изменения в ДНК живой клетки, т. е. переписывать те самые «скрижали». С тех пор вышли сотни научных статей, свидетельствующих о том, что эта система работает в самых различных видах организмов, позволяет вносить разрывы в любые последовательности генов, в том числе несущие мутации, вызывающие наследственные болезни (Немудрый, 2014).
Ремонтируем ДНК направленно
Но вот ДНК разрезана – что дальше? Дальше идет «ремонт» (репарация). Вообще разрывы в ДНК не такая уж и редкость: ежесуточно в каждой клетке человека под действием активных форм кислорода их возникает около 10 тысяч, и клетка их тщательно «штопает», восстанавливая целостность ДНК (Helbock et al., 1998). Но эти разрывы случайны, в отличие от действия CRISPR/Cas.
Существуют «терапевтические» мутации, предотвращающие развитие заболеваний. Например, мутации в гене CCR 5 предотвращают заражение клеток ВИЧ (Genovese et al., 2014, Liu et al., 1996), а мутация A673T в гене APP – развитие болезни Альцгеймера (Jonsson et al., 2012). С помощью системы CRISPR/Cas можно внести в геном необходимые изменения, «сломав» целевые гены либо внеся целевые замены (Cox et al., 2015)
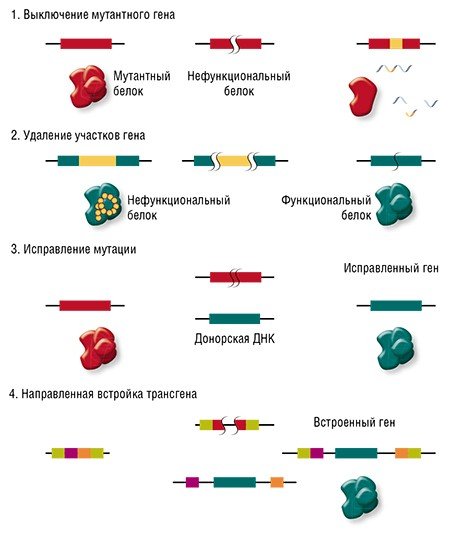
Направленные разрывы, внесенные CRISPR/Cas, могут быть репарированы по-разному: существует несколько способов, отличающихся механизмом, точностью и т. п. В зависимости от пути репарации можно получить следующие результаты. Во-первых, «сломать» ген, если при репарации ДНК произойдет мутация. Такого эффекта можно добиться, если репарация произойдет, например, по механизму соединения негомологичных концов, для которого характерна неточность. Также возможно добиться крупной делеции (утраты фрагмента ДНК) и удалить участок либо целый ген.
 Во-вторых, можно «переписать» определенную последовательность ДНК в клетке. Как известно, при репарации разрывов по пути гомологичной рекомбинации восстановление поврежденного участка ДНК идет по шаблону сестринской хромосомы (в клетках у нас присутствует по две копии каждой хромосомы – от отца и от матери). Фокус в том, что клетку можно обмануть, «подсунув» ей вместо сестринской хромосомы искусственно созданную «донорную» ДНК. Если такая ДНК будет «похожа» на поврежденный участок, то клетка может использовать ее в качестве образца.
Во-вторых, можно «переписать» определенную последовательность ДНК в клетке. Как известно, при репарации разрывов по пути гомологичной рекомбинации восстановление поврежденного участка ДНК идет по шаблону сестринской хромосомы (в клетках у нас присутствует по две копии каждой хромосомы – от отца и от матери). Фокус в том, что клетку можно обмануть, «подсунув» ей вместо сестринской хромосомы искусственно созданную «донорную» ДНК. Если такая ДНК будет «похожа» на поврежденный участок, то клетка может использовать ее в качестве образца.
Сестринская хромосома присутствует в клетке в единичном экземпляре, а копий «донорной» ДНК можно доставить множество, что дает искусственной ДНК конкурентное преимущество, пусть она и отличается немного от поврежденного участка. Таким образом можно «исправить», к примеру, мутацию, или вставить небольшой новый фрагмент ДНК.
И вот здесь мы вплотную подходим к терапии генетических заболеваний. Начнем с того, что все такие патологии отличаются друг от друга: они вызваны мутациями в разных генах, да и сами мутации могут иметь различную природу и давать разный эффект в одном и том же гене. Соответственно, есть разные варианты применения геномного редактирования: ген можно «сломать» или просто удалить мутантный участок, «исправить» мутацию или, напротив, добавить в геном полезные «терапевтические» мутации или даже новый дополнительный трансген.
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
Работаем «в пробирке» и в организме
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
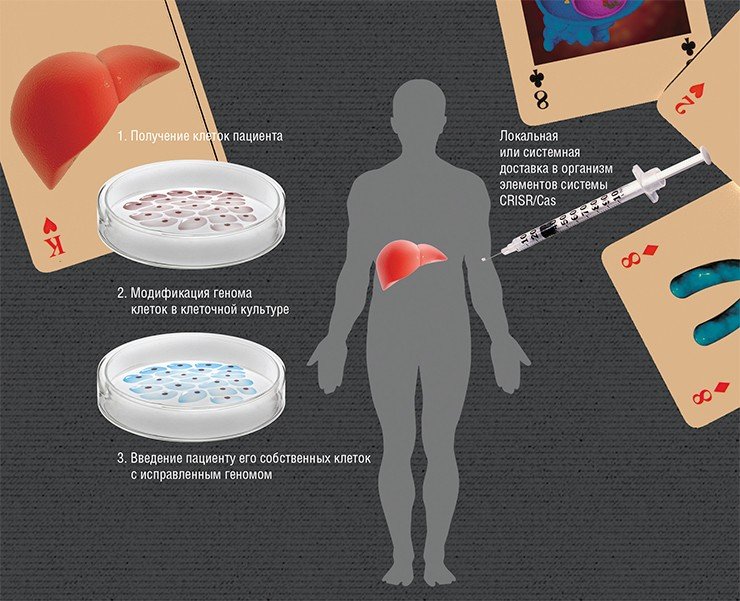
Суть редактирования геномов ex vivo («вне живого») заключается во введении в организм «здоровых» клеток, в которых, к примеру, будет синтезироваться нужный белок. Но если вводить клетки, взятые даже от здорового донора, то организм пациента с большой вероятностью их отторгнет. Поэтому нужно взять клетки самого пациента и изменить в них мутантный ген, а потом ввести их обратно. Наиболее разработан этот подход для заболеваний крови, поскольку забор и пересадка костного мозга, где идет кроветворение, практикуется с 1959 г.
Но что делать в случае, если «дефектные» клетки не так просто получить? Например, если болезнь проявляется в головном мозге? Вдобавок не все типы клеток способны пережить все процедуры в чашке Петри вне организма. Здесь на помощь приходит другая крайне перспективная технология нашего времени, связанная с получением так называемых индуцированных плюрипотентных стволовых клеток (ИПСК).
Плюрипотентные стволовые клетки бессмертны: теоретически они могут делиться бесконечно и при действии определенных стимулов образовывать любые клетки тканей и органов взрослого организма. Используя необходимый набор стимулов, можно направить развитие стволовых клеток в определенный тип клеток, например, в нейроны. Этот процесс называют направленной дифференцировкой
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Но зачем тратить время и деньги на извлечение и культивирование клеток, если можно все сделать прямо «на месте»? Ведь система CRISR/Cas в силу своей универсальности теоретически способна работать непосредственно в клетках живого организма. Главная проблема – это эффективно и безопасно доставить элементы этой системы в нужное место.
Сегодня наиболее часто для доставки генов CRISPR/Cas в организм используются вирусные частицы. В качестве таких носителей обычно выступают аденоассоциированные вирусы – дефектные вирусы, способные размножаться только в присутствии «помощников»-аденовирусов. Эти вирусы эффективно заражают клетки человека, но не вызывают у него никаких патологий. А вирусные частицы, в геном которых встроены гены CRISPR/Сas, после заражения уже не могут размножаться. При этом разные серотипы этих вирусов имеют «склонность» к разным тканям. Например, серотип AAV8 предпочитает ткани печени, а уже сегодня можно создать искусственные серотипы, нацеленные на любой орган.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Всегда есть это «но». Технология CRISPR/Cas начала применяться для редактирования геномов млекопитающих пять лет назад. На сегодня получено колоссальное количество данных, достигнут огромный прогресс на пути к клиническому применению, но все же остается ряд вопросов, которые необходимо будет решить для каждого конкретного генетического заболевания. Например, какая доставка будет оптимальна? Приживутся ли введенные клетки? Какова будет эффективность и безопасность лечения? И etc. …
Возьмем для примера пару вопросов из этого списка и посмотрим, какие конкретные ответы на них уже получены в научном сообществе. Одна из проблем использования CRISPR/Cas связана с возможностью нецелевых эффектов: система может вносить разрывы в участки, отличающиеся от целевого на несколько «букв» – нуклеотидов, что чревато риском возникновения нежданных мутаций. Особенно остро вопрос безопасности стоит при редактировании геномов in vivo, когда проверить результат предварительно невозможно.
Для решения этой проблемы лидирующие группы ученых под руководством Д. Дудны, Ф. Чжана и К. Джуна независимо друг от друга создали мутантные «улучшенные» варианты белка Cas9 с повышенной специфичностью, частота нецелевых эффектов которых упала на несколько порядков.
С помощью технологии геномного редактирования можно не только лечить наследственные заболевания, но и создавать «дизайнерских» детей. Ведь если можно исправить ген, вызывающий болезнь, то почему бы не изменить ген, регулирующий цвет глаз, продолжительность жизни, наконец, интеллект? Уже сегодня в Китае с помощью CRISPR/Cas выведены собаки породы бигль, у которых «выключен» ген, кодирующий миостатин – фактор, подавляющий рост мышечной ткани. В результате эти животные отличаются повышенной мускулистостью. А что мешает «выключить» этот ген в эмбрионе человека?
Что касается эффективности терапии, то все зависит от особенностей самого заболевания и мутации, его вызывающей. Возможны три варианта: после исправления мутации жизнеспособность клеток увеличится, не изменится или ухудшится. В первом случае исправленные клетки получают конкурентное преимущество и могут постепенно заместить мутантные. Например, на линии мышей с наследственным заболеванием печени – тирозинемией I типа – было показано, что при системной доставке CRISPR/Cas непосредственно в организм животного мутация «исправляется» в 6 % клеток печени. Даже такого небольшого количества клеток достаточно, чтобы предотвратить падение веса и привести в норму биохимические показатели печени животных. А более жизнеспособные клетки с исправленной мутацией начинают «обживать» печень.
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
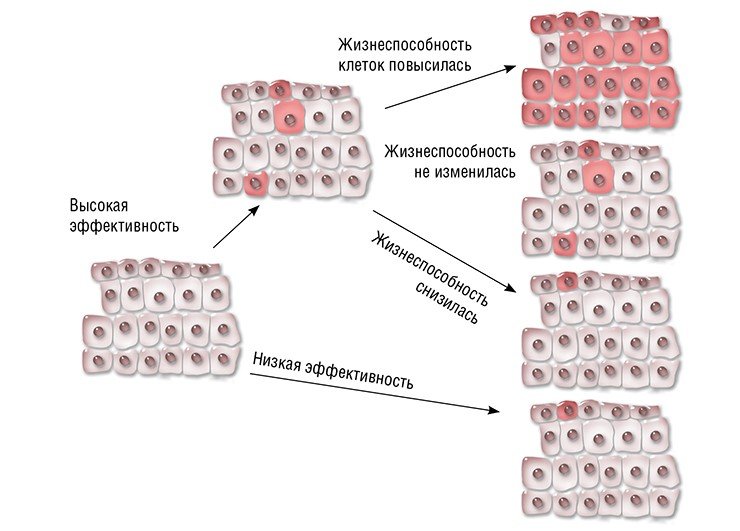
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Классическими же модельными заболеваниями в исследованиях по терапии с помощью геномного редактирования являются гемоглобинопатии и мышечная дистрофия Дюшенна. Именно на этих заболеваниях была подтверждена работоспособность концепций такого лечения, показано, что клетки с исправленной мутацией демонстрируют «здоровый» фенотип. В случае мышечной дистрофии Дюшенна такие клетки не только успешно встраивались в мышечную ткань взрослых мышей, но и улучшали функциональные показатели всей мышцы в целом.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
Можно ожидать, что уже в ближайшее десятилетие новая технология найдет и клиническое применение. Так, в 2016 г. в Китае стартовали первые клинические испытания нового метода иммунотерапии метастазирующего немелкоклеточного рака легкого, в котором используются T-лимфоциты с «отредактированным» геномом.
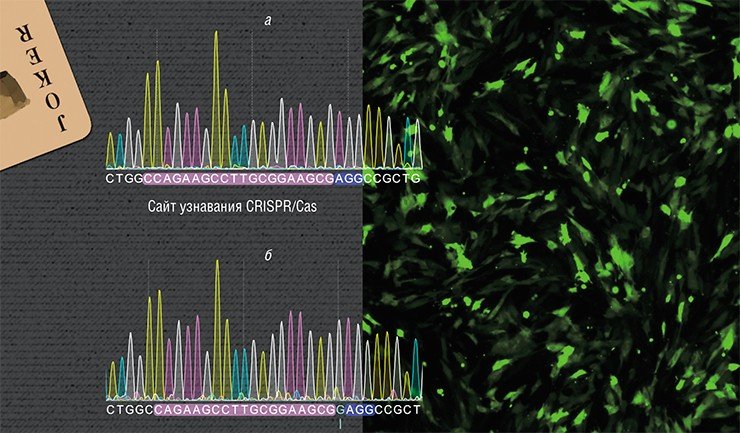
С. М. ЗАКИЯН: «НАМ БЫЛ БРОШЕН ВЫЗОВ, И МЫ ДОЛЖНЫ НА НЕГО ОТВЕТИТЬ!» Исследования по применению системы CRISPR/Cas для терапии наследственных заболеваний начались в лаборатории эпигенетики развития ИЦиГ СО РАН под руководством С. М. Закияна в 2013 г., буквально сразу после выхода первых публикаций на эту тему.
Исследования ведутся на лабораторных крысах линии Brattleboro – модели генетически детерминированного заболевания, при котором наблюдается дефицит гормона аргинин-вазопрессина. В результате у животных развивается наследственный несахарный диабет с характерным для него чрезмерным потреблением жидкости. На сегодня уже получена линия клеток с исправленной мутацией в гене, кодирующем этот гормон.
В данном случае задача усложнялась тем, что ген вазопрессина по последовательности нуклеотидов схож с геном другого гормона – окситоцина. Более того, на участке, в котором возникла мутация у крыс Brattleboro, эти гены практически идентичны. Тем не менее удалось добиться специфичного действия CRISPR/Cas в гене вазопрессина без нецелевых двунитевых разрывов ДНК в гене окситоцина. На следующем этапе предполагается вводить исправленные клетки в организм животных для оценки терапевтического эффекта
Возможности, которые дает нам технология CRISPR/Cas, пугающие и захватывающие одновременно. Сначала китайские исследователи, а затем их коллеги из США смогли внести изменения в эмбрионы человека. Недавно группа американских ученых под руководством Ш. Миталипова «исправила» в человеческом эмбрионе мутацию, вызывающую гипертрофическую кардиомиопатию (Ma et al., 2017). Эти эмбрионы были получены специально в результате искусственного оплодотворения, для которого были использованы здоровая яйцеклетка и сперматозоиды носителя мутации. Согласно современным нормам, зародыши были выведены из эксперимента на стадии бластоцисты. Однако с помощью современных репродуктивных технологий уже сегодня можно было бы имплантировать такие эмбрионы суррогатным матерям.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Литература
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
![]()
: 7 окт 2017 , Россия Делает Сама , том 75,
№4
Успешное применение CRISPR/Cas9 системы для редактирования генома эмбриона
Генетические анализы в настоящее время направлены на предупреждение наследственного заболевания или своевременное вмешательство для снижения или предотвращения негативного эффекта заболевания. Это связано с тем, что развитие инструментов для фактического исправления мутации в гене, вызывающем наследственное заболевание, отстает от методов диагностики.
В чем же сложность исправления мутации в гене? У человека примерно 30 000 генов, взрослый человек состоит в среднем из 4 триллионов клеток, некоторые из них ежедневно обновляются. Для полного «исцеления» нужно исправить мутацию в каждой клетке организма и при этом не «испортить» другие гены. Тут и начинаются сложности.
Первая задача – это сам механизм исправления гена. Для исправления генетической «ошибки», приводящей к заболеванию, нужны весьма специфические инструменты – молекулярные «ножницы», которые разрежут ДНК в строго указанном месте, и «пинцет», который вместо вырезанного фрагмента с ошибкой вставит правильный кусок ДНК. Вся система клетки направлена на сохранение генетической информации в неизменном виде. ДНК, которая является материальным носителем этой информации, сама по себе в клетке не работает – это инструкция по построению разных функциональных молекул и их применению. Это значит, что любая попытка внести изменения в ДНК воспринимается клеткой как нападение, от которого она может защищаться разными способами. Некоторые вирусы научились встраиваться в ДНК человека в обход этой защиты. Их инструменты можно использовать для привнесения в ДНК клетки здорового гена целиком, с которого будет синтезироваться правильно работающий белок. Однако вирусы не заботятся о том, чтобы не испортить другие гены в чужом геноме при встройке, поэтому такой метод исправления мутаций может быть опасен нарушением других, здоровых генов.
Также есть специальные системы внутри клетки, которые помогают разным белкам, работающим с ДНК, находить нужные гены, следят за цельностью длинных молекул ДНК и т.д. Эти белки умеют распознавать определенную последовательность нуклеотидов, то есть их можно настроить так, чтобы они работали с высокой точностью только с тем участком, который нужно исправить. Однако проблема таких молекулярных ножниц заключается в том, что они очень большие и доставить их в клетки организма человека очень сложно.
Самая остроумная и многообещающая идея направляемых «молекулярных ножниц» основана на использовании свойств защитной системы бактерий. Еще в 1987 году в ДНК бактерий нашли необычные последовательности, которые позже назовут CRISPR-кассетами. Однако на тот момент разобрать их структуру и понять функцию не удалось. До 2006 года эти последовательности активно использовали для классификации бактерий, так как они значительно различаются не только между видами, но даже между штаммами – они были своеобразными генетическими карточками каждого бактериального штамма. Но в 2006 году, объединив данные о структуре CRISPR-кассет и ассоциированных с ними белков cas, исследователи поняли функцию всей этой системы, а также механизм ее работы. CRISPR/Cas система бактерий – это защитный механизм, предохраняющий одноклеточный организм от проникновения чужой ДНК. В ДНК CRISPR-кассеты хранится информация о вирусах, которые раньше попадались этой бактерии или ее предкам, в виде небольших фрагментов ДНК этих вирусов. С помощью этих фрагментов клетка вырабатывает сигнальные РНК, распознающие проникшую вирусную ДНК и направляющие к ней cas-белки, которые разрежут ее на небольшие безопасные для клетки куски. Получается, что эта система позволяет разрезать ДНК, но только в определенном месте в соответствии с тем, где укажут небольшие молекулы РНК. При использовании этого механизма для исправления мутации в клетку человека нужно доставить лишь небольшой (по сравнению с описанными выше собственными белками клетки) белок cas9 и «руководящую» РНК, которая укажет место мутации.
Второй задачей «починки» гена является доставка инструментов до всех клеток, чтобы исправить ошибку в каждой клетке организма. К этой задаче подходят с двух сторон. С одной стороны, в каждом типе клеток каждого органа работают разные гены. Это значит, что исправлять ген нужно не во всех клетках организма, а только в тех, в которых этот ген необходим для полноценного выполнения функций ткани или органа. Такой подход значительно ограничивает количество клеток, в которые нужно доставить инструментарий и позволяет подобрать наиболее эффективный способ в зависимости от особенностей этих клеток, тканей, органов. С другой стороны, наш организм изначально развивается из одной клетки и на ранних этапах развития эмбрион состоит всего из нескольких клеток. И если внести изменение на таком этапе, то с высокой эффективностью можно получить эмбрион с исправленной мутацией во всех клетках, а значит из него вырастет здоровый человек.
Несмотря на кажущуюся простоту идеи использовать систему CRISPR/Cas9 для исправления мутации на стадии зиготы (оплодотворенной яйцеклетки, из которой развивается эмбрион), такая процедура была успешно проведена только недавно. Исследователи из Китая представили результаты работы, в которой описали применение CRISPR/Cas9 для исправления точечной мутации в гене HBB, вызывающей β-талассемию, и мутации в гене G6PD, связанной с развитием дефицита глюкозо-6-фосфатдегидрогеназы, на самой ранней стадии развития эмбриона – в зиготе.
Процедура по исправлению мутации на стадии зиготы проводилась при искусственном оплодотворении. В более ранних исследованиях оценивали эффективность редактирования генома с помощью системы CRISPR/Cas9 на нежизнеспособных зиготах с тремя пронуклеусами (результат некорректоного оплодотворения). Он оказался не слишком впечатляющим – исправление мутации наблюдали только 20% случаев.
В последней же работе провели процедуру редактирования генома на нормальных зиготах. При этом оказалось, что для мутации в гене HBB в 50% и для гена G6PD в 100% случаев мутация была исправлена. Это говорит о том, что система работает на потенциально жизнеспособных зиготах и может быть эффективна.
Важно понимать, что у этой работы есть как технические ограничения: малое количество образцов, отсутствие проверки на способность имплантироваться и нормально развиваться во время беременности, так и этические. В настоящее время эту систему планируют использовать для исследования влияния разных генов и мутаций в них на ранние стадии развития эмбриона, выявления функции разных генов в процессе имплантации эмбриона, что, возможно, позволит повысить эффективность процедур ЭКО.
Авторы: Вероника Юрьева, стажер
Светлана Жикривецкая, биолог-исследователь
Научные статьи-источники:
Bianconi E et al. An estimation of the number of cells in the human body. Ann Hum Biol, 2013
Tang L et al. CRISPR/Cas9-mediated gene editing in human zygotes using Cas9 protein. Mol Genet Genomics, 2017

Генная терапия с использованием аденовирусного вектора. В некоторых случаях аденовирус вставляет новый ген в клетку. Если лечение успешно, то новый ген будет производить функциональный белок, что приводит к выздоровлению
Генотерапия — совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток[1] человека в целях лечения заболеваний[2]. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК, поражением ДНК человека вирусами[3] или придания клеткам новых функций.
Развитие концепции генотерапии[править | править код]
Концепция генотерапии, по-видимому, появилась сразу после открытия явления трансформации у бактерий и изучения механизмов трансформации клеток животных опухолеобразующими вирусами. Такие вирусы могут осуществлять стабильное внедрение генетического материала в геном клетки хозяина, поэтому было предложено использовать их в качестве векторов для доставки желаемой генетической информации в геном клеток. Предполагалось, что такие векторы могут в случае необходимости поправлять дефекты генома.
Реальностью генная коррекция соматических клеток стала после 1980-х годов, когда были разработаны методы получения изолированных генов, созданы эукариотические экспрессирующие векторы, стали обычными переносы генов у мышей и других животных.
Исторически генная терапия нацеливалась на лечение наследственных генетических заболеваний, однако поле её применения, по крайней мере теоретически, расширилось. В настоящее время генную терапию рассматривают как потенциально универсальный подход к лечению широкого спектра заболеваний, начиная от наследственных, генетических, и заканчивая инфекционными.
История генной терапии[править | править код]
1970-е и ранее[править | править код]
В 1972 Фридман и Роблин опубликовали статью в Журнале Science под заголовком «Генная терапия для генетических болезней человека?»[4] Роджерс (1970) предложил заменять дефектный ДНК у тех, кто страдал от генетических дефектов.[5]
1980-е[править | править код]
В 1984 была разработана система ретровирусного вектора, способная эффективно вставлять инородные гены в хромосомы млекопитающих.[6]
1990[править | править код]
Первое разрешенное в истории США клиническое исследование генной терапии было проведено 14 сентября 1990 в Национальном институте здоровья (NIH) под руководством Вильяма Андерсона.[7].
Четырёхлетняя Ашанти ДеСильва получила лечение от тяжелого генетического дефекта сложного комбинированного иммунодефицита, связанного с недостатком фермента ADA. Во взятой у пациента крови дефектный ген был заменен на функциональный вариант. Это привело к частичному восстановлению иммунной системы Ашанти. Она временно стимулировала производство недостающего фермента, но не порождало новые клетки с функциональным геном. Ашанти продолжала получать инъекции скорректированных T-клеток каждые два месяца и имела возможность вести нормальную жизнь.[8]
1993—2002[править | править код]
1993 год. Генная терапия пациента, страдающего SCID[источник не указан 3849 дней] команде Френча Андерсона из Калифорнийского Университета. После проведения терапии белые кровяные клетки продолжали выполнять свои функции в течение 4 лет. Затем потребовалось повторное лечение.
«Отец генной терапии» Френч Андерсон вылечил двух девочек, 4 и 8 лет. Девочки были на грани смерти, но благодаря ему живы и здоровы по сей день.
1999 год. Джесси Гелсинджер умер при клиническом испытании генной терапии. Случай с Гелсинджером имел сильный тормозящий эффект для всех ученых в данной области[9].
1999 год. Каждый четвёртый ребёнок, страдающий SCID, лечится с помощью генной терапии[источник не указан 3849 дней].
2003 год[править | править код]
В 2003 команде Калифорнийского Университета удалось перенести гены в нейроны головного мозга, используя липосомы, покрытые полимером полиэтиленгликоль (англ. PEG). До этого перенос генов в нейроны головного мозга был невозможен из-за того, что вирусные векторы не могли преодолеть гематоэнцефалический барьер из-за своих больших размеров[источник не указан 3849 дней]. На основе новой технологии разрабатываются методы генной терапии болезни Паркинсона[источник не указан 3849 дней].
Разрабатываются методы лечения синдрома Хантингтона с использованием процесса РНК-интерференции[источник не указан 3849 дней].
2006 год[править | править код]
Первая демонстрация эффективной борьбы с раком с использованием генной терапии. Учёные из National Institutes of Health (Мэриленд) успешно борются с метастазирующей меланомой у двух пациентов, используя генетически изменённые Т-киллеры[источник не указан 3849 дней].
Май 2006 года. Коллектив учёных во главе с Luigi Naldini и Brian Brown из Миланского San Raffaele Telethon Institute for Gene Therapy (HSR-TIGET) сообщил о прорыве в генотерапии: разработан способ «обмана» иммунной системы, вызывающей отторжение генно-модифицированных клеток[источник не указан 3849 дней]. Для этого специфическим образом используется микроРНК. Открытие может сыграть ключевую роль в разработке методов генной терапии гемофилии.
В марте 2006 г. международная группа учёных объявила об успешном использовании генотерапии для лечения двух взрослых пациентов от заболевания, связанного с миелоидными клетками[источник не указан 3849 дней].
2007 год[править | править код]
В мае 2007 года Moorfields Eye Hospital и University College London’s Institute of Ophthalmology объявили о первом испытании генотерапии для лечения врожденного амавроза Лебера[10]. Первая операция была выполнена на 23-летнем британце Роберте Джонсоне в начале 2007 года. Для этого использовался рекомбинантный аденоассоциированный вирус, несущий ген RPE65. Лечение привело к положительным результатам, при этом не было обнаружено никаких побочных эффектов.
2008 год[править | править код]
В декабре 2008 года успешно завершились испытания на мышах терапии серповидно-клеточной анемии[11].
2009 год[править | править код]
Генотерапия успешно применена для улучшения состояния больных ВИЧ[12] и ТКИД (тяжелый комбинированный иммунодефицит)[13]. На грызунах показана эффективность генотерапии в терапии хронической боли[14] и некоторых видов глухоты[15][16] и слепоты[17].В настоящее время разрабатывается генотерапия для редкого и тяжелого заболевания — фибродисплазии. Происходит это в Университете штата Пенсильвания, при участии генетиков всего мира[18].
2010 год[править | править код]
Статья Комароми, опубликованная в апреле 2010 года, описала технологию генной терапии для лечения форм ахроматопсии у собак. Ахроматопсия или полная цветовая слепота используется в виде идеальной модели для разработки методов генной терапии, направленных на конусные фоторецепторы. Функция конусов и дневное зрение были восстановлены, по крайней мере, в течение 33 месяцев у двух молодых собак с ахроматопсией. Тем не менее, терапия была менее эффективна для старых собак.[19]
2011 год[править | править код]
Пациент, проходивший лечение в 2007 и 2008 годах у Геро Хюттера, был излечен от ВИЧ методом повторной трансплантации гематопоэтических стволовых клеток (см. также аллогенная трансплантация стволовых клеток, аллогенная трансплантация костного мозга, аллотрансплантация) с двойной дельта-32 мутацией, которая отключает рецептор CCR5. Методы этого лечения, которые требовали полного удаления существующего костного мозга пациента, что было очень изнурительной процедурой, не были приняты медицинским сообществом вплоть до 2011 года.[20]
Группе генетиков удалось вылечить лабораторных мышей от гемофилии с помощью аденоассоциированных вирусов.[21] В течение 8 месяцев не обнаружено никаких побочных эффектов.
В 2011 в России был зарегистрирован «Неоваскулген» — первый в классе препарат генотерапии для лечения периферийной артериальной болезни, включая критическую ишемию конечности. Состав препарата — дезоксирибонуклеиновая кислота плазмидная сверхскрученная pCMV-VEGF165.
2012 год[править | править код]
Учёные из испанского Национального онкологического научного центра (исп. Centro Nacional de Investigaciones Oncologicas) под руководством его директора Марии Бласко (исп. María Blasco) доказали, что продолжительность жизни мышей можно увеличить однократным введением препарата, непосредственно воздействующего на гены животного во взрослом состоянии. Они сделали это с помощью генной терапии — стратегии, ещё ни разу не использовавшейся для борьбы со старением. Применение этого метода на мышах признано безопасным и эффективным. Мыши, получавшие терапию в возрасте одного года, жили дольше в среднем на 24 %, а в возрасте двух лет — на 13 %. Кроме того, лечение привело к значительному улучшению состояния здоровья животных, задержав развитие возрастных заболеваний — таких как остеопороз и резистентность к инсулину — и улучшив такие показатели старения, как нервно-мышечная координация. Это исследование «показывает, что можно разработать антивозрастную генную терапию на основе теломеразы без увеличения заболеваемости раком», утверждают его авторы. Таким образом, генная терапия становится одним из перспективных направлений, которые рождаются в настоящее время терапевтической сферы радикального продления жизни и остановки старения.[22][23]
2 ноября Еврокомиссия впервые разрешила выпуск и продажу в ЕС лекарства нидерландской компании uniQure на основе генотерапии для лечения тяжёлого генетического заболевания — липопротеинолипазной недостаточности[24]. Стоимость лекарства составит 1,6 млн долларов США, что является рекордом за всю историю медицины.
С 2012 года продаётся на территории России препарат, лечащий атеросклероз сосудов с помощью местной генотерапии[25].
2013 год[править | править код]
На 2013 год в мире разрешено к клиническому применению всего пять генных препаратов: три для лечения злокачественных новообразований, четвёртый — глибера, для лечения редкого наследственного заболевания — дефицита липопротеинлипазы, и неоваскулген.
2017 год[править | править код]
В ноябре 2017 года в Калифорнии прошла первая в мире процедура по «редактированию» генома взрослого человека прямо внутри его тела. Пациентом стал мужчина с мукополисахаридозом II типа (синдромом Хантера)[26][27].
2019 год[править | править код]
На основе аденоассоциированного вектора AAV9 был создан препарат Zolgensma для лечения спинальной мышечной атрофии. Этот препарат считается наиболее дорогим лекарством со стоимостью курса (1 укол) более $2 млн[28]. Разрешен в ряде стран с 2019 года[29][30]. По некоторым оценкам, возможно порядка тысячи применений препарата до 2025 или 2027 года[31][32].
Методы генотерапии[править | править код]
Новые подходы к генной терапии соматических клеток можно поделить на две большие категории: генная терапия ex vivo и in vivo. Разрабатываются специфические лекарственные препараты на основе нуклеиновых кислот: РНК-ферменты, модифицированные методами генной инженерии олигонуклеотиды, корректирующие генные мутации in vivo и т. д.
Использование при имплантации ген-активированных материалов, модифицированных геннотерапевтическими препаратами, позволяет обеспечить отложенное и продолжительное высвобождение препарата in situ[33][34].
Разработка таких мощных инструментов для генной модификации как CRISPR/Cas9[35][36] предоставили человечеству возможность в ближайшем будущем с помощью генной модификации успешно устранять причины наследственных заболеваний[37][38] и повысить устойчивость организма к старческим заболеваниям[39].
Существует несколько способов введения новой генетической информации в клетки млекопитающих. Это позволяет разрабатывать прямые методы лечения наследственных болезней — методы генотерапии.
Используют два основных подхода, различающихся природой клеток-мишеней:
- фетальная генотерапия, при которой чужеродную ДНК вводят в зиготу или эмбрион на ранней стадии развития; при этом ожидается, что введённый материал попадёт во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению);
- соматическая генотерапия, при которой генетический материал вводят только в соматические клетки, и он не передаётся половым клеткам.
Риски[править | править код]
Генотерапия может как обеспечить клиническую пользу, так и привести к расширению и злокачественной трансформации гемопоэтических клонов с переносными векторными вставками вблизи онкогенов, при использовании лентивирусных векторов, что увеличит риск лейкемии[40].
См. также[править | править код]
- Антисенс-терапия
- Наследственные заболевания
- Полигенные болезни
- Генопатология
- Генетически модифицированный организм
- CRISPR
- Cas9
- Сенотерапевтики
Примечания[править | править код]
- ↑ Только лишь соматических клеток — с точки зрения российского закона. В мире существует также генотерапия половых клеток (germline gene therapy)
- ↑ Федеральный закон от 5 июля 1996 г. N 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» (с изменениями и дополнениями) Федеральный закон от 5 июля 1996 г. N 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» С изменениями и дополнениями от: 12 июля 2000 г., 30 декабря 2008 г., 4 октября 2010 г., 19 июля 2011 г. Статья 2. Основные понятия. Дата обращения: 27 октября 2014. Архивировано 28 октября 2014 года.
- ↑ van Diemen F. R., Kruse E. M., Hooykaas M. J., Bruggeling C. E., Schürch A. C., van Ham P. M., Imhof S. M., Nijhuis M., Wiertz E. J., Lebbink R. J. CRISPR/Cas9-Mediated Genome Editing of Herpesviruses Limits Productive and Latent Infections. (англ.) // PLoS pathogens. — 2016. — Vol. 12, no. 6. — P. e1005701. — doi:10.1371/journal.ppat.1005701. — PMID 27362483.
- ↑ Friedmann T., Roblin R. Gene therapy for human genetic disease? (англ.) // Science. — 1972. — March (vol. 175, no. 4025). — P. 949—955. — doi:10.1126/science.175.4025.949. — Bibcode: 1972Sci…175..949F. — PMID 5061866.
- ↑ Rogers S, New Scientist 1970, p. 194
- ↑ Cepko C. L., Roberts B. E., Mulligan R. C. Construction and applications of a highly transmissible murine retrovirus shuttle vector (англ.) // Cell : journal. — Cell Press, 1984. — July (vol. 37, no. 3). — P. 1053—1062. — doi:10.1016/0092-8674(84)90440-9. — PMID 6331674.
- ↑ The first gene therapy. Life Sciences Foundation (21 июня 2011). Дата обращения: 7 января 2014. Архивировано 28 ноября 2012 года.
- ↑ Blaese R. M., Culver K. W., Miller A. D., Carter C. S., Fleisher T., Clerici M., Shearer G., Chang L., Chiang Y., Tolstoshev P., Greenblatt J. J., Rosenberg S. A., Klein H., Berger M., Mullen C. A., Ramsey W. J., Muul L., Morgan R. A., Anderson W. F. T lymphocyte-directed gene therapy for ADA- SCID: initial trial results after 4 years (англ.) // Science : journal. — 1995. — October (vol. 270, no. 5235). — P. 475—480. — doi:10.1126/science.270.5235.475. — Bibcode: 1995Sci…270..475B. — PMID 7570001.
- ↑ A History Lesson for Stem Cells. Sciencemag.org (8 мая 2009). Дата обращения: 29 февраля 2012. Архивировано 30 сентября 2012 года.
- ↑ Gene therapy first for poor sight, BBC News (1 мая 2007). Архивировано 14 марта 2009 года. Дата обращения: 3 мая 2010.
- ↑ Голос Америки. Дата обращения: 6 декабря 2008. Архивировано из оригинала 9 декабря 2008 года.
- ↑ Архивированная копия. Дата обращения: 16 мая 2009. Архивировано 3 мая 2009 года.
- ↑ Архивированная копия. Дата обращения: 16 мая 2009. Архивировано 26 апреля 2009 года.
- ↑ Архивированная копия. Дата обращения: 16 мая 2009. Архивировано 26 апреля 2009 года.
- ↑ Архивированная копия. Дата обращения: 16 мая 2009. Архивировано 26 апреля 2009 года.
- ↑ Дина Файн Марон. Путь из мира безмолвия // В мире науки. — 2019. — № 1/2. — С. 142—150.
- ↑ Генная терапия возвращает зрение — Наука и техника — Биотехнологии и медицина — Компьюлента. Дата обращения: 26 октября 2009. Архивировано из оригинала 30 октября 2009 года.
- ↑ Ольга Португалова. Ген двойного скелета, Газета.Ru (25 апреля 2006). Архивировано 4 марта 2016 года. Дата обращения: 9 августа 2013.
- ↑ András M. Komáromy,John J. Alexander, Jessica S. Rowlan, Monique M. Garcia, Vince A. Chiodo, Asli Kaya, Jacqueline C. Tanaka, Gregory M. Acland, William W. Hauswirth и Gustavo D. Aguirre1. Gene therapy rescues cone function in congenital achromatopsia (англ.) // Human Molecular Genetics (англ.) (рус.. — Oxford University Press, 2010. — Vol. 19, iss. 13. — P. 2581—2593. — doi:10.1093/hmg/ddq136.
- ↑ The Man Who Was Cured of HIV and What It Means for a Cure for AIDS — New York Magazine. Дата обращения: 31 августа 2011. Архивировано 12 апреля 2014 года.
- ↑ Алла Солодова. Генетики вылечили мышей от болезни семьи Романовых. Инфокс (27 июня 2011). Дата обращения: 1 ноября 2011. Архивировано 16 февраля 2012 года.
- ↑ Генная терапия позволила увеличить продолжительность жизни | iLive. Я живу! Здорово! 🙂. Дата обращения: 11 августа 2012. Архивировано 14 апреля 2014 года.
- ↑ [https://web.archive.org/web/20180403064948/https://www.ncbi.nlm.nih.gov/pubmed/22585399 Архивная копия от 3 апреля 2018 на Wayback Machine Telomerase gene therapy in adult and old mice d… [EMBO Mol Med. 2012] — PubMed — NCBI]
- ↑ Генетическое лекарство за 1,6 миллиона долларов вылечит безнадежных больных (3 ноября 2012). Дата обращения: 4 ноября 2012. Архивировано 5 ноября 2012 года.
- ↑ Генная терапия в России: три года опыта Р. В. Деев «Химия и жизнь» № 12, 2013. Дата обращения: 27 октября 2014. Архивировано 27 октября 2014 года.
- ↑ Ольга Страховская. В США впервые отредактировали гены прямо в теле человека. Чего можно добиться с помощью новой технологии? (рус.), Истории, Meduza (17 ноября 2017). Архивировано 25 ноября 2017 года. Дата обращения: 17 ноября 2017.
- ↑ Ученые США сделали умопомрачительный опыт на живом человеке (рус.), Вести (17 ноября 2017). Архивировано 26 ноября 2017 года. Дата обращения: 17 ноября 2017.
- ↑ Самое дорогое лекарство в мире. Novayagazeta.ru (6 февраля 2020). Дата обращения: 12 июля 2020. Архивировано 31 октября 2020 года.
- ↑ Zolgensma — FDA Архивная копия от 19 ноября 2019 на Wayback Machine, Highlights of Prescribing Information, 2019 (англ.)
- ↑ «Золгенсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности. Мосмедпрепараты (14 июня 2019). Дата обращения: 18 августа 2020. Архивировано 20 ноября 2020 года.
- ↑ Victoria Rees. Study suggests Zolgensma will generate $2.5bn of global sales by 2025 (англ.). European Pharmaceutical Review (31 марта 2020). Дата обращения: 18 августа 2020. Архивировано 9 августа 2020 года.
- ↑ The Global Spinal Muscular Atrophy Market is Estimated to be Valued at US$ 2.8 Billion in the Year 2027 (англ.). businesswire.com (12 июня 2020). Дата обращения: 18 августа 2020. Архивировано 14 октября 2021 года.
- ↑ Клабуков И.Д., Балясин М.В., Люндуп А.В., Крашенинников М.Е., Титов А.С., Мудряк Д.Л., … & Дюжева Т.Г. Ангиогенная витализация биосовместимого и биодеградируемого матрикса (экспериментальное исследование in vivo) Архивная копия от 30 октября 2020 на Wayback Machine // Патологическая физиология и экспериментальная терапия. — 2018. — Т. 62, № 2. — С. 53-60. — doi:10.25557/0031-2991.2018.02.53-60.
- ↑ E. Presnyakov, I. Bozo, I. Smirnov, V. Komlev, V. Popov. Bioresorption and biodegradation of the 3D-printed gene-activated bone substitutes based on octacalcium phosphate // Genes & Cells. — 2020. — Т. XV, вып. 1. — doi:10.23868/202003009. Архивировано 7 марта 2020 года.
- ↑ Mehmet Fatih Bolukbasi, Ankit Gupta & Scot A Wolfe (2016). Creating and evaluating accurate CRISPR-Cas9 scalpels for genomic surgery. Nature Methods 13, 41-50 doi:10.1038/nmeth.3684
- ↑ Gori, J. L., Hsu, P. D., Maeder, M. L., Shen, S., Welstead, G. G., & Bumcrot, D. (2015). Delivery and Specificity of CRISPR/Cas9 Genome Editing Technologies for Human Gene Therapy. Human gene therapy, 26(7), 443—451. doi:10.1089/hum.2015.074
- ↑ Wu, Y., Zhou, H., Fan, X., Zhang, Y., Zhang, M., Wang, Y., … & Tang, W. (2015). Correction of a genetic disease by CRISPR-Cas9-mediated gene editing in mouse spermatogonial stem cells. Cell research, 25(1), 67-79. doi:10.1038/cr.2014.160
- ↑ Pellagatti, A., Dolatshad, H., Valletta, S., & Boultwood, J. (2015). Application of CRISPR/Cas9 genome editing to the study and treatment of disease. Archives of toxicology, 1-12. doi:10.1007/s00204-015-1504-y
- ↑ Paul Knoepfler (2015). GMO Sapiens. The Life-Changing Science of Designer Babies Архивная копия от 24 июня 2017 на Wayback Machine E-Book
- ↑ Aiuti, A.; Biasco, L.; Scaramuzza, S.; Ferrua, F.; Cicalese, M. P.; Baricordi, C.; Dionisio, F.; Calabria, A. et al. (2013). «Lentiviral Hematopoietic Stem Cell Gene Therapy in Patients with Wiskott-Aldrich Syndrome». Science. doi: 10.1126/science.1233151.
Литература[править | править код]
- Gene Correction. Methods and Protocols. Series: Methods in Molecular Biology, Vol. 1114 Storici, Francesca (Ed.), 2014. — ISBN 978-1-62703-760-0
- Thomas Gaj,Charles A. Gersbach,Carlos F. Barbas (2013) ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology, 31(7), 397—405, doi: 10.1016/j.tibtech.2013.04.004
- Paul Singleton (2012) Dictionary of DNA and Genome Technology, 3rd Edition, ISBN 978-1-118-44757-4
Online-журналы[править | править код]
- Human Gene Therapy
- Human Gene Therapy Methods
- Human Gene Therapy Clinical Development
Ссылки[править | править код]
- Российские биотехнологии и биоинформатика
- «База знаний по биологии человека». Институт математических проблем биологии Пущинского научного центра РАН
- А. В. Зеленин. Генная терапия на границе третьего тысячелетия. «Вестник РАН», том 71, № 5, с. 387—395 (2001)
В конце XX века тогда еще начинающие британские биохакеры совершили настоящий прорыв в генетике и предоставили любому человеку возможность с помощью ДНК-теста узнать больше о своих далеких предках и загадочной наследственности. Тогда, правда, только избранные могли объяснить, зачем и кому это нужно, — генетика была интересна лишь узкой группе специалистов, работающих с редкими заболеваниями. Но теперь за простым любопытством стоит более глобальная задача — разобраться в своей наследственности. А причина этому — надвигающийся тренд на тотальное оздоровление, исцеление и персонализированную медицину.
Сегодня эксперты уже не сомневаются в том, что генетика — основополагающая наука медицины будущего, хотя ее технологии и без того кажутся чем-то из мира научной фантастики. Перспективы развития генетики в России обсудят на площадках форума «БИОТЕХМЕД», который пройдет 16 и 17 сентября в Геленджике. В преддверии этого события «РБК Стиль» пообщался с одним из экспертов форума — врачом-генетиком Екатериной Захаровой — и узнал у нее, как работает ДНК, какие особенности мы можем унаследовать от родителей и безопасно ли вмешательство генетиков в организм.
Екатерина Захарова
Заведующая лабораторией наследственных болезней обмена веществ ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», член экспертного совета по редким болезням при комитете Государственной думы по охране здоровья
Как устроена клетка
Со школьных времен всем известно, что организм человека состоит из множества клеток, в каждой из которых есть ядро — именно там хранится генетическая информация. Ее мы наследуем от родителей и дальше передаем своим детям. В материальном обличии эта информация представлена в виде той самой нити ДНК — дезоксирибонуклеиновой кислоты. Эта макромолекула была открыта достаточно давно, но то, что именно в ней хранится генетическая информация, стало известно только в XX веке.
Дезоксирибонуклеиновая кислота (ДНК) — макромолекула, которая хранит и передает из поколения в поколение генетическую программу функционирования живых организмов. Биологическая информация в ДНК представлена в виде уникального генетического кода, состоящего из последовательности нуклеотидов.

© DrAfter123/gettyimages.com
Зачем нужна ДНК
Говоря о том, зачем нам ДНК и что она делает, можно привести аналогию: каждый белок в нашем организме синтезируется по определенному «рецепту». В нем указано, сколько должно быть аминокислот, в какой последовательности они будут соединяться и куда дальше последуют. В таком случае ДНК — это поваренная книга, в которой записаны рецепты всех наших белков, а мутация — это повреждение белка или изменение текста поваренной книги. Если в рецепте появляется опечатка, то белок получается «неправильный» и не выполняет свои функции должным образом, отчего страдает как клетка, так и весь организм, что приводит к развитию заболевания.
Во всех наших клетках хранятся одинаковые гены. Но функции у клеток разные: одни, например, синтезируют гемоглобин, другие занимаются мышечными белками, третьи — нервными. Это обеспечивается с помощью системы регуляции активности генов: она способна «включать» одни гены и оставлять в молчании другие.
Чем генетика отличается от наследственности
Генетика — большая и очень разнообразная наука. Клиническая генетика изучает, как проявляются наследственные болезни, популяционная — наше происхождение и особенности каждого народа. А вот наследственность — понятие уже более узкое. Люди давно заметили, что есть признаки, которые ярко проявляются у представителей одной семьи и передаются из поколения в поколение.
Если вспомнить живопись и портреты членов династии испанских Габсбургов, то многим сразу придут на ум их наследственные приметы: выступающая «габсбургская губа» и гипертрофированная нижняя челюсть, которая, говорят, даже мешала монарху нормально пережевывать пищу. Совершенно очевидно, что эти признаки связаны с изменениями определенных генов в известном роду.
Что еще хранится в ДНК
Информация, закодированная в ДНК, способна рассказать как о заболеваниях, так и о цвете волос, форме глаз, группе крови и даже вкусовых предпочтениях. Например, в ходе генетических исследований ученые обнаружили, что всех людей можно разделить на две категории: тех, кто любит капусту брокколи, и тех, кто ее просто ненавидит. Оказалось, что у второй группы есть определенные повреждения в гене, ответственные за восприятие этого вкуса, — им брокколи кажется горькой и неприятной.
В ДНК также могут быть записаны наши пагубные привычки, склонность к полноте или употреблению алкоголя. Изменения в некоторых генах делают нас более восприимчивыми к этим факторам. Но, как правило, за них отвечает не один, а сразу множество взаимосвязанных генов. Кроме того, врачи уверены, что более существенную роль в данном вопросе играют воспитание и другие социальные факторы.

© DrAfter123/gettyimages.com
Можно ли унаследовать интеллектуальные способности
Считается, что интеллектуальные и эмоциональные способности будущего ребенка определяются большим набором генов, и предсказать, какую именно комбинацию они составят, наука пока не в состоянии. Поэтому утверждать, что у гениальных родителей рождаются только гениальные дети, нельзя. Хотя такой миф до сих пор существует: некоторые женщины даже продолжают выбирать себе избранника, исходя из его интеллектуальных способностей, или искать какого-нибудь выдающегося донора — нобелевского лауреата.
Однако есть теория, согласно которой IQ будущего ребенка в большей степени определяется матерью, поскольку в тех областях мозга, которые отвечают за интеллект, чаще активируется ген, наследуемый от нее. А вот за эмоциональное состояние и характер чаще отвечает отец. И в этом случае нобелевский лауреат может оказаться не самым лучшим кандидатом на отцовство.
Как наследуются болезни
Болезни могут наследоваться по-разному. В некоторых случаях патология должна быть у одного из родителей, который, в свою очередь, передает ее детям (с вероятностью 50%). В других болезнь наследуется только по женской линии, и в итоге страдают ей мальчики, а девочки остаются ее здоровыми носительницами. Есть и заболевания, которые переносят оба родителя — у них больной ребенок может появиться на свет только в 25% случаев.
Кроме того, существует множество патологий, которые не наследуются, а появляются случайным образом. Например, в одной половой клетке матери или отца происходят изменения без особых на то причин, и в семье, где никогда не встречались с генетическими заболеваниями, может родиться малыш с синдромом Дауна (хромосомной патологией) или ахондроплазией — моногенным заболеванием, которое проявляется как карликовость. В такой ситуации одна из главных задач врача-генетика — выяснить, как наследуется болезнь, проинформировать семью о возможных рисках рождения больного ребенка, а также рассказать, что можно сделать, чтобы ребенок родился здоровым.
© DrAfter123/gettyimages.com
Наследуются ли онкологические заболевания
Большинство онкологических заболеваний — это мутации в генах. Однако они возникают не в половых, а в соматических клетках и не передаются по наследству. В таком случае на их развитие большое влияние оказывают именно внешние факторы: курение, радиация и канцерогенные химические вещества.
Но, к сожалению, есть отдельные виды онкозаболеваний, к которым приводит мутация в генах: они переходят от родителей к ребенку. Самый известный пример — рак молочной железы, за появление которого отвечают гены BRCA1 и BRCA2. В группу риска попадает подавляющее большинство девушек и женщин, у которых в семье были случаи рака молочной железы, поскольку наличие мутации в генах сильно повышает риск развития этого заболевания в определенном возрасте. Это означает, что рак может появиться вне зависимости от образа жизни, занятий спортом и сбалансированности рациона.
Как разгадать свои гены
Попытаться разобрать загадочную ДНК и узнать больше о своих генах можно при помощи генетических тестов. Как правило, их рекомендуют проводить в первую очередь тем семьям, где уже были зафиксированы случаи наследственных заболеваний. Но есть скрининг-тесты, которые проводятся для всех, вне зависимости от того, есть ли вероятность возникновения наследственного заболевания. Например, сейчас у всех беременных женщин есть возможность сдать анализы на определение генетических заболеваний у эмбриона. Скрининг на раннем сроке проводится специально для того, чтобы определить, входят ли будущая мама и ее малыш в группу риска. Дальше назначаются дополнительные обследования, которые подтверждают или опровергают развитие патологии. В ходе беременности не менее важно своевременно делать УЗИ, потому что пороки развития у плода встречаются намного чаще, чем любые наследственные заболевания.
Будущие родители должны осознавать, что комбинации их генов не всегда могут привести к идеальному результату. Но с некоторыми из наследственных патологий ребенок может жить совершенно нормально, поэтому пугаться их не стоит.
Может ли врач исправить наследственность
Если представить, что врач на начальном этапе сможет скомбинировать гены так, чтобы исправить недочеты в хромосомах будущего ребенка, родители, наверное, согласятся. Хотя стоит взять в расчет то, что часто двигателями прогресса, науки и искусства становятся именно неординарные люди. У талантливых художников, поэтов или музыкантов неоднократно были зафиксированы особенности развития, и если бы отбор по таким критериям существовал сотни лет назад, то мир лишился бы практически всех гениев.
Сейчас мы знаем многое о геноме человека и уже научились читать его последовательность. Но вот понять смысл этого «текста» можем далеко не всегда. Так же, как не всегда знаем, повлияет ли положительно наше вмешательство в структуру одного гена на работу других. Больше того, функция многих участков ДНК до сих пор остается не изучена.

© DrAfter123/gettyimages.com
ЭКО и дети из пробирки
Когда начинаешь работать с чем-то малоизвестным (а это часто встречается в генетике), всегда возникает вопрос о том, что делать правильно и этично, а что нет. Сегодня в цивилизованных странах накладывается запрет на генетические манипуляции с половыми клетками, потому что мы не знаем, как их изменения могут передаваться дальше и к каким последствиям это приведет. И, конечно, нельзя проводить эксперименты на живых эмбрионах.
Пока что в случае обнаружения какого-либо генетического заболевания врач может только предложить пренатальную или предимплантационную диагностику — метод, позволяющий произвести генетическую экспертизу одной клетки эмбриона перед процедурой ЭКО (экстракорпорального оплодотворения). Задача такой диагностики — предоставить возможность рождения здоровых детей в семьях, где существует высокий риск рождения ребенка с тяжелыми заболеваниями. Но у любых современных технологий, включая ЭКО, есть свои риски. Даже после подсадки эмбрион может не прижиться. При этом среди нас уже растет множество детей, которые появились благодаря искусственному оплодотворению, и они совершенно ничем не отличаются от обычных малышей.
Что происходит с эволюцией
В глобальном плане человеческие гены могут со временем мутировать и видоизменяться. И онкологические заболевания — одна из самых ярких иллюстраций этого процесса. Теперь, когда продолжительность жизни выросла, увеличилась и вероятность появления опухолей. С другой стороны, прогресс тоже не стоит на месте: появляется все больше методов диагностики и лечения, которые помогают справляться с тяжелыми недугами.
Еще до недавнего времени выявление генетических заболеваний было непростой задачей. Однако методы секвенирования уже позволяют «читать» ДНК не по одной букве-нуклеотиду, а разбирать все буквы одновременно. Так можно выявлять и мутации, передающиеся по наследству и новые, от появления которых не застрахован никто. Конечно, некоторые окружающие факторы тоже могут влиять на то, как ведут себя наши гены. Это и экология, и пища, и привычки. Их изучением наука тоже занимается активно.
Куда движется генетика
Генетика становится всеобъемлющей: по одной капле крови теперь можно определить все, что веками записывалось в ДНК человека. Вместо сотрудников диагностикой занимаются математические алгоритмы. Вполне возможно, что через некоторое время генетическая экспертиза станет обычным делом и без нее не будет обходиться даже рядовой прием у врача-терапевта.
И наверняка будет создаваться все больше препаратов, основанных на принципах персонализированной медицины, которые подбираются в зависимости от особенностей метаболизма пациента и его мутаций. Что же касается детей на заказ, то наука должна помогать нам корректировать гены только в случаях тяжелых наследственных заболеваний, а не для того, чтобы выбирать пол ребенка и цвет его глаз или особенности поведения. В этом вопросе нужно позволить природе комбинировать наши гены для появления на свет совершенно неповторимого чудесного существа — человека.
Теперь у нас есть точный способ корректировать, заменять или даже удалять дефектные ДНК. Научный редактор The Guardian Ян Сэмпл объясняет научную сторону редактирования генома и риски, которые могут возникнуть в будущем.
Так что же такое редактирование генома?
Учёные сравнивают это с программами в компьютере, которые находят и заменяют ошибки в тексте. Только вместо исправления слов, редактор генома исправляет ДНК – биологический код, который является своеобразной “инструкцией” к живым организмам. С помощью редактирования генома исследователи могут деактивировать отдельные гены, корректировать вредоносные мутации и изменять активность специфичных генов у растений и животных – в том числе и у людей.
В чем смысл?
Энтузиазм вокруг темы редактирования генома объясняется возможностью лечить или предотвращать заболевания. Существуют тысячи генетических нарушений, которые передаются от поколения к поколению; многие из них – серьёзные и разрушительные. И они не редки: один ребёнок из двадцати пяти рождается с генетическим заболеванием. Среди самых распространённых – муковисцидоз (заболевание, которое характеризуется поражением желез внешней секреции – прим.), серповидноклеточная анемия (изменение строения белка гемоглобина, ведущее к тяжёлой форме анемии – прим.) и мышечная дистрофия.
Редактирование генома вселяет надежду на то, что эти болезни могут быть побеждены путём “переписывания” повреждённых генов в клетках пациента. Однако починка дефектных генов – это ещё не все возможности; уже есть опыт модифицирования иммунных клеток человека для борьбы с раком или для повышения их устойчивости к ВИЧ-инфекции. Также возможно исправление дефектных генов у человеческого эмбриона – таким образом можно предотвратить наследование серьёзных заболеваний. Но эта технология неоднозначна, так как генетические изменения могут распространиться на сперму или яйцеклетки пациента, то есть все внесённые генетические корректировки и любые побочные эффекты могут быть переданы следующим поколениям.
В каких ещё сферах применяется редактирование генома?
Агроиндустрия совершила большой скачок с помощью редактирования генома по целому ряду причин. Эта процедура быстрее, дешевле и более точная по сравнению с традиционной генетической модификацией, но помимо этого она позволяет производителям улучшать урожай без добавления генов других организмов – это как краеугольный камень всех споров вокруг ГМО в некоторых странах. С помощью редактора генома исследователи вырастили томаты без семян, пшеницу без глютена и грибы, которые не коричневеют со временем.
Некоторые отрасли медицины также воспользовались потенциалом новой технологии. Компании, работающие над производством антибиотиков нового поколения, разработали вирусы, которые сами по себе безопасны, но умеют находить и атаковать специфичные, вызывающие опасные инфекции штаммы бактерий. Также учёные используют редактор генома, чтобы обезопасить пересадку органов свиньи человеку. Помимо этого, редактирование генома повлияло на фундаментальные исследования, позволив учёным более точно понимать, как работают те или иные гены.
Так как это работает?
Есть множество способов редактировать гены, но настоящим прорывом в последние годы стал молекулярный инструмент Crispr-Cas9. Он использует особый участок бактериальной ДНК – CRISPR (буквально: короткие палиндромные повторы, регулярно расположенные группами) – чтобы найти специфическую область в генетическом коде организма, например, мутировавший ген. Эта область в дальнейшем отсекается с помощью фермента Cas9. В попытках восстановить повреждения клетка часто “отключает” этот ген. Этот способ очень полезен для работы с “вредоносными генами”, но возможны и другие способы. Например, чтобы исправить дефектный ген, учёные могут разрезать мутировавшую ДНК и заменить здоровой цепочкой, которая доставляется вместе с молекулами Crispr-Cas9. Вместо Cas9 могут быть использованы другие ферменты, которые могут помочь редактировать ДНК более эффективно — например, Cpf1.
Напомните-ка, что такое гены?
Ген – это биологический шаблон, который организм использует для создания протеинов и ферментов, необходимых для построения и поддержания тканей и органов. Он представляет собой цепочку генетического кода, обозначаемого буквами G, C, T и A. У человека есть около 20 тысяч генов, сгруппированных в 23 пары хромосом, которые, в свою очередь, содержатся в ядре почти каждой клетки тела. Только около 1.5% нашего генетического кода, или генома, состоят из генов. Ещё 10% регулируют их, удостоверяясь, например, что гены включаются и выключаются в нужных клетках в нужное время. Остальная часть ДНК, судя по всему, бесполезна. “Бóльшая часть нашего генома не делает ничего, – говорит Джертон Лантер, генетик из Оксфордского Университета. – Это просто осколок эволюции”.
Что за G, C, T и A?
Буквы генетического кода соответствуют молекулам гуанина (G), цитозина (С), тимина (Т) и аденина (А). В ДНК эти молекулы идут попарно: G и С, Т и А. Эти “основные пары” являются ступенями всем знакомой двойной спирали ДНК. Чтобы составить один ген, нужно много таких ступеней. Мутировавший ген, ответственный за муковисцидоз, содержит около 300.000 базовых пар, а за мышечную дистрофию – около 2,5 миллионов пар, это самый длинный ген в человеческом теле. Каждый из нас наследует от наших родителей около 60 новых мутаций, большинство – от отцов.
Но как добраться до нужных клеток?
Это весьма трудная задача. Большинство лекарств – это маленькие молекулы, которые могут путешествовать по телу с потоком крови, именно так они доставляются к органам и тканям. По сравнению с ними, молекулы, используемые в редакторе генома, огромны и доставить их к клеткам сложно. Но возможно. Один способ – добавить молекулы редактора генома в безвредные вирусы, которые инфицируют определённые типы клеток. Миллионы таких вирусов после этого вводятся в кровь или напрямую в поражённые ткани. Оказавшись в теле, вирусы вторгаются в необходимые клетки и высвобождают молекулы редактора генома, чтобы те делали свою работу. В 2017 году учёные из Техаса таким образом вылечили мышей от мышечной дистрофии Дюшена. Следующий шаг – клинические испытания на человеке.
Однако вирусы – не единственный способ доставить молекулы к клеткам. Исследователи использовали жировые наночастицы для переноса молекул Crispr-Cas9 к печени, а также короткие импульсы электричества, чтобы “открыть” поры эмбриона и через них ввести молекулы редактора генома.
Редактирование обязательно делать в самом организме?
Нет. Во время одного из самых первых испытаний редактора генома учёные забирали клетки из крови пациента, выполняли необходимые генетические корректировки и вводили исправленные клетки обратно. Такой метод выглядит многообещающим для лечения для людей, живущих с ВИЧ. Когда вирус попадает в организм, он инфицирует и убивает иммунные клетки. Но чтобы инфицировать иммунную клетку, ВИЧ сначала должен прицепиться к определённым белкам на её поверхности. Учёные выделили иммунные клетки из крови пациента и использовали редактор генома, чтобы вырезать ту ДНК, которая нужна клеткам для образования этих поверхностных белков. Без них ВИЧ не может получить доступ к клеткам.
Подобный способ может использоваться для борьбы с некоторыми типами рака: иммунные клетки выделяются из крови пациента и редактируются так, что они больше не могут синтезировать поверхностные белки, к которым цепляются раковые клетки. Отредактировав иммунные клетки и сделав из них “убийц рака”, учёные размножают их и вводят обратно в организм пациента. Прелесть модифицирования клеток вне организма в том, что всё можно перепроверить до того, как вводить обратно, чтобы убедиться, что процесс редактирования проведён верно.
А что может пойти не так?
Современное редактирование генома довольно точное, но не идеальное. Процедура похожа на прицельную стрельбу – надо попасть по нужным клеткам, а по остальным – промахнуться. Даже если Crispr попадает куда нужно, изменения могут отличаться от клетки к клетке, например, в одной нужно исправить две копии мутировавшего гена, а в другой – только одну. Для некоторых генетических заболеваний это не столь важно, но становится проблемой, если заболевание возникает из-за единственного мутировавшего гена. Другая трудность возникает, когда изменения были произведены в неправильном участке генома. Таких “выстрелов не по мишени” может быть сотни, и они могут быть опасны, если разрушают здоровые гены или критически важные регуляторы ДНК.
Приведёт ли это всё к “редактированию” будущих детей?
Огромные усилия в медицине направлены на то, чтобы исправить дефектные гены у детей и взрослых. Но некоторые исследования показали, что есть возможность редактировать гены у эмбрионов. В 2017 году учёные, созванные Национальной Академией Наук и Национальной Академией Медицины США, сдержанно поддержали редактирование генома у человеческих эмбрионов для предотвращения самых серьёзных заболеваний, но только один такой опыт оказался безопасным.
Любые изменения на эмбриональной стадии повлияют на все клетки человека и будут переданы его детям, поэтому очень важно избегать вредоносных ошибок и побочных эффектов. Проектирование человеческих эмбрионов также поднимает вопрос непростой перспективы “дизайна” детей, когда эмбрионы редактируются больше по социальным, чем по медицинским причинам; например, чтобы сделать человека выше или умнее. Однако такие черты могут контролироваться тысячами генов, большинство из которых ещё неизвестны. Поэтому на данный момент перспектива редактирования генома будущего потомства весьма отдалённая.
Когда редактирование будет доступно простым пациентам?
Открытие клиникам доступа к редактированию генома – практически на финишной прямой. Около десятка испытаний Crispr-Cas9 запланированы или проводятся прямо сейчас. Большинство из них ведётся китайскими исследователями с целью борьбы с разными формами рака. Одно из первых исследований было запущено в 2016 году, когда учёные из провинции Сычуань вводили отредактированные иммунные клетки пациентам с поздней стадией рака лёгких. Большинство американских и европейских исследований ожидают своего начала в течение следующих нескольких лет.
Что дальше?
Базовое редактирование
Более мягкая форма редактирования генома – без разрезания ДНК на кусочки – использует химические реакции, чтобы изменить буквы генетического кода. Пока что это выглядит неплохо. В 2017 году исследователи в Китае использовали базовое редактирование для исправления мутаций, которые вызывают серьёзные нарушения кровеносной системы: как, например, гемолитическая анемия у человеческих эмбрионов.
Перемещение генов
Спроектированное перемещение генов может доставить определённые гены целым популяциям организмов. Например, таким образом можно сделать москитов бесплодными и сократить количество заболеваний, которые они распространяют. Но эта технология очень противоречива, так как может иметь широкомасштабные непреднамеренные экологические последствия.
Редактирование эпигенома
Иногда нет цели полностью удалить или заменить ген – необходимо просто ослабить или усилить его активность. Сейчас учёные работают над способностью Crispr выполнять такие задачи, предоставляя его молекулам больше возможностей, чем раньше.
