Трансплантация печени – показания и особенности
Для успешной трансплантации печени пациентам с терминальной стадией заболевания печени (рак печени, цирроз) важно, чтобы сохранялись критерии подходящего донора печени.
Пересадка печени – это метод лечения печеночной недостаточности, когда этот орган не может выполнять свои и никакие другие методы лечения не подходят. Также пересадка печени может проводиться у пациентов с раком печени.
Печеночная недостаточность может быть острой или хронической. В первом случае нарушение функций печени возникают в течение нескольких недель. Обычно, она является является результатом токсического воздействия на печень.
Несмотря на то, что трансплантация печени может применяться в лечении острой печеночной недостаточности, ее чаще используют у пациентов с хронической печеночной недостаточностью. Такое состояния возникает медленно в течение нескольких месяцев и лет.
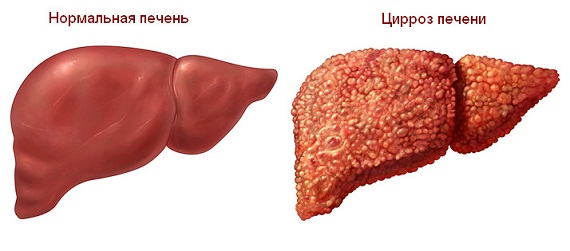
Хроническая печеночная недостаточность может быть вызвана различными состояниями. Наиболее распространенной причиной хронической печеночной недостаточности является цирроз, процесс, при котором рубцовая ткань заменяет нормальную ткань печени и ухудшает функцию печени. Цирроз является наиболее частой причиной пересадки печени.
Основные причины цирроза, приводящие к печеночной недостаточности и необходимости пересадки печени, включают:
- Вирусный гепатит B и C.
- Алкогольная болезнь печени.
- Неалкогольной стеатоз.
- Генетические заболевания, поражающие печень (включая гемохроматоз и болезнь Вильсона).
- Заболевания, которые влияют на желчные протоки, такие как первичный билиарный цирроз, первичный склерозирующий холангит и атрезия желчных путей. Атрезия желчевыводящих путей является наиболее распространенной причиной пересадки печени у детей.
Пересадка печени может быть показана при некоторых виды рака печени (чаще первичные формы рака печени).
Недостаток донорских органов является основным ограничивающим фактором при трансплантации печени. Оптимальный вариант — доноры, которые являются молодыми, здоровыми людьми, погибшими в результате смерти головного мозга из-за таких причин, как травма головы, внутримозговое кровоизлияние или аноксия. Относительный недостаток донорских органов привел к тому, что центры трансплантации вынуждены были заниматься забором донорских органов у пациентов, выходящих из критериев оптимального донора.
В настоящее время подбор донора для пересадки печени является стандартизованным процессом. При этом в различных медцентрах имеются свои критерии оптимального донора печени. Так как потребность в пересадке печени в последнее время выросла, стали использоваться донорские органы, которые ранее выходили из критериев непригодности к пересадке.
Для успешной трансплантации печени пациентам с терминальной стадией заболевания печени (рак печени, цирроз) важно, чтобы сохранялись критерии подходящего донора печени. Донором печени может быть человек в возрасте от 2 месяцев до 55 лет.
Важно, чтобы донор не страдал какими-либо системными заболеваниями, метаболическими и обменными нарушениями, включая диабет. Для пересадки печени годится орган без признаков жировой дистрофии, что отмечается у пациентов с ожирением.
Риск ишемических поражений ткани печени донора увеличивается в случае, если у него до момента клинической смерти отмечалось значительное снижение артериального давления, кислородного голодания, а также не было остановки сердца на долгий срок.
Еще один важный критерий подбора донорской печени — совместимость донора и реципиента по группе крови. При несовместимости групп крови может возникнуть реакция отторжения. В таких случаях трансплантация печени при отсутствии совместимости по группе крови донора и реципиента допустимо только в случае, когда имеется неотложная ситуация.
Важным считается также обследование донора печени на предмет маркеров вирусного гепатита С и В, а также ВИЧ и цитомегаловируса.
В случае, если оптимальный донор печени найдет и соответствует всем критериям, печень выделяется и охлаждается через введение раствора Рингела-Локка в селезеночную вену и аорту. Отток жидкости производится через канюлирование нижней половой вены. Затем донорскую печени снова подвергают промывке через печеночную артерию и воротную вену. Хранение печени в ходе ее транспортировки осуществляется в растворе Висконсинского университета в специальном транспортируемом холодильнике. Таким образом стало возможным хранить донорскую печень до 20 ч, что позволяет проводить операцию пациенту, который ждет донорскую печень, в удобное время, без спешки.
Если донор печени и сам реципиент находятся в одной клинике, то пересадку может проводить один хирург. В современных центрах трансплантации пригодность и жизнеспособность донорской печени может оцениваться с помощью МРТ.
Также среди критериев пригодности донорской печени можно отметить такие факторы, как размеры печени и форма. Желательно, чтобы размеры донорской печени были не больше и не меньше, чем печень реципиента. Отметим, что если реципиенту пересажена донорская печень малых размеров, она постепенно увеличивается в размерах, которые соответствуют реципиенту в плане массы тела, пола и возраста.
Кто может стать донором?
В первую очередь проводится трансплантация печени от умершего донора. Смерть донорского мозга дважды подтверждается командой, состоящей из анестезиолога, невролога и лечащего врача, за исключением врача-трансплантолога.
Донором также может стать живой человек — родственник пациента со здоровым органом, не имеющий противопоказаний к операции, с одинаковой с пациентом группой крови, по его согласию.
Когда появляется подходящий орган, пациент должен как можно скорее прибыть на операцию, поэтому ему нужно находиться в том месте, где планируется проводить вмешательство. Орган может ждать реципиента не более 6 часов.
Вся операция по трансплантации занимает в среднем до 12 часов.
Каков прогноз после трансплантации печени?
Около 90% людей выживают через год после трансплантации печени, а 75% — через 5 лет. Хроническое отторжение трансплантата печени происходит примерно в 3–4% случаев.
Возможны следующие осложнения:
- кровотечение
- тромбоз сосудов
- стриктура (сужение) и перегиб печеночной артерии и воротной вены
- рецидив заболевания (например, рака, аутоиммунных заболеваний)
- другие системные осложнения, такие как инфекции, нарушения свертывания крови, респираторные расстройства, гипертония, почечные нарушения и заболевания костей
Обычно через 3-4 дня после операции функция печени и других систем стабилизируется, и пациенты переводятся в отделение интенсивной терапии. Примерно через две недели госпитализации пациент может быть выписан домой.
После трансплантации печени требуется иммуносупрессивное лечение: ослабление иммунной системы, предотвращение отторжения трансплантата.
Сколько стоит операция?
Стоимость операции в РФ составляет от 2,5 млн до 3,5 млн рублей в зависимости от типа операции, состояния пациента, региона, больницы. Возможно лечение по квоте, но скорее всего, вам придется ждать на нескольких этапах.
Где найти клинику для пересадки печени?
На портале RussianHospitals представлены лучшие медицинские центры России, где занимаются пересадкой органов. Если вы сомневаетесь в том, какую клинику выбрать, воспользуйтесь формой заявки на сайте, и мы предоставим вам предложения от ведущих клиник страны.
Чтобы получить предложения от клиник, выполните 3 несложных шага:
- Выберите клинику на RussianHospitals
- Заполните форму обращения и загрузите свои медицинские документы
- Получите ответ от клиники
Трансплантация или пересадка печени – частичная или полная замена пораженного органа реципиента (больного) здоровым донорским органом. Сегодня пересадка проводится как от мертвых, так и от живых доноров на платной или бесплатной основе.
Показания к пересадке
Трансплантация печени – радикальная мера, её назначают, когда терапевтическое лечение неэффективно.
Основные показания занесены в список национальных клинических рекомендаций:
- Рак печени. В сравнении с удалением опухоли, замена пораженного органа повышает выживаемость.
- Поликистоз. Множественное образование полостей с мертвыми клетками или жидкостью заменяет здоровую ткань, приводит к дисфункции органа. Если кисты вызваны вирусом, пересадка неэффективна.
- Муковисцидоз. Наследственное нарушение транспорта желчи, что приводит к замене желчных протоков соединительной тканью, атрофии печени и желчного пузыря.
- Печеночная недостаточность из-за отравления.
- Цирроз. Замена тканей печени фиброзной (прочной, неэластичной) соединительной тканью при гепатите С или из-за злоупотребления алкоголем. При циррозе не всегда разрешена пересадка, зависит от причины болезни.
- Билиарная атрезия – отсутствие или непроходимость желчных протоков у новорожденных. Основная причина детской трансплантации.
- Нарушение метаболизма. Заболевание Вильсона-Коновалова – накопление меди, атрофия тканей печени. Гемохроматоз – нарушение обмена железа, приводящее к дисфункции органа.

Донор печени
Донор печени – это человек, чей орган пересаживают живому, нуждающемуся пациенту. Выступить донором может живой или мертвый. В обоих случаях, помимо здоровой печени, не должно быть повреждений почек или желчных протоков.
От живого человека можно пересадить только часть железы, основные требования к донору:
- Возраст от 18, минимальный вес — 50 кг. Отсутствие беременности, если донор женщина.
- Желательно кровное родство до 4 колена включительно. Сюда входят внучатые племянники, бабушки, дедушки, тёти, дяди.
- Совместимость по группе крови. Желательно, по резус-фактору и тканевой принадлежности. Совместимость по всем параметрам даёт больше шансов на выздоровление.
- Отсутствие вирусных инфекций, перенесенных онкологических заболеваний и общее здоровье организма. Подтверждается анализами.
- Размер железы донора подходит по габаритам реципиенту.
Приоритет в трансплантации отдается печени от родственника. Орган приживется с большей вероятностью, и восстановление пройдет быстрее, так как на психологическом уровне такая пересадка переносится легче. Дополнительные преимущества – это сроки, трупную печень можно ждать до 2 лет.
От родного человека пересаживают левую часть печени: она больше по размерам и её легче изъять. Ребенку до 15 лет хватит половины этой части.
Мертвый донор – чаще это человек, умерший из-за черепно-мозговой травмы. Допустимый возраст от 2 месяцев до 55 лет. После смерти мозга, при совместимости с живым пациентом по группе крови и тканевой основе, орган изымают, помещают в стерильный контейнер и пересаживают не позже чем через 13-16 часов.
Для использования органов недавно умершего человека необходимо его прижизненное согласие на пересадку или разрешение родственников. Печень от мертвого донора можно пересадить сразу 2 пациентам: левую (большую) часть – взрослым, правую (меньшую) — детям.
Подготовка к операции
Перед пересадкой в клинике пациент проходит полное обследование, включающее в себя:
- Анализ крови на резус-фактор и группу.
- Томография брюшной полости.
- Серологический анализ на выявление ВИЧ, бруцеллеза, ЗППП или иных вирусных инфекций.
- УЗИ печени.
- Проба Манту.
- Электрокардиография.
- Заключение стоматолога.
- Заключение гинеколога.
- Сбор крови на случай обширного кровотечения во время ходе операции.
В течение полугода до операции (если она несрочная) пациент посещает нарколога и психиатра, придерживается здоровой диеты, ни в коем случае не употребляет алкоголь или табак.
В качестве предварительной медикаментозной подготовки прописывают:
- антигистаминные препараты – для предотвращения аллергических реакций;
- седативные препараты – для уменьшения эмоционального напряжения;
- препараты, снижающие артериальное давление;
- иммунодепрессанты – чтобы во время или сразу после операции организм не отторгнул орган, как чужеродное тело.
Важно! Если пациента заносят в список на трансплантацию, то во время ожидания он обязан находиться в городе. Информация о поступлении печени обычно приходит неожиданно и у больного есть максимум 6 часов на прибытие в больницу.
Как проходит ортотопическая трансплантация
Ортотопическая трансплантация печени – полное замещение органа реципиента на здоровый донорский орган или его часть. Пересадку выполняют хирург, гепатолог и анестезиолог, в особых случаях приглашают кардиолога и пульмонолога.
Операция по пересадке проходит в 3 этапа:
- Гепатэктомия – удаление собственной печени реципиента, длится от 2 до 4 часов. Если в ходе болезни орган утратил свою анатомическую конфигурацию или удалению предшествовали другие операции на печени, например, попытка желчеотведения при атрезии у детей, этап может затянуться. После удаления печени хирург сшивает сосуды и формирует обходной путь для венозной крови.
- Имплантация донорского органа и реваскуляризация (восстановление кровообращения) трансплантата. На этом этапе сосуды соединяют с новой печенью, проверяют состояние и цвет желчи.
- Восстановление желчных протоков. Печень пересаживают без желчного пузыря, после трансплантации хирург сшивает места соединения сосудов желчных протоков, дренирует открытую рану и зашивает полость.
Скорость операции зависит от координации бригад врачей: тех, кто изымает донорскую печень и тех, кто помещает её в организм пациента. Если донор и реципиент находятся в одной больнице, всю процедуру может проделать одна бригада. Операция длится от 12 до 20 часов.
Жизнь после операции
После успешной трансплантации пациента переводят в реанимацию на 3-7 дней.
Медикаментозная терапия после пересадки органа:
- Циклоспорин. Назначают курс иммуносупрессоров – препаратов для снижения действия антител на новый орган. Возможен пероральный прием до операции, после пересадки дозы вводят внутривенно около 7-10 дней.
- Метилпреднизолон и Азатиоприн. В случаях слабого функционирования почек.
- Такролимус. Назначают при отторжении печени.
Кровь регулярно проверяют на концентрацию лекарств. Если осложнений нет, пациента отпускают домой через 7-14 дней и назначают прием лекарств перорально.
Важно! Риск отторжения нового органа может остаться на всю жизнь, поэтому имунносупрессивную терапию продолжают не менее 5 лет.
Год после первой пересадки пациент придерживается диеты, чтобы уменьшить нагрузку на печень.
В список разрешенных продуктов входят:
- мясо на пару;
- овощи: свёкла, морковь, капуста, сладкий перец, тыква;
- фрукты: чернослив, виноград, яблоки;
- супы на овощном бульоне;
- овсянка, гречка и рис;
- ржаной хлеб.
В течение всего восстановления запрещается употреблять соленую, сладкую, жареную, острую пищу, жирные молочные продукты, алкоголь.
Важно! В 70% случаев после хорошо перенесенной операции, пациент будет жить более 5 лет. 87% детей восстанавливаются и нормально развиваются как физически, так и психологически.
Возможные осложнения
Осложнения после операции могут проявиться как у донора, так и у пациента.
Тяжелые последствия для донора
Внутреннее кровотечение или инфекция возникают менее чем в 1% случаев, они связаны с неаккуратной техникой забора органа. Уже через полгода печень восстановится до 85% начального объема.
Для реципиента
Помимо риска отторжения, возможны осложнения на протяжении от 1 до 26 недели после операции:
- 1-4 неделя: осложнения почечной, дыхательной и нервной систем, тромбоз печеночной артерии.
- 5-12 недели: вирусный гепатит С или гематит от CMV (из-за подавления иммунной системы).
- 13-26 недели: желчеистечение, клеточное отторжение, медикаментозный гепатит, рецидив исходного заболевания и тромбоз воротной вены.

Противопоказания к трансплантации
| Абсолютные | Относительные |
| 1. Активные, неизлечимый инфекционные заболевания (вирусный гепатит, туберкулез, ВИЧ).
2. Онкология на стадии метастаза. 3. Неоперабельные нарушения внутренних органов: сердечная, дыхательная, почечная недостаточность. 4. Инфекции, локализованные в других органах. |
1. Алкоголизм и наркозависимость.
2. Наличие ранних операций на органы брюшной полости. 3. Тромбоз воротной и брыжеечной вен. 4. Возраст более 60 лет. 5. Удаленная селезенка. 6. Ожирение. |
Где делают трансплантацию и сколько стоит?
Пересадку печени в России делают в институтах трансплантологии в Москве и Санкт-Петербурге, стоимость платной операции варьируется от 2,5 до 3 млн. рублей.
Важно! Официально граждане могут получить квоту на бесплатную пересадку. Однако тогда придется ждать очереди на сдачу анализов и саму операцию не менее года (если болезнь не смертельна). Ежегодно Минздравом выделяется ограниченное количество бесплатных трансплантаций, приоритет отдается тем, кто без донора не выживет.
Центры трансплантологии существуют по всему миру, больше всего операций проводят США, Германия, Израиль и Южная Корея. Средняя цена трансплантации в этих странах — 160-200 тыс. евро.
Строгая диета, употребление лекарств и регулярные обследования в трансплантологии – цена за здоровую печень и долгую жизнь. Не всегда можно дождаться операции по квоте, если есть шанс, лучше делать пересадку платно, чтобы не потерять драгоценные месяцы или годы здоровья.
В данной статье речь пойдёт о трансплантации печени: правовые аспекты трансплантации печени в РФ, показания к операции, подготовка к оперативному лечению, виды доноров, оперативное вмешательство у пациентов, особенности ведения реципиентов после операции.
Каждому человеку нужна здоровая печень для осуществления нормальной жизнедеятельности. Печень выполняет ряд жизненно важных функций в организме: она обеспечивает синтез глюкозы, белков, жиров, витаминов, выработку желчных кислот и холестирина, она отвечает за образования ряда факторов свёртывающей и противосвёртывающей систем организма. Также печень служит своего рода «фильтром» — она обеспечивает обезвреживание различных чужеродных веществ, в том числе аллергенов и токсинов. Если хотя бы одна из этих функций будет серьёзно нарушена, это может стать жизнеугрожающей ситуацией для организма.
Симптомы и синдромы заболевания печени:
- Желтуха — пожелтение кожи, и видимых слизистых оболочек;
- Потемнение мочи (цвет тёмного чая или тёмного пива);
- Обесцвечивание кала;
- Желудочно-кишечные кровотечения (рвота кровью, рвота чёрными массами, чёрный стул или кровь в стуле);
- Зуд;
- Асцит — скопление жидкости в животе;
- Склонность к кровоточивости слизистых носа, дёсен и т.д.;
- Энцефалопатия — нарушения памяти, забывчивость, спутанность сознания и подобные неврологические нарушения.
Помимо всего прочего, печеночная недостаточность даёт осложнения на другие органы и системы, что в итоге может привести к нарушению работы почек, лёгких, что в комплексе очень сильно ухудшает тяжесть состояния пациентов и требует дополнительного более сложного лечения.
При развитии печеночной недостаточности в исходе различных заболеваний, часто единственным методом лечения становится трансплантация печени.
Кто нуждается в трансплантации печени?
Трансплантация печени является наиболее эффективным и, часто, единственным радикальным методом лечения больных с терминальной стадией хронических диффузных болезней печени (цирроз, фиброз и пр.), фульминантной печеночной недостаточностью, злокачественными и доброкачественными опухолями печени.
В трансплантации печени нуждаются пациенты со следующими заболеваниями:
- Цирроз печени в исходе вирусных гепатитов B, C и D;
- Аутоиммунный гепатит;
- Токсический гепатит;
- Криптогенный цирроз печени (цирроз печени неуточнённой этиологии);
- Билиарный цирроз печени;
- Первичный склерозирующий холангит (ПСХ);
- Болезнь Кароли;
- Алкогольный цирроз печени (цирроз Лаэннека) — при условии 6-месячной алкогольной ремиссии;
- Острая печеночная недостаточность;
- Опухоли печени;
- Нейроэндокринные опухоли;
- Гепатоцеллюлярная карцинома (ГЦК);
- Гемангиоэндотелиома;
- Метастазы гастроинтестинальной стромальной опухоли (при условии медленного роста);
- Цирроз печени в исходе дефицита альфа-1-антитрипсина;
- Муковисцидоз; (статья по теме — трансплантация печени при муковисцидозе);
- Семейная гиперхолестеринемия;
- Гемохроматоз;
- Болезнь Вильсона-Коновалова;
- Болезни накопления гликогена
- Синдром Бадда-Киари;
- Синдром Клиглера-Найяра;
- Поликистоз печени;
- Синдром Алажиля;
- Амилоидоз;
- Саркоидоз;
- Обширная травма печени, ведущая к печеночной недостаточности.
Противопоказания к трансплантации печени.
После того как были исчерпаны возможности консервативного лечения и установлена необходимость трансплантации печени требуется ответить на 3 основных вопроса:
- Сможет ли пациент перенести операцию и ранний послеоперационный период;
- Будет ли пациент привержен к терапии и режиму необходимому для выживания после трансплантации печени;
- Есть ли у пациента сопутствующие заболевания, которые могут скомпрометировать его выживание или функцию трансплантата.
Абсолютные противопоказания:
- СПИД;
- внепечёночное распространение злокачественных опухолей;
- активная внепеченочная инфекция (туберкулез и другие);
- активный алкоголизм и наркомания;
- психические заболевания, исключающие регулярный прием иммунодепрессантов;
Относительные противопоказания:
- высокий кардиологический или анестезиологический риск;
- распространенный тромбоз воротной вены (статья по теме — трансплантация печени у пациентов с тромбозом воротной вены);
- ранее перенесенные вмешательства на печени;
- возраст более 60 лет;
- индекс массы тела (ИМТ) более 35 кг/м2.
Также читайте статью: Пересадка печени ребенку: о листе ожидания, донорах и операции.
Виды органного донорства.
В качестве потенциальных доноров рассматриваются как посмертные доноры, так и живые родственные доноры.
Трансплантация печени от посмертного донора.
Печень для трансплантации изымается только у посмертных доноров, перенесших смерть головного мозга (с сохранённым кровообращением и поддерживаемым аппаратным дыханием). Обстоятельства смерти и личности умерших доноров остаются конфиденциальными. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Подробнее здесь и здесь. Выполняют ортотопическую трансплантацию печени (целого органа), так и SPLIT-трансплантацию (донорская печени разделяется на две части и каждая часть пересаживается отдельному реципиенту).
Статья по теме: https://doctorsemash.com/tx-law-russia/
Трансплантация печени от живого донора.
В Российской Федерации, как и во многих других странах, в целях трансплантации печени широко распространено использование фрагментов печени взрослых доноров. Этот вид трансплантологической помощи обладает рядом преимуществ – хорошее качество трансплантата, возможность проведения операции в необходимые сроки, и как правило, тканевая совместимость с донором. Такой вид трансплантации в нашей стране наиболее часто выполняют детям (трансплантация левого латерального сектора печени, трансплантация правой или левой доли печени).
Правовые аспекты родственного органного донорства в РФ.
По законам Российской Федерации, трансплантация печени (как и почки) от живого донора может быть произведена только в том случае, если потенциальный донор является биологическим родственником реципиента. Это могут быть ближайшие родственники — мать или отец, а так же более отдалённые — тётки, дяди, сёстры и братья. Стоит отметить, что супруги не являются кровными родственниками. Также, если реципиент является усыновлённым ребенком, его усыновители не могут быть донорами для него, в отличие от его биологических родителей. К донорству нельзя принуждать. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Изъятие органов и (или) тканей для трансплантации у лиц, находящихся в служебной или иной зависимости от реципиента, не допускается. Подробнее здесь и здесь.
Статья по теме: https://doctorsemash.com/tx-law-russia/
Обследование живого родственного донора.
В качестве живого родственного донора обследуется кровный родственник реципиента старше 18 лет. В первоначальной беседе врач выявляет первичные противопоказания к донорству — проводит сбор анамнеза (выясняет у пациента подробно о перенесенных заболеваниях, наличии аллергических реакций, проводит измерение роста и веса, проводит психоэмоциональную оценку потенциального донора).
Далее проводится комплекс лабораторно-диагностического обследования, который включает в себя:
- Определение группы крови и резус-фактора;
- Клинический анализ крови с подсчётом лейкоцитарной формулы;
- Общий анализ мочи;
- Биохимический анализ крови;
- КЩС и электролитный статус;
- HLA-типирование и перекрестная лимфоцитотоксическая проба;
- Обзорная рентгенография органов грудной клетки;
- Электрокардиография;
- УЗИ сердца (ЭХО-КГ);
- Эзофагогастродуоденоскопия;
- Исследование функции внешнего дыхания (по показаниям);
- Ультразвуковая допплерография нижних конечностей.
Также, особенно важным аспектом обследования родственного донора является дооперационная оценка печени. Для этого выполняются УЗИ органов брюшной полости, мультиспиральная компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием. При индексе массы тела потенциального донора печени боле 25,0 баллов, выполняется пункционная биопсия печени.
Трансплантация печени (оперативное лечение).
Собственно оперативное вмешательства начинается с двухстороннего субкостального разреза, дополненного срединным разрезом до мечевидного отростка. При выполнении доступа требуется соблюдение тщательного гемостаза, ввиду наличия обширной развитой сети подкожных вен. Хирургическое вмешательство у реципиента включает в себя следующие этапы:
- Гепатэктомия;
- Наложение сосудистых анастомозов (в следующей последовательности – кавальная, портальная, артериальная реконструкция);
- Гемостаз и формирование желчеотводящего анастомоза.
Удаление пораженной печени в большинстве случаев представляет собой наиболее трудоемкий этап. В случае опухолевых поражений печени это связано с выраженной гепатомегалией. В случаях же цирроза, несмотря на значительное уменьшение размеров печени, гепатэктомия усложняется наличием венозных коллатералей в связках печени и ее воротах, наличием спаек, а также изменением обычных топографо-анатомических отношений в верхнем отделе брюшной полости и, нарушениями свертывающей системы крови.
Рассечение связочного аппарата начинают с круглой и серповидной связок. Затем пересекаются левая треугольная и левая венечная связки. Следующей составляющей этапа гепатэктомии является диссекция печеночно- двенадцатиперстной связки, при этом выделение воротной вены и печеночной артерии предусматривает полное освобождение от околососудистой ткани, тогда как при выделении желчного протока скелетирование последнего нежелательно.
Доступ к элементам печеночно-двеннадцатиперстной связки может быть крайне сложен. Изоляции элементов могут мешать увеличенные лимфатические узлы, содержащие множественные венозные и лимфатические коллатерали, спайки после перенесенных оперативных вмешательств. Общий желчный проток с окружающей клетчаткой пересекается. Собственная печеночная артерия выделяется до паренхимы. Она или ее долевые ветви должны быть лигированы как можно дистальнее. Проксимально артерия мобилизуется до желудочно- двеннадцатиперстной с выделением последней и взятием на держалку. Воротная вена склелетируется с подведением турникета.
После мобилизации элементов печеночно-двеннадцатиперстной связки рассекают правую венечную связку и мобилизуют правую долю печени. Данная манипуляция в условиях выраженного фиброза, развития венозных коллатералей, в особенности при уменьшении размеров печени представляет значительные трудности и нередко осложняется диффузным кровотечением из паренхимы печени. После описанных манипуляций становится доступной позадипеченочный отдел НПВ.
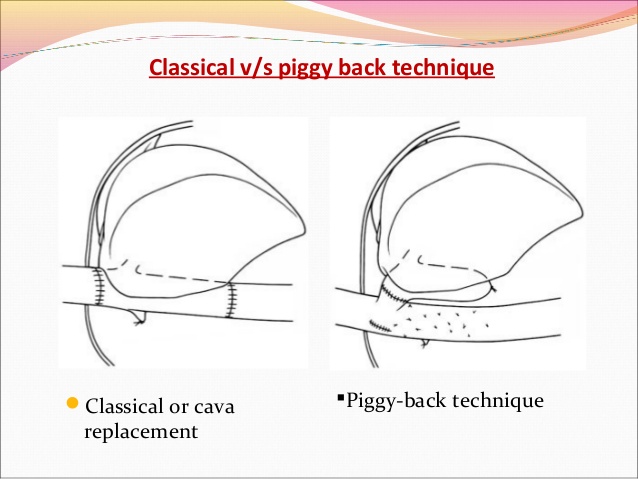
Дальнейшие действия зависят от избранной техники имплантации печени «классической» или Piggyback.
Техника классической трансплантации печени и техника Piggy-back.
Классическая техника ортотопической трансплантации печени.
Позадипеченочный отдел нижней полой вены мобилизуется на всем протяжении ретрокавального пространства: от почечный вен до диафрагмы. Ключевым моментом является выделение и пересечение правой надпочечниковой вены, впадающей непосредственно в нижнюю полую вену. После подготовки нижней полой вены пережимается воротная и полая вены (проксимально и дистально), выполняется гепатэктомия. Формируются анастомозы нижней полой вены донорской печени и реципиента проксимально и дистально и анастомоз воротной вены. Для поддержания гемодинамики традиционно использовалось обходное вено-венозное шунтирование. Для этого до гепатэктомии канюлируется воротная вена, предварительно подготовленные левая бедренная и подмышечная вены. Кровь от нижней половины тела и органов брюшной полости с помощью насоса направляется в верхнюю полую вену. Обходное вено-венозное шунтирование может применяться на начальных этапах освоения трансплантации печени.
Техника Piggyback.
Данный вариант подразумевает сохранение кровотока по нижней полой вене, отделение печени от позадипеченочного отдела НПВ. Пересечение связки НПВ по является ключевым моментом мобилизации позадипеченочного отдела НПВ, особенно в той ситуации, когда гипертрофированная хвостатая доля (I сегмент) окружает НПВ. Все мелкие печеночные вены, дренирующие хвостатую долю, и добавочные правые печеночные вены раздельно лигируются и пересекаются по направлению снизу вверх до уровня основных печеночных вен Таким образом, нижняя полая вена реципиента сохраняется на всем протяжении. Производится пережатие печеночных вен и воротной вены. Выполняется гепатэктомия без пережатия нижней полой вены. Устья печеночных вен объединяются, формируется анастомоз с надпеченочным отделом НПВ донорской печени. Подпеченочный отдел НПВ трансплантата ушивается. В некоторых случаях правая печеночная вена расположена каудально, что делает невозможным вовлечение ее в шов. В этом случае последнюю обходят циркулярно и пересекают между двумя зажимами, затем ушивают стороны НПВ непрерывным швом нитью / . В то же время пересечение правой печеночной вены позволяет отвести печень влево и провести безопасную изоляцию средней и левой печеночных вен.
Методика Piggyback c формированием анастомоза по типу «бок в бок».
Вариантом методики Piggyback, предложенным Belghiti является формирование анастомоза по типу «бок в бок» между ретропеченочным отделом НПВ реципиента и трансплантата. Производят предварительную подготовку НПВ трансплантата: ушиваются проксимальный и дистальный отдел полой вены донорской печени. После продольного частично пережатия полой вены реципиента максимально широко рассекается ее передняя стенка. Соответственно этому рассекается задняя стенка НПВ трансплантата, выполняется формирование анастомоза. В течение кавальной реконструкции трансплантат перфузируется мл или 1 раствора альбумина. Приступают к анастомозу воротной вены, которая предварительно максимально укорачивается. После окончания портального анастомоза снимаются зажимы с нижней полой и воротной вен, начинается реперфузия трансплантата. Кровотечение по линии анастомозов останавливается дополнительными швами. Артериальный анастомоз может быть выполнен в различных вариантах, в зависимости от состояния сосудов донора и реципиента, а также предпочтений хирурга. Наиболее часто артерия трансплантата на уровне чревного ствола анастомозируется с артерией реципиента на уровне гастродуоденальной артерии. В некоторых случаях использование артерии реципиента для анастомоза не представляется возможным (малый диаметр, доминирующая правая печеночная артерия из системы верхней брыжеечной артерии, изменения стенки сосуда после эндоваскулярных вмешательств). В этом случае может быть использована селезеночная артерия трансплантата. Альтернативным вариантом является использование подвздошных сосудов донора или сосудистого протеза и анастомоз с инфраренальным отделом аорты. Имплантация печени завершается билиарной реконструкцией. Наиболее предпочтительна холедохо-холедохостомия без дренирования. При невозможности использования собственного протока следует выполнить холедохоеюностомию. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Хирургическая техника родственной ортотопической трансплантации левого латерального сектора печени.
Донорский этап.
Донору выполняется левосторонняя латеральная секторэктомия. На основании принципов хирургии живых родственных доноров и необходимости получить жизнеспособный трансплантат с приемлемым анатомическим вариантом кровоснабжения и желчеоттока, основными задачами при операции у донора являются:
- минимизация кровопотери при сохранённом кровоснабжении печени в период разделения паренхимы;
- сокращение времени тепловой ишемии трансплантата;
- получение пригодных для последующей реконструкции участков сосудов (левой печ ночной вены, левой ветви воротной вены и левой печёночной артерии).
Левый латеральный сектор печени.
Реципиентский этап.
Операция у детей раннего возраста имеет ряд особенностей ввиду маленьких размеров брюшной полости ребёнка и проявлений основной болезни: гепатомегалии, спленомегалии, а также портальной гипертензии. Факторами, осложняющими операцию, могут быть последствия перенесённого ранее оперативного вмешательства. После пересечения связочного аппарата печени, мобилизации над-, подпечёночных и ретропечёночного отделов нижней полой вены и диссекции на протяжении элементов печёночно-двенадцатиперстной связки приступают к собственно гепатэктомии, которая включает:
- лигирование и пересечение долевых печёночных артерий;
- пережатие воротной вены сосудистым зажимом над областью слияния верхней брыжеечной и селезёночной вен;
- пережатие подпечёночного (над устьями почечных вен), затем надпечёночного отделов нижней полой вены;
- отсечение печени острым путём по паренхиме над нижней полой веной с оставлением на ней небольшого фрагмента;
- продольное рассечение остатка печени над нижней полой веной;
- прецизионное лигирование, клипирование и пересечение коротких вен, дренирующих преимущественно I сегмент и следующих к нижней полой вене от правой доли печени.
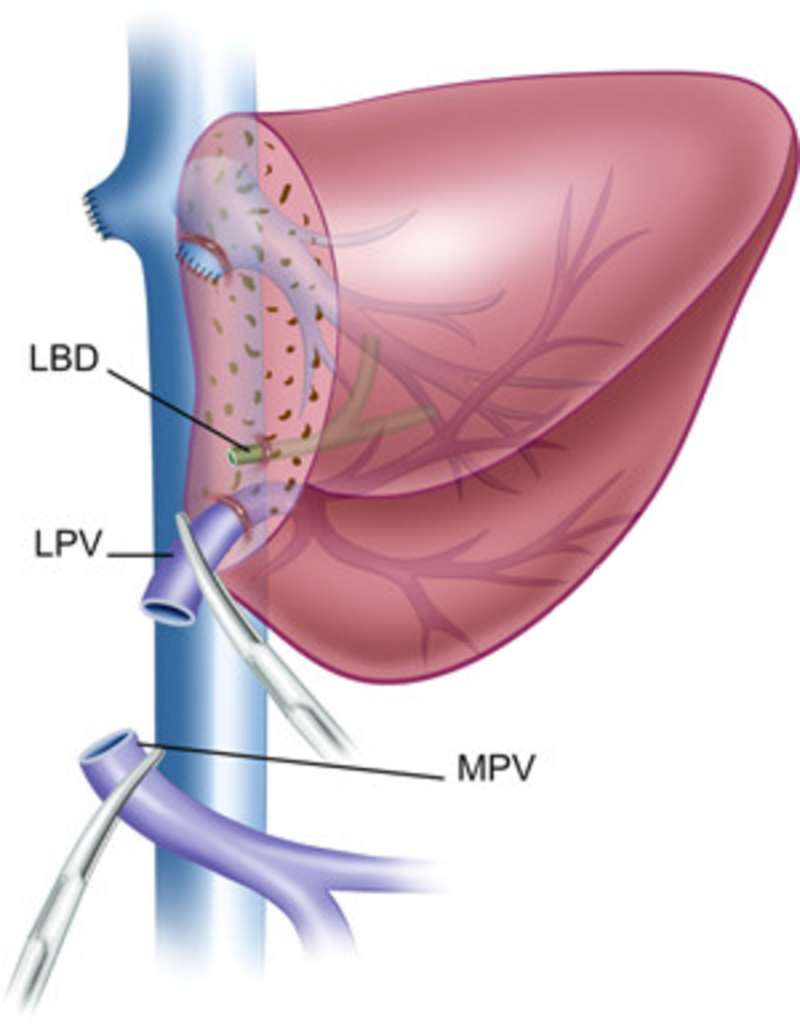
Методика имплантации левого латерального сектора печени После скелетизации и проверки герметичности нижней полой вены приступают к наложению сосудистых анастомозов. При наложении гепатико-кавального анастомоза необходимо создание широкого соустья путём объединения устий печёночных вен реципиента с последующим рассечением нижней полой вены в нисходящем направлении, таким образом создается треугольный дефект последней высотой 2,5-3 см, адекватный сформированному устью левой печ ночной вены трансплантата. Анастомоз накладывается непрерывным швом нитью PDS 5/0 или 4/0. Следующим накладывается порто-портальный анастомоз непрерывным швом нитью PDS 6/0. Завершение портальной реваскуляризации позволяет осуществить реперфузию трансплантата путём поочерёдного снятия зажимов:
- с надпечёночного отдела нижней полой вены;
- с воротной вены;
- с подпечёночного отдела нижней полой вены.
После выполнения гемостаза, следующего за реперфузией, в основном заключающегося в коррекции герметичности гепатикокавального анастомоза и дефектов стенки нижней полой вены, приступают к артериальной реконструкции. Принимается решение о выборе уровня печ ночной артерии реципиента для анастомозирования с левой долевой печёночной артерией трансплантата. Анастомоз накладывается атравматической нерассасывающейся нитью Prolene 7/0. Для увеличения просвета анастомозируемых сосудов прибегают к продольному рассечению соответствующих стенок артерий трансплантата и реципиента. Сосудистые анастомозы необходимо формировать при оптическом 3-х кратном увеличении операционного поля.
Билиарную реконструкцию выполняют путем наложения гепатикоеюноанастомоза с выключенной по Ру петлей тощей кишки. Диаметр протока трансплантата может быть увеличен за счет продольного рассечения его стенки. Дренирование желчных путей при выполнении билиарной реконструкции нецелесообразно. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Послеоперационное ведение пациентов после трансплантации печени.
В раннем послеоперационном периоде пациентам проводится мониторинг, который включает в себя:
- ЭКГ – ежечасно, запись на ленту – 1 р/сут с последующим описанием в отделении функциональной диагностики;
- Пульсоксиметрия – постоянно;
- Частота дыхания – постоянно;
- Диурез – катетер Фолея со стерильным мочеприемником для измерения почасового диуреза;
- Контроль отделяемого из дренажей, учет отделяемого по каждому дренажу в отдельности;
- Учет отделяемого по назогастральному зонду;
- Температура тела – постоянно.
Помимо этого, оцениваются следующие данные:
- Контроль показателей газового и электролитного состава крови, кислотно- щелочного равновесия каждые 3 часа;
- Контроль показателей тканевого метаболизма каждые 3 часа: уровень лактата, содержание глюкозы в плазме крови;
- Общий анализ крови (подсчет форменных элементов крови, уровень гемоглобина, гематокрита) один раз в сутки в течение 1 дней, далее при благоприятном течении послеоперационного периода 2 раза в неделю;
- Биохимическое исследование крови (билирубин (общий прямой), АСТ, АЛТ, ЛДГ, ГГТ, ЩФ, мочевина, креатинин, холестерин) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Показатели коагулограммы (время свертывания крови, протромбиновый индекс, МНО, агрегационная способность тромбоцитов, фибриноген, антитромбин III, протеин С) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Контроль титров группоспецифических антител, проводится в течение первой недели после трансплантации – ежедневно, далее 1 раз в 1-2 дня.С 3-й недели после операции, при условии гладкого течения послеоперационного периода, определение титров антигрупповых антител проводится дважды в неделю. С 4-й недели после операции и до выписки пациентов, перенесших трансплантацию от АВО-несовместимого донора, из стационара достаточным можно считать определение группоспецифических антител 1 раз в неделю (при отсутствии эпизодов их повышения);
- Ежедневные микробиологические исследования крови в течение 7 суток, затем в течение 7 суток 2 раза в неделю;
- Определение концентрации иммуносупрессивных препаратов. В течение 14 суток – ежедневно, далее — не менее 2 раза в неделю;
- УЗИ — ежедневно 1-2р/сут в течение 14 суток;
- Рентгенография органов грудной клетки 1-2 раза в неделю первые 2-3 недели;
- КТ по показаниям
Пациентам проводится антибактериальная, противогрибковая, противовирусная, иммуносупрессивная, гастропротективная, спазмолитическая, инфузионно-трансфузионная терапия, которая подбирается индивидуально.
Иммуносупрессивная терапия, как правило, назначается пожизненно.
После выписки из стационара, пациент должен регулярно наблюдаться амбулаторно.
Количество людей, прочитавших эту статью: 26 287
Процесс отбора доноров для трансплантации печени стандартизован. Однако критерии «хорошей» или «плохой» печени в разных клиниках различные. Растущая потребность в проведении трансплантации печени привела к использованию донорских органов, которые раньше могли быть признаны непригодными. При этом существенного учащения случаев неудач, связанных с плохой функцией трансплантата, не произошло.
Информированное согласие даётся родственниками донора. Возраст донора может быть от 2 мес до 55 лет. Донором печени является человек, получивший черепно-мозговую травму, в результате которой наступила смерть мозга.
Поддерживают адекватную деятельность сердечно-сосудистой системы, для осуществления функции дыхания производят искусственную вентиляцию лёгких. Трансплантация печени и других жизненно важных органов от доноров с сокращающимся сердцем сводит к минимуму ишемию, которая появляется при нормальной температуре тела и в значительной степени влияет на исход трансплантации.
У донора не должно быть других заболеваний, в том числе сахарного диабета и ожирения. Гистологическое исследование должно исключить жировые изменения в печени. У донора не должно быть периодов длительной артериальной гипотензии, гипоксии или остановки сердца.
Трансплантация печени без учёта группы крови по системе АВ0 может закончиться тяжёлой реакцией отторжения. Такую печень можно использовать в случае крайней необходимости в неотложных ситуациях.
Более трудным является подбор донора по системе HLA. Доказано, что несовместимость по отдельным антигенам HLA II класса даёт преимущества, особенно в предотвращении развития синдрома исчезновения жёлчных протоков.
Донора исследуют на маркёры вирусного гепатита В и С, антитела к CMV и ВИЧ.
Детали операции у донора и реципиента обсуждаются во многих работах. После выделения печени её охлаждают введением через селезёночную вену раствора Рингера и дополнительно через аорту и воротную вену 1000 мл раствора Висконсинского университета. Введённая в дистальный конец нижней полой вены канюля обеспечивает венозный отток. После иссечения охлаждённую печень дополнительно промывают через печёночную артерию и воротную вену 1000 мл раствора Висконсинского университета и хранят в этом растворе в пластиковом пакете на льду в переносном холодильнике. Эта стандартная процедура позволила увеличить время хранения донорской печени до 11-20 ч, сделала операцию у реципиента «полуплановой» и выполнимой в более удобное время. Один и тот же хирург может произвести операции у донора и реципиента. Дальнейшее усовершенствование консервации органов включает использование автоматического устройства для перфузии после доставки печени в центр трансплантации. Жизнеспособность трансплантата можно исследовать с использованием ядерного магнитного резонанса.
При подборе донорской печени необходимо, чтобы она по возможности соответствовала по размерам и форме анатомическим особенностям реципиента. Размеры донорской печени не должны быть больше и по возможности не должны быть меньше таковых у реципиента. Иногда печень маленьких размеров имплантируют крупному реципиенту. Донорская печень увеличивается в объёме со скоростью приблизительно 70 мл в день вплоть до достижения размеров, соответствующих массе тела, возрасту и полу реципиента.
Операция у реципиента
Средняя продолжительность операции трансплантации печени составляет 7,6 ч (4-15 ч). В среднем переливают 17 (2-220) доз эритроцитной массы. Используемый аппарат, возвращающий эритроциты, позволяет сохранить приблизительно треть объёма крови, изливающейся в брюшную полость. При этом кровь аспирируют и эритроциты после многократного отмывания и ресуспендирования вводят больному.
Выделяют анатомические структуры ворот печени, полую вену выше и ниже печени. Выделенные сосуды пережимают, пересекают, после чего удаляют печень.
Во время имплантации донорской печени приходится прерывать кровоток в системах селезёночной и полой вен. В беспечёночном периоде вено-венозное шунтирование с помощью насоса предотвращает депонирование крови в нижней половине тела и отёк органов брюшной полости. Канюли устанавливают в нижнюю полую (через бедренную вену) и воротную вены, отток крови осуществляется в подключичную вену.
Веновенозное шунтирование позволяет уменьшить кровоточивость, увеличить допустимое время операции и облегчить её выполнение.
Наложение всех сосудистых анастомозов завершают до восстановления кровотока в имплантированной печени. Необходимо исключить тромбоз воротной вены. Часто встречаются аномалии печёночной артерии, и для её реконструкции следует использовать донорские сосудистые трансплантаты.
Анастомозы обычно накладывают в следующем порядке: надпечёночный отдел полой вены, подпечёночный отдел полой вены, воротная вена, печёночная артерия, жёлчные протоки. Билиарную реконструкцию обычно выполняют наложением холедохохоледохоанастомоза на Т-образном дренаже. Если у реципиента поражён или отсутствует жёлчный проток, выполняют холедохоеюностомию конец в бок с выключенной по Ру петлёй тощей кишки. Перед ушиванием брюшной полости хирург обычно выжидает примерно 1 ч для выявления и устранения оставшихся источников кровотечения.
Трансплантация частей печени (уменьшенной или разделённой печени)
Из-за трудностей в получении донорских органов малых размеров для трансплантации детям стали использовать часть печени взрослого донора. Этот метод обеспечивает получение двух жизнеспособных трансплантатов из одного донорского органа, хотя обычно используют лишь левую долю или левый латеральный сегмент. Соотношение массы тела реципиента и донора должно составлять приблизительно 3:4. В 75% случаев трансплантации печени у детей используют уменьшенный донорский орган взрослого человека.
Результаты не столь удовлетворительны, как при пересадке всего органа (годичная выживаемость составляет соответственно 75 и 85%. Наблюдается большое число осложнений, включая увеличение кровопотери во время операции и неадекватное кровоснабжение трансплантата вследствие гипоплазии воротной вены. Потеря трансплантата и билиарные осложнения у детей наблюдаются чаще, чем у взрослых.
Трансплантация печени от живого родственного донора
При особых обстоятельствах, обычно у детей, можно использовать в качестве трансплантата левый латеральный сегмент печени от живого родственного донора. Живыми донорами являются кровные родственники больного, которые должны дать добровольное информированное согласие на операцию. Это позволяет получить трансплантат при отсутствии трупного донорского органа. Такую операцию производят у реципиентов с терминальной стадией заболевания печени или в странах, где запрещена трансплантация трупных органов. При высоком уровне хирургической техники и анестезиологического пособия, а также интенсивной терапии риск для донора составляет менее 1%. Период госпитализации длится в среднем 11 дней, а кровопотеря составляет только 200-300 мл. Изредка у донора могут развиться осложнения во время операции и после неё, например повреждение жёлчных протоков и селезёнки или абсцедирование.
Эту операцию в основном выполняют у детей. Её применяли при первичном билиарном циррозе, а также при ФПН, когда отсутствовала возможность срочно получить трупную печень. Недостатком операции является также отсутствие времени для предоперационной подготовки донора, в том числе психологической, и заготовки аутологичной крови.
Гетеротопическая трансплантация добавочной печени
При гетеротопической трансплантации здоровую ткань донорской печени пересаживают реципиенту, оставляя его собственную печень. Эта операция может проводиться при ФПН, когда есть надежда на регенерацию собственной печени, а также для лечения некоторых метаболических дефектов.
Обычно используют уменьшенный трансплантат. Левую долю донорской печени удаляют, а сосуды правой доли анастомозируют с воротной веной и аортой реципиента. Донорская печень гипертрофируется, а собственная печень реципиента подвергается атрофии.
После восстановления функции печени больного иммунодепрессивную терапию прекращают. К этому времени дополнительная печень атрофируется и может быть удалена.
Ксенотрансплантация
Трансплантация печени бабуина была осуществлена у HBV- и ВИЧ-положительного больного с терминальной стадией цирроза. Ранние результаты оказались хорошими, однако через 70 дней больной умер от сочетанной бактериальной, вирусной и грибковой инфекций. Подобные операции в дальнейшем не выполнялись, что объясняется нерешенностью ряда вопросов, в том числе связанных с этической стороной проблемы и с защитой прав животных.
Трансплантация печени в педиатрической практике
Средний возраст больных детей составляет приблизительно 3 года; трансплантация была с успехом выполнена и у ребёнка в возрасте до 1 года. Основная трудность заключается в подборе донора для детей, что обусловливает необходимость использования фрагментов трансплантата, полученных в результате уменьшения или разделения взрослой донорской печени.
Рост детей и качество жизни после трансплантации печени не страдают.
Маленькие размеры сосудов и жёлчных протоков вызывают трудности технического характера. Перед операцией необходимо исследовать анатомические особенности больного с помощью КТ или, что предпочтительнее, магнитно-резонансной томографии. Тромбоз печёночной артерии наблюдается по крайней мере в 17% случаев. Часто необходимы ретрансплантации. Высока также частота билиарных осложнений.
У детей в возрасте до 3 лет годичная выживаемость составляет 75,5%. Функция почек может ухудшиться после трансплантации, что обусловлено не только применением циклоспорина. Часто развиваются инфекционные осложнения, особенно ветряная оспа, а также заболевания вызываемые вирусом EBV, микобактериями, грибами рода Candida и CMV.
Иммунодепрессия
Обычно проводится многокомпонентная терапия, выбор протокола определяется конкретным трансплантационным центром. В большинстве клиник используют сочетание циклоспорина и кортикостероидов.
Циклоспорин можно назначать в предоперационном периоде перорально. При невозможности приёма препарата внутрь его вводят внутривенно. Назначение циклоспорина сочетают с внутривенным введением метилпреднизолона.
После трансплантации циклоспорин назначают внутривенно дробными дозами, если пероральный приём препарата окажется недостаточным. Параллельно внутривенно вводят метилпреднизолон, снижая его дозу до 0,3 мг/кг в сутки к концу 1-й недели. Если возможно, терапию продолжают, назначая препарат перорально. В других трансплантационных центрах не применяют циклоспорин до трансплантации, но вместе с метилпреднизолоном назначают азатиоприн; циклоспорин начинают вводить, убедившись в адекватности функции почек. Длительную поддерживающую терапию обычно проводят циклоспорином в дозе 5-10 мг/кг в сутки.
К побочным эффектам циклоспорина относится нефротоксичность, однако клубочковая фильтрация через несколько месяцев обычно стабилизируется. Нефротоксичность усиливается при назначении таких препаратов, как аминогликозиды. Электролитные нарушения включают гиперкалиемию, гиперурикемию и снижение уровня магния в сыворотке. Возможны также артериальная гипертензия, уменьшение массы тела, гирсутизм, гипертрофия дёсен и сахарный диабет. В отдалённые сроки могут наблюдаться лимфопролиферативные заболевания. Возможно развитие холестаза. Нейротоксичность проявляется нарушениями психики, судорогами, тремором и головной болью.
Концентрация циклоспорина и такролимуса в крови может меняться при одновременном приеме других лекарственных препаратов.
Циклоспорин – дорогой препарат; из-за малой широты терапевтического действия необходим тщательный контроль за лечением. Следует определять его истинную концентрацию в крови, вначале часто, а затем регулярно через определённые интервалы времени. Выбор дозы основывается на нефротоксичности препарата. Побочные эффекты могут потребовать снижения дозы вплоть до замены циклоспорина азатиопри-ном.
Такролимус (FK506) – антибиотик из группы макролидов, несколько сходный по структуре с эритромицином. Этот препарат вызывает более сильное, чем циклоспорин, подавление синтеза интерлейкина-2 (ИЛ-2) и экспрессии рецептора ИЛ-2. Препарат использовался для спасения больных с повторными кризами отторжения трансплантированной печени. По своему влиянию на выживаемость реципиентов и жизнеспособность трансплантатов он сопоставим с циклоспорином. Такролимус реже вызывает эпизоды острого и рефрактерного к лечению отторжения и необходимость в проведении кортикостероидной терапии. Однако число побочных эффектов, требующих прекращения лечения, больше, чем при терапии циклоспорином. К ним относят нефротоксичность, сахарный диабет, диарею, тошноту и рвоту. Неврологические осложнения (тремор и головная боль) при лечении такролимусом встречаются чаще, чем при использовании циклоспорина. Основным показанием к назначению такролимуса остаётся рефрактерное отторжение.
Взаимодействие между циклоспорином (и такролимусом) и другими препаратами
Повышают концентрацию циклоспорина
- Эритромицин
- Кетоконазол
- Кортикостероиды
- Метоклопрамид
- Верапамил
- Дилтиазем
- Такролимус
Снижают концентрацию циклоспорина
- Октреотид
- Фенобарбитал
- Фенитоин
- Рифампицин
- Септрин (бактрим)
- Омепразол
Побочные эффекты азатиоприна – угнетение костного мозга, холестаз, пелиоз, перисинусоидальный фиброз и веноокклюзионная болезнь.
Миграция клеток и химеризм
У реципиентов донорской печени выявлены донорские клетки. Этот химеризм может влиять на иммунную систему хозяина, вызывая развитие толерантности к тканям донора. Через 5 лет иммунодепрессивную терапию можно прекратить, не опасаясь развития отторжения трансплантата. К сожалению, полное прекращение возможно лишь приблизительно в 20% случаев, а значительное снижение дозы препаратов – у 55% реципиентов. У больных, у которых трансплантация печени была выполнена в связи с аутоиммунным гепатитом, при снижении дозы иммунодепрессантов может развиться рецидив заболевания.