Хлор элемент. Свойства хлора. Применение хлора
19 граммов на литр. Таково содержание хлора в морской воде. Норма для водопроводной – не более 1,5 грамма на литр. Для обеззараживания этого достаточно. Почему такая разница? Причина в соли, растворенной в океанах.
По химическому составу она является хлоридом натрия. В одном литре морской воды на него приходятся 35 граммов.

Не удивительно, что 19 из них – хлор. В мире его, как видно, немало. Велика и роль. Кто-то элемент боится, а кто-то понимает, что без него никак. Чтобы утвердиться в принятой позиции, или поменять ее, ознакомимся с фактами.
Свойства хлора
Хлор – элемент газообразный. Цвет у него желто-зеленый. Название 17-го элемента с греческого так и переводиться. Однако, ткани и бумагу вещество отбеливает. Правда, для этого нужна хлорноватистая кислота – итог взаимодействия хлора с водой.
В 18-ом веке, когда 17-е вещество только открыли, говорили «хлорная вода», не зная о том, что имеют дело с кислотой.
В начале 19-го века ей начали ополаскивать свои руки медики. Такая практика была введена, к примеру, в одном из госпиталей Вены. Врачи, конечно, не хотели отбелить руки. Хлорная вода служила обеззараживающим средством.
Способность 17-го элемента убивать болезнетворные бактерии заметили в конце 18-го столетия.
Раствор хлора – одно из примерно 200-от его соединений. В чистом виде элемент не встречается. Причина – высокая химическая активность. Вещество обязательно вступает во взаимодействие с «соседями». Однако, чистый хлор, все же, получен.

Первый удачный опыт проведен в 1774-ом году Карлом Шеелем. Это шведский химик. Он соединил соляную кислоту с пиролюзитом оксида марганца.
Понадобились предосторожности в работе с газом, ведь он токсичен. Если хлор попадает в легкие, то вызывает удушье и ожоги. Поэтому, в дыхательной системе, точнее в ее кровотоках, находят лишь соединения хлора. Общее содержание 17-го вещества в организме человека – 0,25% от массы.
Интересно! Хлор – хим. элемент, обнаруженный в большем количестве в телах профессиональных пловцов. Они, как говорится, не вылезают из бассейнов. Вода в них хлорирована и, видимо, ионы вещества просачиваются в кровоток.
Жидкий хлор – часть соляной кислоты, находящейся в желудке человека. 17-ый элемент в реагенте играет не только обеззараживающую роль, но и расщепляет пищу.
Получается, хлор, опасный в газообразном состоянии, приносит пользу в виде соединений, к примеру, той же поваренной соли.

Как видно, роль хлора весьма относительна. Он может быть благом, а может и ядом. В последнем амплуа элемент использовали немецкие войска.
Применение хлора
Хлор – химический элемент, используемый для производства соляной кислоты, не только в желудке.
Соляную кислоту с помощью 17-го вещества получают и вне организма. Соединение пригождается при дублении и окрашивании кож, на производстве активированного угля, синтетических красителей и органических полупродуктов.

Без хлора не обойтись и в гальванопластике. В составе соляной кислоты элемент нужен при изготовлении различных клеев и гидролизного спирта.
Обеззараживающая характеристика элемента пригождается теперь не в госпиталях, а в обработке водопроводной воды.
Ее хлорирование применяется больше века. Появилась альтернатива – озонирование. Хлор воду обеззараживает, но может негативно влиять на организм. Ресурсоснабжающие организации волнует еще и то, что 17-е вещество разъедает трубы.
Следовательно, сети чаще требуют ремонта и замены. Это убытки. Однако, пока, озонирование – лишь перспектива, а не реалии сегодняшнего дня.
Метод затратнее хлорирования, а результаты обработки воды не столь впечатляющие. В металлургии активный хлор участвует в процессах получения ниобия, титана, тантала. Это редкие и ценные металлы, так что у 17-го элемента важная роль. Уважают вещество и аграрии. Они закупают хлорорганические соединения.
С их помощью борются с сорняками. Чтобы отравление хлором «не заработали» и культурные растения, они должны быть двудольными. Реагент пагубно действует лишь на однодольные побеги. Содержат хлор и инсектициды. Эти соединения направлены уже на вредителей-насекомых.
Инсектициды убивают их избирательно, оставляя нетронутыми растения и полезные микроорганизмы. Потребность человеческого организма – 800 миллиграммов в сутки. Получают их не только из соли.

Продукты содержащие хлор
Помогут морская рыба, а так же, яйца, стручковый горох, гречка и рис. Рыбу заменяют устрицами и морскими огурцами.
Ионы хлора из них поддерживают осмотическое равновесие систем организма и регулируют водно-соляной обмен. Орган, в котором сосредоточенна основная масса 17-го элемента – кожа. Хлор в ней должен постоянно обновляться, поскольку выводится с потом и мочой.
В них переходит почти столько же вещества, сколько потребляется. Поэтому, хлор должен присутствовать в рационе всегда.
Добыча хлора
Методы 18-го века в 21-ом не актуальны. Вместо использованного когда-то Карлом Шееле оксида марганца и соляной кислоты применяют обычные соль и воду. Натрий хлор растворяют и подвергают действию электрического тока.
Не нужно ни специального оборудования, ни тары, ни повышенных температур. Современный метод прост и дешев. Сколько хлора произвести диктует спрос. Так, в 1970-е миру требовались 20 000 000 тонн в год.
Тогда, в производстве основных неорганических продуктов 17-ый элемент занял 5-е место. Позиция осталась прежней, но объем потребления вырос. На 2015-ый год — около 28 000 000 тонн. Это и хлор для бассейна, и хлористый винил, и пестициды, и растворители, и хлор в таблетках.
Последние растворяют в воде и используют, как моющее и обеззараживающее средство.

Половину хлора производят в Соединенных Штатах. Это обосновано потребностью в 17-ом веществе самой Америки.
В год внутренняя промышленность потребляет около 12 000 000 тонн реагента. Весома роль на рынке и у Великобритании. Производят, в основном, соединения 17-го элемента, к примеру, кислоты хлора.
Если говорить не об искусственном получении хлора и его производстве, а о добычи в природе, то она сводится к выработке каменной соли. Получается, месторождения 17-го вещества разрабатывали еще 3000-4000 лет назад. Тогда, добывать соль начали на землях современной Ливии.
Общее количество хлора в земных недрах – всего 0,017%. Получается, при активной добыче есть возможность истощения ресурсов. Так что, в далекой перспективе стоимость 17-го элемента может возрасти. А какова она на данный момент?
Цена хлора
Хлор купить в чистом виде можно канистрами. Как правило, это 30-литровая тара. В нее вмещаются 34 килограмма хлора. Это указывает на тяжесть вещества, даже в газообразном состоянии. Цена канистры со сжиженным хлором 1500-1800 рублей.
Остальная продукция основана на соединениях 17-го элемента, поэтому, стоимость, порой, непредсказуема. Ценник зависит от производителя, разрекламированности товара, его транспортировки, затрат на синтез, или добычу основы.
Так, белизну можно купить и за 13, и за 45 рублей. На отбеливающие порошки, собственно, столь же весомый разброс цен. Речь и о стиральных, и о чистящих составах. Средство для плиты, к примеру, предлагают и за 20, и за 80 рублей. Причем, объем одинаков. Обычно, это 500 граммов.
Интересно! Многие хлорсодержащие средства можно использовать в качестве изоляторов.
Сжиженный элемент №17 проводит электрический ток в миллиард раз хуже дистиллированной воды. Можно поаплодировать сему факту. Но, услышать авиации придется с запозданием. Дело в том, что звук тоже «вязнет» в хлоре, распространяясь в полтора раза медленнее, чем в атмосферном воздухе.
Источник
Хлор: лучший защитник от или токсичный яд




Репортеры программы «НашПотребНадзор» выяснили, правда ли хлорным отбеливателем моют курятину и орехи и насколько велик риск отравиться хлором, надышавшись его парами во время мытья полов или ванны.
Пока ученые ломают головы, придумывая лекарства от коронавируса, в США это лекарство уже вовсю продается. И это средство обычный хлор. Тот самый, из которого готовят отбеливатель. Конечно, никакое это не лекарство, а ядовитая смесь, и пить такое нельзя. Но за океаном просто бум спроса на него. А вот в России все наоборот. Хлора боятся так, что у хлорированный воды репутация страшного химоружия. А белую муку некоторые отправляют в черный список, потому что уверены: ее якобы отбеливают хлором. Так ли это?
Несмотря на свою токсичность, хлор зарегистрирован в европейской классификации пищевых добавок под кодом E925 и относится к хлебопекарным улучшителям. И руководитель крупнейшего в России мукомольного завода признаётся: самый популярный вопрос, который ему задают друзья и знакомые, правда ли, что мука на его заводе такая белая именно потому, что ее отбеливают хлором?
Но мука высшего сорта исключительно потому, объясняют технологи, что достают ее из самой сердцевины зерна, которая на две трети состоит из белоснежного крахмала. А отбеливание хлоркой миф.
А вот грецкие орехи на прилавках часто действительно намного светлее, чем в природе, когда их только сорвали с дерева, они, как правило, бурые и пятнистые. Фермеры, которым некуда торопиться, оставляют орехи под лучами солнца, и ультрафиолет отбеливают скорлупу. Но такой процесс занимает восемь дней, поэтому особо торопливые производители обрабатывают урожай раствором углекислой соды и хлорной известью, наводя белизну за пару часов. Такая химобработка не опасна, успокаивают эксперты. Куриное мясо тоже вымачивали в хлорке, вытравливая бактерий и выравнивая цвет тушек. Это правда. Но и в Европе, и в России сейчас делать так запрещено.
Хлором очищают водопроводную воду во всем мире. Это самый дешевый и доступный метод. Хлор разрушает оболочку клетки бактерии, и та погибает. В холерном XIX веке именно дезинфекция воды хлором спасла миллионы жизней. Обработка воды хлором способствовала ее обеззараживанию. Соответственно, такая вода уже была безопасна для применения, для использования в качестве питьевой воды.
Воду в бассейнах во всем мире тоже дезинфицируют преимущественно хлором, однако у такой санобработки есть серьезный побочный эффект. Так как хлор тяжелее воды, он начинает опускаться вниз. Ближе ко дну бассейна концентрация может быть больше намного, и люди, когда начинают плавать, этот хлор могут поднять. Но страшнее всего, если работники, которые отвечают за дезинфекцию бассейнов, халатно относятся к своей работе.
Опасным может быть и принятие ванны дома. Полчаса в хлорированной воде равноценны 10 литрам выпитой воды с хлором, так как распаренная кожа с открытыми порами впитывает вредные вещества, как губка.
Во время пандемии помешательство на дезинфекции не обошло стороной даже бывшего президента США Дональд Трамп призвал американцев лечить инфекции хлоркой в виде инъекций. В России чиновники подсели на «блокатор вирусов» бейдж с диоксидом хлора. Однако концентрация диоксида хлора, которая вокруг этого бейджика, ничтожно мала. Даже если вы будете находиться в замкнутом помещении, то для достижения необходимой концентрации, которая бы позволила убивать вирусы, необходимо несколько десятков часов. Если вы просто ходите по улице или по помещению с этим бейджиком, он абсолютно неэффективен. Кроме того, такой бейдж может привести к химическим ожогам на коже и повреждению слизистой.
Источник
Продукты питания богатые хлором
 Хлор – важнейший макроэлемент водно-солевого обмена в человеческом организме.
Хлор – важнейший макроэлемент водно-солевого обмена в человеческом организме.
У здоровых людей соединение содержится практически во всех клетках тела, однако, наибольшая концентрация сосредоточена в кожном покрове, межклеточной жидкости, костной ткани, крови и лимфе. Помимо регуляции кислотно-щелочного баланса, хлор участвует в поддержании осмотического равновесия внутри каждой клетки.
Данный элемент – эффективный антисептик, используемый для очистки воды от возбудителей инфекционных болезней: холеры, гепатита, брюшного тифа. При продолжительном отстаивании (8 – 10 часов) или кипячении хлор улетучивается.
Физические и химические свойства
Хлор – химический элемент главной подгруппы VII группы периодической системы Д. И. Менделеева, с атомарным номером 17. Впервые соединение в чистом виде выделено в 1774 году немецким химиком Карлом Вильгельмом Шееле в Швеции. Данный элемент – химически активный неметалл, входящий в группу галогенов. Элементарный хлор при нормальных условиях (0 градусов) – ядовитый газ жёлто – зелёного цвета с резким «удушающим» запахом, который в 3 раза «тяжелее» воздуха.
Соединение вступает в реакцию практически со всеми химическими элементами, образуя хлориды (кроме азота, кислорода, углерода, инертных газов). При растворении в щелочах или воде, он дисмутирует, переходя в хлорноватистую и соляную кислоты.
В природе хлор встречается только в составе минеральных соединений: сильвина KCl, галита NaCl, сильвинита KCl · NaCl, карналлита KCl·MgCl2·6Н2O, бишофита MgCl2·6H2O, каинита KCl·MgSO4·3Н2О. При этом, основные его запасы сосредоточены в солях морских и океанических вод, содержание которых стартует от 19 грамм на литр.
В здоровом организме взрослого человека, с массой тела 80 килограмм, присутствует не менее 95 грамм хлора.
Биологическая роль
 Первостепенная «задача» хлора – поддержание постоянного осмотического давления в крови, лимфе, внутриклеточных жидкостях, которое потенцирует выведение из организма излишка отработанных веществ и распределение полезных соединений в тканях, клетках и сосудах.
Первостепенная «задача» хлора – поддержание постоянного осмотического давления в крови, лимфе, внутриклеточных жидкостях, которое потенцирует выведение из организма излишка отработанных веществ и распределение полезных соединений в тканях, клетках и сосудах.
Другие свойства макроэлемента:
Биохимические реакции в организме человека, в которых участвуют ионы натрия и калия происходят только в присутствии хлора.
Суточная норма
Для здоровых людей дневная потребность в хлоре – 4000 – 6000 миллиграмм.
 При сбалансированном питании соединение в необходимом объёме поступает с едой. На сегодня верхний допустимый предел потребления хлора не установлен, однако минимальная дозировка составляет не менее 800 миллиграмм в день.
При сбалансированном питании соединение в необходимом объёме поступает с едой. На сегодня верхний допустимый предел потребления хлора не установлен, однако минимальная дозировка составляет не менее 800 миллиграмм в день.
Для детей суточная потребность в хлоридах варьирует от 300 до 2300 миллиграмм в зависимости от возраста ребёнка.
Дневная дозировка макроэлемента составляет:
Потребность в хлоре возрастает при жаркой погоде, интенсивных занятиях спортом, повышенном потреблении воды, обильном потоотделении.
Недостаточность и избыток хлора в организме
Учитывая, что заготовленные впрок продукты содержат соль, а очистка водопроводной воды выполняется с помощью хлора, нехватка хлоридов в здоровом организме – редкое явление. Однако часто дефицит макроэлемента возникает на фоне патологической функции внутренних органов.
Причины, провоцирующие недостаточность хлора в организме:
 Указанные факторы в 80 % случаев провоцируют дестабилизацию кислотно – щелочного равновесия, что влечёт за собой нарушение обменных процессов в организме.
Указанные факторы в 80 % случаев провоцируют дестабилизацию кислотно – щелочного равновесия, что влечёт за собой нарушение обменных процессов в организме.
Резкое уменьшение хлора в крови на фоне острой гипохлоремии чревато развитием тяжёлого состояния вплоть до комы или летального исхода.
Избыток хлора в 80 % случаев возникает у людей, работающих в фармацевтической, химической, целлюлозно-бумажной и текстильной промышленностях. Помните, вдыхание концентрированных хлорных паров оказывает губительное влияние на человеческий организм из-за торможения дыхательного центра и «обжигания» бронхиального ствола.
В повседневной жизни передозировка макроэлемента практически невозможна, поскольку 90-95% вещества выводится с мочой, 4–8 % – с калом, 1–2 % – с потом.
Рассмотрим какие факторы провоцируют гиперхлоремию (чрезмерное повышение концентрации хлора в крови).
Помимо этого, дезинфекция питьевой воды при помощи хлора приводит к образованию канцерогенных соединений (хлороформа, хлорфенола, хлоридов) в ней, которые провоцируют развитие респираторных заболеваний, гастритов, пневмоний.
 Признаки гиперхлоремии:
Признаки гиперхлоремии:
Если продолжительное время не купировать гиперхлоремию, происходит накопление воды в тканях и органах, что ведёт к стойкому повышению кровяного давления. В тяжёлых случаях избыток вещества в организме сопровождается подъёмом температуры тела и токсическим отеком легких. Стабилизировать водно-солевой баланс поможет уменьшение количества потребляемой соли, а также контроль качества выпиваемой воды.
Для обесхлоривания жидкости целесообразно использовать механизмы многоуровневой очистки, угольные фильтры, кипятить или отстаивать ее на протяжении 6 – 8 часов.
Источники хлора
Природным кладезями макроэлемента, помимо хлорированной воды, является хлорид натрия или обычная поваренная соль. С данным продуктом в организм человека поступает до 90 % дневной нормы соединения. Кроме того, он присутствует в морепродуктах, злаках, животных белках, овощах, фруктах и зелени.
| Наименование продукта | Содержание хлора в 100 граммах продукта, миллиграмм |
|---|---|
| Соль пищевая поваренная | 59 000 |
| Хлеб ржаной | 1020 |
| Сыр твёрдый | 880 |
| Хлеб белый | 620 |
| Сливочное масло | 325 |
| Язык говяжий | 250 |
| Почки свиные | 185 |
| Рыба (хек, мойва, минтай, сайра, сельдь) | 170 |
| Устрицы | 165 |
| Творог 9% | 150 |
| Оливки | 136 |
| Рис | 133 |
| Коровье молоко (цельное) 3 – 4 % | 115 |
| Кефир (домашний) 3 – 4 % | 110 |
| Яйцо куриное | 105 |
| Молоко пастеризованное | 100 |
| Овсяная каша | 70 |
| Гречка | 95 |
| Свёкла отварная | 60 |
| Горох | 55 |
| Картофель отварной | 40 |
| Морковь отварная | 35 |
| Капуста | 30 |
| Яблоки | 25 |
| Груши | 10 |
Таблица № 1 « Природные источники хлора»
Интересно, что добавление щепотки соли в готовое блюдо повышает концентрацию хлора в еде в 3 – 5 раз.
Вывод
Хлор – важнейший биогенный элемент для человеческого организма, который входит в состав практически всех клеток кожи, крови и костной ткани.
Данное вещество участвует в образовании желудочного сока, стимулировании выработки ферментов, формировании плазмы крови. Соединение играет ключевую роль в поддержании кислотно-щелочного и осмотического равновесия в лимфе, крови, спинномозговой жидкости. Наряду с этим, хлориды потенцируют отложение гликогена в тканях печени, вследствие чего повышается энергетический потенциал организма, особенно при физических нагрузках.
Дисбаланс хлора в организме в 80 % случаев сопровождается ухудшением общего самочувствия и появлением осложнений со стороны нервно-мышечной или сердечно-сосудистой систем.
Наибольшее содержание хлора в обычной поваренной соли, ввиду чего гипохлоремия у людей – редкое явление.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru

Источник
Как правильно развести хлорку для дезинфекции
Хлорная известь — порошок белого цвета с резким специфическим запахом (смесь гипохлорита, хлорида и гидроксида кальция), содержащий до 25% хлора. Агрессивна к материалам поверхностей, вызывает коррозию.
Хлорка для дезинфекции
Хлорная известь широко применяется для дезинфекции, так как активно уничтожает грамположительные и грамотрицательные бактерии (в том числе микобактерии туберкулёза), грибки (кандида и др.), вирусы (все виды ОРВИ, герпес, гепатиты А, В, С, ВИЧ, коронавирусы).
Сухим порошком хлорки дезинфицируют выгребные ямы, биологические жидкости и выделения больных (кровь, моча, рвотные массы, гной и др.).
Растворами хлорной извести различной концентрации обеззараживают поверхности в помещениях, транспорте, общественных местах (рынки, подъезды, игровые площадки и др.). Их используют для обработки инструментов и отбеливания посуды, очищения известкового налёта, стирки белья, дезинфекции детских игрушек, мебели, сантехники.
Как приготовить рабочий раствор хлорки
Сначала нужно развести основной, маточный 10%-ный раствор:
Из этого маточного раствора готовятся рабочие растворы нужной концентрации для дезинфекции различных поверхностей.
Для обеззараживания сантехники используется 5%, посуды – 0, 05-1%, пола и стен – 0,5-1%, рук – 0,25% растворы.
Во всех случаях растворы приготавливаются согласно приложенной инструкции.
Работу выполняет специально обученный персонал в индивидуальных средствах защиты (халат, перчатки, очки, респиратор).
Хлорсодержащие препараты относятся ко 2 классу опасности, поэтому обработку поверхностей следует проводить в отсутствии людей. После выдержки времени экспозиции (5-30 минут) необходимо хорошо промыть поверхность чистой водой и протереть сухой ветошью. Затем нужно проветрить помещение. Обычно запах хлорки полностью выветривается через час.
Другие хлорсодержащие дезинфектанты
Кроме хлорной извести для дезинфекции используется такой препарат как хлорамин (белый порошок с 28% активного хлора), имеющий менее интенсивный запах и слабую коррозию материалов.
Препараты на основе гипохлорита натрия («Доместос», «Белизна») оказывают своё дезинфицирующее действие за счет мощного окислительного эффекта активного кислорода, который выделяется при распаде хлорноватистой кислоты.
«Септолит ДХЦ»

Для дезинфекции поверхностей удобно использовать растворимые в воде таблетки, содержащие активный хлор. Таким средством является «Септолит ДХЦ», который выпускается российской компанией Сателлит.
Эти небольшие таблетки весом 3,3 г расфасованы по 300 шт. в пластиковые банки (вес 1 кг) с плотно завинчивающейся крышкой, исключающей намокание и повреждение. Препарат снабжён подробной инструкцией и всеми документами, необходимыми при проверке Роспотребнадзора.
Для приготовления рабочего раствора в пластиковую ёмкость с водой добавляют нужное количество таблеток. Быстро растворяясь, они выделяют активные хлор и кислород, которые губительно действуют на все патогенные микроорганизмы и споры.
Например, для дезинфекции санузла необходим 0,096% раствор с экспозицией 30 минут. Используя приложенную инструкцию, к 5 л воды добавим 3 таблетки средства, подождём до полного их растворения и получим нужный рабочий раствор. Его можно хранить в закрытой ёмкости до 7 дней.
Этот дезинфектант применяется для обработки поверхностей, инструментов, сантехники, посуды, уборочного инвентаря, биологических жидкостей в ЛПУ, парикмахерских, косметических салонах, лабораториях, детских учреждениях, в инфекционных очагах и на других объектах.
Источник
Запрос «Cl» перенаправляется сюда; см. также другие значения.
| Хлор | |||
|---|---|---|---|
| ← Сера | Аргон → | |||
|
|||
| Внешний вид простого вещества | |||

Жидкий хлор в запаянном сосуде под давлением |
|||
| Свойства атома | |||
| Название, символ, номер | Хлор / Chlorum (Cl), 17 | ||
| Группа, период, блок |
17 (устар. 7), 3, p-элемент |
||
| Атомная масса (молярная масса) |
[35,446; 35,457][комм 1][1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ne] 3s23p5 1s22s22p63s23p5 |
||
| Радиус атома | 99 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 102±4 пм | ||
| Радиус иона | (+7e)27 (-1e)181 пм | ||
| Электроотрицательность | 3,16 (шкала Полинга) | ||
| Электродный потенциал | +1,3595[2] | ||
| Степени окисления | -1, 0, +1, +3, +4, +5, +6, +7 | ||
| Энергия ионизации (первый электрон) |
1254,9(13,01) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
3,21 г/л; (жидкая фаза при −35 °C) 1,557 г/см3; (твердая фаза при −105 °C) 1,9 г/см³ |
||
| Температура плавления | 172,2К; −100,95 °C | ||
| Температура кипения | 238,6К; −34,55 °C | ||
| Критическая точка | 416,9 К, 7,991 МПа | ||
| Уд. теплота плавления | 6,41 кДж/моль | ||
| Уд. теплота испарения | 20,41 кДж/моль | ||
| Молярная теплоёмкость | 21,838[3] Дж/(K·моль) | ||
| Молярный объём | (ж) 18,7 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Орторомбическая | ||
| Параметры решётки | a=6,29 b=4,50 c=8,21 Å | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 0,009 Вт/(м·К) | ||
| Номер CAS | 7782-50-5 | ||
| Эмиссионный спектр | |||
|
|
Хлор (химический символ — Cl, от др.-греч. χλωρός — «изжелта-зелёный»[4], от лат. Chlorum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17.
Простое вещество хлор (при нормальных условиях) — ядовитый удушающий двухатомный газ (формула — Cl2) желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
История открытия хлора[править | править код]
Соединение с водородом — газообразный хлороводород — был впервые получен Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теорией флогистона, предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту. Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетического элемента мурия. Однако попытки его выделения оставались безуспешными вплоть до работ Г. Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор, доказав элементарную природу последнего.
В 1811 г. Дэви предложил для нового элемента название «хлорин» (chlorine). Спустя год Ж. Гей-Люссак «сократил» французское название до хлора (chlore), хотя в английском языке оно осталось прежним. В том же 1811 г. немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (дословно солерод), однако впоследствии этот термин закрепился за всей 17-й (VIIA) группой элементов, в которую входит и хлор[5].
В 1826 году атомная масса хлора была с высокой точностью определена шведским химиком Йёнсом Якобом Берцелиусом (отличается от современных данных не более чем на 0,1 %)[6].
Распространение в природе[править | править код]
В земной коре хлор — самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl·NaCl, бишофита MgCl2·6Н2О, карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л[7]). На долю хлора приходится 0,025 % от общего числа атомов земной коры; кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав[править | править код]
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %[8]. Свойства стабильных и некоторых радиоактивных изотопов хлора перечислены в таблице (см. [1],[9]:
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35Cl | 34,968852721 | Стабилен | — | 3/2 |
| 36Cl | 35,9683069 | 301 тыс. лет | β-распад в 36Ar | 2 |
| 37Cl | 36,96590262 | Стабилен | — | 3/2 |
| 38Cl | 37,9680106 | 37,2 минуты | β-распад в 38Ar | 2 |
| 39Cl | 38,968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
| 40Cl | 39,97042 | 1,38 минуты | β-распад в 40Ar | 2 |
| 41Cl | 40,9707 | 34 c | β-распад в 41Ar | |
| 42Cl | 41,9732 | 46,8 c | β-распад в 42Ar | |
| 43Cl | 42,9742 | 3,3 c | β-распад в 43Ar |
Физические и химические свойства[править | править код]

Газообразный хлор в ампуле
При нормальных условиях хлор — жёлто-зелёный газ с резким запахом. Некоторые его физические свойства представлены в таблице.
| Свойство | Значение[10] |
|---|---|
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) |
~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоёмкость (298 К, газ) | 34,94 Дж/(моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 кДж/моль |
| Стандартная энтропия образования (298 К, газ) | 222,9 Дж/(моль·K) |
| Энтальпия плавления | 6,406 кДж/моль |
| Энтальпия кипения | 20,41 кДж/моль |
| Энергия гомолитического разрыва связи Х—Х | 243 кДж/моль |
| Энергия гетеролитического разрыва связи Х—Х | 1150 кДж/моль |
| Энергия ионизации | 1255 кДж/моль |
| Энергия сродства к электрону | 349 кДж/моль |
| Атомный радиус | 0,073 нм |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду — Рохову | 2,83 |
| Устойчивые степени окисления | −1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a = 6,29 Å, b = 4,50 Å, c = 8,21 Å[11]. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a = 8,56 Å и c = 6,12 Å[11].
Растворимость[править | править код]
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода[12] (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl при 1000 К равна 2,07⋅10−4%, а при 2500 К — 0,909 %.
Порог восприятия запаха в воздухе равен 2—3 мг/м³.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов (благодаря сильному сродству к электрону, что приводит к практически полному отсутствию свободных носителей заряда): он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в газообразном хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства[править | править код]
Строение электронной оболочки[править | править код]
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность, равная 1 для атома хлора, очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления |
Электронное состояние валентного уровня |
Пример соединений |
|---|---|---|---|
| I | +1, −1, 0 | 3s2 3p5 | NaCl, NaClO, Cl2 |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентности IV и VI, например, ClO2 и Cl2O6. Однако оксид хлора(IV) является стабильным радикалом, то есть имеет неспаренный электрон, а оксид хлора(VI) содержит два атома хлора, имеющих степени окисления +5 и +7.
Взаимодействие с металлами[править | править код]
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
Взаимодействие с неметаллами[править | править код]
C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов) образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикально-цепному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным[13] или жёлто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.
С кислородом хлор образует оксиды), в которых проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
Напрямую хлор с кислородом не реагирует.
При реакции с фтором образуется не хлорид, а фториды:
Известны фторид хлора(I), фторид хлора(III) и фторид хлора(V) (ClF, ClF3 и ClF5), Могут быть синтезированы из элементов, степень окисления хлора меняется в зависимости от условий синтеза. Все они представляют собой при комнатной температуре бесцветные ядовитые тяжёлые газы с сильным раздражающим запахом. Сильные окислители, реагируют с водой и стеклом. Используются как фторирующие агенты.
Другие свойства[править | править код]
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При реакции с монооксидом углерода образуется фосген:
При растворении в воде или щелочах, хлор диспропорционирует, образуя хлорноватистую (а при нагревании хлорноватую) и соляную кислоты, либо их соли:
(при нагревании)
Хлор взаимодействует с водой в присутствии солей кобальта[источник не указан 280 дней]:
Хлорированием сухого гидроксида кальция получают хлорную известь:
Действием хлора на аммиак можно получить трихлорид азота:
Окислительные свойства хлора[править | править код]
Хлор — очень сильный окислитель:
Раствор хлора в воде используется для отбеливания тканей и бумаги.
Реакции с органическими веществами[править | править код]
С насыщенными соединениями:
(получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
Способы получения[править | править код]
Химические методы[править | править код]
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение.
Метод Шееле[править | править код]
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции оксида марганца(IV) (пиролюзита) с соляной кислотой:
Метод Дикона[править | править код]
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Современные лабораторные методы[править | править код]
Ввиду доступности хлора в лабораторной практике обычно используется сжиженный хлор в баллонах.
Хлор можно получить действием кислоты на гипохлорит натрия:
При этом также выделяется кислород. Если использовать соляную кислоту, то реакция выглядит по-другому:
Для получения хлора обычно используются процессы, основанные на окислении хлороводорода сильными окислителями (чаще всего диоксидом марганца или перманганатом калия, но также и хлоритом кальция, хроматом калия, дихроматом калия, диоксидом свинца, бертолетовой солью и т. п.)[14]:
При невозможности использования баллонов и химических методов получения хлора могут быть использованы электрохимические — при помощи небольших электролизёров с обычным или вентильным электродом для получения хлора.
Электрохимические методы[править | править код]
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза водного раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
На тонну выделяющегося хлора образуется 1,13 т гидроксида натрия[3]. Поскольку хлор является одним из наиболее востребованных продуктов химической промышленности, расходы электроэнергии на его производство весьма заметны: в США для производства хлора используется около 2% всей генерируемой электроэнергии и 28% энергии, потребляемой электрохимическими промышленными установками[3].
Гораздо реже в промышленности используется электролиз раствора хлорида калия[3].
Применяется три варианта электрохимического метода получения хлора. Два из них — электролиз с твёрдым катодом: диафрагменный и мембранный методы. Третий — электролиз с жидким ртутным катодом (ртутный метод производства). Качество хлора, получаемого электрохимическими методами, отличается мало:
| Ртутный метод | Диафрагменный метод | Мембранный метод | |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) на 1 т хлора | 3150 | 3260 | 2520 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Начало применения[3] | XIX век | XIX век | 1975 год |
Диафрагменный метод[править | править код]
Наиболее простым из электрохимических методов получения хлора, в плане организации процесса и конструкционных материалов для электролизёра, является диафрагменный метод.
Раствор соли в диафрагменном электролизёре непрерывно подается в анодное пространство и протекает через, как правило, насаженную на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Насасывание диафрагмы производится путём прокачивания через электролизёр пульпы из асбестовых волокон, которые, застревая в сетке катода, образуют слой асбеста, играющий роль диафрагмы.
Во многих конструкциях электролизёров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из-под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизёра. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH– ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO–), который затем может окисляться на аноде до хлорат-иона ClO3–. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе. Так же вредит и выделение кислорода, которое к тому же ведёт к разрушению анодов и, если они из углеродных материалов, попадания в хлор примесей фосгена.
- Анод:
— основной процесс
- Катод:
— основной процесс
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов галита, бишофита и других минералов, содержащих хлорид натрия, а также растворением их в специальных ёмкостях на месте производства. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения хлора до сих пор широко используется в промышленности.
- Схема диафрагменного электролизёра.
Мембранный метод[править | править код]

Мембранный процесс производства хлора и щёлочи
Мембранный метод производства хлора наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизёре, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли, а в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов, и выходит хлор, а из катодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Однако питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищаются от любых примесей. Такая тщательная очистка определяется высокой стоимостью полимерных катионообменных мембран и их уязвимостью для примесей в питающем растворе.
Кроме того, ограниченная геометрическая форма, а также низкая механическая прочность и термическая стойкость ионообменных мембран, во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизёра.
Ртутный метод с жидким катодом[править | править код]

Схема старинного ртутного электролизёра для получения хлора и щёлоков методом Кастнера — Келлнера[en]: А — графитовый анод, В — раскачивающие опоры, С — железный катод, D — пространство, заполненное газами (над анодом — хлор, над катодом — водород), М — ртуть, в которой в ходе электролиза растворяется металлический натрий. Фактически в цилиндрическом электролизёре две ячейки, последовательно соединённые через ртутный электрод; в первой, внешней ячейке ртуть служит катодом, во второй, центральной, — анодом. Весь аппарат слегка раскачивается для перемешивания ртути и обеспечения переноса растворённого в ней натрия к центру
В ряду электрохимических методов получения хлора ртутный метод позволяет получать самый чистый хлор.
- Схема ртутного электролизёра.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего раствора поваренной соли.
На аноде происходит окисление ионов хлора из электролита и выделяется хлор:
— основной процесс
Хлор и анолит отводятся из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения хлора с твёрдым катодом.
Хранение хлора[править | править код]
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — защитный цвет c зелёной полосой. При длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый трихлорид азота, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора[править | править код]
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора:
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объёмная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля трёххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение[править | править код]
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:

Оконный профиль, изготовленный из хлорсодержащих полимеров

- В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
- Отбеливающие свойства хлора известны с давних времен. Хлор разрушает многие органические красители, делая их бесцветными, однако это происходит лишь в присутствии жидкой или газообразной воды[15], поскольку «отбеливает» не сам хлор, а атомарный кислород, который образуется при распаде хлорноватистой кислоты[16]:
Этот старинный способ отбеливания тканей, бумаги, картона.
- Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах XX столетия.
- Хлор использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприта, фосгена.
- Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов, катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01[17] устанавливает пределы (коридор) допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0,3—0,5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды. Альтернативой является озонирование. Материалы, из которых изготовлены водопроводные трубы, по-разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, больше известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
- В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
- В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль[править | править код]
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов в виде соединений.
У животных и человека ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10—15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90—95 %), калом (4—8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно (взаимно) с гидрокарбонат-ионами HCO3− (кислотно-щелочной баланс).
Человек потребляет 5—10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20—0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3—6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки, на которых нет конкуренции. Растения, произрастающие на засоленных почвах, называются галофитами. Они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду, притеняя поверхности от солнечного света.
Среди микроорганизмов также известны галофилы — галобактерии, — которые обитают в сильносоленых водах или почвах.
Токсичность[править | править код]




Хлор — токсичный удушающий газ, сильный ирритант, при попадании в лёгкие вызывает ожог лёгочной ткани (в результате образования в них хлорноватистой и соляной кислоты), удушье.
Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе уже от 1 до 6 мг/м³ (что близко к порогу восприятия запаха хлора), при 12 мг/м³ переносится с трудом, концентрации больше 100 мг/м³ опасны для жизни (смерть от остановки дыхания наступает через 5—25 минут, при высоких концентрациях — мгновенно)[18].
Предельно допустимая концентрация хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
Хлор был одним из первых химических отравляющих веществ, использованных в Первую мировую войну, впервые применён Германией в 1915 году во время битвы при Ипре.
Комментарии[править | править код]
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ Таблица 8.1. Стандартные электродные потенциалы при 25° С и их изотермические температурные коэффициенты // Л. И. Антропов. Теоретическая электрохимия: Учебник для химико-технологических специальностей вузов. — 4-е изд. — М.: Высшая школа, 1984. — С. 180.
- ↑ 1 2 3 4 5 Росаловский В. Я. Хлор // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 280—281. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ Дворецкий И. Х. Древнегреческо-русский словарь. — М.: Гос. изд-во иностр. и национ. словарей, 1958. — Т. II. — С. 1777. — 12 000 экз.
- ↑ Популярная библиотека химических элементов. Книга первая. Водород — палладий / И. В. Петрянов-Соколов (отв. ред.), В. В. Станцо, М. Б. Черненко (составители). — 3-е изд. — М.: Наука, 1983. — С. 238—247. — 575 с.
- ↑ Берцелиус, Иоган-Яков // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965.
- ↑ Данные о изотопах хлора
- ↑ Fuller G. H.,. Nuclear spin of Cl-36 // J. Phys. Chem. Ref. Data, : статья. — 1976. — Апрель (т. vol. 5,, № no. 4,). — С. p. 879..
- ↑ Описание свойств хлора на сайте ChemPortal.ru
- ↑ 1 2 Inorganic Crystal Structure Database
- ↑ Насыщенный раствор хлора в воде называют «хлорной водой»
- ↑ Взаимодействие хлора с водородом — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Получение хлора — видео опыта в Единой коллекции цифровых образовательных ресурсов
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 76. Хлор // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 184—187. — 240 с. — 1 630 000 экз.
- ↑ Взаимодействие хлора с органическими красителями — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ СанПиН 2.1.4.1074-01
- ↑ Вредные вещества в промышленности / Под ред. Н. В. Лазарева и И. Д. Гадаскиной. — М., 1977. — Т. 3. — С. 21—22.
Литература[править | править код]
- Некрасов Б. В. Основы общей химии, т. 3. — М.: Химия, 1970;
- Якименко Л. М. Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974;
- Постановление Госгортехнадзора России от 05.06.2003 № 48 «Об утверждении Правил безопасности при производстве, хранении, транспортировании и применении хлора» ПБ от 05.06.2003 09-594-03;
- Федеральный закон от 21.07.1997 № 116-ФЗО промышленной безопасности опасных производственных объектов (с изменениями на 18 декабря 2006 года);
- Постановление Госгортехнадзора России от 18.10.2002 № 61-А «Об утверждении Общих правил промышленной безопасности для организаций, осуществляющих деятельность в области промышленной безопасности опасных производственных объектов» ПБ от 18.10.2002 № 03-517-02;
- Приказ Минздрава РФ от 28 марта 2003 г. № 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов»;
- Приказ МПР РФ от 2 декабря 2002 г. № 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.);
- Постановление Госкомтруда СССР от 25.10.1974 № 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых дает право на дополнительный отпуск и сокращенный рабочий день» (с изменениями на 29 мая 1991 года);
- Постановление Минтруда России от 22.07.1999 № 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств»;
- Постановление Главного государственного санитарного врача РФ от 30.05.2003 № 116 «О введении в действие ГН 2.1.6.1339-03 „Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населенных мест“» (с изменениями на 3 ноября 2005 года);
- ГОСТ 6718-93 Хлор жидкий. Технические условия.
Ссылки[править | править код]
- Хлор на Webelements
- Хлор в Популярной библиотеке химических элементов
- Де Лазари А. Н. Первая германская газобаллонная атака на западноевропейском театре мировой войны у г. Ипра 22 апреля 1915 г. // Химическое оружие на фронтах Мировой войны 1914—1918 гг.: Краткий исторический очерк / А. Н. Де Лазари; Науч. ред. и коммент. М. В. Супотницкого. — М.: Вузовская книга, 2008. — 268 с. — 300 экз. — ISBN 978-5-9502-0314-5.
- Плаванье в хлорированной воде повышают риск возникновения астмы
| Хлор | |
|---|---|

Жидкий хлор в запаянном сосуде |
|
| Название, символ, номер | Хлор / Chlorum (Cl), 17 |
| Атомная масса (молярная масса) |
[35,446; 35,457]а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p5 |
| Радиус атома | 99 пм |
| Ковалентный радиус | 102±4 пм |
| Радиус иона | (+7e)27 (-1e)181 пм |
| Электроотрицательность | 3,16 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 7, 6, 5, 4, 3, 1, 0, −1 |
| Энергия ионизации (первый электрон) |
1254,9(13,01) кДж/моль (эВ) |
| Плотность (при н. у.) | 3,21 г/л; (жид. при −35 °C) 1,557 г/см3; (тв. при −105 °C) 1,9 г/см³ |
| Температура плавления | 172,2К; −100,95 °C |
| Температура кипения | 238,6К; −34,55 °C |
| Критическая точка | 416,9 К, 7,991 МПа |
| Уд. теплота плавления | 6,41 кДж/моль |
| Уд. теплота испарения | 20,41 кДж/моль |
| Молярная теплоёмкость | 21,838 Дж/(K·моль) |
| Молярный объём | 18,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=6,29 b=4,50 c=8,21 Å |
| Теплопроводность | (300 K) 0,009 Вт/(м·К) |
| Номер CAS | 7782-50-5 |
Хлор (от греч. χλωρός — «жёлто-зелёный») — химический элемент с атомным номером 17. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в третьем периоде таблицы. Атомная масса элемента 35,446…35,457 а. е. м.. Обозначается символом Cl (от лат. Chlorum). Химически активный неметалл. Входит в группу галогенов.
Простое вещество хлор при нормальных условиях — ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом. Молекула хлора двухатомная (формула Cl2).
Содержание
- 1 История открытия хлора
- 2 Распространение в природе
- 3 Изотопный состав
- 4 Физические и химические свойства
- 4.1 Растворимость
- 5 Химические свойства
- 5.1 Строение электронной оболочки
- 5.2 Взаимодействие с металлами
- 5.3 Взаимодействие с неметаллами
- 5.4 Другие свойства
- 5.5 Окислительные свойства хлора
- 5.6 Реакции с органическими веществами
- 6 Способы получения
- 6.1 Химические методы
- 6.1.1 Метод Шееле
- 6.1.2 Метод Дикона
- 6.1.3 Современные лабораторные методы
- 6.2 Электрохимические методы
- 6.2.1 Диафрагменный метод
- 6.2.2 Мембранный метод
- 6.2.3 Ртутный метод с жидким катодом
- 6.1 Химические методы
- 7 Хранение хлора
- 8 Стандарты качества хлора
- 9 Применение
- 10 Биологическая роль
- 11 Токсичность

История открытия хлора
См. также: Мурий
Соединение с водородом — газообразный хлороводород — был впервые получен Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
- 4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теорией флогистона, предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту. Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетического элемента мурия. Однако попытки его выделения оставались безуспешными вплоть до работ Г. Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор, доказав элементарную природу последнего.
В 1811 г. Дэви предложил для нового элемента название «хлорин» (chlorine). Спустя год Ж. Гей-Люссак «сократил» название до хлора (chlore). В том же 1811 г. немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (дословно солерод), однако впоследствии этот термин закрепился за всей 17-й (VIIA) группой элементов, в которую входит и хлор.
В 1826 году атомная масса хлора была с высокой точностью определена шведским химиком Йёнсом Якобом Берцелиусом (отличается от современных данных не более, чем на 0,1 %).
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl·NaCl, бишофита MgCl2·6H2O., карналлита KCl·MgCl2·6H2O., каинита KCl·MgSO4·3H2O. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0,025 % от общего числа атомов земной коры; кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав
Основная статья: Изотопы хлора
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %. Свойства стабильных и некоторых радиоактивных изотопов хлора перечислены в таблице:
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35Cl | 34,968852721 | Стабилен | — | 3/2 |
| 36Cl | 35,9683069 | 301 тыс. лет | β-распад в 36Ar | 0 |
| 37Cl | 36,96590262 | Стабилен | — | 3/2 |
| 38Cl | 37,9680106 | 37,2 минуты | β-распад в 38Ar | 2 |
| 39Cl | 38,968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
| 40Cl | 39,97042 | 1,38 минуты | β-распад в 40Ar | 2 |
| 41Cl | 40,9707 | 34 c | β-распад в 41Ar | |
| 42Cl | 41,9732 | 46,8 c | β-распад в 42Ar | |
| 43Cl | 42,9742 | 3,3 c | β-распад в 43Ar |
Физические и химические свойства

При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
| Свойство | Значение |
|---|---|
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) |
~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоёмкость (298 К, газ) | 34,94 Дж/(моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 кДж/моль |
| Стандартная энтропия образования (298 К, газ) | 222,9 Дж/(моль·K) |
| Энтальпия плавления | 6,406 кДж/моль |
| Энтальпия кипения | 20,41 кДж/моль |
| Энергия гомолитического разрыва связи Х—Х | 243 кДж/моль |
| Энергия гетеролитического разрыва связи Х—Х | 1150 кДж/моль |
| Энергия ионизации | 1255 кДж/моль |
| Энергия сродства к электрону | 349 кДж/моль |
| Атомный радиус | 0,073 нм |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду — Рохову | 2,83 |
| Устойчивые степени окисления | −1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a = 6,29 Å, b = 4,50 Å, c = 8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a = 8,56 Å и c = 6,12 Å.
Растворимость
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl при 1000 К равна 2,07⋅10−4%, а при 2500 К — 0,909 %.
Порог восприятия запаха в воздухе равен 2—3 мг/м³.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в газообразном хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность, равная 1 для атома хлора, очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления |
Электронное состояние валентного уровня |
Пример соединений |
|---|---|---|---|
| I | +1, −1, 0 | 3s2 3p5 | NaCl, NaClO, Cl2 |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентности IV и VI, например, ClO2 и Cl2O6. Однако оксид хлора(IV) является радикалом, то есть у него есть один неспаренный электрон, а оксид хлора(VI) содержит два атома хлора, имеющих степени окисления +5 и +7.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
- 2Na + Cl2 → 2NaCl
- 2Sb + 3Cl2 → 2SbCl3
- 2Fe + 3Cl2 → 2FeCl3
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов) образует соответствующие хлориды.
- 5Cl2 + 2P → 2PCl5 ,
- 2S + Cl2 → S2Cl2
или
- S + Cl2 → SCl2
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикально-цепному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или жёлто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.
- H2 + Cl2 → 2HCl
С кислородом хлор образует оксиды (см. статью Оксиды хлора), в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. Напрямую хлор с кислородом не реагирует. При реакции с фтором образуется не хлорид, а фториды:
- Cl2 + F2 → 2ClF
- Cl2 + 3F2 → 2ClF3
- Cl2 + 5F2 → 2ClF5
Известны фторид хлора(I), фторид хлора(III) и фторид хлора(V) (ClF, ClF3 и ClF5), Могут быть синтезированы из элементов, степень окисления хлора меняется в зависимости от условий синтеза. Все они представляют собой при комнатной температуре бесцветные ядовитые тяжёлые газы с сильным раздражающим запахом. Сильные окислители, реагируют с водой и стеклом. Используются как фторирующие агенты.
Другие свойства
Хлор вытесняет бром и йод из их соединений с водородом и металлами:
- Cl2 + 2HBr → Br2 + 2HCl
- Cl2 + 2NaI → I2 + 2NaCl
При реакции с монооксидом углерода образуется фосген:
- Cl2 + CO → COCl2
При растворении в воде или щелочах, хлор диспропорционирует, образуя хлорноватистую (а при нагревании хлорноватую) и соляную кислоты, либо их соли:
- Cl2+ H2O ⇄ HCl + HClO
- Cl2 + 2NaOH → NaCl + NaClO + H2O
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании)
Хлорированием сухого гидроксида кальция получают хлорную известь:
- Cl2 + Ca(OH)2 → CaCl(OCl) + H2O
Действием хлора на аммиак можно получить трихлорид азота:
- 4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Окислительные свойства хлора
Хлор — очень сильный окислитель:
- Cl2 + H2S → 2HCl + S
Раствор хлора в воде используется для отбеливания тканей и бумаги.
Реакции с органическими веществами
С насыщенными соединениями:
- CH3-CH3 + Cl2 → C2H5Cl + HCl
- CH4 + Cl2 → CH3Cl + HCl (получение хлороформа, реакция идет многоступенчато с образованием тетрахлорметана CCl4)
Присоединяется к ненасыщенным соединениям по кратным связям:
- CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
- C6H6 + Cl2 → C6H5Cl + HCl
Способы получения
Химические методы
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение.
Метод Шееле
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
- MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Метод Дикона
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
- 4HCl + O2 → 2H2O + 2Cl2↑
Современные лабораторные методы
Ввиду доступности хлора в лабораторной практике обычно используется сжиженный хлор в баллонах. Хлор можно получить действием кислоты на гипохлорит натрия:
- 4NaOCl + 4CH3COOH = 4NaCH3COO + 2Cl2↑ + O2↑ + 2H2O
При этом также выделяется кислород. Если использовать соляную кислоту, то реакция выглядит по-другому:
- NaOCl + 2HCl = NaCl + Cl2↑ + H2O
Для получения хлора в небольших количествах обычно используются процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, хлоритом кальция, хроматом калия, дихроматом калия, диоксидом свинца, бертолетовой солью и т. п.), обычно используется диоксид марганца или перманганат калия:
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
При невозможности использования баллонов и химических методов получения хлора могут быть использованы электрохимические — при помощи небольших электролизеров с обычным или вентильным электродом для получения хлора.
Электрохимические методы
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
- 2NaCl + 2H2O + 2e− → 2NaOH + Cl2↑ + H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них — электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). Качество хлора, получаемого электрохимическими методами, отличается мало:
| Ртутный метод | Диафрагменный метод | Мембранный метод | |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
Диафрагменный метод
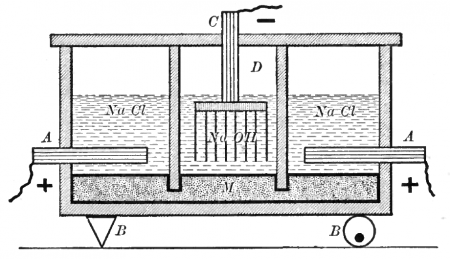
Схема старинного диафрагменного электролизера для получения хлора и щелоков: А — анод, В — изоляторы, С — катод, D — пространство, заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения хлора.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, насаженную на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Насасывание диафрагмы производится путём прокачивания через электролизер пульпы из асбестовых волокон, которые, застревая в сетке катода, образуют слой асбеста, играющий роль диафрагмы.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из-под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щелоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH– ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO–), который затем может окисляться на аноде до хлорат-иона ClO3–. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе. Так же вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попадания в хлор примесей фосгена.
- Анод:
- 2Cl− − 2e− → Cl2↑ — основной процесс
- 2H2O − 4e− → O2↑ + 4H+
- 12ClO− + 6H2O − 12e− → 4ClO3− + 8Cl− + 3O2↑ + 6H+
- Катод:
- 2H2O + 2e− → H2↑ + 2OH− — основной процесс
- ClO− + H2O + 2e− → Cl− + 2OH−
- ClO3− + 3H2O + 6e− → Cl− + 6OH−
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов галита, бишофита и других минералов, содержащих хлорид натрия, а также растворением их в специальных ёмкостях на месте производства. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения хлора до сих пор широко используется в промышленности.
- Схема диафрагменного электролизера.
Мембранный метод
Мембранный метод производства хлора наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и выходит хлор, а из катодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Однако питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищаются от любых примесей. Такая тщательная очистка определяется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма, а также низкая механическая прочность и термическая стойкость ионообменных мембран, во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
- Схема мембранного электролизера.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения хлора ртутный метод позволяет получать самый чистый хлор.
- Схема ртутного электролизера.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего раствора поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
- 2Cl− − 2e− → Cl2↑ — основной процесс
- 2H2O − 2e− → O2↑ + 4H+
- 12ClO− + 6H2O − 12e− → 4ClO3− + 8Cl− + 3O2↑ + 12H+
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения хлора с твердым катодом.
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — защитный цвет c зелёной полосой. Следует отметить, что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый трихлорид азота, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора:
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:

Оконный профиль, изготовленный из хлорсодержащих полимеров

Основным компонентом отбеливателей является Лабарракова вода (гипохлорит натрия)
- В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
- Отбеливающие свойства хлора известны с давних времен. Хлор разрушает многие органические красители, делая их бесцветными, однако это происходит лишь в присутствии жидкой или газообразной воды, поскольку «отбеливает» не сам хлор, а атомарный кислород, который образуется при распаде хлорноватистой кислоты:
-
- Cl2 + H2O → HCl + HOCl
- HOCl → HCl + O
Этот старинный способ отбеливания тканей, бумаги, картона.
- Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах XX столетия.
- Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
- Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов, катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 [1] устанавливает следующие пределы (коридор) допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0,3 — 0,5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды. Альтернативой является озонирование. Материалы, из которых изготовлены водопроводные трубы, по-разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, больше известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
- В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
- В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
- Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов в виде соединений.
У животных и человека ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90—95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно (взаимно) с гидрокарбонат-ионами HCO3− (кислотно-щелочной баланс).
Человек потребляет 5—10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20—0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3—6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки, на которых нет конкуренции. Растения, произрастающие на засоленных почвах, называются галофитами. Они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду, притеняя поверхности от солнечного света.
Среди микроорганизмов также известны галофилы — галобактерии, — которые обитают в сильносоленых водах или почвах.
Токсичность
Хлор — токсичный удушающий газ, сильный ирритант, при попадании в лёгкие вызывает ожог лёгочной ткани (в результате образования в них хлорноватистой и соляной кислоты), удушье.
Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе уже от 1 до 6 мг/м³ (что близко к порогу восприятия запаха хлора), при 12 мг/м³ переносится с трудом, концентрации больше 100 мг/м³ опасны для жизни (смерть от остановки дыхания наступает через 5—25 минут, при высоких концентрациях — мгновенно).
Предельно допустимая концентрация хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну, впервые применен в 1915 году во время битвы при Ипре.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Для каждого применения подходит различный метод определения хлора. В данной статье представлен краткий обзор самых распространенных методов и решений для выполнения анализа концентрации хлора в воде.
Методы определения концентрации хлора в воде
Колориметрические методы определения хлора
 Как правило, в этом оптическом методе используется измерение интенсивности цвета для определения концентрации хлора в растворе. Когда к образцу добавляются соответствующие буферные и индикаторные растворы, происходит реакция, дающая окраску, интенсивность которой пропорциональна концентрации хлора. Интенсивность цвета измеряется визуально (на глаз), колориметром или спектрофотометром. Колориметрические методы определения чувствительны к влиянию цвета и мутности в образце, а также некоторых химических веществ, помимо хлора, одновременно реагирующих с индикатором.
Как правило, в этом оптическом методе используется измерение интенсивности цвета для определения концентрации хлора в растворе. Когда к образцу добавляются соответствующие буферные и индикаторные растворы, происходит реакция, дающая окраску, интенсивность которой пропорциональна концентрации хлора. Интенсивность цвета измеряется визуально (на глаз), колориметром или спектрофотометром. Колориметрические методы определения чувствительны к влиянию цвета и мутности в образце, а также некоторых химических веществ, помимо хлора, одновременно реагирующих с индикатором.
Метод DPD
Метод DPD – наиболее широко используемый колориметрический метод измерения хлора. Его можно использовать для измерения как свободного, так и общего хлора с помощью полевых, лабораторных и промышленных датчиков и онлайн анализаторов. Однако метод DPD подвержен влиянию других окислителей, таких как марганец, хром и хлорамины. Узнайте подробнее про определение свободного и общего хлора методом DPD в статье ->
Индофенольный метод
Индофенольный метод, будучи селективным по отношению к монохлорамину, может использоваться для измерения монохлорамина и свободного аммиака, а также свободного хлора. Монохлорамин определяется напрямую, но при одновременном определении монохлорамина и свободного аммиака в одной и той же пробе, в методе используется дополнительный реагент для преобразования свободного аммиака в монохлорамин. Свободный хлор можно также измерить индофенольным методом с использованием двухреагентной системы, которая не подвержена помехам, которые могут влиять на результат в DPD методе. Однако этот метод доступен только для проведения анализа в лаборатории или в полевых условиях.
На нашем сайте представлены реагенты, лабораторные спектрофотометры и промышленные колориметрические анализаторы хлора.
Определение хлора в воде методом титрования
 Этот метод определяет концентрацию хлора на основе завершения химической реакции между хлором и титрантом, добавленным в образец. Титрант добавляется постепенно, пока реакция не завершится. Конечная точка (или точка эквивалентности) – это точка, в которой титрант и хлор уравновешиваются. Точку эквивалентности можно определить визуально с помощью цветного индикатора или с помощью электрохимического датчика. Ручные визуальные измерения менее точны и более подвержены влиянию цвета или мутности в образце, тогда как титрование с использованием электродов является более точным и не подвержено помехам такого рода.
Этот метод определяет концентрацию хлора на основе завершения химической реакции между хлором и титрантом, добавленным в образец. Титрант добавляется постепенно, пока реакция не завершится. Конечная точка (или точка эквивалентности) – это точка, в которой титрант и хлор уравновешиваются. Точку эквивалентности можно определить визуально с помощью цветного индикатора или с помощью электрохимического датчика. Ручные визуальные измерения менее точны и более подвержены влиянию цвета или мутности в образце, тогда как титрование с использованием электродов является более точным и не подвержено помехам такого рода.
Метод DPD-FEAS
В методе DPD-FEAS используется пурпурный визуальный индикатор, титруемый до бесцветной конечной точки. Этот метод измеряет свободный и общий хлор.
Йодометрический метод
В йодометрическом методе используется синий визуальный индикатор, который исчезает в конце титрования. Этот метод обычно используется для измерения высоких концентраций общего хлора.
Амперометрический метод
Этот метод представляет собой амперометрическое титрование для определения конечной точки вручную или автоматически. К электроду прикладывают небольшое напряжение, и конечная точка определяется изменением тока в результате восстановления хлора титрантом (оксидом фениларсина). Изменение силы тока и объема титранта измеряется в соответствии с концентрацией хлора. Этот метод предлагает процедуры для измерения как свободного, так и общего хлора, диоксида хлора и хлорита с использованием процедур прямого и обратного титрования.
С перечнем титраторов и комплектующих (прикладных наборов) вы можете ознакомиться по ссылке ->
Амперометрический метод анализа хлора в промышленности

Данный электрохимический метод измеряет изменение электрического тока в результате химических реакций, происходящих на электродах, причем ток пропорционален концентрации хлора. Доступны различные конструкции амперометрических датчиков, обеспечивающие лучшую селективность для различных видов хлора. Этот метод не подвержен влиянию цвета или мутности в образце, однако поверхность сенсора, контактирующая с образцом, склонна к загрязнению. Ряд амперометрических анализаторов не требуют реагентов. Амперометрические датчики требуют обслуживания и калибровки с частотой, зависящей от области применения.
Подробнее про амперометрические датчики свободного и общего хлора.
Если у вас остались вопросы, обращайтесь за консультацией к нашим специалистам. На сайте представлен широкий выбор лабораторного и промышленного оборудования и реагентов для анализа хлора в вашем применении. Свяжитесь с нами удобным для вас способом:
Представительство в России: +7 (495) 201-53-02 info@aquaanalytics.ru
Представительство в Узбекистане: +998 (90) 174-57-84 info@aquaanalytics-tekhnika.ru
Предыдущая статья
Следующая статья
Последние новости
Статьи

Измерение растворенного кислорода оптическими датчиками
Апрель 05, 2023
Читать далее
Статьи

Оценка качества работы мойки с помощью определения АТФ
Февраль 17, 2023
Читать далее
Статьи

Поправка на мутность при проведении анализа ХПК с использованием кюветных тестов LCK 314 и LCK 1414
Январь 30, 2023
Читать далее
Статьи

Глютен и способы его обнаружения на поверхности оборудования после CIP-мойки
Январь 11, 2023
Читать далее
Хлор является элементом основной группы VII и получил свое название от цвета газообразного хлора “хлорос” (зеленый). Это зелено-желтый, очень ядовитый газ с резким запахом. Хлор плохо растворяется в воде, 0,5% раствор называется хлорированной водой. Хлор тяжелее воздуха (примерно в 2,5 раза).
Хлор является очень реактивным газом и образует большое количество органических и неорганических соединений. Наиболее важными неорганическими соединениями являются хлористый водород, соляная кислота и встречающиеся в природе хлориды металлов, которые служат сырьем для производства многих химикатов и продуктов, например, каустическая сода, ПВХ, силиконов, моющих средств, пестицидов и средств от сорняков (гербицидов).
История
Хлор был открыт Карлом Вильгельмом Шееле в 1774 году.
Во время Первой мировой войны газообразный хлор использовали в качестве химического оружия. 22 апреля 1915 года недалеко от города Ипр во Фландрии германскими войсками был распылен газообразный хлор, что привело к гибели большого числа солдат и многочисленным жертвам, некоторые из которых остались инвалидами на всю жизнь. Однако, вскоре хлор заменили на более эффективные ядовитые газы, например, фосген.
Свойства
Желто-зеленый, негорючий, едкий газ, в 2,5 раза тяжелее воздуха. Хлор очень реактивен и вытесняет бром и йод из их водородных и металлических связей. Вступает в реакцию со многими другими элементами с образованием хлоридов. Умеренно растворим в воде, используется для хлорирования воды.
Смеси хлора и водорода (газообразный хлор-кислород) взрываются при воздействии тепла или света.
Нахождение в природе
Хлор не существует в природе в элементарной форме, но главным образом как анион Cl — (хлорид), который является очень реакционноспособным элементом. Но есть и природные органические соединения хлора (соли) с ковалентной связью. Например, хлорид натрия и хлорид калия можно найти во многих крупных солевых отложения. Хлориды составляют примерно 0,05% объема земной коры.
Производство
В промышленном масштабе, хлор получают с помощью так называемого хлорно-щелочного электролиза в виде хлорида натрия — раствора или расплава:
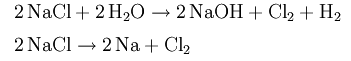
Соляная кислота, которая образуется в ходе реакции хлора с органическими углеводородами, также может быть использована в качестве исходного сырья. Которая может быть преобразована обратно в хлор с помощью электрического тока в водном растворе:
![]()
До появления электролитического процесса применялось прямое окисление хлористого водорода с кислородом или воздухом:
![]()
Эту равновесную реакцию проводили на катализаторах на основе хлорида меди (II) (CuCl2). Из-за крайне агрессивной реакционной смеси, этот технологический процесс был связан с большими трудностями.
В лабораторных условиях хлор можно получить реакцией перманганата калия с концентрированной соляной кислотой
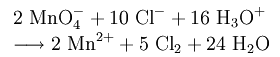
Реакцией диоксида марганца с концентрированной соляной кислотой
![]()
Реакцией хлорной извести с концентрированной соляной кислотой
![]()
Физические свойства
При нормальных условиях хлор является газообразным веществом. Обладает едким, резким запахом и классифицируется как токсичный. Хлор относительно растворим в воде: 0,0921 моль растворяется в одном литре при 25 С при нормальном атмосферном давлении.
Этот водный раствор хлора называют хлористый водород и содержит небольшие количества соляной кислоты.
Химические свойства
Хлор не горит в воздухе, но он является одним из наиболее реактивных элементов в периодической таблице. Даже при нормальной температуре он реагирует с многочисленными элементами, многими органическими и неорганическими соединениями.
Реакции хлора
Наряду с фтором хлор является одним из самых реактивных элементов. Это мощный окислитель. Даже при комнатной температуре хлор реагирует со многими элементами, выделяя большое количество тепла (экзотермические реакции). С щелочными, щелочноземельными и другими металлами образует ионные соединения, соли металлов.
Неметаллы, такие как водород и фосфор, полуметаллы, такие как бор и кремний, реагируют с хлором с образованием молекулярных соединений. Поскольку хлор является очень реактивным элементом, он часто встречается в природе. Огромные солевые месторождения в основном содержат минералы каменную соль (NaCl), сильвин (KCl) или сильвинит. Количество хлоридов, растворенных в Мировом океане, почти неизмеримо, если учесть, что морская вода состоит в основном из хлоридных солей.
Изотопы
Природный хлор представляет собой смесь двух стабильных изотопов: 35 Cl и 37 Cl.
В атмосфере также наблюдается взаимодействие между изотопом хлора и протонами космического излучения с образованием нестабильного изотопа 36 Cl. Большие количества этого изотопа были получены при облучении воздуха во время испытаний ядерного оружия в атмосфере между 1952 и 1958 годами.
Соединения хлора
Хлор встречается с числами окисления от -1 до +7. В степени окисления -1 хлор присутствует в виде хлорид-аниона во многих солях, особенно в щелочных металлах: хлорид натрия, хлорид калия и хлорид лития. Однако, наиболее важным соединением Cl (-1) является хлористый водород (HCl) и его водный раствор, а также соляная кислота. Соединения с уровнями окисления +1, +3, +5, +7 существуют в основном в виде хлорангидридов кислот. С уровнем окисления +1 они представляют собой хлористоводородную кислоту (HClO) с ее солями, такими как гипохлорит натрия.
Хлороводород
Важными неорганическими соединениями хлора являются хлористый водород и хлориды. Хлороводород состоит из одного атома хлора и одного атома водорода, которые связаны полярной атомной связью. Бесцветен, имеет резкий запах, негорюч и хорошо растворяется в воде.
Газообразный хлористый водород менее реактивен, чем его водный раствор соляной кислоты.
Соляная кислота
Соляная кислота является сильной кислотой, потому что молекула HCl полностью диссоциирует на ионы водорода и ионы хлора в водном растворе. Соляная кислота реагирует с основными металлами в окислительно-восстановительной реакции с образованием водорода и хлоридов металлов. Она легко растворяет ряд оксидов и карбонатов металлов и поэтому может использоваться для очистки металлов (травление) и удаления накипи.
Обычными коммерческими формами являются разбавленная соляная кислота (около 7%), концентрированная соляная кислота (около 30%) и дымящая соляная кислота (около 37%). Как сильная неорганическая кислота, соляная кислота используется во многих отраслях промышленности. Помимо обработки металлов, она служит сырьем для производства различных соединений хлора, нейтрализации щелочных сточных вод и для кислотной обработки источников нефти и газа.
Хлориды
Хлориды — это соединения соляной кислоты. Хлориды образуются в результате окислительно-восстановительной реакции соляной кислоты с основными металлами, с оксидами металлов или в результате реакции нейтрализации гидроксидами металлов. Хлориды обычно хорошо растворяются в воде и диссоциируют на положительно заряженные катионы и хлорид-анионы.
Важными ионными хлоридами являются хлорид натрия и хлорид калия. Хлорид натрия из солевых отложений известен как каменная соль. Лишь небольшая часть полученной каменной соли используется как поваренная соль для наших блюд и как консервант для рыбных и мясных продуктов. В химической промышленности хлорид натрия используется в качестве сырья, например производства соляной кислоты, каустической соды, хлора.
Хлорид калия и другие соли калия, полученные из него, такие как сульфат калия, являются важными минеральными удобрениями, содержащими ионы калия. Который является основным сельхозудобрением.
Органические соединения
Помимо неорганических, существует огромное количество органических соединений хлора, например хлорированные углеводороды, хлорангидриды, хлорированные ароматические соединения, такие как хлорбензол. Однако это почти исключительно антропогенные соединения, созданные человеком. В природе же существует лишь несколько органических соединений хлора.
Применение
Крупнейшими потребителями хлора являются компании, производящие этилендихлорид и другие хлорированные растворители, поливинилхлорид (ПВХ), хлорфторуглероды и оксиды пропилена. На бумажных фабриках хлор используется для отбеливания бумаги. Компании водоснабжения и водоотведения используют хлор для дезинфекции воды.
Около 30% хлора используется в химической промышленности, около 25% требуется для производства ПВХ, 20% для очистки воды, 15% используется в растворителях и около 10% в отбеливателях.
Этот элемент также необходим для производства лекарств, силиконов и полимеров. Хлор также входит в состав бытовых отбеливателей, средств для удаления краски, антипиренов и пестицидов.
Другие применения соединений хлора:
- в качестве пестицида (хлорбензол);
- при производстве ПВХ, полиуретана и поликарбоната, соляной кислоты, хлорной извести;
- как моющее и дезинфицирующее средство;
- при производстве красок, клеев, ионообменников и даже снотворных
Высокая реакционная способность (является активным окислителем) привела к использованию хлора в качестве отбеливателя (например, в бумажной промышленности). Сейчас в этой роли все чаще используют перекись водорода, из-за вредного воздействия хлора на окружающую среду.
Хлор используется в качестве недорогого дезинфицирующего средства для питьевой воды. Получающаяся в результате хлорноватистая кислота убивает практически все вирусы и бактерии. Так называемый хлорный эффект (депо) имеет преимущество перед другими агентами. То есть после добавления хлора в водопровод, он оказывает дезинфицирующее действие на трубопроводную сеть еще в течение длительного времени. Большинство общественных бассейнов используют хлор в качестве дезинфицирующего средства.
Строительство
В прошлом в кирпичную кладку иногда добавляли хлорсодержащий антифриз. Выцветание хлоридов на необработанных кирпичных поверхностях может быть результатом неправильного подкисления. Кладка должна быть тщательно влажной перед подкислением, а после обработки ее следует быстро и обильно промыть.
Цель состоит в том, чтобы преобразовать CaCO3 (нерастворимый в воде раствор), который уже застыл с разбавленной соляной кислотой, в растворимый и моющийся хлорид кальция.
Хлорсодержащие материалы, применяемые в строительстве и быту:
- Покрытия, плиты, фасадные, настенные и напольные покрытия, содержащие ПВХ (поливинилхлорид);
- Краски, клеи или герметики с ПВХ, полихлоропреном или другим хлорсодержащим агентом;
- Средства для снятия краски, разбавители, средства для чистки кистей, содержащие хлорированные углеводороды в качестве компонентов растворителя.
Биологическое значение
Физиологически, хлор имеет большое значение в ионной форме хлорида как минерала. Употребляется в пищу в основном в форме поваренной соли (хлорид натрия). Ежедневно человек потребляет от 3 до 12г соли, которая выводится через почки и пот.
Хлорид натрия необходим для выработки желудочной кислоты, поддержания осмоса в организме, а также для проводимости нервных импульсов.
Обнаружение
Хлорид (Cl -) может обнаружен в реакции водного раствора путем подкисления азотной кислотой с нитратом серебра. В результате образуется белый осадок хлорида серебра. В дополнение к хлоридам, этот эксперимент может также обнаружить йодиды и бромиды в разбавленной аммиачной воде (реакция комплексообразования).
![]()
Хлор и вода
Среднее содержание хлора в морской воде составляет около 20 000 частей на миллион (2%). Концентрация в речной воде обычно составляет около 8 частей на миллион. Хлор — один из самых реактивных элементов, поэтому он легко вступает в реакцию с водой, образуя соляную кислоту и гипохлорит.
Растворимость газообразного хлора в воде составляет около 6,3 г / л при стандартных условиях. Считается, что соли хлора также легко растворяются в воде.
Как хлор может попасть в воду?
Хлор естественным образом содержится в некоторых минералах, таких как галит, сильвин и карналлит. Он не встречается в природе в свободной форме, а только в соединениях, в основном в виде хлорида натрия (поваренная соль). Поваренную соль получают в основном из галита, но ее также можно извлечь из морской воды.
Использование противообледенительных солей на дорогах и человеческих экскрементов в городских сточных водах быстро приводит к увеличению количества хлоридов в воде и почве.
Какие экологические проблемы может вызвать загрязнение воды хлором?
Концентрация хлоридов в нормальных почвах колеблется в пределах 50-2000 ppm. Самые высокие концентрации соли можно найти в засушливых и полузасушливых районах, а также в районах, расположенных недалеко от моря.
Растения поглощают хлорид через свои корни, а газообразный хлор через надземные части растения. У растения часто наблюдается скопление хлоридов в цитоплазме. Содержание хлора в растениях обычно составляет около 2000-20 000 частей на миллион. Некоторые деревья, такие как чинары или дубы, могут спокойно переносить относительно высокие концентрации солей хлора в почве.
В водных процессах часто происходят взаимодействия между хлоридом и железом, что имеет место, например, в фотохимических процессах. Также интересно, что хлорид натрия в частицах морской соли может реагировать с оксидами азота, образуя атомы хлора, которые могут разрушать озон.
Хлор оказывает токсическое действие на рыбу, смертельная концентрация при которой умирает около 50% популяции составляет около 293 частей на миллион. Соединения хлора также могут быть токсичными и очень опасными для окружающей среды.
Опасность для здоровья
При попадании на слизистые оболочки, образуются хлорноватистая и соляная кислоты. В зависимости от концентрации, вдыхание приводит к раздражению слизистых оболочек, кашлю и одышке, а также к удушью.
Попадание жидкого хлора может вызвать ожоги как слизистых оболочек, так и кожи.
Газообразный хлор крайне токсичен при вдыхании, раздражает дыхательные пути, глаза, кожу и пищеварительный тракт. Вызывает повреждение легких с тяжелыми хроническими последствиями, различные сердечно-сосудистые заболевания. Концентрация хлора около 0,5% в воздухе смертельна для человека. Концентрация около 0,001% уже может вызывать симптомы отравления.
Одно из научных исследований установило, что хлорированная вода увеличивает риск рака мочевого пузыря на 35 процентов. Плавание в хлорированной воде увеличивает опасность уже на 57 процента. Негативные эффекты зависят от концентрации хлора, продолжительности и частоты приема, а также от состояния здоровья человека.
Техника безопасности
Хранить контейнеры, содержащие хлор, плотно закрытыми в хорошо проветриваемом месте, вдали от открытого огня, тепла и солнечного света, а также влаги. При входе в помещение с газообразным хлором всегда надевать защитные респираторы.
Замена баллона с газообразным хлором возможна только при защите рук (защитные перчатки) и органов дыхания (полнолицевая маска с кислородным фильтром или автономный дыхательный аппарат). После каждой замены баллона необходимо проверять герметичность фитингов и предохранять баллоны от опрокидывания (фиксация на кронштейне).
Первая помощь при отравлении хлором
- При попадании на одежду: немедленно снять загрязненную одежду.
- После вдыхания: вынести пациента на свежий воздух, при возможности дать подышать чистым кислородом. Немедленно доставить в больницу.
- При попадании на кожу: немедленно промыть водой с мылом, в случае ожога — наложить стерильную повязку. Немедленная транспортировка в больницу.
При попадании в глаза: промыть под проточной водой в течение 10–15 минут с широко открытым веком. Затем немедленно обратиться к офтальмологу.
Экология
Использование многих продуктов, содержащих хлор, экологически сомнительно. С одной стороны, электролитическое производство хлора требует больших затрат энергии. Однако гораздо важнее то, что многие продукты, содержащие хлор, могут нанести вред окружающей среде и здоровью человека.
Причина заключается в том, что из-за недостатка природных органических соединений хлора очень немногие микроорганизмы специализируются на разложении этих соединений в ходе эволюции. Следствием этого является то, что эти неприродные соединения часто остаются в окружающей среде в течение очень долгого времени, поскольку они химически очень стабильны. Если соединения хлора затем попадают в пищевую цепь, то накапливаются в организме в конечных звеньях цепи (биоаккумуляция).
При утилизации хлорорганических соединений и пластиковых отходов из ПВХ образуются очень ядовитые диоксины и другие ядовитые соединения хлора, загрязняющие окружающую среду.






































