Запрос «Oxygen» перенаправляется сюда; о других значениях см. Oxygene.
| Кислород | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Азот | Фтор → | ||||||||||||||||||||
|
||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||

Жидкий кислород |
||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||
| Название, символ, номер | Кислоро́д / Oxygenium (Oxygen)(O), 8 | |||||||||||||||||||
| Группа, период, блок |
16 (устар. 6), 2, p-элемент |
|||||||||||||||||||
| Атомная масса (молярная масса) |
[15,99903; 15,99977][комм 1][1] а. е. м. (г/моль) | |||||||||||||||||||
| Электронная конфигурация |
[He] 2s22p4 1s22s22p4 |
|||||||||||||||||||
| Радиус атома | 60 (48) пм | |||||||||||||||||||
| Химические свойства | ||||||||||||||||||||
| Ковалентный радиус | 73 пм | |||||||||||||||||||
| Радиус иона | 132 (-2e) пм | |||||||||||||||||||
| Электроотрицательность | 3,44 (шкала Полинга) | |||||||||||||||||||
| Электродный потенциал | 0 | |||||||||||||||||||
| Степени окисления | –2, −1, –½, –⅓, 0, +½, +1, +2 | |||||||||||||||||||
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) | |||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||
| Термодинамическая фаза | Газ | |||||||||||||||||||
| Плотность (при н. у.) | 0,00142897 г/см³ | |||||||||||||||||||
| Температура плавления | 54,8 К (-218,35 °C) | |||||||||||||||||||
| Температура кипения | 90,19 К (-182,96 °C) | |||||||||||||||||||
| Уд. теплота плавления | 0,444 кДж/моль | |||||||||||||||||||
| Уд. теплота испарения | 3,4099 кДж/моль | |||||||||||||||||||
| Молярная теплоёмкость | 29,4[2] Дж/(K·моль) | |||||||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | |||||||||||||||||||
|
||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||
| Структура решётки | Моноклинная | |||||||||||||||||||
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å | |||||||||||||||||||
| Температура Дебая | 155 K | |||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||
| Теплопроводность | (300 K) 0,027 Вт/(м·К) | |||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||
|
|
||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||
|
Основная статья: Изотопы кислорода
|
Кислоро́д (химический символ — O, от лат. Oxygenium) — химический элемент 16-й группы (по устаревшей классификации — главной подгруппы шестой группы, VIA), второго периода периодической системы Д. И. Менделеева, с атомным номером 8.
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Как простое вещество (при нормальных условиях) кислород — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов (формула — O2). Систематическое название: дикислород[3].
Жидкий кислород (при низких температурах) имеет светло-голубой цвет, а твёрдый (при низких температурах) представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3). Систематическое название: трикислород. Часто можно почувствовать запах озона после грозы. Озон образует озоновый слой в стратосфере, который образуется там за счёт ионизации кислорода ультрафиолетом.
История открытия[править | править код]
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия[править | править код]
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе[править | править код]

Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1. (3,85—2,45 млрд лет назад) — O2 не производился
2. (2,45—1,85 млрд лет назад) — O2 производился, но поглощался океаном и породами морского дна
3. (1,85—0,85 млрд лет назад) — O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O2 в атмосфере
5. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород[6].
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад кислород начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня[8][9].
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере[15].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Физические свойства[править | править код]

В мировом океане концентрация растворённого O2 больше в холодных водах, меньше — в тёплых

При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г, то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20—40 об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 МПа[17].

Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[18].
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[18].
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[18].
Ещё три фазы существуют при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4[19] или O8[20][21], существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства[править | править код]
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород). Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений в реакциях горения:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- Некоторые оксиды поглощают кислород:
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−
2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- Неорганические озониды содержат ион O−
3 со степенью окисления кислорода, формально равной −⅓. Получают действием озона на гидроксиды щелочных металлов:
- В ионе диоксигенила O+
2 кислород имеет формально степень окисления +½. Получают по реакции:
В этой реакции кислород проявляет восстановительные свойства.
Фториды кислорода[править | править код]
- Дифторид кислорода, OF2, степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифтороксония[en][22] OF+
3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[23][24].
Получение[править | править код]
Перегонка жидкого воздуха[править | править код]
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии, а также использующие принцип адсорбции.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ[править | править код]
Небольшие количества кислорода можно получать нагреванием перманганата калия 
.
Используют также реакцию каталитического разложения пероксида водорода 
.
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) 
.
Разложение оксида ртути(II) {{{1}}} было первым методом получения кислорода:
.
Электролиз водных растворов[править | править код]
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
Реакция перекисных соединений с углекислым газом[править | править код]
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Применение[править | править код]
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии[править | править код]
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов[править | править код]
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Компонент ракетного топлива[править | править код]
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине[править | править код]
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров[25].
В пищевой промышленности[править | править код]
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[26], как пропеллент и упаковочный газ.
В химической промышленности[править | править код]
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние описанные реакции часто проводят в режиме горения.
В сельском хозяйстве[править | править код]
В тепличном хозяйстве для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода[править | править код]

Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом.
Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях для улучшения обменных процессов в желудок вводили кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода[править | править код]
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие, как синглетный кислород, пероксид водорода, супероксид, озон и гидроксильный радикал, являются токсичными и реакционноспособными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), пероксид водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Токсичность кислорода[править | править код]
Длительное вдыхание чистого кислорода может иметь опасные последствия для организма. Безопасно длительно дышать при обычном давлении смесями, содержащими до 60 % кислорода, вдыхая и выдыхая через нос, поскольку зубная эмаль и верхние дыхательные пути особенно страдают от контакта с чистым кислородом[27]. Дыхание 90 % кислородом в течение 3 суток приводит к тахикардии, рвоте, пневмонии, судорогам. При повышении давления токсическое действие кислорода ускоряется и усиливается. Молодые люди более чувствительны к токсическому действию кислорода, чем пожилые[28].
Изотопы[править | править код]
Кислород имеет три устойчивых изотопа: 16O, 17O и 18O, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16O связано с тем, что ядро атома 16O состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода с массовыми числами от 12O до 28O. Все радиоактивные изотопы кислорода имеют малый период полураспада, наиболее долгоживущий из них — 15O с периодом полураспада ~120 секунд. Наиболее краткоживущий изотоп 12O имеет период полураспада 5,8⋅10−22 секунд.
См. также[править | править код]
- Категория:Соединения кислорода
Примечания[править | править код]
- Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
- Источники
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- ↑ Дикислород Архивная копия от 4 марта 2016 на Wayback Machine // Большая Энциклопедия Нефти Газа
- ↑ J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑ W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 1 2 Кнунянц И. Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387—389. — 671 с. — 100 000 экз.
- ↑ Я. А. Угай. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — С. 432—435. — 527 с.
- ↑ Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. Atmospheric oxygenation three billion years ago (англ.). — Nature, 2013. — Iss. 501, no. 7468. — P. 535—538. — doi:10.1038/nature12426. — PMID 24067713.
- ↑ Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. — San Francisco: Pearson – Benjamin Cummings, 2005. — С. 522–23. — ISBN 0-8053-7171-0.
- ↑ Freeman, Scott. Biological Science, 2nd. — Upper Saddle River, NJ: Pearson – Prentice Hall, 2005. — P. 214, 586. — ISBN Biological Science, 2nd.
- ↑ Berner, Robert A. Atmospheric oxygen over Phanerozoic time. — Proceedings of the National Academy of Sciences of the USA, 1999. — doi:10.1073/pnas.96.20.10955. — PMID 10500106. Архивировано 7 октября 2019 года.
- ↑ Butterfield, N. J. Oxygen, animals and oceanic ventilation: An alternative view (англ.). — Geobiology, 2009. — Iss. 7, no. 1. — P. 1—7. — doi:10.1111/j.1472-4669.2009.00188.x. — PMID 19200141.
- ↑ «Лёгкие планеты» находятся в океане. Дата обращения: 26 июля 2015. Архивировано 8 декабря 2015 года.
- ↑ Образование кислорода в природе и получение его в технике. © Зооинженерный факультет МСХА. Дата обращения: 26 июля 2015. Архивировано 8 декабря 2015 года.
- ↑ Dole, Malcolm. The Journal of General Physiology (англ.). — 1965. — Iss. 49, no. 1. — doi:10.1085/jgp.49.1.5. — PMID 5859927. Архивировано 17 января 2014 года.
- ↑ ТАСС: Наука — Учёные: кислород в атмосфере Земли появился на 800 млн лет раньше, чем считалось ранее. Дата обращения: 25 марта 2016. Архивировано 23 апреля 2016 года.
- ↑ Рябин В. А. и др., Термодинамические свойства веществ, 1977, с. 127.
- ↑ 1 2 3 Inorganic Crystal Structure Database. Дата обращения: 3 августа 2009. Архивировано 3 марта 2012 года.
- ↑ Yu. A. Freiman, H. J. Jodl. Solid oxygen // Physics Reports. — 2004. — Т. 401, № 1—4. — С. 1—228. — doi:10.1016/j.physrep.2004.06.002.
- ↑ Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda. O8 Cluster Structure of the Epsilon Phase of Solid Oxygen // Phys. Rev. Lett.. — 2006. — Т. 97. — С. 085503. — doi:10.1103/PhysRevLett.97.085503.
- ↑ Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers, Paul Loubeyre. Observation of an O8 molecular lattice in the ε phase of solid oxygen (англ.) // Nature. — 2006. — Vol. 443. — P. 201—204. — doi:10.1038/nature05174.
- ↑ Margaret-Jane Crawford и Thomas M. Klapötke. The trifluorooxonium cation, OF3+ (англ.) // Journal of Fluorine Chemistry. — 1999. — Vol. 99, iss. 2. — P. 151—156. — doi:10.1016/S0022-1139(99)00139-6. Архивировано 24 сентября 2015 года.
- ↑ Curie P., Curie M. Effets chimiques produits par les rayons de Becquerel (фр.) // Comptes rendus de l’Académie des Sciences (англ.) (рус. : magazine. — 1899. — Vol. 129. — P. 823—825. Архивировано 16 февраля 2016 года.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28—33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4.
- ↑ Food-Info.net: E-numbers: E948 : Oxygen Архивная копия от 4 апреля 2009 на Wayback Machine.
- ↑ Трагедии советского подплава – Владимир Шигин – Google Books
- ↑ Вредные химические вещества: Неорганические соединения элементов V—VIII групп. Справочник. — Л., 1989. — С. 150—170
Литература[править | править код]
- Кислород / Зломанов В. П. // Киреев — Конго. — М. : Большая российская энциклопедия, 2009. — С. 59. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 14). — ISBN 978-5-85270-345-3.
- Рябин В. А., Остроумов М. А., Свит Т. Ф. Термодинамические свойства веществ. Справочник. — Л.: Химия, 1977. — 392 с.
Из БРЭ:
- Saunders N. Oxygen and the elements of group 16. Oxf., 2003. (англ.)
- Дроздов А. А., Зломанов В. П., Мазо Г. Н., Спиридонов Ф. М. Неорганическая химия. М., 2004. Т. 2.
- Шрайвер Д., Эткинс П. Неорганическая химия. М., 2004. Т. 1-2.
Ссылки[править | править код]
- Кислород на Webelements Архивная копия от 30 августа 2004 на Wayback Machine (англ.)
- Кислород в Популярной библиотеке химических элементов Архивная копия от 30 сентября 2007 на Wayback Machine
- Твёрдый кислород при сверхбольших давлениях: образование молекул O4 Архивная копия от 14 января 2020 на Wayback Machine
- Выяснено магнитное упорядочение оранжевого кислорода Архивная копия от 12 сентября 2011 на Wayback Machine
- Магнитный коллапс в твёрдом кислороде Архивная копия от 27 марта 2008 на Wayback Machine
- Растворимость кислорода в воде TWT department of MPEI: Live Calculations by MAS
- Учёным удалось напрямую получить молекулы кислорода из углекислого газа Архивная копия от 3 февраля 2015 на Wayback Machine
- Российским кислородом дышит весь мир: О проблемах сохранения леса
- В лаборатории кислород получают разложением некоторых кислородсодержащих веществ. Собирают его вытеснением воды или воздуха.
Разложение марганцовки (перманганата калия) при нагревании:

Рис. (1). Разложение перманганата калия
Разложение пероксида водорода в присутствии катализатора:

Рис. (2). Разложение пероксида
водорода
Электролиз воды:
Можно получить кислород и при разложении некоторых других веществ: бертолетовой соли
KClO3
, нитратов
NaNO3
,
KNO3
и т. д.
- В промышленных масштабах кислород получают из воздуха. Для этого воздух при повышенном давлении охлаждают и превращают в жидкость. Затем жидкий воздух нагревают. Сначала выделяется азот (температура кипения (–196) °С). Жидкий кислород остаётся, так как его температура кипения выше ((–183) °С). Хранят жидкий кислород в стальных баллонах голубого цвета.
Применение кислорода
- В металлургической промышленности кислород используется при выплавке чугуна и стали.
- В смеси с водородом или ацетиленом кислород применяется для резки и варки металлов.
- Находит применение кислород в качестве окислителя ракетного топлива.
- Используется он для обеспечения жизнедеятельности на подводных лодках и космических кораблях, при работе водолазов.
- Находит применение в медицине в лечебных целях.
Источники:
Рис. 1. Разложение перманганата калия © ЯКласс
Рис. 2. Разложение пероксида водорода © ЯКласс
Получение кислорода


4.9
Средняя оценка: 4.9
Всего получено оценок: 235.
4.9
Средняя оценка: 4.9
Всего получено оценок: 235.
Кислород появился в земной атмосфере с возникновением зелёных растений и фотосинтезирующих бактерий. Благодаря кислороду аэробными организмами осуществляется дыхание или окисление. Важно получение кислорода в промышленности – он используется в металлургии, медицине, авиации, народном хозяйстве и других отраслях.
Свойства
Кислород – восьмой элемент периодической таблицы Менделеева. Это газ, поддерживающий горение и осуществляющий окисление веществ.
Официально кислород был открыт в 1774 году. Английский химик Джозеф Пристли выделил элемент из оксида ртути:
2HgO → 2Hg + O2↑.
Однако Пристли не знал, что кислород является частью воздуха. Свойства и нахождение в атмосфере кислорода позже уставил коллега Пристли – французский химик Антуан Лавуазье.
Общая характеристика кислорода:
- бесцветный газ;
- не имеет запаха и вкуса;
- тяжелее воздуха;
- молекула состоит из двух атомов кислорода (О2);
- в жидком состоянии имеет бледно-голубой цвет;
- плохо растворим в воде;
- является сильным окислителем.

Присутствие кислорода легко проверить, опустив в сосуд с газом тлеющую лучину. При наличии кислорода лучина вспыхивает.
Как получают
Известно несколько способов получения кислорода из различных соединений в промышленных и лабораторных условиях. В промышленности кислород получают из воздуха путём его сжижения под давлением и при температуре в -183°С. Жидкий воздух подвергают испарению, т.е. постепенно нагревают. При -196°C азот начинает улетучиваться, а кислород сохраняет жидкое состояние.
В лаборатории кислород образуется из солей, пероксида водорода и в результате электролиза. Разложение солей происходит при нагревании. Например, хлорат калия или бертолетову соль нагревают до 500°С, а перманганат калия или марганцовку – до 240°С:
- 2KClO3 → 2KCl + 3O2↑;
- 2KMnO4 → K2MnO4 + MnO2 + O2↑.

Также можно получить кислород путём нагревания селитры или нитрата калия:
2KNO3 → 2KNO2 + O2↑.
При разложении пероксида водорода используется оксид марганца (IV) – MnO2, углерод или порошок железа в качестве катализатора. Общее уравнение выглядит следующим образом:
2Н2О2 → 2Н2О + О2↑.
Электролизу подвергается раствор гидроксида натрия. В результате образуется вода и кислород:
4NaOH → (электролиз) 4Na + 2H2O + O2↑.
Также кислород с помощью электролиза выделяют из воды, разложив её на водород и кислород:
2H2O → 2H2 + O2↑.
На атомных подводных лодках кислород получали из пироксида натрия – 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑. Способ интересен тем, что вместе с выделением кислорода поглощается углекислый газ.
Как применяют
Собирание и распознавание необходимо для выделения чистого кислорода, использующегося в промышленности для окисления веществ, а также для поддержания дыхания в космосе, под водой, в задымлённых помещениях (кислород необходим пожарным). В медицине баллоны кислорода помогают дышать пациентам с затруднённым дыханием. Также кислород используется для лечения респираторных заболеваний.
Кислород применяют для сжигания топлива – угля, нефти, природного газа. Кислород широко применяется в металлургии и машиностроении, например, для плавки, резки и сварки металла.

Что мы узнали?
Кислород – бесцветный газ, необходимый для дыхания и используемый в промышленности. Кислород получают путём сжижения и испарения воздуха, электролизом воды или гидроксида натрия, выделяют из солей и пероксида водорода. Кислород используется для поддержания дыхания в местах с ограниченным запасом кислорода или его отсутствием, а также в промышленности для сжигания топлива и производства металла.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Томас Шелби
10/10
-

Лидия Маслова
10/10
-

Михаил Заричняк
5/10
-

Gordievich Igor
9/10
-

Владочка Дунина
9/10
Оценка доклада
4.9
Средняя оценка: 4.9
Всего получено оценок: 235.
А какая ваша оценка?
| Кислород | |
|---|---|
| Газ без цвета, вкуса и запаха; голубоватая жидкость (при низких температурах) |
|

Жидкий кислород |
|
| Название, символ, номер | Кислород / Oxygenium (Oxygen)(O), 8 |
| Атомная масса (молярная масса) |
[15,99903; 15,99977] а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p4 |
| Радиус атома | 60 (48) пм |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
| Электроотрицательность | 3,44 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | -2, −1, -½, -⅓, 0, ½, +1, +2 |
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
| Плотность (при н. у.) |
газ: 1,42897 кг/м³ жидкость: 1,141 г/см³ |
| Температура плавления | 54,8 К (-218,35 °C) |
| Температура кипения | 90,19 К (-182,96 °C) |
| Уд. теплота плавления | 0,444 кДж/моль |
| Уд. теплота испарения | 3,4099 кДж/моль |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å |
| Температура Дебая | 155 K |
| Теплопроводность | (300 K) 0,027 Вт/(м·К) |
Кислород (O, лат. oxygenium) — химический элемент 16-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VI группы, или к группе VIA), второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 4.1 Перегонка жидкого воздуха
- 4.2 Разложение кислородсодержащих веществ
- 4.3 Электролиз водных растворов
- 4.4 Реакция перекисных соединений с углекислым газом
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Фториды кислорода
- 7 Применение
- 7.1 В металлургии
- 7.2 Сварка и резка металлов
- 7.3 Компонент ракетного топлива
- 7.4 В медицине
- 7.5 В пищевой промышленности
- 7.6 В химической промышленности
- 7.7 В сельском хозяйстве
- 8 Биологическая роль кислорода
- 9 Токсические производные кислорода
- 10 Токсичность кислорода
- 11 Изотопы
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
-
- 2HgO →ot 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygene), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
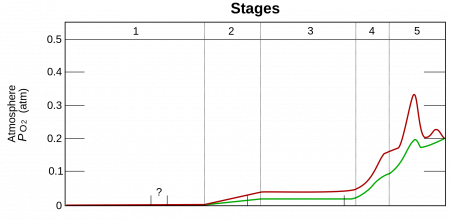
Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1. (3,85—2,45 млрд лет назад) — O2 не производился
2. (2,45—1,85 млрд лет назад) O2 производился, но поглощался океаном и породами морского дна
3. (1,85—0,85 млрд лет назад) O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O2 в атмосфере
5. (0,54 млрд лет назад — по настоящее время) современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
-
- 2KMnO4 → K2MnO4 + MnO2 + O2↑
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца (IV):
-
- 2H2O2 →MnO2 2H2O + O2↑
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
-
- 2KClO3 → 2KCl + 3O2↑
Разложение оксида ртути (II) (при t = 100 °C) было первым методом синтеза кислорода:
-
- 2HgO →100oC 2Hg + O2↑
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
-
- 2H2O →e− 2H2 + O2↑
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
-
- 2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Физические свойства
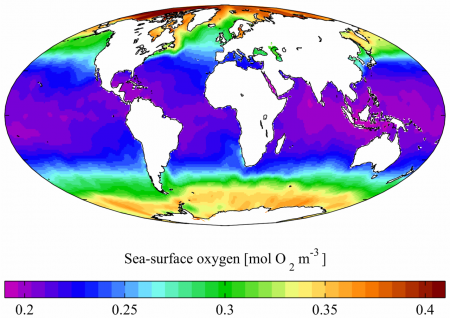
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой

При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
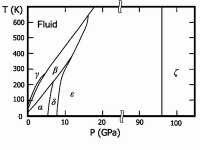
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы. Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-O2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4 или O8, существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li + O2 → 2Li2O
- 2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO + O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 + 15O2 → 12CO2 + 6H2O
- CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH + O2 → CH3COOH + H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 2Na + O2 → Na2O2
- Некоторые оксиды поглощают кислород:
- 2BaO + O2 → 2BaO2
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- H2 + O2 → H2O2
- В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−
2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Na2O2 + O2 → 2NaO2
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- K + O2 → KO2
- Неорганические озониды содержат ион O−
3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- 3KOH + 3O3 → 2KO3 + KOH ∗ H2O + 2O2↑
- В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
- PtF6 + O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
- Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
- 2F2 + 2NaOH → 2NaF + H2O + OF2↑
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- F2 + O2 → O2F2
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Применение]
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Компонент ракетного топлива
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Основная статья: Кислородная терапия
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горения.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода

Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие, как синглетный кислород, пероксид водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), пероксид водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Токсичность кислорода
Длительное вдыхание чистого кислорода может иметь опасные последствия для организма. Безопасно длительно дышать при обычном давлении смесями, содержащими до 60 % кислорода. Дыхание 90 % кислородом в течение 3 суток приводит к тахикардии, рвоте, пневмонии, судорогам. При повышении давления токсическое действие кислорода ускоряется и усиливается. Молодые люди более чувствительны к токсическому действию кислорода, чем пожилые.
Изотопы
Основная статья: Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16O, 17O и 18O, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16O связано с тем, что ядро атома 16O состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода с массовыми числами от 12O до 28O. Все радиоактивные изотопы кислорода имеют малый период полураспада, наиболее долгоживущий из них 15O с периодом полураспада ~120 секунд. Наиболее краткоживущий изотоп 12O имеет период полураспада 5,8⋅10−22 секунд.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Здравствуйте. Вы уже читали мои статьи в блоге Tutoronline.ru. Сегодня я расскажу Вам о кислороде и о способах его получения. Напоминаю, если у Вас будут ко мне вопросы, Вы можете писать их в комментариях к статье. Если же Вам понадобиться любая помощь по химии, записывайтесь на мои занятия в расписании. Буду рад Вам помочь.
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно.
В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода – Оо , дикислорода – О2 и озона – О3. Причём, атомарный кислород может быть получен следующим образом:
КClO3 = KCl + 3O0
KNO3 = KNO2 + O0
Кислород входит в состав более 1400 различных минералов и органических веществ, в атмосфере его содержание составляет 21% по объёму. А в человеческом теле содержится до 65% кислорода. Кислород газ без цвета и запаха, мало растворим в воде (в 100 объёмах воды при 20оС растворяется 3 объёма кислорода).
В лаборатории кислород получают умеренным нагреванием некоторых веществ:
1) При разложении соединений марганца (+7) и (+4):
2KMnO4 → K2MnO4 + MnO2 + O2
перманганат манганат
калия калия
2MnO2 → 2MnO + O2
2) При разложении перхлоратов:
2KClO4 → KClO2 + KCl + 3O2
перхлорат
калия
3) При разложении бертолетовой соли (хлората калия).
При этом образуется атомарный кислород:
2KClO3 → 2 KCl + 6O0
хлорат
калия
4) При разложении на свету солей хлорноватистой кислоты – гипохлоритов:
2NaClO → 2NaCl + O2
Ca(ClO)2 → CaCl2 + O2

5) При нагревании нитратов.
При этом образуется атомарный кислород. В зависимости от того, какое положение в ряду активности занимает металл нитрата, образуются различные продукты реакции:
2NaNO3 → 2NaNO2 + O2
Ca(NO3)2 → CaO + 2NO2 + O2
2AgNO3 → 2 Ag + 2NO2 + O2
6) При разложении пероксидов:
2H2O2 ↔ 2H2O + O2
7) При нагревании оксидов неактивных металлов:
2Аg2O ↔ 4Аg + O2
Данный процесс имеет актуальное значение в быту. Дело в том, что посуда, изготовленная из меди или серебра, имея естественный слой оксидной плёнки, при нагревании образует активный кислород, что является антибактериальным эффектом. Растворение солей неактивных металлов, особенно нитратов, также приводит к образованию кислорода. Например, суммарный процесс растворения нитрата серебра можно представить по этапам:
AgNO3 + H2O → AgOH + HNO3
2AgOH → Ag2O + O2
2Ag2O → 4Ag + O2
или в суммарном виде:
4AgNO3 + 2H2O → 4Ag + 4HNO3 + 7O2
8) При нагревании солей хрома высшей степени окисления:
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3 O2
бихромат хромат
калия калия
В промышленности кислород получают:
1) Электролитическим разложением воды:
2Н2О → 2Н2 + О2
2) Взаимодействием углекислого газа с пероксидами:
СО2 + К2О2 →К2СО3 + О2
Данный способ представляет собой незаменимое техническое решение проблемы дыхания в изолированных системах: подводных лодках, шахтах, космических аппаратах.
3) При взаимодействии озона с восстановителями:
О3 + 2КJ + H2O → J2 + 2KOH + O2
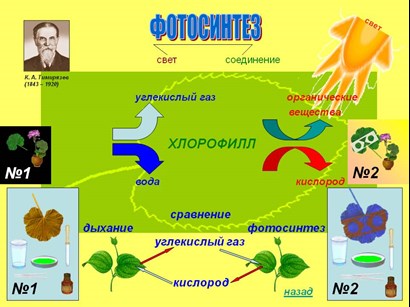 Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
Особое значение получение кислорода имеет место в процессе фотосинтеза, происходящего в растениях. Кардинальным образом от этого процесса зависит вся жизнь на Земле. Фотосинтез – сложный многоступенчатый процесс. Начало ему даёт свет. Сам фотосинтез состоит из двух фаз: световой и темновой. В световую фазу пигмент хлорофилл, содержащийся в листьях растений, образует так называемый «светопоглощающий» комплекс», который отнимает электроны у воды, и тем самым расщепляет её на ионы водорода и кислород:
2Н2О = 4е + 4Н + О2
Накопившиеся протоны способствуют синтезу АТФ:
АДФ + Ф = АТФ
В темновую фазу происходит преобразование углекислого газа и воды в глюкозу. И побочно выделяется кислород:
6СО2 + 6Н2О = С6Н12О6 + О2
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
















![{displaystyle {ce {2H2O ->[e^-] 2H2 ^ + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8db728b3843f8a1cdd2018f9fc927b902a80673f)

