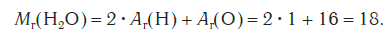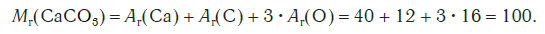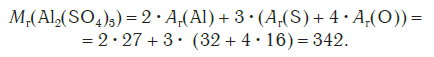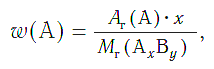From Wikipedia, the free encyclopedia
The molecular mass (m) is the mass of a given molecule: it is measured in daltons or atomic mass (Da or u).[1][2] Different molecules of the same compound may have different molecular masses because they contain different isotopes of an element. The related quantity relative molecular mass, as defined by IUPAC, is the ratio of the mass of a molecule to the unified atomic mass unit (also known as the dalton) and is unitless. The molecular mass and relative molecular mass are distinct from but related to the molar mass. The molar mass is defined as the mass of a given substance divided by the amount of a substance and is expressed in g/mol. That makes the molar mass an average of many particles or molecules, and the molecular mass the mass of one specific particle or molecule. The molar mass is usually the more appropriate figure when dealing with macroscopic (weigh-able) quantities of a substance.
The definition of molecular weight is most authoritatively synonymous with relative molecular mass; however, in common practice, it is highly variable. When the molecular weight is used with the units Da or u, it is frequently as a weighted average similar to the molar mass but with different units. In molecular biology, the mass of macromolecules is referred to as their molecular weight and is expressed in kDa, although the numerical value is often approximate and representative of an average.
The terms molecular mass, molecular weight, and molar mass are often used interchangeably in areas of science where distinguishing between them is unhelpful. In other areas of science, the distinction is crucial. The molecular mass is more commonly used when referring to the mass of a single or specific well-defined molecule and less commonly than molecular weight when referring to a weighted average of a sample. Prior to the 2019 redefinition of SI base units quantities expressed in daltons (Da or u) were by definition numerically equivalent to otherwise identical quantities expressed in the units g/mol and were thus strictly numerically interchangeable. After the 20 May 2019 redefinition of units, this relationship is only nearly equivalent.
The molecular mass of small to medium size molecules, measured by mass spectrometry, can be used to determine the composition of elements in the molecule. The molecular masses of macromolecules, such as proteins, can also be determined by mass spectrometry; however, methods based on viscosity and light-scattering are also used to determine molecular mass when crystallographic or mass spectrometric data are not available.
Calculation[edit]
Molecular masses are calculated from the atomic masses of each nuclide present in the molecule, while relative molecular masses are calculated from the standard atomic weights[3] of each element. The standard atomic weight takes into account the isotopic distribution of the element in a given sample (usually assumed to be “normal”). For example, water has a relative molecular mass of 18.0153(3), but individual water molecules have molecular masses which range between 18.010 564 6863(15) Da (1H
216O) and 22.027 7364(9) Da (2H
218O).
Atomic and molecular masses are usually reported in daltons which is defined relative to the mass of the isotope 12C (carbon 12). Relative atomic and molecular mass values as defined are dimensionless. However, the “unit” Dalton is still used in common practice. For example, the relative molecular mass and molecular mass of methane, whose molecular formula is CH4, are calculated respectively as follows:
The uncertainty in molecular mass reflects variance (error) in measurement not the natural variance in isotopic abundances across the globe. In high-resolution mass spectrometry the mass isotopomers 12C1H4 and 13C1H4 are observed as distinct molecules, with molecular masses of approximately 16.031 Da and 17.035 Da, respectively. The intensity of the mass-spectrometry peaks is proportional to the isotopic abundances in the molecular species. 12C 2H 1H3 can also be observed with molecular mass of 17 Da.
Determination[edit]
Mass spectrometry[edit]
In mass spectrometry, the molecular mass of a small molecule is usually reported as the monoisotopic mass, that is, the mass of the molecule containing only the most common isotope of each element. Note that this also differs subtly from the molecular mass in that the choice of isotopes is defined and thus is a single specific molecular mass of the many possibilities. The masses used to compute the monoisotopic molecular mass are found on a table of isotopic masses and are not found on a typical periodic table. The average molecular mass is often used for larger molecules since molecules with many atoms are unlikely to be composed exclusively of the most abundant isotope of each element. A theoretical average molecular mass can be calculated using the standard atomic weights found on a typical periodic table, since there is likely to be a statistical distribution of atoms representing the isotopes throughout the molecule. The average molecular mass of a sample, however, usually differs substantially from this since a single sample average is not the same as the average of many geographically distributed samples.
Mass photometry[edit]
Mass photometry (MP) is a rapid, in-solution, label-free method of obtaining the molecular mass of proteins, lipids, sugars & nucleic acids at the single-molecule level. The technique is based on interferometric scattered light microscopy.[4] Contrast from scattered light by a single binding event at the interface between the protein solution and glass slide is detected and is linearly proportional to the mass of the molecule. This technique is also capable of measuring sample homogeneity,[5] detecting protein oligomerisation state, characterisation of complex macromolecular assemblies (ribosomes, GroEL, AAV) and protein interactions such as protein-protein interactions.[6] Mass photometry can measure molecular mass to an accurate degree over a wide range of molecular masses (40kDa – 5MDa).
Hydrodynamic methods[edit]
To a first approximation, the basis for determination of molecular mass according to Mark–Houwink relations[7] is the fact that the intrinsic viscosity of solutions (or suspensions) of macromolecules depends on volumetric proportion of the dispersed particles in a particular solvent. Specifically, the hydrodynamic size as related to molecular mass depends on a conversion factor, describing the shape of a particular molecule. This allows the apparent molecular mass to be described from a range of techniques sensitive to hydrodynamic effects, including DLS, SEC (also known as GPC when the eluent is an organic solvent), viscometry, and diffusion ordered nuclear magnetic resonance spectroscopy (DOSY).[8] The apparent hydrodynamic size can then be used to approximate molecular mass using a series of macromolecule-specific standards.[9] As this requires calibration, it’s frequently described as a “relative” molecular mass determination method.
Static light scattering[edit]
It is also possible to determine absolute molecular mass directly from light scattering, traditionally using the Zimm method. This can be accomplished either via classical static light scattering or via multi-angle light scattering detectors. Molecular masses determined by this method do not require calibration, hence the term “absolute”. The only external measurement required is refractive index increment, which describes the change in refractive index with concentration.
See also[edit]
- Cryoscopy and cryoscopic constant
- Ebullioscopy and ebullioscopic constant
- Dumas method of molecular weight determination
- François-Marie Raoult
- Standard atomic weight
- Mass number
- Absolute molar mass
- Molar mass distribution
- Dalton (unit)
- SDS-PAGE
References[edit]
- ^ International Bureau of Weights and Measures (2006), The International System of Units (SI) (PDF) (8th ed.), p. 126, ISBN 92-822-2213-6, archived (PDF) from the original on 2021-06-04, retrieved 2021-12-16
- ^ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2011). “CODATA Recommended Values of the Fundamental Physical Constants: 2010”. Database developed by J. Baker, M. Douma, and S. Kotochigova. National Institute of Standards and Technology, Gaithersburg, MD 20899.
- ^ “Atomic Weights and Isotopic Compositions for All Elements”. NIST. Retrieved 2007-10-14.
- ^ Young et al. (2018). Quantitative imaging of single biological macromolecules. Science 360, 423-427. DOI: https://doi.org/10.1126/science.aar5839
- ^ Sonn-Segev, A., Belacic, K., Bodrug, T. et al. Quantifying the heterogeneity of macromolecular machines by mass photometry. Nat Commun 11, 1772 (2020). https://doi.org/10.1038/s41467-020-15642-w
- ^ Soltermman et al. Quantifying protein-protein interactions by molecular counting using mass photometry. Angew. Chem Int Ed, 2020, 59(27), 10774-10779
- ^ Paul, Hiemenz C., and Lodge P. Timothy. Polymer Chemistry. Second ed. Boca Raton: CRC P, 2007. 336, 338–339.
- ^ Johnson Jr., C. S. (1999). “Diffusion ordered nuclear magnetic resonance spectroscopy: principles and applications”. Progress in Nuclear Magnetic Resonance Spectroscopy. 34 (3–4): 203–256. doi:10.1016/S0079-6565(99)00003-5.
- ^ Neufeld, R.; Stalke, D. (2015). “Accurate Molecular Weight Determination of Small Molecules via DOSY-NMR by Using External Calibration Curves with Normalized Diffusion Coefficients” (PDF). Chem. Sci. 6 (6): 3354–3364. doi:10.1039/C5SC00670H. PMC 5656982. PMID 29142693.
External links[edit]
- A Free Android application for molecular and reciprocal weight calculation of any chemical formula
- Stoichiometry Add-In for Microsoft Excel for calculation of molecular weights, reaction coefficients and stoichiometry.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Относительная молекулярная масса

4.3
Средняя оценка: 4.3
Всего получено оценок: 760.
4.3
Средняя оценка: 4.3
Всего получено оценок: 760.
В химии чрезвычайно важным является понятие «молекулярная масса». Молекулярную массу часто путают с молярной массой. Чем отличаются эти величины, и какими свойствами обладают?
Молекулярная масса
Атомы и молекулы – мельчайшие частицы любых химических вещества. Если постараться выразить их массу в граммах, то получится число, в котором перед запятой будет находиться около 20 нулей. Поэтому измерять массу в таких единицах, как граммы, неудобно. Чтобы выйти из этой ситуации, следует какую-нибудь очень малую массу принять за единицу, а все остальные массы выражать по отношению к ней. В качестве этой единицы используют 1/12 массы атома углерода.
Относительна молекулярная масса – это масса молекулы вещества, которую измеряют в атомных единицах массы. Молекулярная масса равна отношению массы молекулы того или иного вещества к 1/12 части массы атома углерода. Она показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
Атомная единица массы (а. е. м.) равна 1,66*10 в -24 степени и представляет собой 1/12 часть массы атома углерода, то есть атома изотопа элемента углерода массовое число которого равно 12. Химический элемент в природе может иметь несколько устойчивых изотопов, поэтому, когда говорят об относительной атомной массе элемента или, как часто говорят, об атомной массе элемента A, то обязательно учитывают атомную массу всех устойчивых нуклидов.
Молекулярную массу часто путают с молярной массой, единицей измерения которой является г/моль. И действительно численно эти две величины абсолютно идентичны, однако размерность у них абсолютно разная.
Относительную молекулярную массу можно найти, сложив между собой атомные массы
Чтобы вычислить молекулярную массу простых и сложных веществ, необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr (H2O), которая состоит, как известно, из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.
Это означает, что масса молекулы воды в 18 раз больше 1/12 массы атома углерода. А молекулярная масса воздуха равна 29.
Атомная масса
Атомная масса химического элемента – также одно из важнейших обозначений в химии. Атомная масса – это средняя величина из атомных масс устойчивых природных изотопов этого элемента с учетом их относительного содержания в природе (их природного распространения). Так, в природе существуют два устойчивых изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34.97*0.7553)+(36.95*0.2447)=35.45 – именно такая величина принята для элемента хлора в качестве его относительной атомной массы.
Впервые вычисление атомных весов были сделаны Д. Дальтоном. Атомные веса элементов он относил к атомному весу водорода, приняв его за единицу. Однако вычисленные в соответствии с его принципом «наибольшей простоты» вес атома кислорода и некоторых других элементов оказались неверными.
Истинные атомные массы являются мизерными. Атом водорода весит 1,674*10 в -24 степени грамм, кислорода 26,67*10 в -24 степени грамм, а углерода 19,993*10 в -24 степени грамм.
Что мы узнали?
В школьной программе по химии (8 класс) большое внимание уделяется таким понятием, как относительная атомная и молекулярная масса вещества. Учащиеся изучают их отличия и особенности, а также учатся определять массы газов и веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Жале Гаджибекова
10/10
-
Александр Котков
10/10
-
Мерьем Рифатова
9/10
-
Наталья Моя
8/10
-
Александр Котков
10/10
-
Александр Котков
10/10
-
Сергей Макаров
10/10
-
Анастасия Ватанина
9/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 760.
А какая ваша оценка?
Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.
Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
Пример 1. Найдите молекулярную массу гидроксида калия (KOH)
Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:
Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
Пример 2. Найдите молекулярную массу серной кислоты (H2SO4 аш-два-эс-о-четыре)
Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:
Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (H2SO4) = 2 х 2 + 32 + 4 х 16 = 98
Видео по теме
Обратите внимание
При расчетах сначала выполняется умножение или деление, а только потом сложение или вычитание
Полезный совет
При определении относительной атомной массы округляйте значения, которые находятся в таблице Д.И. Менделеева до целого числа
Источники:
- как вычислить молекулярную массу
- Молекулярной массы определение
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Пример простого расчета молекулярной массы
Например, чтобы найти молекулярную массу NH 3 , первым делом нужно найти атомные массы азота (N) и водорода (H).
H = 1,00794 N = 14,0067
Затем умножьте атомную массу каждый атом числом атомов в соединении. Имеется один атом азота (для одного атома индекс не дается). Есть три атома водорода, как указано в нижнем индексе.
молекулярная масса = (1 x 14,0067) + (3 x 1,00794) молекулярная масса. mass = 14.0067 + 3.02382 молекулярная масса = 17.0305
Обратите внимание, что калькулятор даст ответ 17.03052, но полученный ответ содержит меньше значащих цифр. потому что в расчетах используется шесть значащих цифр в значениях атомной массы.
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Видео
Молярная масса вещества
ОПРЕДЕЛЕНИЕ
Молярная масса (М) – это масса 1 моль вещества.
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Тест по теме
/10 Вопрос 1 из 10