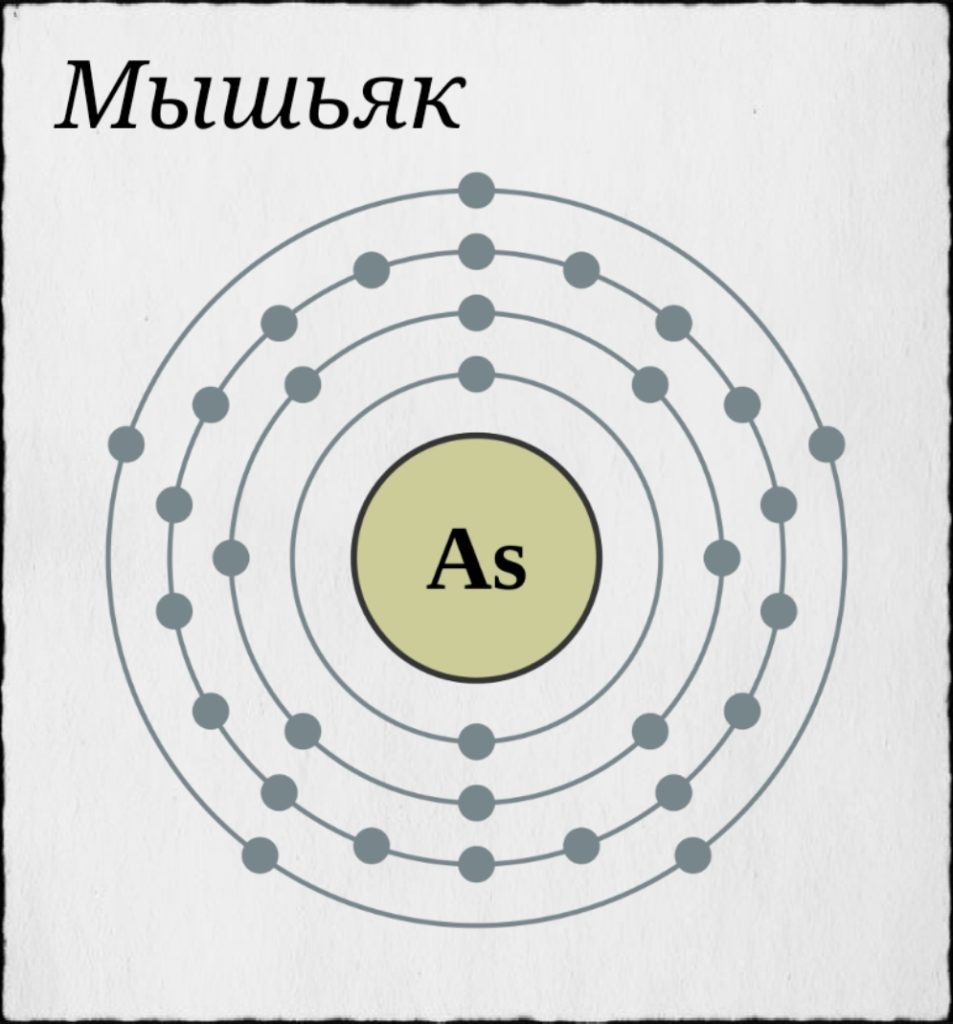
 М Мышьяк является химическим элементом таблицы Менделеева с атомным номером 33 и условным обозначением As. Мышьяк представляет собой серебристо-белый полуметалл, так как он проявляет и металлические и неметаллические свойства.
М Мышьяк является химическим элементом таблицы Менделеева с атомным номером 33 и условным обозначением As. Мышьяк представляет собой серебристо-белый полуметалл, так как он проявляет и металлические и неметаллические свойства.
Содержание
- Как был открыт Мышьяк;
- Где и как добывают Мышьяк;
- Распространенность Мышьяка;
- Применение Мышьяка;
- Интересные факты
Как был открыт Мышьяк

Такой химический элемент как мышьяк был известен людям с древнейших времен. Еще в третьем тысячелетии до Нашей Эры люди сталкивались с этим элементом когда добывали медь, где он является побочным продуктом. Позднее его начали использовать в качестве примеси в сплаве, который по своим свойствам напоминает бронзу. Сегодня предполагается, что первым человеком который выделил мышьяк, является немецкий католик Альберт Великий. Это событие предположительно произошло в 1250 году. Он восстанавливал этот элемент углем. Так же в 1649 году Иоганн Шредер опубликовал 2 разных способа получения чистого мышьяка. В дальнейшем, его изучение учеными позволило узнать многие его свойства. Он был достаточно популярен и находил применение во многих областях. К таким направлениям относятся медицина(косметика и лекарство), военное дело(химическое оружие) и литейное производство.
Где и как добывают Мышьяк

Мировое производство мышьяка ежегодно составляет порядка 40 000 тонн. Лидерами по производству этого элемента являются Китай, Морокко и Россия. Ежегодно Китай производит порядка 25 000 тонн. Марокко, в свою очередь, добывает порядка 9 000 тонн и на долю РФ приходится около 3000 тонн. Странами которые так же производят мышьяк являются Бельгия, Боливия, США и Канада. Их ежегодное производство составляет меньше 1 000 тонн. Этот химический элемент производится как побочный продукт при добыче свинца, меди, кобальта и золота.
Его технология производства выглядит следующим образом. Изначально оксид мышьяка получают методом обжига арсенопирита(FeAsS) в воздушном пространстве. Затем оксид мышьяка нагревают при температуре около 600°C и методом сублимации осаждают очищенный мышьяк в глиняных трубках. Для применения в полупроводниковых технологиях чистота мышьяка должна превышать отметку в 99,999%. Такой чистоты добиваются путем многократного восстановления дисцилированного хлорида мышьяка водородом. Операция проводится до того момента пока не будет достигнута определенная чистота.
Распространенность Мышьяка

Мышьяк является довольно распространенным элементом на Земле, но он содержится в малых концентрациях. По некоторым оценкам мышьяк занимает 53 позицию по распространенности в земной коре. Его процентная составляющая в земной коре составляет 10 частей на миллион. Он является таким же распространенным элементом как уран и германий. Мышьяк может содержатся как в свободном виде так и в составе минералов. Этот элемент в свободном виде так же причислен Международной Минералогической Ассоциацией к отдельному минералу.
На сегодняшний день известно более 550 минералов содершащих части мышьяка. Самыми коммерчески важными из них являются дуранусит, скуттерудит и арсенолит. Эти минералы являются достаточно редкими, но процентное содержание мышьяка в них составляет для дуранусита 96% и по 76% для скуттерудита и арсенолита. Есть более распространенные минералы, но они содержат значительно меньшие концентрации мышьяка. К таким минералам относятся арсенопирит, реальгар, аурипигмент и др. Содержание мышьяка в этих минералах варьируется в пределах 35% — 45%.
Так же мышьяк содержится в воздухе в виде частиц оксида мышьяка(III). Это объясняется тем, что извержения вулканов выбрасывают в атмосферу вулканическую пыль и некоторые бактерии производят их как продукт жизнедеятельности. Ежегодно в атмосферу поступает около 3000 тонн частиц мышьяка из-за извержений вулканов и 20 000 тонн производимых бактериями. Концентрация мышьяка в атмосферном воздухе составляет от 0,5 до 15 нанограмм на кубический метр в зависимости от места измерения.
Что же касается водной среды, то мышьяк является плохо растворимым в воде элементом. Поэтому его содержание в мировом океане оценивается чрезвычайно малым. По оценкам ученых содержание мышьяка в воде составляет 1.6 миллиардных частей массовой доли на кубический метр.
Применение Мышьяка

Применение мышьяка является не очень широким но достаточно распространенным. Основные направления в которых применяется мышьяк является медицина, литейная промышленность и производство электроники. В других направлениях этот элемент так же находит применение, но его участие является незначительным.
Применение мышьяка в медицине было известно еще в древние времена. Гиппократ и Плиний использовали этот элемент как жаропонижающее и тонизирующее средство. Так же мышьяк использовался для лечения мигрени, ревматизма, малярии, туберкулеза и диабета. В XVIII веке раствор Фаулера, который является смесью арсенита калия и лавандовой воды, применялся для снижения жара и лечения псориаза, а так же в качестве афродизиаков. В Германии арсенит калия использовался для лечения псориаза вплоть до 1960-х годов. Так же мышьяк и его соединения широко применяются в стоматологии и по сей день. Хотя из-за его токсичности и канцерогенного воздействия многие развитые страны стараются отказаться от мышьяка. Полностью отказаться от него пока не представляется возможным, так как соединения этого элемента являются единственным средством влияния на раковые заболевания. В пример можно поставить острый промиелоцитарный лейкоз, который с 2002 года лечится мышьяксодержащим продуктом под названием Trisenox.
Еще одной значимой областью применения мышьяка является литейная промышленность. В качестве примеси он используется для изготовления сплавов на основе свинца, которые увеличивают его прочность. В пример можно поставить пластины для автомобильных аккумуляторов, которые не смогли бы быть применены без примеси мышьяка. Так же эта примесь используется в металлургии при обработке меди. Его применение значительно облегчает его обработку.
Что же касается электроники, то тут основное применение мышьяка заключается в качестве полупроводника. В пример можно привести интегральные схемы, светодиоды и лазерные диоды. Особенностью является то, что в этой области применения чистота мышьяка должна составлять 99,999%.
Интересные факты

Интересных фактов связанных с мышьяком достаточно много. Стоит начать с того, что мышьяк является токсичным веществом и представляет серьезную опасность для здоровья человека. В истории его часто использовали для отравления высокопоставленных и влиятельных фигур того времени. Из-за того, что отравление мышьяком не удавалось распознать до 1836 года(открытие пробы Марша). В пример можно привести такую фигуру как Наполеон. Эксперты некоторое время предполагали, что военноначальник был отравлен именно мышьяком из-за высокой концентрации его в волосах.
Другой значимой фигурой является Григорий Распутин. Его пытались отравить мышьяком, но попытка оказалась провальной. Распутин знал о том, что его собираются отравить и начал принимать этот элемент в малых дозах и добился таким образом невоспреимчивости к этому яду. Из-за этого события Григорий Распутин заслужил себе славу ведьмака и оккультиста. Из-за огромного количества отравлений в высокопоставленных кругах, мвшьяк прозвали «ядом королей» или «королевским ядом».
Еще одним интересным моментом является то, что в 1858 году в английском городе Брэдфорд произошло массовое отравление мышьяком. Отравляющий элемент был добавлен в сладости, которые продавались в обычной уличной лавке. В результате такого отравления погиб 21 человек, а отравившихся было более 200.
| Мышьяк | |||
|---|---|---|---|
| ← Германий | Селен → | |||
|
|||
| Внешний вид простого вещества | |||

Элементарный мышьяк |
|||
| Свойства атома | |||
| Название, символ, номер | Мышьяк / Arsenicum (As), 33 | ||
| Группа, период, блок |
15 (устар. 5), 4, p-элемент |
||
| Атомная масса (молярная масса) |
74,92160(2)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 3d10 4s24p3 1s22s22p63s23p63d104s24p3 |
||
| Радиус атома | 139 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 120 пм | ||
| Радиус иона | +5e: 46, −3e: 222 пм | ||
| Электроотрицательность | 2,18[2] (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | -3, +3, +5 | ||
| Энергия ионизации (первый электрон) |
946,2 (9,81) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 5,73 (серый мышьяк) г/см³ | ||
| Температура кипения | сублим. 886 K | ||
| Тройная точка | 1090 К (817°C), 3700 кПа | ||
| Уд. теплота плавления | (серый) 24,44 кДж/моль | ||
| Уд. теплота испарения | 32,4 кДж/моль | ||
| Молярная теплоёмкость | 25,05[3] Дж/(K·моль) | ||
| Молярный объём | 13,1 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Тригональная | ||
| Параметры решётки | a=0,4123 нм, α=54,17° | ||
| Температура Дебая | 285 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 50,2 Вт/(м·К) | ||
| Номер CAS | 7440-38-2 |
Мышья́к (химический символ — As, от лат. Arsenicum) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы, VA), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 33.
Простое вещество мышья́к — это хрупкий полуметалл стального цвета с зеленоватым оттенком (в серой аллотропной модификации). Ядовит и является канцерогеном.
История[править | править код]
Мышьяк является одним из древнейших элементов, используемых человеком. Сульфиды мышьяка As2S3 и As4S4, так называемые аурипигмент («арсеник») и реальгар, были знакомы римлянам и грекам. Эти вещества ядовиты.
Мышьяк является одним из элементов, встречающихся в природе в свободном виде. Его можно сравнительно легко выделить из соединений. Поэтому история не знает, кто впервые получил в свободном состоянии элементарный мышьяк. Многие приписывают роль первооткрывателя алхимику Альберту Великому. В трудах Парацельса также описано получение мышьяка в результате реакции арсеника с яичной скорлупой. Многие историки науки предполагают, что металлический мышьяк был получен значительно раньше, но он считался разновидностью самородной ртути. Это можно объяснить тем, что сульфид мышьяка был очень похож на ртутный минерал. Выделение из него было очень легким, как и при выделении ртути. Элементарный мышьяк был известен в Европе и в Азии ещё со средних веков. Китайцы получали его из руд. В отличие от европейцев, они могли диагностировать смерть от отравления мышьяком. Но этот метод анализа не дошёл до настоящих времён. Европейцы научились определять наступление смерти при отравлении мышьяком гораздо позже, это впервые сделал Джеймс Марш. Данная реакция используется и в настоящее время.
Мышьяк иногда встречается в оловянных рудах. В китайской литературе средних веков описаны случаи смерти людей, которые выпивали воду или вино из оловянных сосудов, из-за наличия в них мышьяка. Сравнительно долго люди путали сам мышьяк и его оксид, принимая их за одно вещество. Это недоразумение было устранено Георгом Брандтом и Антуаном Лораном Лавуазье, которые и доказали, что это разные вещества, и что мышьяк — самостоятельный химический элемент. Оксид мышьяка долгое время использовался для уничтожения грызунов. Отсюда и происхождение русского названия элемента. Оно происходит от слов «мышь» и «яд».[источник не указан 1906 дней]
Этимология[править | править код]
Название мышьяка в русском языке происходит от слова «мышь», в связи с употреблением его соединений для истребления мышей и крыс[4]. Греческое название ἀρσενικόν происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Народная этимология возводит к др.-греч. ἀρσενικός — мужской[5].
Латинское название arsenicum является прямым заимствованием греческого ἀρσενικόν. В 1789 году А. Лавуазье включил мышьяк в список химических элементов под названием arsenic[6].
Нахождение в природе[править | править код]
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7⋅10−4 % по массе. В морской воде 0,003 мг/л[7]. Этот элемент иногда встречается в природе в самородном виде, минерал имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из мелких зёрнышек.
Известно около 200 мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам. Довольно распространены два природных минерала мышьяка в виде сульфидов (бинарных соединений с серой): оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3. Минерал, имеющий промышленное значение для получения мышьяка — арсенопирит (мышьяковый колчедан) FeAsS или FeS2·FeAs2 (46 % As), также перерабатывают мышьяковистый колчедан — лёллингит (FeAs2) (72,8 % As), скородит FeAsO4 (27—36 % As). Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
Месторождения[править | править код]
|
|
Этот раздел статьи ещё не написан. Здесь может располагаться отдельный раздел. Помогите Википедии, написав его. (4 апреля 2023) |
Изотопы[править | править код]
Известны 33 изотопа и, по крайней мере, 10 возбуждённых состояний ядерных изомеров. Из этих изотопов стабилен только 75As, и природный мышьяк состоит только из этого изотопа. Наиболее долгоживущий радиоактивный изотоп 73As имеет период полураспада 80,3 дня.
Химические свойства[править | править код]
При сильном нагреве мышьяк сгорает, образуя оксид мышьяка (III), который плохо растворяется в воде, но реагирует с ней, образуя гидроксид мышьяка (III) или мышьяковистую кислоту. Сильные окислители, такие, как хлор, переводят элемент в мышьяковую кислоту, соли которой очень похожи на соответствующие фосфаты. Прокаливая эту кислоту, можно получить оксид мышьяка (V). При восстановлении соединений мышьяка образуется газ арсин[8].
Получение[править | править код]
Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами.
Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твёрдый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк окисляется в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2О3.
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углём (углеродом)[9]:
Применение[править | править код]
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают[уточнить].
Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
В пиротехнике реальгар употребляется для получения «греческого» огня или «индийского» (бенгальского) огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными фармацевтическими препаратами, не содержащими мышьяк.
Некоторые соединения мышьяка в очень малых дозах применялись в качестве препаратов для борьбы с малокровием и рядом других заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд систем организма, в частности, на красный костный мозг и ЦНС. Ввиду появления сравнимых и превосходящих по эффекту препаратов, растворимые соединения мышьяка практически вышли из медицинской практики с середины-конца 80-х годов ХХ века. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва (см. пульпит). В настоящее время (2015 г.) препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Биологическая роль и физиологическое действие[править | править код]
Токсичность[править | править код]

Токсикология[править | править код]
Мышьяк и многие его соединения ядовиты и канцерогенны[10]. Неорганические соединения мышьяка относятся к 1 категории канцерогенов по МАИР, арсенобетаин и другие органические соединения, не метаболизируемые в организме человека — к 3 группе.[11] Смертельная доза мышьяка для человека составляет 50-170 мг (1,4 мг/кг массы тела)[источник не указан 1870 дней]. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло маскировать использование соединений мышьяка (чаще всего, триоксида мышьяка, т. н. «белого мышьяка») в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую эффективность получил обиходное название «наследственный порошок» (фр. poudre de succession). Существует предположение, что соединениями мышьяка был отравлен Наполеон на острове Святой Елены. В 1832 году появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность диагностирования отравлений.
Помощь и противоядия при отравлении мышьяком: приём водных растворов тиосульфата натрия Na2S2O3, промывание желудка, приём молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка составляет 0,5 мг/м³.
Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались как отравляющие вещества в Первую мировую войну.
В 2016 году широкую огласку получила техногенная экологическая катастрофа на юге Индии — из-за чрезмерного отбора воды из водоносных горизонтов мышьяк стал поступать в питьевую воду. Это вызвало токсическое и онкологическое поражение у десятков тысяч людей.
Считалось, что при длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет. Этот факт установлен как для людей, так и для животных. Известны случаи, когда привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие смертельную, и оставались здоровыми. Опыты на животных показали своеобразие этой привычки. Оказалось, что животное, привыкшее к мышьяку при его употреблении, быстро погибает, если значительно меньшая доза вводится в кровь или под кожу. Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н. «острой токсичности», и не защищает от новообразований. Тем не менее, в настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в качестве противоракового средства.
Как органические, так и неорганические соединения мышьяка токсичны для живых организмов в высоких концентрациях. Тем не менее, в малых дозах некоторые соединения мышьяка способствуют обмену веществ, укреплению костей, оказывают положительное влияние на кроветворную функцию и иммунную систему, увеличивают усвоение азота и фосфора из пищи. С растениями, наиболее заметный эффект мышьяка — замедление обмена веществ, что снижает урожайность, но мышьяк также стимулирует фиксацию азота.[12][13]
Отмечалось, что для растущего организма у человека и животных микродозы мышьяка способствуют росту костей в длину и толщину, а в отдельных случаях рост костей под воздействием микродоз мышьяка отмечался и в период окончания роста[14].
Некоторые авторы рассматривают мышьяк, как жизненно важный микроэлемент и причисляют его к ультрамикроэлементам — микроэлементам, необходимым в особо малых концентрациях (подобно селену, ванадию, хрому и никелю). Необходимая суточная доза для человека составляет 10-15 мкг.[12]
В традиционной медицине[править | править код]
В западных странах мышьяк был известен преимущественно как сильный яд, в то же время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза[источник не указан 2046 дней].
Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк», например, «Таблетки Бло с мышьяком», и др.) продолжалось до середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических заболеваний[источник не указан 1373 дня].
Соединение мышьяка сальварсан (также известен как «препарат 606» и арсфенамин) — исторически первое эффективное и в то же время относительно безвредное этиотропное лекарство от сифилиса, созданное химиком Паулем Эрлихом[15]. К настоящему времени сальварсан вышел из употребления и заменён другими, гораздо более эффективными и безопасными средствами.
В судебной медицине[править | править код]
Метод обнаружения мышьяка в теле человека, трупах и продуктах питания при подозрениях на отравления был разработан в начале XIX в. английским химиком Джеймсом Маршем[16].
Жизнь на основе мышьяка[править | править код]
Известны экстремофильные бактерии, которые способны выживать при высоких концентрациях арсената в окружающей среде. Было высказано предположение, что в случае штамма GFAJ-1 мышьяк замещает фосфор в биохимических реакциях, в частности, входит в состав ДНК[17][18][19], однако это предположение не подтвердилось[20].
Загрязнения мышьяком[править | править код]
На территории Российской Федерации в городе Скопине Рязанской области вследствие многолетней работы местного металлургического комбината СМК «Металлург» в могильниках предприятия было захоронено около полутора тысяч тонн пылеобразных отходов с высоким содержанием мышьяка[21]. Мышьяк является характерным сопутствующим элементом многих месторождений золота, что приводит к дополнительным экологическим проблемам в золотодобывающих странах, таких как, например, Румыния[22][23].
См. также[править | править код]
- Микроэлементы
- Арсин
- Сильнодействующие ядовитые вещества
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ Arsenic: electronegativities (англ.). WebElements. Дата обращения: 5 августа 2010. Архивировано 1 сентября 2010 года.
- ↑ Редкол.: Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 157. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- ↑ Мышьяк // Большой Энциклопедический словарь. — 2000.
- ↑ Frisk H. Griechisches etymologisches Wörterbuch, Band I. — Heidelberg: Carl Winter’s Universitätsbuchhandlung. — 1960. — С. 152.
- ↑ Lavoisier, Antoine. Traité Élémentaire de Chimie, présenté dans un ordre nouveau, et d’après des découvertes modernes (фр.). — Paris: Cuchet, Libraire, 1789. — С. 192.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965.
- ↑ Общая химия: учебное пособие/Н. Л. Глинка. — Изд. стер. — М.: КНОРУС, 2012. — 752 с. — ISBN 978-5-406-02149-1
- ↑ Неорганическая химия: В 3т. /под ред. Ю. Д. Третьякова. Т. 2 : Химия непереходных элементов : учебник для студ. учреждений высш проф. образования/ А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов — 2-е изд.,перераб. — М. : Издательский центр «Академия», 2011. — 368 с.
- ↑ Книжников В. А.; Бочкарев В. В. (рад ), Зимина Л. Н. (пат. ан.), Марченко E. Н. (гиг.), Рубцов А. Ф. (суд.), Серебряков Л. А. (фарм.). Мышьяк // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1981. — Т. 16 : Музеи — Нил. — С. 90—94. — 512 с. : ил.
- ↑ Agents Classified by the IARC Monographs. Дата обращения: 9 марта 2019. Архивировано 25 февраля 2019 года.
- ↑ 1 2 Копылов, Каминский, 2004, с. 289—291.
- ↑ Чертко, 2012, с. 123.
- ↑ Фармакология проф. Николаева. 1943 г. 1-е издание
- ↑ Поль де Крайф (де Крюи). Охотники за микробами. Издательство: Астрель, Полиграфиздат, 2012. ISBN 978-5-271-35518-9, ISBN 978-5-4215-3274-3
- ↑ Макдермид, 2016, с. 8.
- ↑ Wolfe-Simon F., Blum J.S., Kulp T.R., et al. A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus (англ.) // Science : journal. — 2010. — December. — doi:10.1126/science.1197258. — PMID 21127214.
- ↑ Arsenic-eating microbe may redefine chemistry of life (англ.). naturenews. Дата обращения: 26 января 2011. Архивировано 12 февраля 2012 года.
- ↑ Астробиологическое открытие ведёт насыщенную ядом жизнь. membrana. Дата обращения: 26 января 2011. Архивировано из оригинала 28 января 2012 года.
- ↑
Reaves, Marshall Louis; Sunita Sinha, Joshua D. Rabinowitz, Leonid Kruglyak, Rosemary J. Redfield. Absence of Detectable Arsenate in DNA from Arsenate-Grown GFAJ-1 Cells (англ.) // Science : journal. — 2012. — 27 July (vol. 337, no. 6093). — P. 470—473. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.1219861. - ↑ Детоксикация загрязненных мышьяком почв природными сорбентами, их смесями и модификациями. Дата обращения: 3 февраля 2016. Архивировано 26 февраля 2018 года.
- ↑ Н. В.ПЕТРОВСКАЯ «САМОРОДНОЕ ЗОЛОТО. ОБЩАЯ ХАРАКТЕРИСТИКА, ТИПОМОРФИЗМ , ВОПРОСЫ ГЕНЕЗИСА, ИЗДАТЕЛЬСТВО» НЩКЛ, МОСКВА, 1973
- ↑ Добыча золота как яд для окружающей среды — ВОЙНА и МИР. Дата обращения: 3 февраля 2016. Архивировано 3 февраля 2016 года.
Литература[править | править код]
- Н. И. Копылов, Ю. Д. Каминский. Мышьяк. — Новосибирск, 2004.
- Мышьяк : [арх. 9 декабря 2022] // Монголы — Наноматериалы. — М. : Большая российская энциклопедия, 2013. — С. 562-563. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 21). — ISBN 978-5-85270-355-2.
- Леенсон Илья. Мышьяк. Энциклопедия «Кругосвет».
- Леенсон Илья. Мышьяк и здоровье человека. Энциклопедия «Кругосвет».
- Мышьяк // Популярная библиотека химических элементов / Сост. В. В. Станцо, М. Б. Черненко. — М.: Наука, 1983. — Кн. 1. Водород – палладий. — 575 с.
- Гамаюрова Валентина Семеновна. Мышьяк в экологии и биологии. — М.: Наука, 1993. — 207 с. — ISBN 5-02-001946-1.
- Вэл Макдермид. Анатомия преступления: Что могут рассказать насекомые, отпечатки пальцев и ДНК = Val Mcdermid: “Forensics: The Anatomy of Crime”. — М.: Альпина Нон-фикшн, 2016. — 344 p. — ISBN 978-5-91671-591-0.
- Николай Чертко, Эдуард Чертко, Дмитрий Будько, Анна Таранчук. Гл. 5 Химические элементы p-блока // Биологическая функция химических элементов. — Минск, 2012.
- Стрельникова Е. Мышь, мышьяк и Калле-сыщик // Химия и жизнь : журнал. — 2011. — № 2.
Ссылки[править | править код]
- Мышьяк (рус.). Архивировано из оригинала 21 января 2012 года. на all-minerals
- Мышьяк на Webelements (англ.)
- Геохимия мышьяка. Архивировано из оригинала 14 декабря 2007 года.[]
МЫШЬЯК – химический элемент V группы периодической таблицы, относится к семейству азота. Относительная атомная масса 74,9216. В природе мышьяк представлен только одним стабильным нуклидом 75As. Искусственно получены также более десяти его радиоактивных изотопов с периодом полураспада от нескольких минут до нескольких месяцев. Типичные степени окисления в соединениях –3, +3, +5. Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс; латинское название Arsenicum происходит от греческого «арсен» – сильный, мощный.
Исторические сведения.
Мышьяк относится к пяти «алхимическим» элементам, открытым в средние века (удивительно, но четыре из них – As, Sb, Bi и P находятся в одной группе периодической таблицы – пятой). В то же время соединения мышьяка были известны с древних времен, их применяли для производства красок и лекарств. Особенно интересно использование мышьяка в металлургии.
Несколько тысячелетий назад каменный век сменился бронзовым. Бронза – это сплав меди с оловом. Как полагают историки, первую бронзу отлили в долине Тигра и Евфрата, где-то между 30 и 25 вв. до н.э. В некоторых регионах выплавлялась бронза с особо ценными свойствами – она лучше отливалась и легче ковалась. Как выяснили современные ученые, это был сплав меди, содержащий от 1 до 7% мышьяка и не более 3% олова. Вероятно, поначалу при его выплавке спутали богатую медную руду малахит с продуктами выветривания некоторых тоже зеленых сульфидных медно-мышьяковых минералов. Оценив замечательные свойства сплава, древние умельцы затем уже специально искали мышьяковые минералы. Для поисков использовали свойство таких минералов давать при нагревании специфический чесночный запах. Однако со временем выплавка мышьяковой бронзы прекратилась. Скорее всего это произошло из-за частых отравлений при обжиге мышьяксодержащих минералов.
Конечно, мышьяк был известен в далеком прошлом лишь в виде его минералов. Так, в Древнем Китаем твердый минерал реальгар (сульфид состава As4S4, реальгар по-арабски означает «рудниковая пыль») использовали для резьбы по камню, однако при нагревании или на свету он «портился», так как превращался в As2S3. В 4 в. до н.э. Аристотель описал этот минерал под названием «сандарак». В I в. н.э. римский писатель и ученый Плиний Старший, и римский врач и ботаник Диоскорид описали минерал аурипигмент (сульфид мышьяка As2S3). В переводе с латыни название минерала означает «золотая краска»: он использовался как желтый краситель. В 11 в. алхимики различали три «разновидности» мышьяка: так называемый белый мышьяк (оксид As2O3), желтый мышьяк (сульфид As2S3) и красный мышьяк (сульфид As4S4). Белый мышьяк получался при возгонке примесей мышьяка при обжиге медных руд, содержащих этот элемент. Конденсируясь из газовой фазы, оксид мышьяка оседал в виде белого налета. Белый мышьяк использовали с древних времен для уничтожения вредителей, а также…
В 13 в. Альберт фон Больштедт (Альберт Великий) получил металлоподобное вещество, нагревая желтый мышьяк с мылом; возможно, это был первый образец мышьяка в виде простого вещества, полученный искусственно. Но это вещество нарушало мистическую «связь» семи известных металлов с семью планетами; вероятно, поэтому алхимики считали мышьяк «незаконнорожденным металлом». В то же время они обнаружили его свойство придавать меди белый цвет, что дало повод называть его «средством, отбеливающим Венеру (то есть медь)».
Мышьяк был однозначно идентифицирован как индивидуальное вещество в середине 17 в., когда немецкий аптекарь Иоганн Шрёдер получил его в сравнительно чистом виде восстановлением оксида древесным углем. Позднее французский химик и врач Никола Лемери получил мышьяк, нагревая смесь его оксида с мылом и поташом. В 18 в. мышьяк уже был хорошо известен как необычный «полуметалл». В 1775 шведский химик К.В.Шееле получил мышьяковую кислоту и газообразный мышьяковистый водород, а в 1789 А.Л.Лавуазье, наконец, признал мышьяк самостоятельным химическим элементом. В 19 в. были открыты органические соединения, содержащие мышьяк.
Мышьяк в природе.
В земной коре мышьяка немного – около 5·10–4% (то есть 5 г на тонну), примерно столько же, сколько германия, олова, молибдена, вольфрама или брома. Часто мышьяк в минералах встречается совместно с железом, медью, кобальтом, никелем.
Состав минералов, образуемых мышьяком (а их известно около 200), отражает «полуметаллические» свойства этого элемента, который может находиться как в положительной, так и в отрицательной степени окисления и соединяться со многими элементами; в первом случае мышьяк может играть роль металла (например, в сульфидах), во втором – неметалла (например, в арсенидах). Сложный состав ряда минералов мышьяка отражает его способность, с одной стороны, частично заменять в кристаллической решетке атомы серы и сурьмы (ионные радиусы S–2, Sb–3 и As–3 близки и составляют соответственно 0,182, 0,208 и 0,191 нм), с другой – атомы металлов. В первом случае атомы мышьяка имеют скорее отрицательную степень окисления, во втором – положительную.
Электроотрицательность мышьяка (2,0) мала, но выше, чем у сурьмы (1,9) и у большинства металлов, поэтому степень окисления –3 наблюдается для мышьяка лишь в арсенидах металлов, а также в стибарсене SbAs и сростках этого минерала с кристаллами чистых сурьмы или мышьяка (минерал аллемонтит). Многие соединения мышьяка с металлами, судя по их составу, относятся скорее к интерметаллическим соединениям, а не к арсенидам; некоторые из них отличаются переменным содержанием мышьяка. В арсенидах может присутствовать одновременно несколько металлов, атомы которых при близком радиусе ионов замещают друг друга в кристаллической решетке в произвольных соотношениях; в таких случаях в формуле минерала символы элементов перечисляются через запятую. Все арсениды имеют металлический блеск, это непрозрачные, тяжелые минералы, твердость их невелика.
Примером природных арсенидов (их известно около 25) могут служить минералы лёллингит FeAs2 (аналог пирита FeS2), скуттерудит CoAs2–3 и никельскуттерудит NiAs2–3, никелин (красный никелевый колчедан) NiAs, раммельсбергит (белый никелевый колчедан) NiAs2, саффлорит (шпейсовый кобальт) CoAs2 и клиносаффлорит (Co,Fe,Ni)As2, лангисит (Co,Ni)As, сперрилит PtAs2, маухерит Ni11As8, орегонит Ni2FeAs2, альгодонит Cu6As. Из-за высокой плотности (более 7 г/см3) многие из них геологи относят к группе «сверхтяжелых» минералов.
Наиболее распространенный минерал мышьяка – арсенопирит (мышьяковый колчедан) FeAsS можно рассматривать как продукт замещения серы в пирите FeS2 атомами мышьяка (в обычном пирите тоже всегда есть немного мышьяка). Такие соединения называют сульфосолями. Аналогично образовались минералы кобальтин (кобальтовый блеск) CoAsS, глаукодот (Co,Fe)AsS, герсдорфит (никелевый блеск) NiAsS, энаргит и люцонит одинакового состава, но разного строения Cu3AsS4, прустит Ag3AsS3 – важная серебряная руда, которую иногда называют «рубиновым серебром» из-за ярко-красного цвета, она часто встречается в верхних слоях серебряных жил, где найдены великолепные большие кристаллы этого минерала. Сульфосоли могут содержать и благородные металлы платиновой группы; это минералы осарсит (Os,Ru)AsS, руарсит RuAsS, ирарсит (Ir,Ru,Rh,Pt)AsS, платарсит (Pt,Rh,Ru)AsS, холлингуортит (Rd,Pt,Pd)AsS. Иногда роль атомов серы в таких двойных арсенидах играют атомы сурьмы, например, в сейняйоките (Fe,Ni)(Sb,As)2, арсенопалладините Pd8(As,Sb)3, арсенполибазите (Ag,Cu)16(Ar,Sb)2S11.
Интересно строение минералов, в которых мышьяк присутствует одновременно с серой, но играет скорее роль металла, группируясь вместе с другими металлами. Таковы минералы арсеносульванит Cu3(As,V)S4, арсеногаухекорнит Ni9BiAsS8, фрейбергит (Ag,Cu,Fe)12(Sb,As)4S13, теннантит (Cu,Fe)12As4S13, аргентотеннантит (Ag,Cu)10(Zn,Fe)2(As,Sb)4S13, голдфилдит Cu12(Te,Sb,As)4S13, жиродит (Cu,Zn,Ag)12(As,Sb)4(Se,S)13. Можно представить себе, какое сложное строение имеет кристаллическая решетка всех этих минералов.
Однозначно положительную степень окисления мышьяк имеет в природных сульфидах – желтом аурипигменте As2S3, оранжево-желтом диморфите As4S3, оранжево-красном реальгаре As4S4, карминово-красном гетчеллите AsSbS3, а также в бесцветном оксиде As2O3, который встречается в виде минералов арсенолита и клаудетита с разной кристаллической структурой (они образуются в результате выветривания других мышьяковых минералов). Обычно эти минералы встречаются в виде небольших вкраплений. Но в 30-е годы 20 в. в южной части Верхоянского хребта были найдены огромные кристаллы аурипигмента размером до 60 см и массой до 30 кг.
В природных солях мышьяковой кислоты H3AsO4 – арсенатах (их известно около 90) степень окисления мышьяка – +5; примером могут служить ярко-розовый эритрин (кобальтовый цвет) Co3(AsO4)2·8H2O, зеленые аннабергит Ni3(AsO4)2·8H2O, скородит FeIIIAsO4·2H2O и симплезит FeII3(AsO4)2·8H2O, буро-красный гаспарит (Ce,La,Nd)ArO4, бесцветные гёрнесит Mg3(AsO4)2·8H2O, рузвельтит BiAsO4 и кёттигит Zn3(AsO4)2·8H2O, а также множество основных солей, например, оливенит Cu2AsO4(OH), арсенобисмит Bi2(AsO4)(OH)3. А вот природные арсениты – производные мышьяковистой кислоты H3AsO3 очень редки.
В центральной Швеции есть знаменитые лангбановские железо-марганцевые карьеры, в которых нашли и описали более 50 образцов минералов, представляющих собой арсенаты. Некоторые из них нигде больше не встречаются. Они образовались когда-то в результате реакции мышьяковой кислоты H3AsO4 с пирокроитом Mn(OH)2 при не очень высоких температурах. Обычно же арсенаты – продукты окисления сульфидных руд. Они, как правило, не имеют промышленного применения, но некоторые из них очень красивые и украшают минералогические коллекции.
В названиях многочисленных минералов мышьяка можно встретить топонимы (Лёллинг в Австрии, Фрайберг в Саксонии, Сейняйоки в Финляндии, Скуттеруд в Норвегии, Аллемон во Франции, канадский рудник Лангис и рудник Гетчелл в Неваде, штат Орегон в США и др.), имена геологов, химиков, политических деятелей и т.п. (немецкий химик Карл Раммельсберг, мюнхенский торговец минералами Вильям Маухер, владелец шахты Иоганн фон Герсдорф, французский химик Ф.Клоде, английские химики Джон Пруст и Смитсон Теннант, канадский химик Ф.Л.Сперри, президент США Рузвельт и др.), названия растений (так, название минерала саффлорита произошело от шафрана), начальные буквы названий элементов – мышьяка, осмия, рутения, иридия, палладия, платины, греческие корни («эритрос» – красный, «энаргон» – видимый, «литос» – камень) и т.д. и т.п.
Интересно старинное название минерала никелина (NiAs) – купферникель. Средневековые немецкие горняки называли Никелем злого горного духа, а «купферникелем» (Kupfernickel, от нем. Kupfer – медь) – «чертову медь», «фальшивую медь». Медно-красные кристаллы этой руды внешне очень походили на медную руду; ее применяли в стекловарении для окрашивания стекол в зеленый цвет. А вот медь из нее никому получить не удавалось. Эту руду в 1751 исследовал шведский минералог Аксель Кронштедт и выделил из нее новый металл, назвав его никелем.
Поскольку мышьяк химически достаточно инертен, он встречается и в самородном состоянии – в виде сросшихся иголочек или кубиков. Такой мышьяк обычно содержит от 2 до 16% примесей – чаще всего это Sb, Bi, Ag, Fe, Ni, Co. Его легко растереть в порошок. В России самородный мышьяк геологи находили в Забайкалье, в Амурской области, встречается он и в других странах.
Уникален мышьяк тем, что он встречается повсюду – в минералах, горных породах, почве, воде, растениях и животных, недаром его называют «вездесущным». Распределение мышьяка по разным регионам земного шара во многом определялось в процессах формирования литосферы летучестью его соединений при высокой температуре, а также процессами сорбции и десорбции в почвах и осадочных породах. Мышьяк легко мигрирует, чему способствует достаточно высокая растворимость некоторых его соединений в воде. Во влажном климате мышьяк вымывается из почвы и уносится грунтовыми водами, а затем – реками. Среднее содержание мышьяка в реках – 3 мкг/л, в поверхностных водах – около 10 мкг/л, в воде морей и океанов – всего около 1 мкг/л. Это объясняется сравнительно быстрым осаждением его соединений из воды с накоплением в донных отложениях, например, в железомарганцевых конкрециях.
В почвах содержание мышьяка составляет обычно от 0,1 до 40 мг/кг. Но в области залегания мышьяковых руд, а также в вулканических районах в почве может содержаться очень много мышьяка – до 8 г/кг, как в некоторых районах Швейцарии и Новой Зеландии. В таких местах гибнет растительность, а животные болеют. Это характерно для степей и пустынь, где мышьяк не вымывается из почвы. Обогащены по сравнению со средним содержанием и глинистые породы – в них содержится вчетверо больше мышьяка, чем в среднем. В нашей стране предельно допустимой концентрацией мышьяка в почве считается 2 мг/кг.
Мышьяк может выноситься из почвы не только водой, но и ветром. Но для этого он должен сначала превратиться в летучие мышьякорганические соединения. Такое превращение происходит в результате так называемого биометилирования – присоединения метильной группы с образованием связи C–As; этот ферментативный процесс (он хорошо известен для соединений ртути) происходит при участии кофермента метилкобаламина – метилированного производного витамина В12 (он есть и в организме человека). Биометилирование мышьяка происходит как в пресной, так и в морской воде и приводит к образованию мышьякорганических соединений – метиларсоновой кислоты CH3AsO(OH)2, диметиларсиновой (диметилмышьяковой, или какодиловой) кислоты (CH3)2As(O)OH, триметиларсина (CH3)3As и его оксида (CH3)3As = O, которые также встречаются в природе. С помощью 14С-меченого метилкобаламина и 74As-меченого гидроарсената натрия Na2HAsO4 было показано, что один из штаммов метанобактерий восстанавливает и метилирует эту соль до летучего диметиларсина. В результате в воздухе сельских районов содержится в среднем 0,001 – 0,01 мкг/м3 мышьяка, в городах, где нет специфических загрязнений – до 0,03 мкг/м3, а вблизи источников загрязнения (заводы по выплавке цветных металлов, электростанции, работающие на угле с высоким содержание мышьяка, и др.) концентрация мышьяка в воздухе может превысить 1 мкг/м3. Интенсивность выпадения мышьяка в районах расположения промышленных центров составляет 40 кг/км2 в год.
Образование летучих соединений мышьяка (триметиларсин, например, кипит всего при 51°С) вызывало в 19 в. многочисленные отравления, поскольку мышьяк содержался в штукатурке и даже в зеленой краске для обоев. В виде краски раньше использовали зелень Шееле Cu3(AsO3)2 · nH2O и парижскую, или швейфуртскую зелень Cu4(AsO2)6(CH3COO)2. В условиях высокой влажности и появления плесени из такой краски образуются летучие мышьякорганические производные. Предполагают, что этот процесс мог быть причиной медленного отравления Наполеона в последние годы его жизни (как известно, мышьяк был найден в волосах Наполеона спустя полтора столетия после его смерти).
Мышьяк в заметных количествах содержится в некоторых минеральных водах. Российские нормативы устанавливают, что в лечебно-столовых минеральных водах мышьяка должно быть не более 700 мкг/л. В Джермуке его может быть в несколько раз больше. Выпитые один-два стакана «мышьяковой» минеральной воды человеку вреда не принесут: чтобы смертельно отравиться, надо выпить сразу литров триста… Но понятно, что такую воду нельзя пить постоянно вместо обычной воды.
Химики выяснили, что мышьяк в природных водах может находиться в разных формах, что существенно с точки зрения его анализа, способов миграции, а также разной токсичности этих соединений; так, соединения трехвалентного мышьяка в 25–60 раз токсичнее, чем пятивалентного. Соединения As(III) в воде присутствуют обычно в форме слабой мышьяковистой кислоты H3AsO3 (рКа = 9,22), а соединения As(V) – в виде значительно более сильной мышьяковой кислоты H3AsO4 (рКа = 2,20) и ее депротонированых анионов H2AsO4– и HAsO42–.
В живом веществе мышьяка в среднем содержится 6·10–6 %, то есть 6 мкг/кг. Некоторые морские водоросли способны концентрировать мышьяк в такой степени, что становятся опасными для людей. Более того, эти водоросли могут расти и размножаться в чистых растворах мышьяковистой кислоты. Такие водоросли используются в некоторых азиатских странах в качестве средства против крыс. Даже в чистых водах норвежских фьордов водоросли могут содержать мышьяк в количестве до 0,1 г/кг. У человека мышьяк содержится в мозговой ткани и в мышцах, накапливается он в волосах и ногтях.
Свойства мышьяка.
Хотя с виду мышьяк напоминает металл, он все же скорее является неметаллом: не образует солей, например, с серной кислотой, но сам является кислотообразующим элементом. Поэтому этот элемент часто называют полуметаллом. Мышьяк существует в нескольких аллотропных формах и в этом отношении весьма напоминает фосфор. Самая устойчивая из них – серый мышьяк, весьма хрупкое вещество, которое на свежем изломе имеет металлический блеск (отсюда название «металлический мышьяк»); его плотность 5,78 г/см3. При сильном нагревании (до 615° С) он возгоняется без плавления (такое же поведение характерно для иода). Под давлением 3,7 МПа (37 атм) мышьяк плавится при 817° С, что значительно выше температуры возгонки. Электропроводность серого мышьяка в 17 раз меньше, чем у меди, но в 3,6 раза выше, чем у ртути. С повышением температуры его электропроводность, как и у типичных металлов, снижается – примерно в такой же степени, как у меди.
Если пары мышьяка очень быстро охладить до температуры жидкого азота (–196° С), получается прозрачное мягкое вещество желтого цвета, напоминающее желтый фосфор, его плотность (2,03 г/см3) значительно ниже, чем у серого мышьяка. Пары мышьяка и желтый мышьяк состоят из молекул As4, имеющих форму тетраэдра – и здесь аналогия с фосфором. При 800° С начинается заметная диссоциация паров с образованием димеров As2, а при 1700° С остаются только молекулы As2. При нагревании и под действием ультрафиолета желтый мышьяк быстро переходит в серый с выделением тепла. При конденсации паров мышьяка в инертной атмосфере образуется еще одна аморфная форма этого элемента черного цвета. Если пары мышьяка осаждать на стекле, образуется зеркальная пленка.
Строение внешней электронной оболочки у мышьяка такое же, как у азота и фосфора, но в отличие от них, у него 18 электронов на предпоследней оболочке. Как и фосфор, он может образовать три ковалентные связи (конфигурация 4s24p3), и на атоме As остается неподеленная пара. Знак заряда на атоме As в соединениях с ковалентными связями зависит от электроотрицательности соседних атомов. Участие неподеленной пары в комплексообразовании для мышьяка значительно затруднено по сравнению с азотом и фосфором.
Если в атоме As задействованы d-орбитали, возможно распаривание 4s-электронов с образованием пяти ковалентных связей. Такая возможность практически осуществляется только в соединении с фтором – в пентафториде AsF5 (известен и пентахлорил AsCl5, но он исключительно нестоек и быстро разлагается даже при –50° С).
В сухом воздухе мышьяк устойчив, но во влажном тускнеет и покрывается черным оксидом. При возгонке пары мышьяка легко сгорают на воздухе голубым пламенем с образованием тяжелых белых паров мышьяковистого ангидрида As2O3. Этот оксид – один из наиболее распространенных мышьяксодержащих реагентов. Он обладает амфотерными свойствами:
As2O3 + 6HCl ® 2AsCl3 + 3H2O,
2O3 + 6NH4OH ® 2(NH4)3AsO3 + 3H2O.
При окислении As2O3 образуется кислотный оксид – мышьяковый ангидрид:
As2O3 + 2HNO3® As2O5 + H2O + NO2 + NO.
При его взаимодействии с содой получают гидроарсенат натрия, который находит применение в медицине:
As2O3 + 2Na2CO3 + H2O ® 2Na2HAsO4 + 2CO2.
Чистый мышьяк достаточно инертен; вода, щелочи и кислоты, не обладающие окислительными свойствами, на него не действуют. Разбавленная азотная кислота окисляет его до ортомышьяковистой кислоты H3AsO3, а концентрированная – до ортомышьяковой H3AsO4:
3As + 5HNO3 + 2H2O ® 3H3AsO4 + 5NO.
Аналогично реагирует и оксид мышьяка(III):
3As2O3 + 4HNO3 + 7H2O ® 6H3AsO4 + 4NO.
Мышьяковая кислота является кислотой средней силы, чуть слабее фосфорной. В отличие от нее, мышьяковистая кислота очень слабая, по своей силе соответствующая борной кислоте H3BO3. В ее растворах существует равновесие H3AsO3![]() HAsO2 + H2O. Мышьяковистая кислота и ее соли (арсениты) – сильные восстановители:
HAsO2 + H2O. Мышьяковистая кислота и ее соли (арсениты) – сильные восстановители:
HAsO2 + I2 + 2H2O ® H3AsO4 + 2HI.
Мышьяк реагирует с галогенами и серой. Хлорид AsCl3 – бесцветная маслянистая жидкость, дымящая на воздухе; водой гидролизуется: AsCl3 + 2H2O ® HAsO2 + 3HCl. Известны бромид AsBr3 и иодид AsI3, которые также разлагаются водой. В реакциях мышьяка с серой образуются сульфиды различного состава – вплоть до Ar2S5. Сульфиды мышьяка растворяются в щелочах, в растворе сульфида аммония и в концентрированной азотной кислоте, например:
As2S3 + 6KOH ® K3AsO3 + K3AsS3 + 3H2O,
2S3 + 3(NH4)2S ® 2(NH4)3AsS3,
2S5 + 3(NH4)2S ® 2(NH4)3AsS4,
As2S5 + 40HNO3 + 4H2O ® 6H2AsO4 + 15H2SO4 + 40NO.
В этих реакциях образуются тиоарсениты и тиоарсенаты – соли соответствующих тиокислот (аналогичных тиосерной кислоте).
В реакции мышьяка с активными металлами образуются солеобразные арсениды, которые гидролизуются водой Особенно быстро реакция идет в кислой среде с образованием арсина: Ca3As2 + 6HCl ® 3CaCl2 + 2AsH3. Арсениды малоактивных металлов – GaAs, InAs и др. имеют алмазоподобную атомную решетку. Арсин – бесцветный очень ядовитый газ без запаха, но примеси придают ему запах чеснока. Арсин медленно разлагается на элементы уже при комнатной температуре и быстро – при нагревании.
Мышьяк образует множество мышьякорганических соединений, например, тетраметилдиарсин (CH3)2As–As(CH3)2. Еще в 1760 директор Сервской фарфоровой фабрики Луи Клод Каде де Гассикур, перегоняя ацетат калия с оксидом мышьяка(III), неожиданно получил содержащую мышьяк дымящуюся жидкость с отвратительным запахом, которую назвали аларсином, или жидкостью Каде. Как выяснили впоследствии, в этой жидкости содержались впервые полученные органические производные мышьяка: так называемая окись какодила, которая образовалась в результате реакции
4CH3COOK + As2O3® (CH3)2As–O–As(CH3)2 + 2K2CO3 + 2CO2, и дикакодил (CH3)2As–As(CH3)2. Какодил (от греч. «какос» – дурной) был одним из первых радикалов, открытых в органических соединениях.
В 1854 парижский профессор химии Огюст Каур синтезировал триметиларсин действием метилиодида на арсенид натрия: 3CH3I + AsNa3® (CH3)3As + 3NaI.
В последующем для синтезов использовали трихлорид мышьяка, например,
(CH3)2Zn + 2AsCl3® 2(CH3)3As + 3ZnCl2.
В 1882 были получены ароматические арсины действием металлического натрия на смесь арилгалогенидов и трихлорида мышьяка: 3C6H5Cl + AsCl3 + 6Na ® (C6H5)3As + 6NaCl. Наиболее интенсивно химия органических производных мышьяка развивалась в 20-е годы 20 в., когда у некоторых из них были обнаружены противомикробное, а также раздражающее и кожно-нарывное действие. В настоящее время синтезированы десятки тысяч мышьякорганических соединений.
Получение мышьяка.
Мышьяк получают, в основном, как побочный продукт переработки медных, свинцовых, цинковых и кобальтовых руд, а также при добыче золота. Некоторые полиметаллические руды содержат до 12% мышьяка. При нагревании таких руд до 650–700° С в отсутствие воздуха мышьяк возгоняется, а при нагревании на воздухе образуется летучий оксид As2O3 – «белый мышьяк». Его конденсируют и нагревают с углем, при этом происходит восстановление мышьяка. Получение мышьяка – вредное производство. Раньше, когда слово «экология» было известно лишь узким специалистам, «белый мышьяк» выпускали в атмосферу, и он оседал на соседних полях и лесах. В отходящих газах мышьяковых заводов содержится от 20 до 250 мг/м3 As2O3, тогда как обычно в воздухе содержится примерно 0,00001мг/м3. Среднесуточной допустимой концентрацией мышьяка в воздухе считают всего 0,003 мг/м3. Парадоксально, но и сейчас намного сильнее загрязняют окружающую среду мышьяком не заводы по его производству, а предприятия цветной металлургии и электростанции, сжигающие каменный уголь. В донных осадках вблизи медеплавильных заводов содержится огромное количество мышьяка – до 10 г/кг. Мышьяк может попасть в почву и с фосфорными удобрениями.
И еще один парадокс: получают мышьяка больше, чем его требуется; это довольно редкий случай. В Швеции «ненужный» мышьяк вынуждены были даже захоранивать в железобетонных контейнерах в глубоких заброшенных шахтах.
Главный промышленный минерал мышьяка – арсенопирит FeAsS. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые – в Канаде, мышьяково-оловянные – в Боливии и Англии. Кроме того, известны золото-мышьяковые месторождения в США и Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке.
Определение мышьяка.
Качественной реакцией на мышьяк является осаждение желтого сульфида As2S3 из солянокислых растворов. Следы определяют реакцией Марша или методом Гутцейта: полоски бумаги, смоченные HgCl2, темнеют в присутствии арсина, который восстанавливает сулему до ртути.
В последние десятилетия разработаны различные чувствительные методы анализа, с помощью которых можно количественно определить ничтожные концентрации мышьяка, например, в природных водах. В их числе пламенная атомно-абсорбционная спектрометрия, атомно-эмиссионная спектрометрия, масс-спектрометрия, атомно-флуоресцентная спектрометрия, нейтронный активационный анализ… Если мышьяка в воде очень мало, может потребоваться предварительное концентрирование образцов. Используя такое концентрирование, группа харьковских ученых из Национальной академии наук Украины разработала в 1999 экстракционно-рентгенофлуоресцентный метод определения мышьяка (а также селена) в питьевой воде с чувствительностью до 2,5–5 мкг/л.
Для раздельного определения соединений As(III) и As(V) их предварительно отделяют друг от друга с помощью хорошо известных экстракционных и хроматографических методов, а также используя селективное гидрирование. Экстракцию обычно осуществляют с помощью дитиокарбамата натрия или пирролидиндитиокарбамата аммония. Эти соединения образуют с As(III) нерастворимые в воде комплексы, которые можно извлечь хлороформом. Затем с помощью окисления азотной кислотой мышьяк можно снова перевести в водную фазу. Во второй пробе с помощью восстановителя переводят арсенат в арсенит, а затем производят аналогичную экстракцию. Так определяют «общий мышьяк», а затем вычитанием первого результата из второго определяют As(III) и As(V) порознь. Если в воде есть органические соединения мышьяка, их обычно переводят в метилдииодарсин CH3AsI2 или в диметилиодарсин (CH3)2AsI, которые определяют тем или иным хроматографическим методом. Так, с помощью высокоэффективной жидкостной хроматографии можно определить нанограммовые количества вещества.
Многие мышьяковые соединения можно анализировать так называемым гидридным методом. Он заключается в селективном восстановлении анализируемого вещества в летучий арсин. Так, неорганические арсениты восстанавливаются до AsH3 при рН 5 – 7, а при рН < 1 восстанавливаются как арсениты, так и арсенаты. В этих же условиях метиларсоновая и диметиларсиновая кислоты восстанавливаются до метил- и диметиларсина. Летучие арсины можно затем выморозить в ампулу, охлаждаемую жидким азотом. Затем, медленно нагревая ампулу, можно добиться раздельного испарения разных арсинов.
Чувствителен и нейтронно-активационный метод. Он заключается в облучении образца нейтронами, при этом ядра 75As захватывают нейтроны и превращаются в радионуклид 76As, который обнаруживается по характерной радиоактивности с периодом полураспада 26 часов. Так можно обнаружить до 10–10% мышьяка в образце, т.е. 1 мг на 1000 т вещества
Применение мышьяка.
Около 97% добываемого мышьяка используют в виде его соединений. Чистый мышьяк применяют редко. В год во всем мире получают и используют всего несколько сотен тонн металлического мышьяка. В количестве 3% мышьяк улучшает качество подшипниковых сплавов. Добавки мышьяка к свинцу заметно повышают его твердость, что используется при производстве свинцовых аккумуляторов и кабелей. Малые добавки мышьяка повышают коррозионную устойчивость и улучшают термические свойства меди и латуни. Мышьяк высокой степени очистки применяют в производстве полупроводниковых приборов, в которых его сплавляют с кремнием или с германием. Мышьяк используют и в качестве легирующей добавки, которая придает «классическим» полупроводникам (Si, Ge) проводимость определенного типа.
Мышьяк как ценную присадку используют и в цветной металлургии. Так, добавка к свинцу 0,2…1% As значительно повышает его твердость. Уже давно заметили, что если в расплавленный свинец добавить немного мышьяка, то при отливке дроби получаются шарики правильной сферической формы. Добавка 0,15…0,45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в загазованной среде. Кроме того, мышьяк увеличивает текучесть меди при литье, облегчает процесс волочения проволоки. Добавляют мышьяк в некоторые сорта бронз, латуней, баббитов, типографских сплавов. И в то же время мышьяк очень часто вредит металлургам. В производстве стали и многих цветных металлов умышленно идут на усложнение процесса – лишь бы удалить из металла весь мышьяк. Присутствие мышьяка в руде делает производство вредным. Вредным дважды: во-первых, для здоровья людей; во-вторых, для металла – значительные примеси мышьяка ухудшают свойства почти всех металлов и сплавов.
Более широкое применение имеют различные соединения мышьяка, которые ежегодно производятся десятками тысяч тонн. Оксид As2O3 применяют в стекловарении в качестве осветлителя стекла. Еще древним стеклоделам было известно, что белый мышьяк делает стекло «глухим», т.е. непрозрачным. Однако небольшие добавки этого вещества, напротив, осветляют стекло. Мышьяк и сейчас входит в рецептуры некоторых стекол, например, «венского» стекла для термометров.
Соединения мышьяка применяют в качестве антисептика для предохранения от порчи и консервирования шкур, мехов и чучел, для пропитки древесины, как компонент необрастающих красок для днищ судов. В этом качестве используют соли мышьяковой и мышьяковистой кислот: Na2HAsO4, PbHAsO4, Ca3(AsO3)2 и др. Биологическая активность производных мышьяка заинтересовала ветеринаров, агрономов, специалистов санэпидслужбы. В итоге появились мышьяксодержащие стимуляторы роста и продуктивности скота, противоглистные средства, лекарства для профилактики болезней молодняка на животноводческих фермах. Соединения мышьяка (As2O3, Ca3As2, Na3As, парижская зелень) используются для борьбы с насекомыми, грызунами, а также с сорняками. Раньше такое применение было широко распространено, особенно при обработке фруктовых деревьев, табачных и хлопковых плантаций, для избавления домашнего скота от вшей и блох, для стимулирования прироста в птицеводстве и свиноводстве, а также для высушивания хлопчатника перед уборкой. Еще в Древнем Китае оксидом мышьяка обрабатывали рисовые посевы, чтобы уберечь их от крыс и грибковых заболеваний и таким образом поднять урожай. А в Южном Вьетнаме американские войска применяли в качестве дефолианта какодиловую кислоту («Эйджент блю»). Сейчас из-за ядовитости соединений мышьяка их использование в сельском хозяйстве ограничено.
Важные области применения соединений мышьяка – производство полупроводниковых материалов и микросхем, волоконной оптики, выращивание монокристаллов для лазеров, пленочная электроника. Для введения небольших строго дозированных количеств этого элемента в полупроводники применяют газообразный арсин. Арсениды галлия GaAs и индия InAs применяют при изготовлении диодов, транзисторов, лазеров.
Ограниченное применение находит мышьяк и в медицине. Изотопы мышьяка 72As, 74As и 76As с удобными для исследований периодами полураспада (26 ч, 17,8 сут. и 26,3 ч соответственно) применяются для диагностики различных заболеваний.
Илья Леенсон
Неорганические соединения мышьяка содержатся в почве, отложениях и грунтовых водах. Эти соединения встречаются либо в природе, либо в результате добычи, выплавки руд и промышленного использования мышьяка. Органические соединения мышьяка содержатся в основном в рыбе и моллюсках.
В каких продуктах содержится мышьяк?
Самый высокий уровень мышьяка (во всех формах) в пищевых продуктах содержится в морепродуктах, рисе, рисовых хлопьях (и других рисовых продуктах), грибах и птице, хотя многие другие продукты, в том числе некоторые фруктовые соки, также могут содержать мышьяк.
Как вы получаете мышьяк в природе?
2.1 Мышьяк содержится в природной среде в некотором изобилии в земной коре и в небольших количествах в горных породах, почве, воде и воздухе. Он присутствует во многих различных минералах. Около одной трети мышьяка в атмосфере поступает из природных источников, таких как вулканы, а остальное – из искусственных источников.
Мышьяк содержится во всех почвах?
Мышьяк содержится в грунтовых водах во всех 50 штатах, в основном в районах с неглубокими запасами грунтовых вод и большим количеством мышьяка в почве и месторождениях полезных ископаемых. В Делавэре небольшое количество мышьяка содержится в подземных и общественных водах.
Рис полон мышьяка?
Рис и продукты на основе риса: Рис накапливает больше мышьяка, чем другие пищевые культуры. На самом деле, это самый крупный пищевой источник неорганического мышьяка, который является более токсичной формой (7, 8, 9, 10).
Доктор. Джо Шварц: Все о мышьяке
Dr. Joe Schwarcz: All about arsenic

Определяем мышьяк в воде. Определение нетрудно провести путём выделения арсеникума в виде арсина с индикацией нитратом серебра с предварительным фильтром из ваты, пропитанной ацетатом свинца. Это классический школьный опыт, гугл. Надо заметить, что с мышьяком здесь летит и сурьма, но сурьма это почти такая же гадость, что и мышьяк.
Для начала воду следует упарить. Я упарил пол литра до приблизительно 25мл, в начале упаривания добавил одну каплю конц. серной кислоты (если этого не сделать, то в концентрате выпадет обильный осадок, что затруднит его дальнейшую обработку, например переливание, да и на стенках будут оставаться соли). Концентрат слил в стаканчик на 50мл (концентрат получился желтоватый прозрачный без осадка), налил в пол литровый стакан около пятнадцати миллилитров воды, добавил десять капель серной кислоты и омыв стенки стакана этими слезами, добавил их к предыдущим, ещё десять миллилитров воды для контрольного обмыва и маленький стаканчик поставлен на выпаривание. Выпривание произведено почти до дна, образовалось относительно немного мелкокристаллического осадка. Наверное это кальций сульфат, ну и фиг с ним. Концентрат перелит в пробирку, сделаны обмывки стаканчика. Концентрат закислен конц. серной кислотой до конечной концентрации кислоты в около 15 капель. Объём в пробирке – 4,5см погонных (в мл это 5). В пробирку добавлено порошка цинка на кончике ножа (в итоге почти половина цинка остаётся). Ацкий реактор закрывается пробкой со стеклянной трубкой, в первой половине трубки участок забит свинцово-ацетатной ватой, а во второй – индикаторная бумага незамкнутым кольцом вдоль трубки прижатая палочкой к стенке. Время выдержки 30-40мин с 2-3 подогреваниями и побалтываниями. В течение опыта шприцем 10мл потихоньку проводил продувку (вот на все эти 10мл и продувал), хотя думаю, это было излишним.
Тоже проделано с другими поллитрами воды, но на втором этапе к воде добавлен раствор сульфата железа (сульфат на As не проверялся) для осаждения железа арсената. Эта и другие пробы брались с интервалом 2-3 суток. Упаривание длится примерно 6-10 часов, лучше медленней, чтобы не булькало.
Ещё одна проба воды обогащена 0,025мг мышьяка, обработана как первая.
Третья проба обработана только упариванием как первая.
Сделано четыре стандарта. На 0,025мг/0,5л; 0,05; 0,075; 0,1. Раствор приготовлен на воде с концентрацией кислоты 15капель/объём. Объём всё тот же – 4,5см (5мл).
В результате установлено, что индикация получается сильно размытая, фото. Но принципиально читаемая, особенно если наблюдать динамику почернение воочию. На фото показана “внешняя сторона” – прилегающая к трубке и “внутренняя”. Принципиально видно где мышьяк есть и “много”, а где нас явно недотравливают. В принципе этот результат в отношении ПДК 0,05мг/л я бы интерпретировал как в пределах “нормы”, хотя статистики явно маловато. Да, холостой опыт с цинком и кислотой, всё чдашной квалификации, мышьяка не выявил вообще – индикаторная полоска осталась абсолютно чистой.
Чтобы улучшить индикацию взял трубку поменьше, не 5мм, а 4, от шприца отказался совсем. Также сделал четыре стандарта, на поверку индикация здесь оказалась ещё хуже чем с трубкой большего диаметра, хотя по динамике и характеру почернения разница в 0,025мг определятся довольно уверенно.
Первая же проба воды, обработанная “классически” только упариванием (с подкислением) выявила жуткое превышение ПДК, здесь явно около 0,2мг/л! Вторая проба, взятая через двое суток показала почти полное отсутствие мышьяка (если сильно присмотреться, то на фото внутренней стороны есть тооненькая каёмочка).
Что интересно. В опыте со стандартом 0,1мг/0,5л после извлечения индикаторной полоски по прошествии контрольного времени, вставил туда новую и погонял раствор с нагреванием и бултыханием ещё минут двадцать. И получил довольно толстую, каёмку слабой относительно однородной интенсивности без начальной чёрной полосы.
Ещё по методике. Трубка после каждого опыта продувалась, вата не менялась и почернела от паразитического H2S совсем чуть-чуть только в самом начале. Один раз при вставлении свежей индикаторной полоски она в одном месте пятном (нехарактерно) почернела ещё до опыта и была заменена (остаточный арсин?).
Кто не имеет в закромах мышьяка для изготовления стандартов тому следует исследовать несколько источников воды и ориентироваться на больше/меньше.




